5.1.3不同价态含硫物质的转化 课件(共28张PPT)2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.1.3不同价态含硫物质的转化 课件(共28张PPT)2023-2024学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 20.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-01 00:00:00 | ||
图片预览






文档简介
(共28张PPT)
第五章 第一节
第3课时 不同价态含硫物质的转化
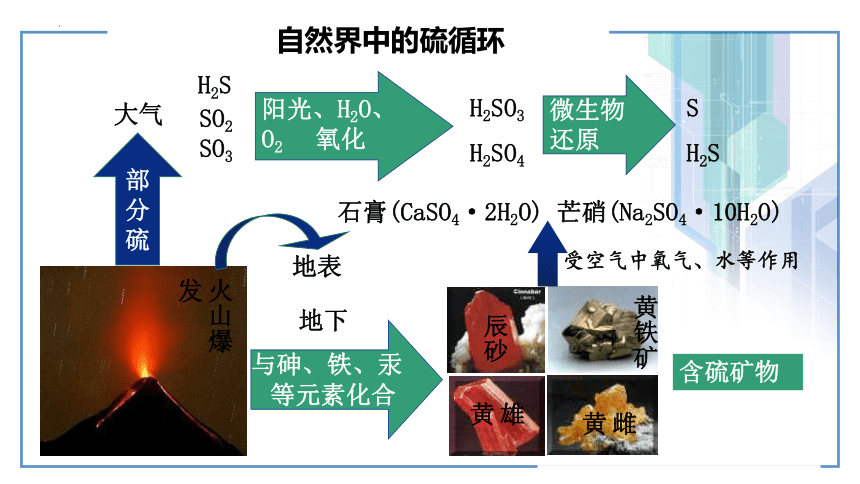
阳光、H2O、
O2 氧化
H2SO3
H2SO4
微生物
还原
S
H2S
与砷、铁、汞
等元素化合
含硫矿物
雄黄
雌黄
黄铁矿
辰砂
石膏(CaSO4·2H2O) 芒硝(Na2SO4·10H2O)
受空气中氧气、水等作用
H2S
火山爆发
大气
地表
地下
SO2
SO3
自然界中的硫循环
部分硫
问题:硫元素家族有哪些常见的物质?具有哪些性质?相互之间如何转化?
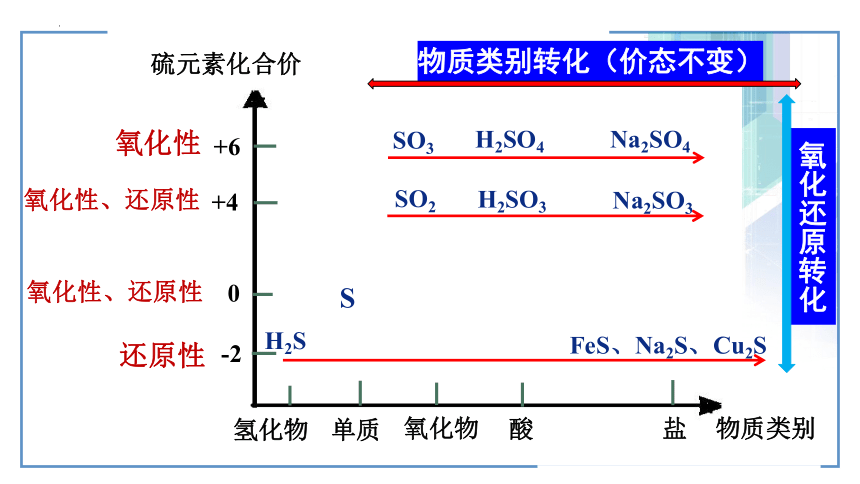
不同价态含硫物质的转化
+6
+4
0
-2
硫元素化合价
物质类别
氢化物
单质
氧化物
酸
盐
H2S
S
SO2
SO3
H2SO3
H2SO4
Na2SO4
Na2SO3
还原性
氧化性
氧化性、还原性
氧化性、还原性
FeS、Na2S、Cu2S
物质类别转化(价态不变)
氧化还原转化
一 相同价态不同含硫化合物间是通过酸碱反应规律联系在一起的。
多H加酸,少H加碱
硫元素常见的化合价有-2、0、+4、+6,可以通过氧化还原反应实现不同价态含硫物质的相互转化。
加入氧化剂,可将硫元素从低价态转化为高价态;
加入还原剂,可将硫元素从高价态转化为低价态。
二 不同价态硫元素的转化与性质
1 实验室不同价态含硫物质的转化所需试剂
常用的氧化剂有:
KMnO4、HNO3、浓硫酸、氯水、溴水、H2O2、Na2O2、Fe3+、O2、HClO等。
常用的还原剂有:
Fe2+、I―、Br―、S2―、SO2、Na、Mg、Fe、C、H2、CO等。
① 从低价态转化为高价态需要氧化剂
② 从高价态转化为低价态需要还原剂
(1)实验操作
(2)实验现象:有淡黄色沉淀生成
实验一:硫化钠转化为单质硫
思考与讨论:氢氧化钠溶液的棉团塞住试管口,其原因是?
吸收实验过程中可能产生的有毒气体硫化氢
(3)实验结论:S2-能被H2SO3氧化生成单质S。
防污染
(1)实验操作
(2)实验现象:紫红色褪色,产生淡黄色沉淀。
实验二:硫化钠转化为单质硫
思考与讨论:氢氧化钠溶液的棉团塞住试管口,其原因是?
吸收实验过程中可能产生的有毒气体二氧化硫
(3)实验结论:S2-能被酸性KMnO4氧化生成单质S。
防污染
(1)实验装置
(2)观察到的现象是混合物继续保持红热,最后生成黑色固体
实验三:硫转化为硫化亚铁
实验序号 价态变化 转化前的物质 选择试剂 转化后的物质 预期现象
1 -2 → 0 H2S
2 0 → +4 S
3 +4 → +6 H2SO3
4 +6 → +4 H2SO4
5 +4 → 0 SO2
6 0 → -2 S
少量O2
S
生成淡黄色固体
空气
SO2
硫燃烧,发出淡蓝色火焰,产生有刺激气味的气体
H2O2
H2SO4
反应前后用pH试纸测pH,值变小;反应后滴入稀盐酸,再滴入BaCl2,产生白色沉淀。
Cu
SO2
产生有刺激气味的气体,该气体能使品红褪色
H2S
S
生成淡黄色固体
Fe
FeS
生成黑色固体
问题:根据所学知识实现下述物质间的相互转化:
【总结】不同价态硫元素的转化,可通过氧化还原反应实现
(1)邻位价态原则:
① 当硫元素化合价升高或降低时,一般升高或降低到其相邻价态(化合价只靠拢不交叉)。
② 同种元素相邻价态的粒子间不发生氧化还原反应。
如S和H2S、S和SO2、SO2和浓硫酸之间不发生氧化还原反应。
(2)归中规律:
当硫元素高价态粒子与低价态粒子反应时,一般生成中间价态。
2H2S+SO2 = 3S+2H2O
2Na2S+Na2SO3+3H2SO4 = 3Na2SO4+3S↓+3H2O
含硫物质的连续氧化
三 含硫物质的其他转化形式
思维建模
二维图定位物质
明确物质转化类型
依据转化类型找寻反应和试剂
物质类别转化(价态不变)
依据物质性质进行酸碱盐之间的转化
物质价态变化(氧化还原)
依据氧还律选择合适的氧化剂和还原剂
化学实验设计:是指实验者在实施化学实验之前,根据一定的实验目的,运用化学知识与技能,按照一定的实验方法,对实验的原理、试剂、仪器与装置、步骤和方法等所进行的规划。例如,设计“不同价态含硫物质的转化”实验,当确定了要实现的转化关系后,需要明确转化前后的含硫物质时哪些,通过怎样的反应(氧化/还原)实现转化,用到的氧化剂或还原剂是什么,等等。
进行化学实验设计时,应遵循科学性、可行性、安全性和绿色化原则。
物质间相互转化:综合考虑实验安全和环境保护!
我国制造硫酸的历史可以追溯到7世纪,炼丹家曾利用胆矾来制备硫酸
CuSO4.5H2O
CuSO4
SO3
H2SO4
+6
+6
+6
+6
S元素的化合价没有变化
问题:人们在生产生活中怎样把他们转化成所需要的物质?(以硫酸的生产为例)
硫酸的制造历史
硝石(KNO3)
SO3
H2SO4
0
+6
+6
S
S元素化合价
+4
0
-2
+6
H2O
17世纪,炼金士采用一种类似钟罩的装置,在其中点燃硫磺和硝石的混合物制得硫酸
空气
SO3
H2SO4
+4
0
+6
+6
19世纪,英国人菲利普把硫磺装入内部镶有铂催化剂的瓷管里加热,并通入足量的空气与其反应,再将生成是三氧化硫溶于水制得硫酸
S
SO2
H2O
S元素化合价
+4
0
-2
+6
现代硫酸工业制法的雏形
1.为了除去粗盐中的Ca2+、Mg2+、SO42-和泥沙,可先将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液
③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液,正确的操作顺序是( )
A.①④②⑤③ B.④①②⑤③
C.②④⑤①③ D.⑤②④①③
√
2.Na2SO3中+4价的硫元素,既有氧化性,又有还原性。要证明Na2SO3具有还原性,需选用的试剂是( )
A.硫化钠溶液 B.盐酸
C.氯化钙溶液 D.溴水
D
3.实验证明铜在低温下不能和氧气发生反应,也不能和稀硫酸共热发生反应。但工业上却是将废铜屑倒入热的稀硫酸中并不断地通入空气来制取硫酸铜溶液的。
(1)写出铜屑在上述状态下发生的一系列反应的化学方程式:_____________________;___________________________。
CuO+H2SO4 == CuSO4+H2O
2Cu + O2 == 2CuO
(2)利用铜和浓硫酸在加热条件下也能制备硫酸铜溶液,其化学方程式?
(3)以上两种方法是前者好还是后者好: ,原因是?
前者好
制得相同质量的产品,前者消耗的硫酸少,而且后者生成的SO2会造成大气污染
C + H2SO4(浓) == CO2↑ + 2SO2↑ + 2H2O
4.在通常情况下,A为固态单质。根据如图转化关系,回答下列问题:
(1)写出A~E的化学式:
A._____;B._____;
C._____;D._____;
E._______。
S
H2S
SO2
SO3
H2SO4
(2)写出下列反应的化学方程式:
①E→C:________________________________________;
②C转化为D:_____________________;
③B转化为C:_____________________________。
5、写出下列含硫物质发生转化的化学方程式
①实验室将硫磺撒在汞的表面以除去不慎洒落的汞
②实验室常用Na2SO3粉末与70%的浓硫酸制备SO2
③长期暴露在空气中的Na2SO3会被O2氧化成Na2SO4
④实验室常用过量NaOH溶液吸收尾气,生成Na2SO3
⑤溶有SO2气体的水溶液久置空气中酸性增强
⑥往新制氯水中通入SO2气体
⑦H2S与SO2混合有淡黄色固体S生成
⑧工业上用98.3%的浓硫酸吸收SO3制备硫酸
【化学与职业】
化工工程师
化工工程师是解决人类在生产、生活等领域面临的化工相关问题的专业技术人才,工作在石油炼制、化肥生产、医药开发和环境治理等了领域。主要工作是依据科学原理,统筹各方面的资源,设计化工生产的工艺流程,并监控生产过程,及时解决生产中遇到的技术问题。
化工工程师需要具有高度的社会责任感、团队精神、全局观念、风险管控意识和创新能力,并具备化学、化工、安全、经济、环境等方面的专业知识。
第五章 第一节
第3课时 不同价态含硫物质的转化
阳光、H2O、
O2 氧化
H2SO3
H2SO4
微生物
还原
S
H2S
与砷、铁、汞
等元素化合
含硫矿物
雄黄
雌黄
黄铁矿
辰砂
石膏(CaSO4·2H2O) 芒硝(Na2SO4·10H2O)
受空气中氧气、水等作用
H2S
火山爆发
大气
地表
地下
SO2
SO3
自然界中的硫循环
部分硫
问题:硫元素家族有哪些常见的物质?具有哪些性质?相互之间如何转化?
不同价态含硫物质的转化
+6
+4
0
-2
硫元素化合价
物质类别
氢化物
单质
氧化物
酸
盐
H2S
S
SO2
SO3
H2SO3
H2SO4
Na2SO4
Na2SO3
还原性
氧化性
氧化性、还原性
氧化性、还原性
FeS、Na2S、Cu2S
物质类别转化(价态不变)
氧化还原转化
一 相同价态不同含硫化合物间是通过酸碱反应规律联系在一起的。
多H加酸,少H加碱
硫元素常见的化合价有-2、0、+4、+6,可以通过氧化还原反应实现不同价态含硫物质的相互转化。
加入氧化剂,可将硫元素从低价态转化为高价态;
加入还原剂,可将硫元素从高价态转化为低价态。
二 不同价态硫元素的转化与性质
1 实验室不同价态含硫物质的转化所需试剂
常用的氧化剂有:
KMnO4、HNO3、浓硫酸、氯水、溴水、H2O2、Na2O2、Fe3+、O2、HClO等。
常用的还原剂有:
Fe2+、I―、Br―、S2―、SO2、Na、Mg、Fe、C、H2、CO等。
① 从低价态转化为高价态需要氧化剂
② 从高价态转化为低价态需要还原剂
(1)实验操作
(2)实验现象:有淡黄色沉淀生成
实验一:硫化钠转化为单质硫
思考与讨论:氢氧化钠溶液的棉团塞住试管口,其原因是?
吸收实验过程中可能产生的有毒气体硫化氢
(3)实验结论:S2-能被H2SO3氧化生成单质S。
防污染
(1)实验操作
(2)实验现象:紫红色褪色,产生淡黄色沉淀。
实验二:硫化钠转化为单质硫
思考与讨论:氢氧化钠溶液的棉团塞住试管口,其原因是?
吸收实验过程中可能产生的有毒气体二氧化硫
(3)实验结论:S2-能被酸性KMnO4氧化生成单质S。
防污染
(1)实验装置
(2)观察到的现象是混合物继续保持红热,最后生成黑色固体
实验三:硫转化为硫化亚铁
实验序号 价态变化 转化前的物质 选择试剂 转化后的物质 预期现象
1 -2 → 0 H2S
2 0 → +4 S
3 +4 → +6 H2SO3
4 +6 → +4 H2SO4
5 +4 → 0 SO2
6 0 → -2 S
少量O2
S
生成淡黄色固体
空气
SO2
硫燃烧,发出淡蓝色火焰,产生有刺激气味的气体
H2O2
H2SO4
反应前后用pH试纸测pH,值变小;反应后滴入稀盐酸,再滴入BaCl2,产生白色沉淀。
Cu
SO2
产生有刺激气味的气体,该气体能使品红褪色
H2S
S
生成淡黄色固体
Fe
FeS
生成黑色固体
问题:根据所学知识实现下述物质间的相互转化:
【总结】不同价态硫元素的转化,可通过氧化还原反应实现
(1)邻位价态原则:
① 当硫元素化合价升高或降低时,一般升高或降低到其相邻价态(化合价只靠拢不交叉)。
② 同种元素相邻价态的粒子间不发生氧化还原反应。
如S和H2S、S和SO2、SO2和浓硫酸之间不发生氧化还原反应。
(2)归中规律:
当硫元素高价态粒子与低价态粒子反应时,一般生成中间价态。
2H2S+SO2 = 3S+2H2O
2Na2S+Na2SO3+3H2SO4 = 3Na2SO4+3S↓+3H2O
含硫物质的连续氧化
三 含硫物质的其他转化形式
思维建模
二维图定位物质
明确物质转化类型
依据转化类型找寻反应和试剂
物质类别转化(价态不变)
依据物质性质进行酸碱盐之间的转化
物质价态变化(氧化还原)
依据氧还律选择合适的氧化剂和还原剂
化学实验设计:是指实验者在实施化学实验之前,根据一定的实验目的,运用化学知识与技能,按照一定的实验方法,对实验的原理、试剂、仪器与装置、步骤和方法等所进行的规划。例如,设计“不同价态含硫物质的转化”实验,当确定了要实现的转化关系后,需要明确转化前后的含硫物质时哪些,通过怎样的反应(氧化/还原)实现转化,用到的氧化剂或还原剂是什么,等等。
进行化学实验设计时,应遵循科学性、可行性、安全性和绿色化原则。
物质间相互转化:综合考虑实验安全和环境保护!
我国制造硫酸的历史可以追溯到7世纪,炼丹家曾利用胆矾来制备硫酸
CuSO4.5H2O
CuSO4
SO3
H2SO4
+6
+6
+6
+6
S元素的化合价没有变化
问题:人们在生产生活中怎样把他们转化成所需要的物质?(以硫酸的生产为例)
硫酸的制造历史
硝石(KNO3)
SO3
H2SO4
0
+6
+6
S
S元素化合价
+4
0
-2
+6
H2O
17世纪,炼金士采用一种类似钟罩的装置,在其中点燃硫磺和硝石的混合物制得硫酸
空气
SO3
H2SO4
+4
0
+6
+6
19世纪,英国人菲利普把硫磺装入内部镶有铂催化剂的瓷管里加热,并通入足量的空气与其反应,再将生成是三氧化硫溶于水制得硫酸
S
SO2
H2O
S元素化合价
+4
0
-2
+6
现代硫酸工业制法的雏形
1.为了除去粗盐中的Ca2+、Mg2+、SO42-和泥沙,可先将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液
③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液,正确的操作顺序是( )
A.①④②⑤③ B.④①②⑤③
C.②④⑤①③ D.⑤②④①③
√
2.Na2SO3中+4价的硫元素,既有氧化性,又有还原性。要证明Na2SO3具有还原性,需选用的试剂是( )
A.硫化钠溶液 B.盐酸
C.氯化钙溶液 D.溴水
D
3.实验证明铜在低温下不能和氧气发生反应,也不能和稀硫酸共热发生反应。但工业上却是将废铜屑倒入热的稀硫酸中并不断地通入空气来制取硫酸铜溶液的。
(1)写出铜屑在上述状态下发生的一系列反应的化学方程式:_____________________;___________________________。
CuO+H2SO4 == CuSO4+H2O
2Cu + O2 == 2CuO
(2)利用铜和浓硫酸在加热条件下也能制备硫酸铜溶液,其化学方程式?
(3)以上两种方法是前者好还是后者好: ,原因是?
前者好
制得相同质量的产品,前者消耗的硫酸少,而且后者生成的SO2会造成大气污染
C + H2SO4(浓) == CO2↑ + 2SO2↑ + 2H2O
4.在通常情况下,A为固态单质。根据如图转化关系,回答下列问题:
(1)写出A~E的化学式:
A._____;B._____;
C._____;D._____;
E._______。
S
H2S
SO2
SO3
H2SO4
(2)写出下列反应的化学方程式:
①E→C:________________________________________;
②C转化为D:_____________________;
③B转化为C:_____________________________。
5、写出下列含硫物质发生转化的化学方程式
①实验室将硫磺撒在汞的表面以除去不慎洒落的汞
②实验室常用Na2SO3粉末与70%的浓硫酸制备SO2
③长期暴露在空气中的Na2SO3会被O2氧化成Na2SO4
④实验室常用过量NaOH溶液吸收尾气,生成Na2SO3
⑤溶有SO2气体的水溶液久置空气中酸性增强
⑥往新制氯水中通入SO2气体
⑦H2S与SO2混合有淡黄色固体S生成
⑧工业上用98.3%的浓硫酸吸收SO3制备硫酸
【化学与职业】
化工工程师
化工工程师是解决人类在生产、生活等领域面临的化工相关问题的专业技术人才,工作在石油炼制、化肥生产、医药开发和环境治理等了领域。主要工作是依据科学原理,统筹各方面的资源,设计化工生产的工艺流程,并监控生产过程,及时解决生产中遇到的技术问题。
化工工程师需要具有高度的社会责任感、团队精神、全局观念、风险管控意识和创新能力,并具备化学、化工、安全、经济、环境等方面的专业知识。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
