2.2.3 氯气的制法 课件(共22张PPT)
文档属性
| 名称 | 2.2.3 氯气的制法 课件(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-01 20:34:24 | ||
图片预览





文档简介
(共22张PPT)
情景导入
氯气大量用于制造盐酸、有机溶剂、农药、染料和药品等,也可生产漂白液和漂白粉等。
自来水消毒
制漂白液
制氯化氢
制漂白粉、漂粉精
如何制取?
氯气是重要的化工原料
舍勒制氯气
必修第一册
第二章 海水中的重要元素——钠和氯
第二节 氯及其化合物
第3课时 氯气的制法
1.掌握实验室制取Cl2的原理和实验装置。
2.能结合实验室制取Cl2的装置特点设计制备其他气体的实验装置,培养科学探究与创新意识,提升实验能力。
核心素养发展目标
一、各种装置的选择
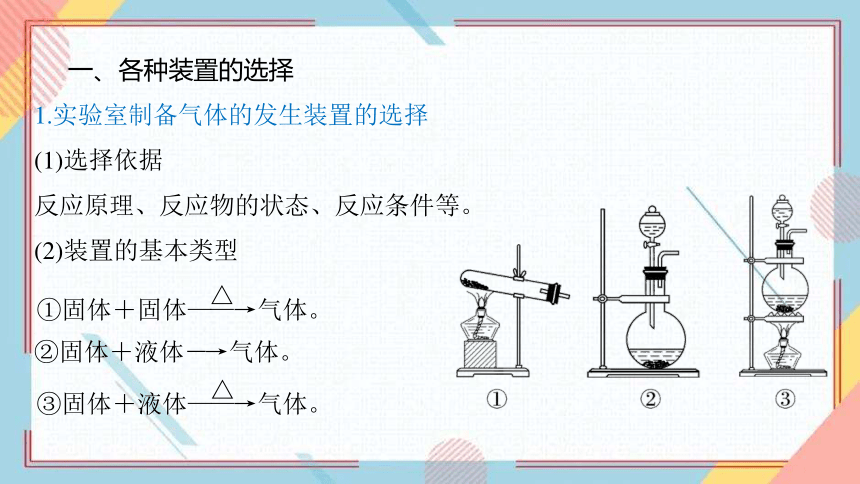
1.实验室制备气体的发生装置的选择
(1)选择依据
反应原理、反应物的状态、反应条件等。
(2)装置的基本类型
②固体+液体―→气体。
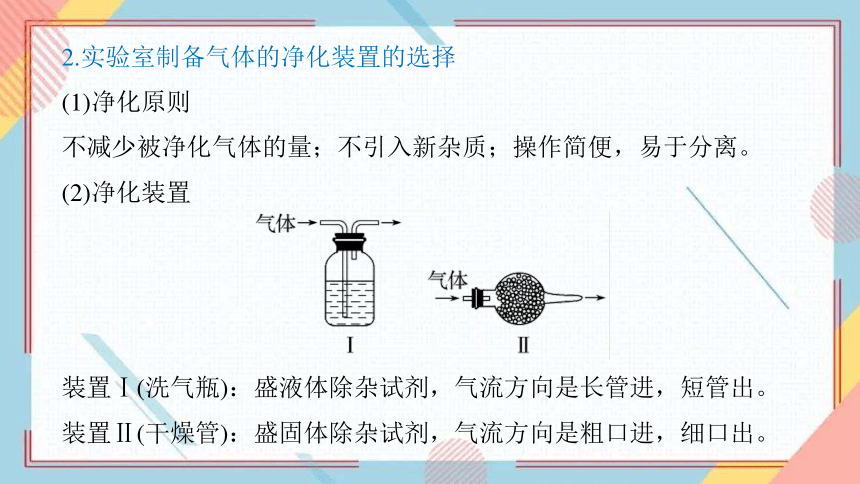
2.实验室制备气体的净化装置的选择
(1)净化原则
不减少被净化气体的量;不引入新杂质;操作简便,易于分离。
(2)净化装置
装置Ⅰ(洗气瓶):盛液体除杂试剂,气流方向是长管进,短管出。
装置Ⅱ(干燥管):盛固体除杂试剂,气流方向是粗口进,细口出。
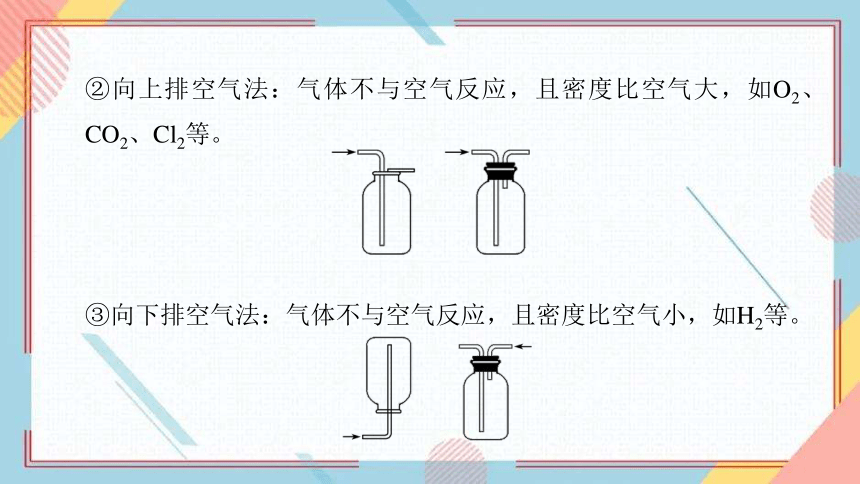
3.实验室制备气体的收集装置的选择
(1)选择依据
根据气体的密度、水溶性及是否与水或空气中的O2发生反应来确定气体的收集方法。
(2)方法选择
①排水法:适用于难溶于水且不与水反应的气体,如O2、H2等。
②向上排空气法:气体不与空气反应,且密度比空气大,如O2、CO2、Cl2等。
③向下排空气法:气体不与空气反应,且密度比空气小,如H2等。
4.实验室制备气体的尾气处理装置的选择
(1)选择依据:根据气体的物理性质、化学性质,将气体转化成无毒物质或吸收。
(2)方法选择:
①点燃法:如CO、H2、CH4等易燃性气体可用此法,必须先验纯,再点燃。
②吸收法:如Cl2、SO2、HCl、H2S等可用碱液吸收。
设计气体制备装置选取的基本思路
(1)药品的选择
(2)发生装置
(3)除杂装置
(4)收集装置
(5)尾气吸收装置
(化学反应原理)
(反应物的状态和反应条件)
(分析气体是否含有杂质,根据气体和杂质性质的差异)
(生成气体的性质(密度、溶解性,是否与水反应))
(气体的性质)
MnO2+ 4HCl(浓) == MnCl2+2H2O+Cl2↑
1、反应原理
1.二氧化锰为难溶于水的黑色粉末。
2.必须使用浓盐酸(稀盐酸与二氧化锰不反应)
3.此反应必须加热。
注意
(2)HCl在反应中表现为什么性?
酸性和还原性
(1)写出离子方程式______________________________________。
酸性
还原性
MnO2+4H++ 2Cl- Mn2++Cl2↑+2H2O
(一)发生装置
1.制取氯气发生装置类型:
固+液 气
分液漏斗
圆底烧瓶
2.有关仪器的名称:
铁架台(带铁圈、铁夹)、酒精灯、石棉网、(圆底)烧瓶、双孔塞、
分液漏斗、玻璃导管。
3.组装时必须
由下到上,从左到右。
石棉网
酒精灯
(一)发生装置
①控制用量
②反应速率
分液漏斗
长颈漏斗
1.分液漏斗和长颈漏斗的区别:
2.分液漏斗的优点:
思考:
装有浓盐酸的仪器叫做分液漏斗,能否用长颈漏斗代替分液漏斗?
不能。氯气有毒,加热时容易逸出
(二)收集装置
1. 氯气的性质
氯气密度比空气密度大、能溶于水且与水发生反应,有毒
2. 收集方法
向上排空气法
作用:吸收多余的Cl2,防止污染环境。
由此收集的氯气纯净吗?有什么杂质?如何除去?
由此实验装置制出的氯气混有杂质气体——水蒸气、HCl气体
饱和食盐水
浓硫酸
氯气在饱和食盐水的溶解度很低
(三)除杂装置
不易溶于水,不与水反应
密度比空气大
密度比空气小
确定收集装置
(四)收集装置
生成气体的性质(密度、溶解性、是否与水反应等)
Cl2 HCl H2O
Cl2 H2O
Cl2
多余的Cl2
发生装置:
固体与液体加热制气体
除杂装置:
饱和食盐水(除Cl2中的HCl)
收集装置:
向上排空气法
(或排饱和食盐水法)
尾气处理:
NaOH溶液吸收
干燥装置:
浓硫酸(除Cl2中的H2O)
验满:湿润的淀粉-碘化钾试纸放在集气瓶瓶口
3. 实验装置改进:
注意:
KClO3+6HCl (浓) =
2KMnO4+16HCl(浓) =
KCl+3Cl2↑+3H2O
2MnCl2+2KCl+5Cl2↑+8H2O
在常温下,高锰酸钾、氯酸钾、次氯酸钠、重铬酸钾跟浓盐酸反应能产生氯气。
思考:MnO2与KMnO4谁的氧化性更强?
你的判断依据是什么?
NaClO+2HCl (浓) =
NaCl+Cl2↑+H2O
1. 含7.3 g HCl的盐酸与足量的MnO2反应,生成的氯气总小于3.55 g,为什么?
①加热使大量HCl挥发;②因为随着反应的进行,浓盐酸逐渐变为稀盐酸,不再与二氧化锰反应。
2.用什么来检验Cl2已收集满?
①观察法
②用湿润的淀粉 KI试纸放在瓶口,试纸变蓝。
课堂检测
1.欲除去Cl2中少量的HCl气体,可选用
A.NaOH溶液 B.饱和食盐水
C.浓硫酸 D.石灰水
B
课堂检测
2.下列关于实验室用MnO2制取Cl2的叙述不正确的是( )
A.MnO2与浓盐酸共热
B.缓慢加热反应
C.用向下排空气法收集Cl2
D.多余的氯气常用较浓的碱液吸收
C
课堂检测
情景导入
氯气大量用于制造盐酸、有机溶剂、农药、染料和药品等,也可生产漂白液和漂白粉等。
自来水消毒
制漂白液
制氯化氢
制漂白粉、漂粉精
如何制取?
氯气是重要的化工原料
舍勒制氯气
必修第一册
第二章 海水中的重要元素——钠和氯
第二节 氯及其化合物
第3课时 氯气的制法
1.掌握实验室制取Cl2的原理和实验装置。
2.能结合实验室制取Cl2的装置特点设计制备其他气体的实验装置,培养科学探究与创新意识,提升实验能力。
核心素养发展目标
一、各种装置的选择
1.实验室制备气体的发生装置的选择
(1)选择依据
反应原理、反应物的状态、反应条件等。
(2)装置的基本类型
②固体+液体―→气体。
2.实验室制备气体的净化装置的选择
(1)净化原则
不减少被净化气体的量;不引入新杂质;操作简便,易于分离。
(2)净化装置
装置Ⅰ(洗气瓶):盛液体除杂试剂,气流方向是长管进,短管出。
装置Ⅱ(干燥管):盛固体除杂试剂,气流方向是粗口进,细口出。
3.实验室制备气体的收集装置的选择
(1)选择依据
根据气体的密度、水溶性及是否与水或空气中的O2发生反应来确定气体的收集方法。
(2)方法选择
①排水法:适用于难溶于水且不与水反应的气体,如O2、H2等。
②向上排空气法:气体不与空气反应,且密度比空气大,如O2、CO2、Cl2等。
③向下排空气法:气体不与空气反应,且密度比空气小,如H2等。
4.实验室制备气体的尾气处理装置的选择
(1)选择依据:根据气体的物理性质、化学性质,将气体转化成无毒物质或吸收。
(2)方法选择:
①点燃法:如CO、H2、CH4等易燃性气体可用此法,必须先验纯,再点燃。
②吸收法:如Cl2、SO2、HCl、H2S等可用碱液吸收。
设计气体制备装置选取的基本思路
(1)药品的选择
(2)发生装置
(3)除杂装置
(4)收集装置
(5)尾气吸收装置
(化学反应原理)
(反应物的状态和反应条件)
(分析气体是否含有杂质,根据气体和杂质性质的差异)
(生成气体的性质(密度、溶解性,是否与水反应))
(气体的性质)
MnO2+ 4HCl(浓) == MnCl2+2H2O+Cl2↑
1、反应原理
1.二氧化锰为难溶于水的黑色粉末。
2.必须使用浓盐酸(稀盐酸与二氧化锰不反应)
3.此反应必须加热。
注意
(2)HCl在反应中表现为什么性?
酸性和还原性
(1)写出离子方程式______________________________________。
酸性
还原性
MnO2+4H++ 2Cl- Mn2++Cl2↑+2H2O
(一)发生装置
1.制取氯气发生装置类型:
固+液 气
分液漏斗
圆底烧瓶
2.有关仪器的名称:
铁架台(带铁圈、铁夹)、酒精灯、石棉网、(圆底)烧瓶、双孔塞、
分液漏斗、玻璃导管。
3.组装时必须
由下到上,从左到右。
石棉网
酒精灯
(一)发生装置
①控制用量
②反应速率
分液漏斗
长颈漏斗
1.分液漏斗和长颈漏斗的区别:
2.分液漏斗的优点:
思考:
装有浓盐酸的仪器叫做分液漏斗,能否用长颈漏斗代替分液漏斗?
不能。氯气有毒,加热时容易逸出
(二)收集装置
1. 氯气的性质
氯气密度比空气密度大、能溶于水且与水发生反应,有毒
2. 收集方法
向上排空气法
作用:吸收多余的Cl2,防止污染环境。
由此收集的氯气纯净吗?有什么杂质?如何除去?
由此实验装置制出的氯气混有杂质气体——水蒸气、HCl气体
饱和食盐水
浓硫酸
氯气在饱和食盐水的溶解度很低
(三)除杂装置
不易溶于水,不与水反应
密度比空气大
密度比空气小
确定收集装置
(四)收集装置
生成气体的性质(密度、溶解性、是否与水反应等)
Cl2 HCl H2O
Cl2 H2O
Cl2
多余的Cl2
发生装置:
固体与液体加热制气体
除杂装置:
饱和食盐水(除Cl2中的HCl)
收集装置:
向上排空气法
(或排饱和食盐水法)
尾气处理:
NaOH溶液吸收
干燥装置:
浓硫酸(除Cl2中的H2O)
验满:湿润的淀粉-碘化钾试纸放在集气瓶瓶口
3. 实验装置改进:
注意:
KClO3+6HCl (浓) =
2KMnO4+16HCl(浓) =
KCl+3Cl2↑+3H2O
2MnCl2+2KCl+5Cl2↑+8H2O
在常温下,高锰酸钾、氯酸钾、次氯酸钠、重铬酸钾跟浓盐酸反应能产生氯气。
思考:MnO2与KMnO4谁的氧化性更强?
你的判断依据是什么?
NaClO+2HCl (浓) =
NaCl+Cl2↑+H2O
1. 含7.3 g HCl的盐酸与足量的MnO2反应,生成的氯气总小于3.55 g,为什么?
①加热使大量HCl挥发;②因为随着反应的进行,浓盐酸逐渐变为稀盐酸,不再与二氧化锰反应。
2.用什么来检验Cl2已收集满?
①观察法
②用湿润的淀粉 KI试纸放在瓶口,试纸变蓝。
课堂检测
1.欲除去Cl2中少量的HCl气体,可选用
A.NaOH溶液 B.饱和食盐水
C.浓硫酸 D.石灰水
B
课堂检测
2.下列关于实验室用MnO2制取Cl2的叙述不正确的是( )
A.MnO2与浓盐酸共热
B.缓慢加热反应
C.用向下排空气法收集Cl2
D.多余的氯气常用较浓的碱液吸收
C
课堂检测
