1.3.1氧化还原反应 课件(共19张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.1氧化还原反应 课件(共19张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-01 00:00:00 | ||
图片预览




文档简介
(共19张PPT)
第三节 氧化还原反应
第一课时 氧化还原反应
第一章 物质及其变化
掌握氧化还原反应与四种基本反应类型之间的关系
学习目标 1min
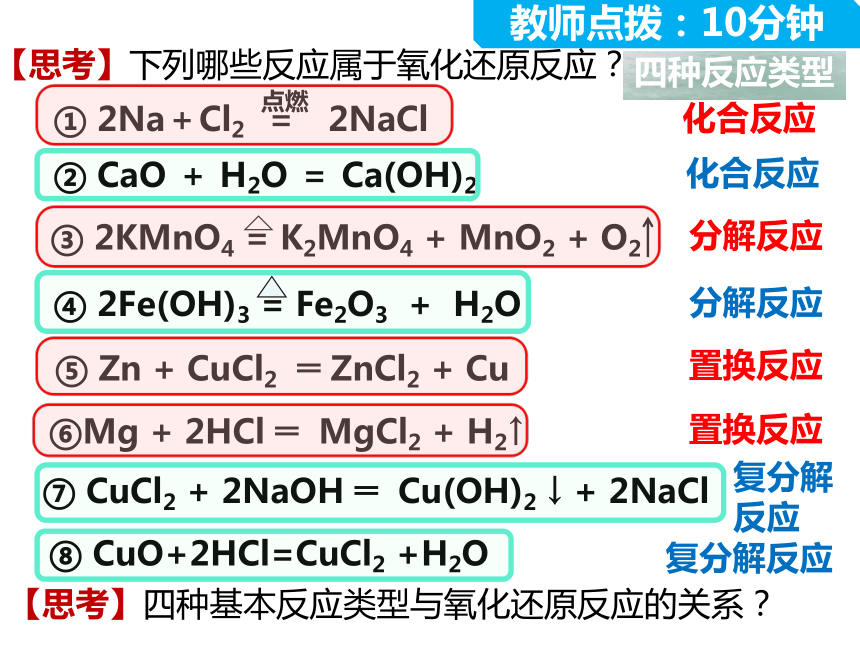
教师点拨:10分钟
【思考】下列哪些反应属于氧化还原反应?
③ 2KMnO4 = K2MnO4 + MnO2 + O2
⑥Mg + 2HCl ═ MgCl2 + H2↑
⑤ Zn + CuCl2 ═ ZnCl2 + Cu
⑦ CuCl2 + 2NaOH ═ Cu(OH)2 ↓ + 2NaCl
⑧ CuO+2HCl=CuCl2 +H2O
② CaO + H2O = Ca(OH)2
① 2Na+Cl2 = 2NaCl
点燃
④ 2Fe(OH)3 = Fe2O3 + H2O
化合反应
复分解反应
置换反应
复分解反应
置换反应
分解反应
化合反应
分解反应
四种反应类型
【思考】四种基本反应类型与氧化还原反应的关系?
【思考】四种基本反应类型与氧化还原反应的关系?
反应类型 结论
化合反应 (A+B=AB)
分解反应 (AB=A+B)
置换反应 (A+BC=B+AC)
复分解反应 (AB+CD=AD+CB)
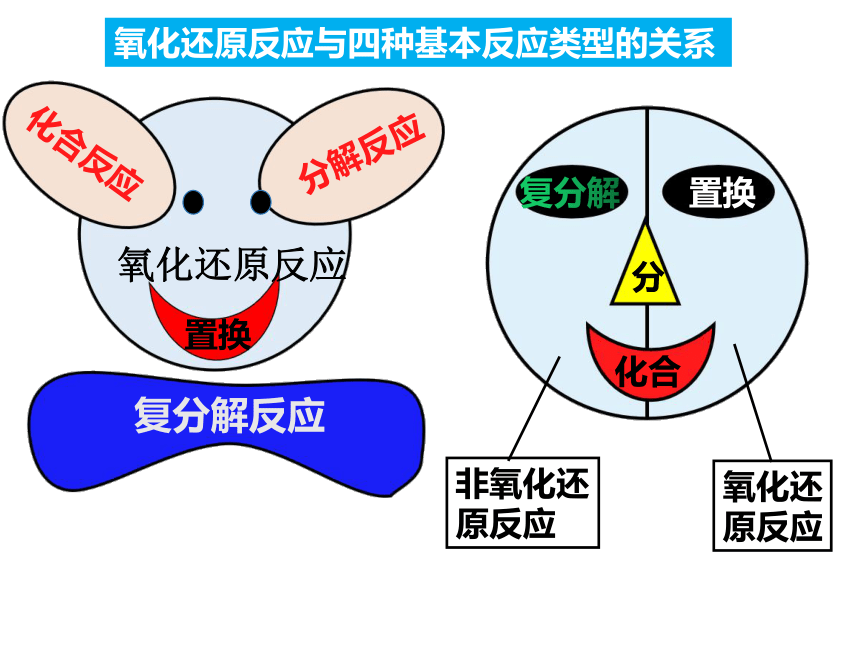
有 参加的化合反应属于氧化还原反应
有 生成的分解反应属于氧化还原反应
置换反应一定是氧化还原反应
复分解反应一定不是氧化还原反应
单质
单质
【思考】有单质参加或生成的化学反应一是氧化还原反应吗?
不一定,如3O2=2O3不是氧化还原反应。
放电
氧化还原反应与四种基本反应类型的关系
氧化还原反应
化合反应
分解反应
置换
复分解反应
氧化还
原反应
非氧化还
原反应
置换
复分解
分
化合
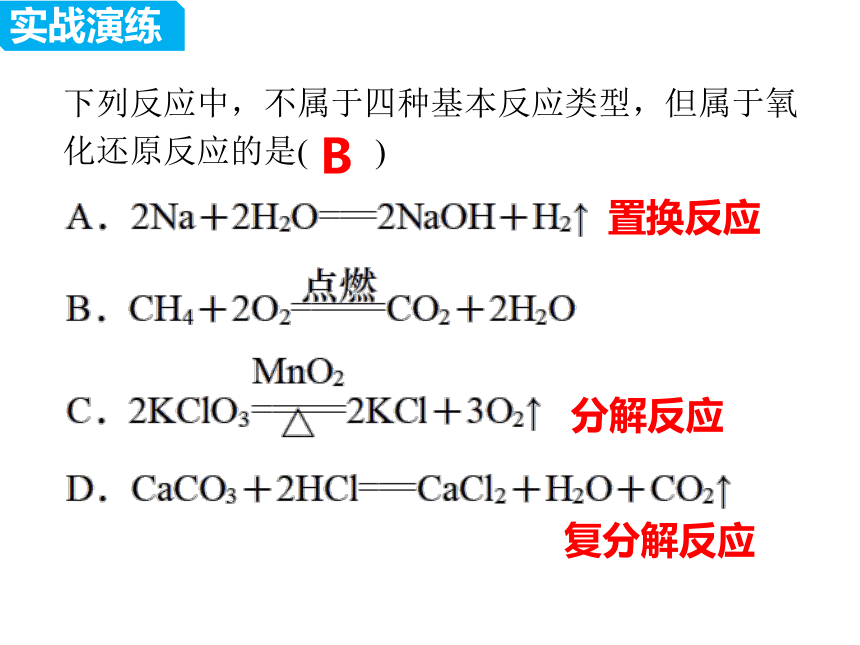
下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是( )
B
置换反应
分解反应
复分解反应
实战演练
掌握表示电子转移的方法——双线桥
学习目标 1min
教师点拨:10分钟
双线桥法
(1)含义:表明同一元素原子得到或失去电子的情况。
(2)示例:
(3)基本步骤:
①箭头必须由反应物指向生成物,且两端对准同种元素。②在“桥”上标明电子“得到”与“失去”,且得到与失去的电子总数必须相等。③电子转移数用a×be-形式表示,a表示发生氧化或还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,可以省略。(5)记忆口诀:先标化合价,再看价变化;
起止同元素,桥上标变化。
(4)使用注意事项:
得到2×3e-
失去3×2e-
①标价态
②连双线
③注得失
1.标出变价元素的化合价,用双线桥法标出电子转移情况
点燃
4P+5O2 =2P2O5
①标价态
②连双线
③注得失
实战演练
2.下列氧化还原反应中,电子转移的方向和数目均正确的是( )
A
实战演练
3.氧化剂和还原剂在生产生活中广泛使用,高锰酸钾和浓盐酸可以发生如下反应:
2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O。(1)发生还原反应的物质是________,失去电子的原子是________ (填元素名称) 原子。(2)已知MnCl2属于可溶性盐,写出该反应的离子方程式:______________________________________________。(3)用双线桥法标出电子转移的方向和数目。2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O
KMnO4
氯
2MnO4-+16H++10Cl-=5Cl2↑+2Mn2++8H2O
+8H2O
掌握表示电子转移的方法——单线桥
学习目标 1min
教师点拨:10分钟
单线桥法
(1)含义:表示反应前后不同元素原子间电子转移的情况。
(2)示例:
(3)基本步骤:
(4)使用注意事项:①单线桥必须画在反应物中。②箭头由化合价升高元素开始到化合价降低元素终止。③不需要标出“失去”“得到”。(5)记忆口诀:先确定变价,再计算价态;
桥上标明电子数,箭头还原到氧化。
CuO + H2 =Cu + H2O
2e-
+2
0
0
+1
①明升降
②连单线
③注数目
1.标出变价元素的化合价,用单线桥法标出电子转移情况
2Na + Cl2 2NaCl
点燃
0 +1
0 -1
2e-
①明升降
②连单线
③注数目
实战演练
2.铜能与浓硝酸反应,化学方程式为
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。(1)用单线桥法标出电子转移的方向和数目。
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(2)上述反应中发生还原反应的物质是________,被氧化的元素是________,化合价降低的元素是________。(3)写出该反应的离子方程式为_________________________________________
2e-
HNO3
铜元素
氮元素
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
实战演练
效
果
检
测
+4 -1 +2 0
2e-
②MnO2 + 4HCl(浓) == MnCl2 + Cl2↑+ 2H2O
Δ
4
①
第三节 氧化还原反应
第一课时 氧化还原反应
第一章 物质及其变化
掌握氧化还原反应与四种基本反应类型之间的关系
学习目标 1min
教师点拨:10分钟
【思考】下列哪些反应属于氧化还原反应?
③ 2KMnO4 = K2MnO4 + MnO2 + O2
⑥Mg + 2HCl ═ MgCl2 + H2↑
⑤ Zn + CuCl2 ═ ZnCl2 + Cu
⑦ CuCl2 + 2NaOH ═ Cu(OH)2 ↓ + 2NaCl
⑧ CuO+2HCl=CuCl2 +H2O
② CaO + H2O = Ca(OH)2
① 2Na+Cl2 = 2NaCl
点燃
④ 2Fe(OH)3 = Fe2O3 + H2O
化合反应
复分解反应
置换反应
复分解反应
置换反应
分解反应
化合反应
分解反应
四种反应类型
【思考】四种基本反应类型与氧化还原反应的关系?
【思考】四种基本反应类型与氧化还原反应的关系?
反应类型 结论
化合反应 (A+B=AB)
分解反应 (AB=A+B)
置换反应 (A+BC=B+AC)
复分解反应 (AB+CD=AD+CB)
有 参加的化合反应属于氧化还原反应
有 生成的分解反应属于氧化还原反应
置换反应一定是氧化还原反应
复分解反应一定不是氧化还原反应
单质
单质
【思考】有单质参加或生成的化学反应一是氧化还原反应吗?
不一定,如3O2=2O3不是氧化还原反应。
放电
氧化还原反应与四种基本反应类型的关系
氧化还原反应
化合反应
分解反应
置换
复分解反应
氧化还
原反应
非氧化还
原反应
置换
复分解
分
化合
下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是( )
B
置换反应
分解反应
复分解反应
实战演练
掌握表示电子转移的方法——双线桥
学习目标 1min
教师点拨:10分钟
双线桥法
(1)含义:表明同一元素原子得到或失去电子的情况。
(2)示例:
(3)基本步骤:
①箭头必须由反应物指向生成物,且两端对准同种元素。②在“桥”上标明电子“得到”与“失去”,且得到与失去的电子总数必须相等。③电子转移数用a×be-形式表示,a表示发生氧化或还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,可以省略。(5)记忆口诀:先标化合价,再看价变化;
起止同元素,桥上标变化。
(4)使用注意事项:
得到2×3e-
失去3×2e-
①标价态
②连双线
③注得失
1.标出变价元素的化合价,用双线桥法标出电子转移情况
点燃
4P+5O2 =2P2O5
①标价态
②连双线
③注得失
实战演练
2.下列氧化还原反应中,电子转移的方向和数目均正确的是( )
A
实战演练
3.氧化剂和还原剂在生产生活中广泛使用,高锰酸钾和浓盐酸可以发生如下反应:
2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O。(1)发生还原反应的物质是________,失去电子的原子是________ (填元素名称) 原子。(2)已知MnCl2属于可溶性盐,写出该反应的离子方程式:______________________________________________。(3)用双线桥法标出电子转移的方向和数目。2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O
KMnO4
氯
2MnO4-+16H++10Cl-=5Cl2↑+2Mn2++8H2O
+8H2O
掌握表示电子转移的方法——单线桥
学习目标 1min
教师点拨:10分钟
单线桥法
(1)含义:表示反应前后不同元素原子间电子转移的情况。
(2)示例:
(3)基本步骤:
(4)使用注意事项:①单线桥必须画在反应物中。②箭头由化合价升高元素开始到化合价降低元素终止。③不需要标出“失去”“得到”。(5)记忆口诀:先确定变价,再计算价态;
桥上标明电子数,箭头还原到氧化。
CuO + H2 =Cu + H2O
2e-
+2
0
0
+1
①明升降
②连单线
③注数目
1.标出变价元素的化合价,用单线桥法标出电子转移情况
2Na + Cl2 2NaCl
点燃
0 +1
0 -1
2e-
①明升降
②连单线
③注数目
实战演练
2.铜能与浓硝酸反应,化学方程式为
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。(1)用单线桥法标出电子转移的方向和数目。
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(2)上述反应中发生还原反应的物质是________,被氧化的元素是________,化合价降低的元素是________。(3)写出该反应的离子方程式为_________________________________________
2e-
HNO3
铜元素
氮元素
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
实战演练
效
果
检
测
+4 -1 +2 0
2e-
②MnO2 + 4HCl(浓) == MnCl2 + Cl2↑+ 2H2O
Δ
4
①
