3.1水与水溶液(含答案)同步练习-鲁科版高中化学选择性必修1
文档属性
| 名称 | 3.1水与水溶液(含答案)同步练习-鲁科版高中化学选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 439.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-01 00:00:00 | ||
图片预览




文档简介
3.1水与水溶液同步练习-鲁科版高中化学选择性必修1
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.水是生命之源,因此对于水的研究非常重要。下列说法中正确的是
A.100℃时pH=6为中性,则水的离子积常数为
B.溶液中溶液显酸性
C.常温下当水电离的为时,此溶液的pH可能为1或13
D.常温下,pH=2的溶液与pH=12的NaOH溶液等体积混合后,溶液的pH>7
2.某温度下,测得0.01mol L-1NaOH溶液的pH为11。在该温度下,将pH=4的HCl溶液与pH=11的Ba(OH)2溶液混合并保持恒温,欲使混合溶液呈中性,则HCl与Ba(OH)2溶液的体积之比为
A.1:10 B.10:1 C.100:1 D.1:100
3.常温下,某一元强酸HX溶液与某一元强碱MOH溶液按2∶5的体积比混合后,测得溶液中c(M+)=c(X—),则混合前,该强酸的pH与强碱的pH之和约为(已知:不考虑溶液混合时体积和温度的变化,lg2≈0.3)
A.13.3 B.13.6 C.13.9 D.14.2
4.NA为阿伏加德罗常数的值。下列叙述正确的是
A.电子总数为1.9 NA的Na2O2晶体中离子总数为0.2 NA
B.5.6g 铁粉与足量水蒸气完全反应转移的电子数为0.2 NA
C.标准状况下,11.2LNO与5.6LO2混合后分子总数为0.5 NA
D.室温下,1L pH= 13的Ba(OH)2溶液中阴离子数为0.1 NA
5.NA是阿伏加德罗常数的值。下列有关说法正确的是
A.常温常压下,1.8g氘羟基(-OD)中含有的中子数为0.9NA
B.标准状况下,11.2L戊烯中含有双键的数目为0.5NA
C.28gN2与足量H2反应,生成NH3的分子数为2NA
D.常温下,1LpH=2的HCl溶液中,H+数目为0.2NA
6.下列叙述与图象对应符合的是
A.图1表示达到平衡状态的在时刻充入了一定量的,平衡逆向移动
B.图2表示等体积,等pH值的盐酸和醋酸溶液分别与过量的反应
C.图3表示常温下,稀释、两种酸的稀溶液时,溶液随加水量的变化,则酸性强
D.对于反应,若,y可以表示Z的百分含量
7.与纯水的电离相似,液氨中也存在着微弱的电离:2NH3NH+NH。某温度下,液氨的离子积常数K=c(NH) c(NH)=1.6×10-29,若用定义pH一样来规定pN=-lgc(NH),则在该温度下,下列叙述正确的是
A.纯净的液氨中,pN=7
B.液氨达到电离平衡时c(NH3)=c(NH)+c(NH)
C.1L溶解有0.001molNH4C1的液氨溶液,其pN=3
D.1L溶解有0.001molNaNH2的液氨溶液,其pN=11
8.常温下,下列溶液中c(H+ )最小的是
A.0.01 mol·L-1 NaOH溶液 B.c(H+)=1×10-3 mol·L-1
C.c(OH-)=1×10-11 mol·L-1 D.c(OH-)= 1×10-14 mol·L-1
9.下列溶液,一定呈中性的是
A.c(H+)=1×10-7mol·L-1的溶液
B.c(H+)=c(OH-)=1×10-6mol·L-1的溶液
C.pH=14-pOH的溶液 [注pOH=-lg c(OH-)]
D.由等体积、等物质的量浓度的一元酸溶液与NaOH溶液混合后所形成的溶液
10.下列能说明溶液一定呈中性的是
A.pH=7的溶液 B.的溶液
C.的溶液 D.滴入酚酞不变色的溶液
二、填空题
11.某温度下,Kw=10-12。
(1)若保持温度不变,向少量水中加入 g的NaOH固体,并加水至1 L,才能使溶液中水电离产生的H+、OH-的浓度乘积即:c(H+)水·c(OH-)水=10-26。
(2)若保持温度不变,向水中通入的HCl气体恰好使溶液中c(H+)/c(OH-)=1010,则此时水电离的c(OH-)= mol·L-1。
(3)若保持温度不变,某溶液中c(H+)为1×10-7mol·L-1,则该溶液显 性(选填“酸”、“碱”或“中”)。
12.溶液酸碱度的表示方法
(1)可以用c平(H+)或c平(OH-)的大小表示溶液的酸碱度
c平(H+)越大 性越强, 性越弱;c平(OH-)越大 性越强, 性越弱。
(2)可以用pH大小表示溶液的酸碱度
pH= ,一定温度下pH越大,c平(H+)越 ,碱性越 。25℃中性溶液中c平(OH-)= ,pH= 。
13.水的电离平衡曲线如图所示,若A点表示时水的电离达平衡时的离子浓度,B点表示时水的电离达平衡时的离子浓度。则时的NaOH溶液中,由水电离出的 填“”、“”或“”。
14.已知水的电离平衡曲线如图所示。
(1)写出使点变为点的措施: 。
(2)向水中滴加溶液可实现点的变化,则点对应溶液的为 。
(3),的盐酸中水电离出来的为 ,,的溶液浓度为 。
15.(1)“完全中和”的含义是什么?
(2)酸与碱完全中和时,溶液的pH=7吗?
16.某温度下重水的离子积常数为1.6×10-15,像定义pH一样来规定pD=-lgc(D+),请回答以下问题:
(1)写出重水的电离方程式 。
(2)该温度下,重水中的c(D+)= ,pD= (已知lg2=0.3)。
(3)0.01mol·L-1的NaOD溶液pD= 。
17.回答下列问题:
(1)常温下,某种饮品pH=4,其中 。
(2)0.05 mol·L-1H2SO4溶液的pH= 。
(3)常温下,pH=13的氢氧化钡溶液, 。
18.已知某温度下,水的离子积常数,请回答下列问题:
(1)此温度 (填“>”“<”或“=”)25℃,原因是 。
(2)对水进行下列操作,能抑制水的电离的是_______(填标号,双选)。
A.通入适量SO2气体 B.加入适量Ba(OH)2溶液
C.升温至60℃ D.加入一小块Na
(3)此温度下纯水中的c(H+) 。
19.勒夏特列原理适用于许多平衡体系。试用该原理分析水的电离平衡(H2OH++OH-),填写下列表格(除④外,其余都假设溶液温度不变):
改变条件 平衡移动方向 c(H+)的变化 c(OH-)的变化 Kw
①加入醋酸
②加入烧碱
③加入CH3COONa
④升高温度
20.水的电离平衡曲线如图所示:
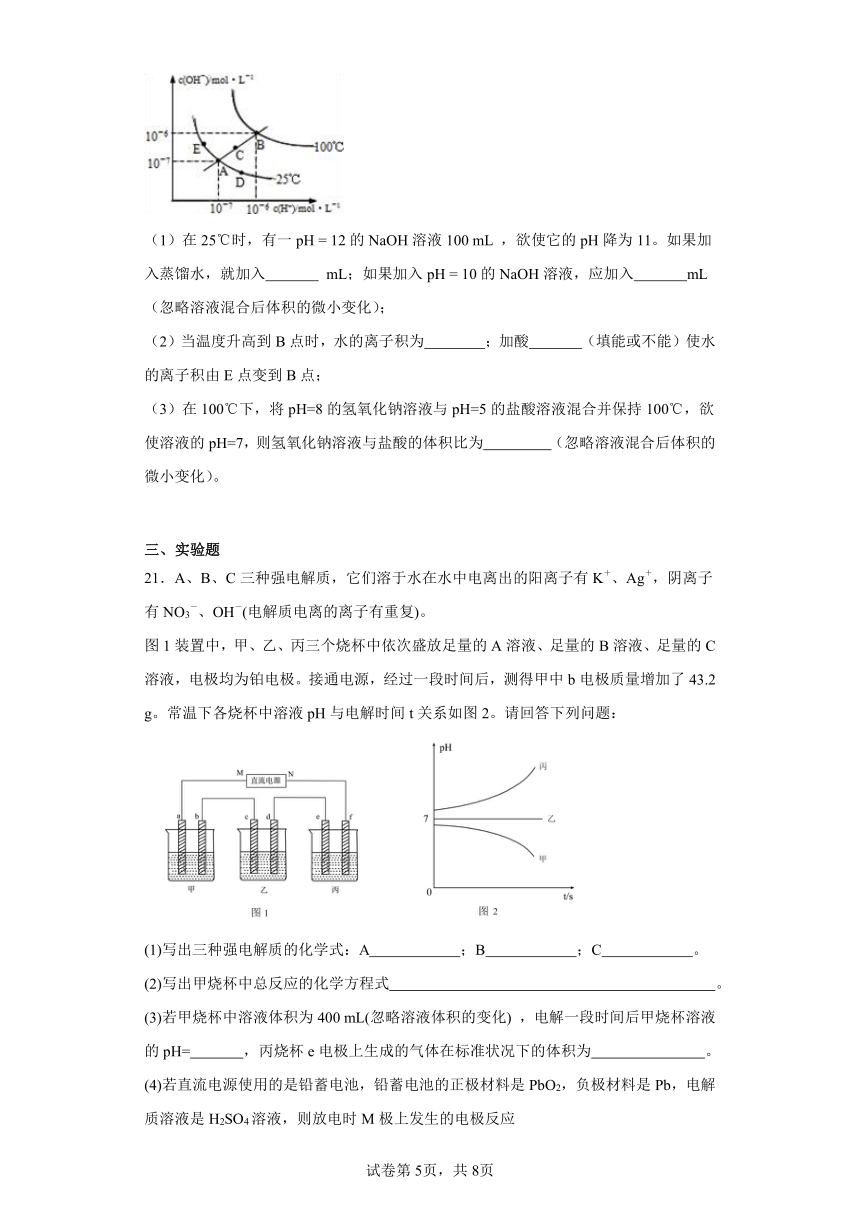
(1)在25℃时,有一pH = 12的NaOH溶液100 mL ,欲使它的pH降为11。如果加入蒸馏水,就加入 mL;如果加入pH = 10的NaOH溶液,应加入 mL(忽略溶液混合后体积的微小变化);
(2)当温度升高到B点时,水的离子积为 ;加酸 (填能或不能)使水的离子积由E点变到B点;
(3)在100℃下,将pH=8的氢氧化钠溶液与pH=5的盐酸溶液混合并保持100℃,欲使溶液的pH=7,则氢氧化钠溶液与盐酸的体积比为 (忽略溶液混合后体积的微小变化)。
三、实验题
21.A、B、C三种强电解质,它们溶于水在水中电离出的阳离子有K+、Ag+,阴离子有NO3-、OH-(电解质电离的离子有重复)。
图1装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为铂电极。接通电源,经过一段时间后,测得甲中b电极质量增加了43.2 g。常温下各烧杯中溶液pH与电解时间t关系如图2。请回答下列问题:
(1)写出三种强电解质的化学式:A ;B ;C 。
(2)写出甲烧杯中总反应的化学方程式 。
(3)若甲烧杯中溶液体积为400 mL(忽略溶液体积的变化) ,电解一段时间后甲烧杯溶液的pH= ,丙烧杯e电极上生成的气体在标准状况下的体积为 。
(4)若直流电源使用的是铅蓄电池,铅蓄电池的正极材料是PbO2,负极材料是Pb,电解质溶液是H2SO4溶液,则放电时M极上发生的电极反应为 。铅蓄电池充电时,若阳极和阴极之间用阳离子交换膜(只允许H+通过)隔开,则当外电路通过0.2 mol电子时,由阳极室通过阳离子交换膜进入阴极室的阳离子有 mol。
22.连二亚硫酸钠(Na2S2O4)俗称保险粉,黄色晶体,可溶于水,但难溶于甲醇和乙醇,易被空气氧化,在碱性介质中较稳定。某化学兴趣小组利用下图所示装置制备保险粉。
其制备过程如下:
步骤1:安装好整套装置,并检查装置的气密性;
步骤2:在锥形瓶中依次加入HCOONa、NaOH、甲醇(溶剂)和水形成混合液;
步骤3:打开分液漏斗活塞,向装置B中先通入一段时间SO2;
步骤4:用磁力搅拌器搅拌一段时间,装置B中有黄色晶体析出,并产生大量气体;
步骤5:过滤、用乙醇洗涤、干燥,收集产品。
回答下列问题:
(1)仪器a的名称为 。
(2)装置B中发生反应的化学方程式为 。
(3)仪器a的作用是 (答出一点即可)。
(4)打开分液漏斗活塞,向装置B中先通入一段时间SO2的目的是 。
(5)用乙醇洗涤保险粉的目的是 。
(6)常温下,测得0.050 mol·L-1 Na2S2O4溶液的pH随时间的变化关系如图所示:
若B点的溶质为NaHSO3,则C点的溶质是 (填化学式)。
23.氯化亚砜(SOCl2) 具有较强的巯基和羟基取代能力,广泛应用于有机合成中。 工业上可以利用SO3与SCl2反应制得,装置如图所示(夹持及加热装置已略):
物质相关性质如下表:
物质 SO3 SCl2 SOCl2
熔点/°C 16.8 -78 - 105
沸点/°C 44.8 60 78. 8
与水反应 均能与水剧烈反应
已知: H2SO4(浓) SO3↑+H2O↑; SCl2与SOCl2互溶。
实验步骤如下:
①通入干燥的氮气,观察集气瓶A中气泡控制N2流速;
②将P2O5固体置于烧瓶B中,向饶瓶B中分批缓慢加入5.44mL浓硫酸(约为0.100mol),再向锥形瓶C中加入足量SCl2;
③将烧瓶B升温至225°C,三氧化硫液体缓慢流入锥形瓶C中;
④待反应完成后取下锥形瓶C,“一系列操作” 后,得到高纯度的SOCl2。
回答下列问题:
(1)仪器a的名称为 ,锥形瓶C中生成氯化亚砜的方程式为 。
(2)该制备SOCl2装置存在的缺陷为 。
(3)实验步骤①通入N2的作用为 ,步骤④中的“一系列操作”为 (写出具体操作步骤)。
(4)将得到的SOCl2溶于水生成两种酸,取所得溶液体积的十分之一用0. 50mol·L-1标准碘溶液滴定,选用淀粉作指示剂,滴定终点消耗标准碘溶液的平均体积为13. 00mL,则SOCl2的产率为 (保留三位有效数字),若滴定后,滴定管尖嘴处有气泡,则测定结果 (填“偏高”“偏低”或“不变”)。
(5)某种锂电池的总反应为4Li+2SOCl2=4LiCl+S+SO2 ↑,该电池工作时正极的电极反应式为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.B
4.D
5.A
6.B
7.C
8.A
9.B
10.B
11. 400 10-11 碱
12.(1) 酸性 碱性 碱性 酸性
(2) -lg c平(H+) 小 强 c平(H+)=1.0×10-7 7
13.
14.(1)升高温度
(2)13
(3) 0.1
15. 酸与碱恰好反应生成盐 否
16.(1)D2OD++OD-
(2) 4×10-8mol·L-1 7.4
(3)12.8
17.(1)
(2)1
(3)
18.(1) > 水的电离是吸热过程,升高温度,促进水的电离,水的离子积常数随温度的升高而增大
(2)AB
(3)10-6 mol·L-1
19. 向左 变大 变小 不变 向左 变小 变大 不变 向右 变小 变大 不变 向右 变大 变大 变大
20. 900 1000 10-12 不能 2:9
21. AgNO3 KNO3 KOH 4AgNO3+2H2O4Ag+O2↑+4HNO3 0 2.24 L PbO2+2e-+4H++SO42-=PbSO4+2H2O 0.2
22. 长颈漏斗 HCOONa+2SO2+NaOH=Na2S2O4+CO2+H2O 可通过长颈漏斗内液面的高度,控制滴加硫酸的速度 排尽整套装置中的空气,防止生成的Na2S2O4被空气中的O2氧化 保险粉难溶于乙醇,减少洗涤时保险粉的损耗,且乙醇易挥发,有利于保险粉的干燥 NaHSO4
23.(1) 蛇形冷凝管或冷凝管 SO3+SCl2=SOCl2+SO2
(2)尾气处理装置D前无干燥装置
(3) 抑制三氧化硫气体逸出,起到封闭的作用(或防止外界的水和氧气进入蒸馏装置) 取下锥形瓶C,将液体转移至蒸馏烧瓶中,加入几粒沸石,温度计下端水银球置于蒸馏烧瓶支管口处,向冷凝管中通冷凝水,加热蒸馏烧瓶,收集78.8℃的馏分
(4) 65.0% 偏低
(5)2SOCl2+4e =S↓+SO2↑+4Cl
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.水是生命之源,因此对于水的研究非常重要。下列说法中正确的是
A.100℃时pH=6为中性,则水的离子积常数为
B.溶液中溶液显酸性
C.常温下当水电离的为时,此溶液的pH可能为1或13
D.常温下,pH=2的溶液与pH=12的NaOH溶液等体积混合后,溶液的pH>7
2.某温度下,测得0.01mol L-1NaOH溶液的pH为11。在该温度下,将pH=4的HCl溶液与pH=11的Ba(OH)2溶液混合并保持恒温,欲使混合溶液呈中性,则HCl与Ba(OH)2溶液的体积之比为
A.1:10 B.10:1 C.100:1 D.1:100
3.常温下,某一元强酸HX溶液与某一元强碱MOH溶液按2∶5的体积比混合后,测得溶液中c(M+)=c(X—),则混合前,该强酸的pH与强碱的pH之和约为(已知:不考虑溶液混合时体积和温度的变化,lg2≈0.3)
A.13.3 B.13.6 C.13.9 D.14.2
4.NA为阿伏加德罗常数的值。下列叙述正确的是
A.电子总数为1.9 NA的Na2O2晶体中离子总数为0.2 NA
B.5.6g 铁粉与足量水蒸气完全反应转移的电子数为0.2 NA
C.标准状况下,11.2LNO与5.6LO2混合后分子总数为0.5 NA
D.室温下,1L pH= 13的Ba(OH)2溶液中阴离子数为0.1 NA
5.NA是阿伏加德罗常数的值。下列有关说法正确的是
A.常温常压下,1.8g氘羟基(-OD)中含有的中子数为0.9NA
B.标准状况下,11.2L戊烯中含有双键的数目为0.5NA
C.28gN2与足量H2反应,生成NH3的分子数为2NA
D.常温下,1LpH=2的HCl溶液中,H+数目为0.2NA
6.下列叙述与图象对应符合的是
A.图1表示达到平衡状态的在时刻充入了一定量的,平衡逆向移动
B.图2表示等体积,等pH值的盐酸和醋酸溶液分别与过量的反应
C.图3表示常温下,稀释、两种酸的稀溶液时,溶液随加水量的变化,则酸性强
D.对于反应,若,y可以表示Z的百分含量
7.与纯水的电离相似,液氨中也存在着微弱的电离:2NH3NH+NH。某温度下,液氨的离子积常数K=c(NH) c(NH)=1.6×10-29,若用定义pH一样来规定pN=-lgc(NH),则在该温度下,下列叙述正确的是
A.纯净的液氨中,pN=7
B.液氨达到电离平衡时c(NH3)=c(NH)+c(NH)
C.1L溶解有0.001molNH4C1的液氨溶液,其pN=3
D.1L溶解有0.001molNaNH2的液氨溶液,其pN=11
8.常温下,下列溶液中c(H+ )最小的是
A.0.01 mol·L-1 NaOH溶液 B.c(H+)=1×10-3 mol·L-1
C.c(OH-)=1×10-11 mol·L-1 D.c(OH-)= 1×10-14 mol·L-1
9.下列溶液,一定呈中性的是
A.c(H+)=1×10-7mol·L-1的溶液
B.c(H+)=c(OH-)=1×10-6mol·L-1的溶液
C.pH=14-pOH的溶液 [注pOH=-lg c(OH-)]
D.由等体积、等物质的量浓度的一元酸溶液与NaOH溶液混合后所形成的溶液
10.下列能说明溶液一定呈中性的是
A.pH=7的溶液 B.的溶液
C.的溶液 D.滴入酚酞不变色的溶液
二、填空题
11.某温度下,Kw=10-12。
(1)若保持温度不变,向少量水中加入 g的NaOH固体,并加水至1 L,才能使溶液中水电离产生的H+、OH-的浓度乘积即:c(H+)水·c(OH-)水=10-26。
(2)若保持温度不变,向水中通入的HCl气体恰好使溶液中c(H+)/c(OH-)=1010,则此时水电离的c(OH-)= mol·L-1。
(3)若保持温度不变,某溶液中c(H+)为1×10-7mol·L-1,则该溶液显 性(选填“酸”、“碱”或“中”)。
12.溶液酸碱度的表示方法
(1)可以用c平(H+)或c平(OH-)的大小表示溶液的酸碱度
c平(H+)越大 性越强, 性越弱;c平(OH-)越大 性越强, 性越弱。
(2)可以用pH大小表示溶液的酸碱度
pH= ,一定温度下pH越大,c平(H+)越 ,碱性越 。25℃中性溶液中c平(OH-)= ,pH= 。
13.水的电离平衡曲线如图所示,若A点表示时水的电离达平衡时的离子浓度,B点表示时水的电离达平衡时的离子浓度。则时的NaOH溶液中,由水电离出的 填“”、“”或“”。
14.已知水的电离平衡曲线如图所示。
(1)写出使点变为点的措施: 。
(2)向水中滴加溶液可实现点的变化,则点对应溶液的为 。
(3),的盐酸中水电离出来的为 ,,的溶液浓度为 。
15.(1)“完全中和”的含义是什么?
(2)酸与碱完全中和时,溶液的pH=7吗?
16.某温度下重水的离子积常数为1.6×10-15,像定义pH一样来规定pD=-lgc(D+),请回答以下问题:
(1)写出重水的电离方程式 。
(2)该温度下,重水中的c(D+)= ,pD= (已知lg2=0.3)。
(3)0.01mol·L-1的NaOD溶液pD= 。
17.回答下列问题:
(1)常温下,某种饮品pH=4,其中 。
(2)0.05 mol·L-1H2SO4溶液的pH= 。
(3)常温下,pH=13的氢氧化钡溶液, 。
18.已知某温度下,水的离子积常数,请回答下列问题:
(1)此温度 (填“>”“<”或“=”)25℃,原因是 。
(2)对水进行下列操作,能抑制水的电离的是_______(填标号,双选)。
A.通入适量SO2气体 B.加入适量Ba(OH)2溶液
C.升温至60℃ D.加入一小块Na
(3)此温度下纯水中的c(H+) 。
19.勒夏特列原理适用于许多平衡体系。试用该原理分析水的电离平衡(H2OH++OH-),填写下列表格(除④外,其余都假设溶液温度不变):
改变条件 平衡移动方向 c(H+)的变化 c(OH-)的变化 Kw
①加入醋酸
②加入烧碱
③加入CH3COONa
④升高温度
20.水的电离平衡曲线如图所示:
(1)在25℃时,有一pH = 12的NaOH溶液100 mL ,欲使它的pH降为11。如果加入蒸馏水,就加入 mL;如果加入pH = 10的NaOH溶液,应加入 mL(忽略溶液混合后体积的微小变化);
(2)当温度升高到B点时,水的离子积为 ;加酸 (填能或不能)使水的离子积由E点变到B点;
(3)在100℃下,将pH=8的氢氧化钠溶液与pH=5的盐酸溶液混合并保持100℃,欲使溶液的pH=7,则氢氧化钠溶液与盐酸的体积比为 (忽略溶液混合后体积的微小变化)。
三、实验题
21.A、B、C三种强电解质,它们溶于水在水中电离出的阳离子有K+、Ag+,阴离子有NO3-、OH-(电解质电离的离子有重复)。
图1装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为铂电极。接通电源,经过一段时间后,测得甲中b电极质量增加了43.2 g。常温下各烧杯中溶液pH与电解时间t关系如图2。请回答下列问题:
(1)写出三种强电解质的化学式:A ;B ;C 。
(2)写出甲烧杯中总反应的化学方程式 。
(3)若甲烧杯中溶液体积为400 mL(忽略溶液体积的变化) ,电解一段时间后甲烧杯溶液的pH= ,丙烧杯e电极上生成的气体在标准状况下的体积为 。
(4)若直流电源使用的是铅蓄电池,铅蓄电池的正极材料是PbO2,负极材料是Pb,电解质溶液是H2SO4溶液,则放电时M极上发生的电极反应为 。铅蓄电池充电时,若阳极和阴极之间用阳离子交换膜(只允许H+通过)隔开,则当外电路通过0.2 mol电子时,由阳极室通过阳离子交换膜进入阴极室的阳离子有 mol。
22.连二亚硫酸钠(Na2S2O4)俗称保险粉,黄色晶体,可溶于水,但难溶于甲醇和乙醇,易被空气氧化,在碱性介质中较稳定。某化学兴趣小组利用下图所示装置制备保险粉。
其制备过程如下:
步骤1:安装好整套装置,并检查装置的气密性;
步骤2:在锥形瓶中依次加入HCOONa、NaOH、甲醇(溶剂)和水形成混合液;
步骤3:打开分液漏斗活塞,向装置B中先通入一段时间SO2;
步骤4:用磁力搅拌器搅拌一段时间,装置B中有黄色晶体析出,并产生大量气体;
步骤5:过滤、用乙醇洗涤、干燥,收集产品。
回答下列问题:
(1)仪器a的名称为 。
(2)装置B中发生反应的化学方程式为 。
(3)仪器a的作用是 (答出一点即可)。
(4)打开分液漏斗活塞,向装置B中先通入一段时间SO2的目的是 。
(5)用乙醇洗涤保险粉的目的是 。
(6)常温下,测得0.050 mol·L-1 Na2S2O4溶液的pH随时间的变化关系如图所示:
若B点的溶质为NaHSO3,则C点的溶质是 (填化学式)。
23.氯化亚砜(SOCl2) 具有较强的巯基和羟基取代能力,广泛应用于有机合成中。 工业上可以利用SO3与SCl2反应制得,装置如图所示(夹持及加热装置已略):
物质相关性质如下表:
物质 SO3 SCl2 SOCl2
熔点/°C 16.8 -78 - 105
沸点/°C 44.8 60 78. 8
与水反应 均能与水剧烈反应
已知: H2SO4(浓) SO3↑+H2O↑; SCl2与SOCl2互溶。
实验步骤如下:
①通入干燥的氮气,观察集气瓶A中气泡控制N2流速;
②将P2O5固体置于烧瓶B中,向饶瓶B中分批缓慢加入5.44mL浓硫酸(约为0.100mol),再向锥形瓶C中加入足量SCl2;
③将烧瓶B升温至225°C,三氧化硫液体缓慢流入锥形瓶C中;
④待反应完成后取下锥形瓶C,“一系列操作” 后,得到高纯度的SOCl2。
回答下列问题:
(1)仪器a的名称为 ,锥形瓶C中生成氯化亚砜的方程式为 。
(2)该制备SOCl2装置存在的缺陷为 。
(3)实验步骤①通入N2的作用为 ,步骤④中的“一系列操作”为 (写出具体操作步骤)。
(4)将得到的SOCl2溶于水生成两种酸,取所得溶液体积的十分之一用0. 50mol·L-1标准碘溶液滴定,选用淀粉作指示剂,滴定终点消耗标准碘溶液的平均体积为13. 00mL,则SOCl2的产率为 (保留三位有效数字),若滴定后,滴定管尖嘴处有气泡,则测定结果 (填“偏高”“偏低”或“不变”)。
(5)某种锂电池的总反应为4Li+2SOCl2=4LiCl+S+SO2 ↑,该电池工作时正极的电极反应式为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.B
4.D
5.A
6.B
7.C
8.A
9.B
10.B
11. 400 10-11 碱
12.(1) 酸性 碱性 碱性 酸性
(2) -lg c平(H+) 小 强 c平(H+)=1.0×10-7 7
13.
14.(1)升高温度
(2)13
(3) 0.1
15. 酸与碱恰好反应生成盐 否
16.(1)D2OD++OD-
(2) 4×10-8mol·L-1 7.4
(3)12.8
17.(1)
(2)1
(3)
18.(1) > 水的电离是吸热过程,升高温度,促进水的电离,水的离子积常数随温度的升高而增大
(2)AB
(3)10-6 mol·L-1
19. 向左 变大 变小 不变 向左 变小 变大 不变 向右 变小 变大 不变 向右 变大 变大 变大
20. 900 1000 10-12 不能 2:9
21. AgNO3 KNO3 KOH 4AgNO3+2H2O4Ag+O2↑+4HNO3 0 2.24 L PbO2+2e-+4H++SO42-=PbSO4+2H2O 0.2
22. 长颈漏斗 HCOONa+2SO2+NaOH=Na2S2O4+CO2+H2O 可通过长颈漏斗内液面的高度,控制滴加硫酸的速度 排尽整套装置中的空气,防止生成的Na2S2O4被空气中的O2氧化 保险粉难溶于乙醇,减少洗涤时保险粉的损耗,且乙醇易挥发,有利于保险粉的干燥 NaHSO4
23.(1) 蛇形冷凝管或冷凝管 SO3+SCl2=SOCl2+SO2
(2)尾气处理装置D前无干燥装置
(3) 抑制三氧化硫气体逸出,起到封闭的作用(或防止外界的水和氧气进入蒸馏装置) 取下锥形瓶C,将液体转移至蒸馏烧瓶中,加入几粒沸石,温度计下端水银球置于蒸馏烧瓶支管口处,向冷凝管中通冷凝水,加热蒸馏烧瓶,收集78.8℃的馏分
(4) 65.0% 偏低
(5)2SOCl2+4e =S↓+SO2↑+4Cl
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
