2023—2024学年上学期高二化学鲁科版(2019)选择性必修一第2章 化学反应的方向、限度与速率 课后练习含答案
文档属性
| 名称 | 2023—2024学年上学期高二化学鲁科版(2019)选择性必修一第2章 化学反应的方向、限度与速率 课后练习含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-02 08:37:24 | ||
图片预览




文档简介
2023—2024学年上学期高二化学鲁科版(2019)选择性必修一第2章 化学反应的方向、限度与速率 课后练习含答案
鲁科版(2019)第2章 化学反应的方向、限度与速率
一、选择题。(18题)
1、已知某化学反应A 2(g) +2B 2(g) = 2AB 2(g)的能量变化如图所示,下列有关叙述中正确的是 ( )
A.该反应是熵增加的反应
B.该反应的ΔH=-(E1-E2) kJ·mol-1
C.该反应的活化能为E2
D.该反应中,反应物分子的键能总和大于生成物分子的键能总和
2、下列事实不能用勒·夏特列原理解释的是( )
A.氯水中存在平衡:Cl2+H2OHCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B.对于反应CO(g)+NO2(g)CO2(g)+NO(g),增大平衡体系的压强,可使颜色变深
C.对于反应2NO2(g)N2O4(g) ΔH<0,升高平衡体系的温度,颜色变深
D.SO2催化氧化成SO3的反应,加入过量的空气
3、如图表示不同温度(T)和压强(p)对可逆反应:
2L(g) 2M(g)+2N(g) △H>0的影响,且p2>p1。则图中纵轴表示的意义可能是( )
①一定条件下L的转化率 ②混合气体中M的百分含量
③混合气体中L的百分含量 ④混合气体的平均摩尔质量
A.①③ B.②④ C.①② D.②③
4、化合物Bilirubin在一定波长的光照下发生分解反应,反应物浓度随反应时间的变化如图所示,计算用反应物表示的4~8min内的平均反应速率和推测反应在16min时反应物的浓度,结果应分别是( )
A.和 B.和
C.和 D.和
5、在不同条件下分别测得反应2SO2+O22SO3的化学反应速率,其中表示该反应进行得最快的是( )
A.v(SO2)=4mol/(L·min) B.v(O2)=3mol/(L·min)
C.v(O2)=0.1mol/(L·s) D.v(SO3)=0.1mol/(L·s)
6、一定温度下,某气态平衡体系的平衡常数表达式为K=,有关该平衡体系的说法正确的是( )
A.升高温度,平衡常数K一定增大
B.增大A浓度,平衡向正反应方向移动
C.增大压强,C体积分数增加
D.升高温度,若B的百分含量减少,则正反应是放热反应
7、H2与ICl的反应分①、②两步进行,其能量曲线如图所示,下列有关说法错误的是( )
A.反应①、反应②均为放热反应
B.反应①、反应②均为氧化还原反应
C.H2与ICl的总反应速率快慢取决于反应②
D.反应H2(g)+2ICl(g)=I2(g)+2HCl(g)的ΔH=-218kJ·mol-1
8、下列反应常温时能自发进行,既能用焓判据又能用熵判据解释的是( )
A.HCl+NH3=NH4Cl B.2Na2O2+2H20=4NaOH+O2↑
C.2KClO3=2KCl+302↑ D.Ba(OH)2 8H20+2NH4Cl=BaCl2+2NH3↑+10H2O
9、有甲、乙、丙三支试管,分别加入下列物质后,观察这三支试管的颜色,其中颜色最浅的是( )
甲:10 mL 0.01 mol·L-1的FeCl3溶液和10 mL 0.01 mol·L-1的KSCN溶液
乙:5 mL水、10 mL 0.01 mol·L-1的FeCl3溶液和5 mL 0.01 mol·L-1的KSCN溶液
丙:10 mL 0.1 mol·L-1的FeCl3溶液和10 mL 0.1 mol·L-1的KSCN溶液
A.甲试管 B.乙试管 C.丙试管 D.无法判断
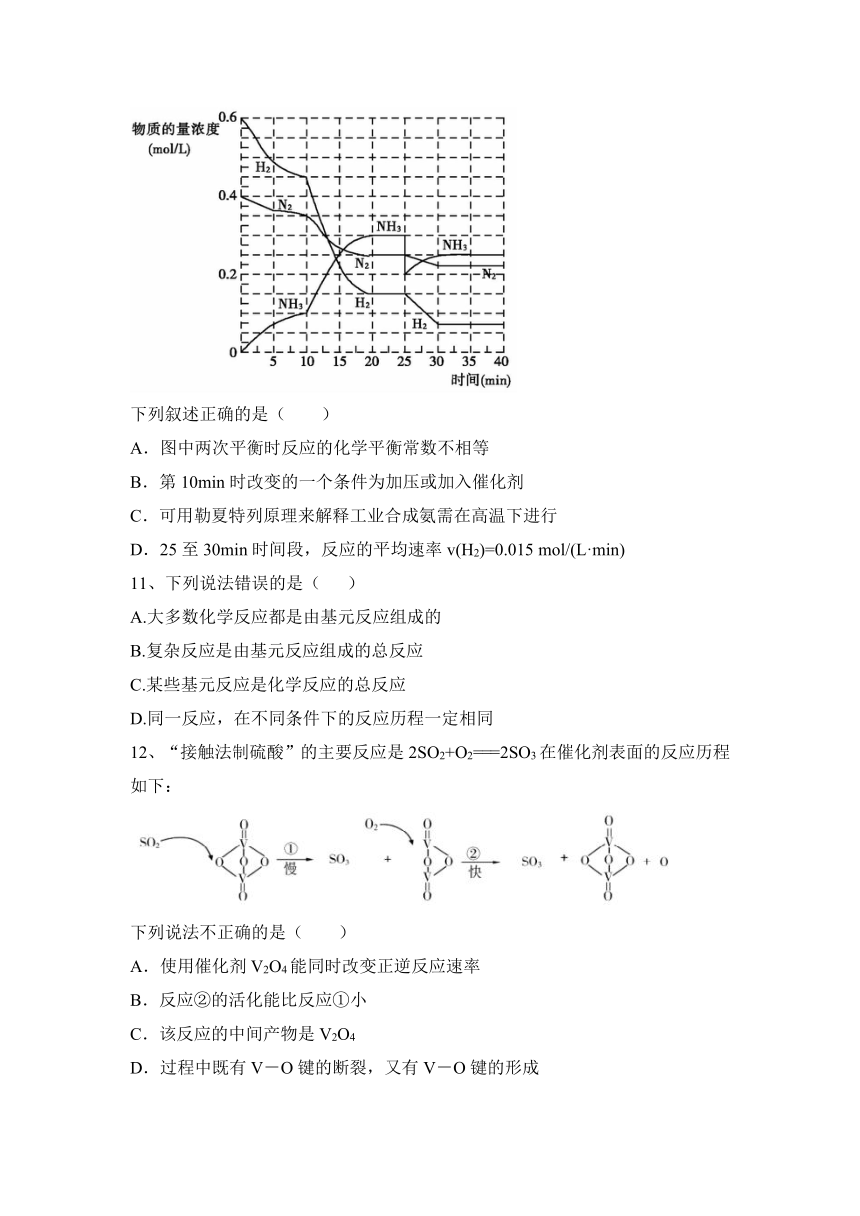
10、氨是最基本的化工原料之一。工业合成氨的反应为 3H2(g)+N2(g)2NH3(g) H<0,在一定条件下,将H2(g)和N2(g)充入恒容密闭容器中,反应过程中各物质的物质的量浓度随时间的变化如图所示∶
下列叙述正确的是( )
A.图中两次平衡时反应的化学平衡常数不相等
B.第10min时改变的一个条件为加压或加入催化剂
C.可用勒夏特列原理来解释工业合成氨需在高温下进行
D.25至30min时间段,反应的平均速率v(H2)=0.015 mol/(L·min)
11、下列说法错误的是( )
A.大多数化学反应都是由基元反应组成的
B.复杂反应是由基元反应组成的总反应
C.某些基元反应是化学反应的总反应
D.同一反应,在不同条件下的反应历程一定相同
12、“接触法制硫酸”的主要反应是2SO2+O2===2SO3在催化剂表面的反应历程如下:
下列说法不正确的是( )
A.使用催化剂V2O4能同时改变正逆反应速率
B.反应②的活化能比反应①小
C.该反应的中间产物是V2O4
D.过程中既有V-O键的断裂,又有V-O键的形成
13、某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)Z(g)+W(s) ΔH>0。下列叙述正确的是( )
A.加入少量W,逆反应速率增大,正反应速率减小
B.升高温度,平衡逆向移动
C.当容器中气体压强不变时,反应达到平衡
D.反应平衡后加入X,上述反应的ΔH增大
14、3.25 g锌与100 mL 1 mol·L-1的稀硫酸反应,为了加快反应速率而不改变H2的产量,可采取的措施是( )
A.滴加几滴浓盐酸 B.滴加几滴浓硝酸
C.滴加几滴硫酸铜溶液 D.加入少量锌粒
15、下列反应在常温下均为非自发反应,在高温下仍为非自发反应的是( )
A.Ag2O(s)===2Ag(s)+O2(g)
B.Fe2O3(s)+C(s)===2Fe(s)+CO2(g)
C.N2O4(g)===2NO2(g)
D.6C(s)+6H2O(l)===C6H12O6(s)
16、把HI气体充入密闭容器中在一定条件下发生反应.2HI(g) H2(g)+I2(g),在反应趋向化学反应限度的过程中,下列说法正确的是( )
A.HI的生成速率等于其分解速率 B.HI的生成速率小于其分解速率
C.HI的生成速率大于其分解速率 D.无法判断
17、将 a mol N2 和 3a mol H2 充入绝热的固定容积密闭容器中,发生合成氨反应 N2(g) + 3H2(g) 2NH3(g)。下列选项中说明反应已经达到平衡状态的是( )
①体系的温度不再改变;②体系的压强不再改变;③混合气体密度不再改变;④混合气体的平均摩尔质量不再改变;⑤N2 和 H2 的浓度之比达到 1:3;⑥v(N2)正反应 = 3v(H2)逆反应; ⑦2v(H2)正反应 = 3v(NH3)逆反应;⑧每有一个N≡N 键断裂就有 6个N-H 键形成
A.②④⑤⑥ B.②④⑥⑧ C.①②④⑥ D.①②④⑦
18、在恒温、恒容条件下发生下列反应:2X2O5 (g) 4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
t/s 0 50 100 150
c(X2O5) mol/L 4.00 2.50 2.00 2.00
下列说法错误的是( )
A.T温度下的平衡数为K=64 (mol/L)3,100s时转化率为50%
B.50s 内 X2O5分解速率为 0.03 mol/ (L s)
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则Kl>K2
D.若只将恒容改为恒压,其它条件都不变,则平衡时X2O5的转化率和平衡常数都不变
二、填空题。(2题)
19、二氧化碳的捕集、存储和转化是当今化学研究的热点问题之一。
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解,发生反应,该反应的________(填“>”“<”或“=”,下同)0,_________0,在低温下,该反应________(填“能”或“不能”)自发进行。
(2)的转化途径之一是首先利用太阳能或生物质能分解水制,然后将与转化为甲醇或其他化学产品。你认为该方法需要解决的技术问题有__________(填字母)。
a.开发高效光催化剂
b.将通过光催化剂制取的从反应体系中有效分离,并与发生催化转化
c.二氧化碳及水资源的供应
20、反应M(l)+N(l) ===E(l)+F(l)分别在相同压强和348K、343K、338K条件下进行,起始时均按M与N的物质的量比1:1投料,测得α(M)随时间t的变化关系如图所示。
已知:v正=k正·x(M) x(N),v逆=k逆·x(E) x(F),其中v正、v逆分别为正、逆反应的反应速率,k正、k逆分别为正、逆反应的速率常数,x为各组分的物质的量分数。回答下列问题:
(1)348K时,以物质的量分数表示的化学平衡常数Kx=________(保留2位有效数字)。该温度下,分别按M与N物质的量之比1:1、1:2和2:1进行初始投料,则达到平衡后,初始投料比为________时,M的转化率最大;与按1:1投料相比,按2:1投料时化学平衡常数Kx________。(填“增大”“减小”或“不变”)。
(2)A、B、C、D四点中,v正最大的是________点,v逆最大的是________点。
(3)在曲线①、②、③中,正、逆反应的速率常数值k正-k逆最大的曲线是________。
三、综合题。(2题)
21、(1)真空碳热冶铝法包含很多反应,其中的三个反应如下:
Al2O3(s)+3C(s)= Al2OC(s)+2CO(g) ΔH1
2Al2OC(s)+3C(s)= Al4C3(s)+2CO(g) ΔH2
2Al2O3(s)+9C(s)= Al4C3(s)+6CO(g) ΔH3
则ΔH3=____(用ΔH1、ΔH2表示)。
(2)下列是碳热还原法制锰合金的三个反应,CO与CO2平衡分压比的自然对数值(lnK=2.303lgK)与温度的关系如图所示(已知Kp是用平衡分压代替浓度计算所得的平衡常数,分压=总压×气体的物质的量分数)。
Ⅰ.Mn3C(s)+4CO2(g)3MnO(s)+5CO(g) Kp(Ⅰ)
Ⅱ.Mn(s)+CO2(g) MnO(s)+CO(g) Kp(Ⅱ)
Ⅲ.Mn3C(s)+CO2(g) 3Mn(s)+2CO(g) Kp(Ⅲ)
①ΔH>0的反应是____(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
②1 200 K时,在一体积为2 L的恒容密闭容器中有17.7 g Mn3C(s)和0.4 mol CO2,只发生反应Ⅰ,5 min后达到平衡,此时CO的浓度为0.125 mol/L,则0~5 min内v(CO2)=____。
③在一体积可变的密闭容器中加入一定量的Mn(s)并充入一定量的CO2(g),只发生反应Ⅱ,下列能说明反应Ⅱ达到平衡的是____(填字母)。
A.容器的体积不再改变 B.固体的质量不再改变 C.气体的总质量不再改变
④向恒容密闭容器中加入Mn3C并充入0.1molCO2,若只发生反应Ⅲ,则在A点反应达到平衡,当容器的总压为a kPa时,CO2的转化率为_______;A点对应温度下Kp(Ⅲ)=_______。
22、I.一定的条件下,合成氨反应为:N2(g)+3H2(g)2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
(1)该反应的平衡常数表达式为_____,升高温度,平衡常数____(填“增大”或“减小”或“不变”)。
(2)由图2信息,计算0~10min内该反应的平均速率v(H2)=____,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 ______(填“a”或“b”或“c”或“d”)
(3)图3的a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是_____点,温度T1___T2(填“>”或“=”或“<”)
Ⅱ.如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(1)M电极的材料是________。
(2)通入乙醇的铂电极的电极反应式为:________。
2023—2024学年上学期高二化学鲁科版(2019)选择性必修一第2章 化学反应的方向、限度与速率 课后练习含答案
鲁科版(2019)第2章 化学反应的方向、限度与速率
一、选择题。(18题)
1、已知某化学反应A 2(g) +2B 2(g) = 2AB 2(g)的能量变化如图所示,下列有关叙述中正确的是 ( )
A.该反应是熵增加的反应
B.该反应的ΔH=-(E1-E2) kJ·mol-1
C.该反应的活化能为E2
D.该反应中,反应物分子的键能总和大于生成物分子的键能总和
【答案】D
2、下列事实不能用勒·夏特列原理解释的是( )
A.氯水中存在平衡:Cl2+H2OHCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B.对于反应CO(g)+NO2(g)CO2(g)+NO(g),增大平衡体系的压强,可使颜色变深
C.对于反应2NO2(g)N2O4(g) ΔH<0,升高平衡体系的温度,颜色变深
D.SO2催化氧化成SO3的反应,加入过量的空气
【答案】B
3、如图表示不同温度(T)和压强(p)对可逆反应:
2L(g) 2M(g)+2N(g) △H>0的影响,且p2>p1。则图中纵轴表示的意义可能是( )
①一定条件下L的转化率 ②混合气体中M的百分含量
③混合气体中L的百分含量 ④混合气体的平均摩尔质量
A.①③ B.②④ C.①② D.②③
【答案】C
4、化合物Bilirubin在一定波长的光照下发生分解反应,反应物浓度随反应时间的变化如图所示,计算用反应物表示的4~8min内的平均反应速率和推测反应在16min时反应物的浓度,结果应分别是( )
A.和 B.和
C.和 D.和
【答案】B
5、在不同条件下分别测得反应2SO2+O22SO3的化学反应速率,其中表示该反应进行得最快的是( )
A.v(SO2)=4mol/(L·min) B.v(O2)=3mol/(L·min)
C.v(O2)=0.1mol/(L·s) D.v(SO3)=0.1mol/(L·s)
【答案】C
6、一定温度下,某气态平衡体系的平衡常数表达式为K=,有关该平衡体系的说法正确的是( )
A.升高温度,平衡常数K一定增大
B.增大A浓度,平衡向正反应方向移动
C.增大压强,C体积分数增加
D.升高温度,若B的百分含量减少,则正反应是放热反应
【答案】D
7、H2与ICl的反应分①、②两步进行,其能量曲线如图所示,下列有关说法错误的是( )
A.反应①、反应②均为放热反应
B.反应①、反应②均为氧化还原反应
C.H2与ICl的总反应速率快慢取决于反应②
D.反应H2(g)+2ICl(g)=I2(g)+2HCl(g)的ΔH=-218kJ·mol-1
【答案】C
8、下列反应常温时能自发进行,既能用焓判据又能用熵判据解释的是( )
A.HCl+NH3=NH4Cl B.2Na2O2+2H20=4NaOH+O2↑
C.2KClO3=2KCl+302↑ D.Ba(OH)2 8H20+2NH4Cl=BaCl2+2NH3↑+10H2O
【答案】B
9、有甲、乙、丙三支试管,分别加入下列物质后,观察这三支试管的颜色,其中颜色最浅的是( )
甲:10 mL 0.01 mol·L-1的FeCl3溶液和10 mL 0.01 mol·L-1的KSCN溶液
乙:5 mL水、10 mL 0.01 mol·L-1的FeCl3溶液和5 mL 0.01 mol·L-1的KSCN溶液
丙:10 mL 0.1 mol·L-1的FeCl3溶液和10 mL 0.1 mol·L-1的KSCN溶液
A.甲试管 B.乙试管 C.丙试管 D.无法判断
【答案】B
10、氨是最基本的化工原料之一。工业合成氨的反应为 3H2(g)+N2(g)2NH3(g) H<0,在一定条件下,将H2(g)和N2(g)充入恒容密闭容器中,反应过程中各物质的物质的量浓度随时间的变化如图所示∶
下列叙述正确的是( )
A.图中两次平衡时反应的化学平衡常数不相等
B.第10min时改变的一个条件为加压或加入催化剂
C.可用勒夏特列原理来解释工业合成氨需在高温下进行
D.25至30min时间段,反应的平均速率v(H2)=0.015 mol/(L·min)
【答案】D
11、下列说法错误的是( )
A.大多数化学反应都是由基元反应组成的
B.复杂反应是由基元反应组成的总反应
C.某些基元反应是化学反应的总反应
D.同一反应,在不同条件下的反应历程一定相同
【答案】D
12、“接触法制硫酸”的主要反应是2SO2+O2===2SO3在催化剂表面的反应历程如下:
下列说法不正确的是( )
A.使用催化剂V2O4能同时改变正逆反应速率
B.反应②的活化能比反应①小
C.该反应的中间产物是V2O4
D.过程中既有V-O键的断裂,又有V-O键的形成
【答案】A
13、某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)Z(g)+W(s) ΔH>0。下列叙述正确的是( )
A.加入少量W,逆反应速率增大,正反应速率减小
B.升高温度,平衡逆向移动
C.当容器中气体压强不变时,反应达到平衡
D.反应平衡后加入X,上述反应的ΔH增大
【答案】C
14、3.25 g锌与100 mL 1 mol·L-1的稀硫酸反应,为了加快反应速率而不改变H2的产量,可采取的措施是( )
A.滴加几滴浓盐酸 B.滴加几滴浓硝酸
C.滴加几滴硫酸铜溶液 D.加入少量锌粒
【答案】A
15、下列反应在常温下均为非自发反应,在高温下仍为非自发反应的是( )
A.Ag2O(s)===2Ag(s)+O2(g)
B.Fe2O3(s)+C(s)===2Fe(s)+CO2(g)
C.N2O4(g)===2NO2(g)
D.6C(s)+6H2O(l)===C6H12O6(s)
【答案】D
16、把HI气体充入密闭容器中在一定条件下发生反应.2HI(g) H2(g)+I2(g),在反应趋向化学反应限度的过程中,下列说法正确的是( )
A.HI的生成速率等于其分解速率 B.HI的生成速率小于其分解速率
C.HI的生成速率大于其分解速率 D.无法判断
【答案】B
17、将 a mol N2 和 3a mol H2 充入绝热的固定容积密闭容器中,发生合成氨反应 N2(g) + 3H2(g) 2NH3(g)。下列选项中说明反应已经达到平衡状态的是( )
①体系的温度不再改变;②体系的压强不再改变;③混合气体密度不再改变;④混合气体的平均摩尔质量不再改变;⑤N2 和 H2 的浓度之比达到 1:3;⑥v(N2)正反应 = 3v(H2)逆反应; ⑦2v(H2)正反应 = 3v(NH3)逆反应;⑧每有一个N≡N 键断裂就有 6个N-H 键形成
A.②④⑤⑥ B.②④⑥⑧ C.①②④⑥ D.①②④⑦
【答案】D
18、在恒温、恒容条件下发生下列反应:2X2O5 (g) 4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
t/s 0 50 100 150
c(X2O5) mol/L 4.00 2.50 2.00 2.00
下列说法错误的是( )
A.T温度下的平衡数为K=64 (mol/L)3,100s时转化率为50%
B.50s 内 X2O5分解速率为 0.03 mol/ (L s)
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则Kl>K2
D.若只将恒容改为恒压,其它条件都不变,则平衡时X2O5的转化率和平衡常数都不变
【答案】D
二、填空题。(2题)
19、二氧化碳的捕集、存储和转化是当今化学研究的热点问题之一。
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解,发生反应,该反应的________(填“>”“<”或“=”,下同)0,_________0,在低温下,该反应________(填“能”或“不能”)自发进行。
(2)的转化途径之一是首先利用太阳能或生物质能分解水制,然后将与转化为甲醇或其他化学产品。你认为该方法需要解决的技术问题有__________(填字母)。
a.开发高效光催化剂
b.将通过光催化剂制取的从反应体系中有效分离,并与发生催化转化
c.二氧化碳及水资源的供应
【答案】> > 不能 ab
20、反应M(l)+N(l) ===E(l)+F(l)分别在相同压强和348K、343K、338K条件下进行,起始时均按M与N的物质的量比1:1投料,测得α(M)随时间t的变化关系如图所示。
已知:v正=k正·x(M) x(N),v逆=k逆·x(E) x(F),其中v正、v逆分别为正、逆反应的反应速率,k正、k逆分别为正、逆反应的速率常数,x为各组分的物质的量分数。回答下列问题:
(1)348K时,以物质的量分数表示的化学平衡常数Kx=________(保留2位有效数字)。该温度下,分别按M与N物质的量之比1:1、1:2和2:1进行初始投料,则达到平衡后,初始投料比为________时,M的转化率最大;与按1:1投料相比,按2:1投料时化学平衡常数Kx________。(填“增大”“减小”或“不变”)。
(2)A、B、C、D四点中,v正最大的是________点,v逆最大的是________点。
(3)在曲线①、②、③中,正、逆反应的速率常数值k正-k逆最大的曲线是________。
【答案】3.2 1:2 不变 A C ①
三、综合题。(2题)
21、(1)真空碳热冶铝法包含很多反应,其中的三个反应如下:
Al2O3(s)+3C(s)= Al2OC(s)+2CO(g) ΔH1
2Al2OC(s)+3C(s)= Al4C3(s)+2CO(g) ΔH2
2Al2O3(s)+9C(s)= Al4C3(s)+6CO(g) ΔH3
则ΔH3=____(用ΔH1、ΔH2表示)。
(2)下列是碳热还原法制锰合金的三个反应,CO与CO2平衡分压比的自然对数值(lnK=2.303lgK)与温度的关系如图所示(已知Kp是用平衡分压代替浓度计算所得的平衡常数,分压=总压×气体的物质的量分数)。
Ⅰ.Mn3C(s)+4CO2(g)3MnO(s)+5CO(g) Kp(Ⅰ)
Ⅱ.Mn(s)+CO2(g) MnO(s)+CO(g) Kp(Ⅱ)
Ⅲ.Mn3C(s)+CO2(g) 3Mn(s)+2CO(g) Kp(Ⅲ)
①ΔH>0的反应是____(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
②1 200 K时,在一体积为2 L的恒容密闭容器中有17.7 g Mn3C(s)和0.4 mol CO2,只发生反应Ⅰ,5 min后达到平衡,此时CO的浓度为0.125 mol/L,则0~5 min内v(CO2)=____。
③在一体积可变的密闭容器中加入一定量的Mn(s)并充入一定量的CO2(g),只发生反应Ⅱ,下列能说明反应Ⅱ达到平衡的是____(填字母)。
A.容器的体积不再改变 B.固体的质量不再改变 C.气体的总质量不再改变
④向恒容密闭容器中加入Mn3C并充入0.1molCO2,若只发生反应Ⅲ,则在A点反应达到平衡,当容器的总压为a kPa时,CO2的转化率为_______;A点对应温度下Kp(Ⅲ)=_______。
【答案】2ΔH1+ΔH2 Ⅲ 0.02 mol·L-1·min-1 BC 33.3% 0.5akPa
22、I.一定的条件下,合成氨反应为:N2(g)+3H2(g)2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
(1)该反应的平衡常数表达式为_____,升高温度,平衡常数____(填“增大”或“减小”或“不变”)。
(2)由图2信息,计算0~10min内该反应的平均速率v(H2)=____,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 ______(填“a”或“b”或“c”或“d”)
(3)图3的a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是_____点,温度T1___T2(填“>”或“=”或“<”)
Ⅱ.如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(1)M电极的材料是________。
(2)通入乙醇的铂电极的电极反应式为:________。
【答案】或 减小 0.045mol/(L·min)
d c < 铁 C2H5OH-12e-+16OH-=2CO+11H2O
鲁科版(2019)第2章 化学反应的方向、限度与速率
一、选择题。(18题)
1、已知某化学反应A 2(g) +2B 2(g) = 2AB 2(g)的能量变化如图所示,下列有关叙述中正确的是 ( )
A.该反应是熵增加的反应
B.该反应的ΔH=-(E1-E2) kJ·mol-1
C.该反应的活化能为E2
D.该反应中,反应物分子的键能总和大于生成物分子的键能总和
2、下列事实不能用勒·夏特列原理解释的是( )
A.氯水中存在平衡:Cl2+H2OHCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B.对于反应CO(g)+NO2(g)CO2(g)+NO(g),增大平衡体系的压强,可使颜色变深
C.对于反应2NO2(g)N2O4(g) ΔH<0,升高平衡体系的温度,颜色变深
D.SO2催化氧化成SO3的反应,加入过量的空气
3、如图表示不同温度(T)和压强(p)对可逆反应:
2L(g) 2M(g)+2N(g) △H>0的影响,且p2>p1。则图中纵轴表示的意义可能是( )
①一定条件下L的转化率 ②混合气体中M的百分含量
③混合气体中L的百分含量 ④混合气体的平均摩尔质量
A.①③ B.②④ C.①② D.②③
4、化合物Bilirubin在一定波长的光照下发生分解反应,反应物浓度随反应时间的变化如图所示,计算用反应物表示的4~8min内的平均反应速率和推测反应在16min时反应物的浓度,结果应分别是( )
A.和 B.和
C.和 D.和
5、在不同条件下分别测得反应2SO2+O22SO3的化学反应速率,其中表示该反应进行得最快的是( )
A.v(SO2)=4mol/(L·min) B.v(O2)=3mol/(L·min)
C.v(O2)=0.1mol/(L·s) D.v(SO3)=0.1mol/(L·s)
6、一定温度下,某气态平衡体系的平衡常数表达式为K=,有关该平衡体系的说法正确的是( )
A.升高温度,平衡常数K一定增大
B.增大A浓度,平衡向正反应方向移动
C.增大压强,C体积分数增加
D.升高温度,若B的百分含量减少,则正反应是放热反应
7、H2与ICl的反应分①、②两步进行,其能量曲线如图所示,下列有关说法错误的是( )
A.反应①、反应②均为放热反应
B.反应①、反应②均为氧化还原反应
C.H2与ICl的总反应速率快慢取决于反应②
D.反应H2(g)+2ICl(g)=I2(g)+2HCl(g)的ΔH=-218kJ·mol-1
8、下列反应常温时能自发进行,既能用焓判据又能用熵判据解释的是( )
A.HCl+NH3=NH4Cl B.2Na2O2+2H20=4NaOH+O2↑
C.2KClO3=2KCl+302↑ D.Ba(OH)2 8H20+2NH4Cl=BaCl2+2NH3↑+10H2O
9、有甲、乙、丙三支试管,分别加入下列物质后,观察这三支试管的颜色,其中颜色最浅的是( )
甲:10 mL 0.01 mol·L-1的FeCl3溶液和10 mL 0.01 mol·L-1的KSCN溶液
乙:5 mL水、10 mL 0.01 mol·L-1的FeCl3溶液和5 mL 0.01 mol·L-1的KSCN溶液
丙:10 mL 0.1 mol·L-1的FeCl3溶液和10 mL 0.1 mol·L-1的KSCN溶液
A.甲试管 B.乙试管 C.丙试管 D.无法判断
10、氨是最基本的化工原料之一。工业合成氨的反应为 3H2(g)+N2(g)2NH3(g) H<0,在一定条件下,将H2(g)和N2(g)充入恒容密闭容器中,反应过程中各物质的物质的量浓度随时间的变化如图所示∶
下列叙述正确的是( )
A.图中两次平衡时反应的化学平衡常数不相等
B.第10min时改变的一个条件为加压或加入催化剂
C.可用勒夏特列原理来解释工业合成氨需在高温下进行
D.25至30min时间段,反应的平均速率v(H2)=0.015 mol/(L·min)
11、下列说法错误的是( )
A.大多数化学反应都是由基元反应组成的
B.复杂反应是由基元反应组成的总反应
C.某些基元反应是化学反应的总反应
D.同一反应,在不同条件下的反应历程一定相同
12、“接触法制硫酸”的主要反应是2SO2+O2===2SO3在催化剂表面的反应历程如下:
下列说法不正确的是( )
A.使用催化剂V2O4能同时改变正逆反应速率
B.反应②的活化能比反应①小
C.该反应的中间产物是V2O4
D.过程中既有V-O键的断裂,又有V-O键的形成
13、某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)Z(g)+W(s) ΔH>0。下列叙述正确的是( )
A.加入少量W,逆反应速率增大,正反应速率减小
B.升高温度,平衡逆向移动
C.当容器中气体压强不变时,反应达到平衡
D.反应平衡后加入X,上述反应的ΔH增大
14、3.25 g锌与100 mL 1 mol·L-1的稀硫酸反应,为了加快反应速率而不改变H2的产量,可采取的措施是( )
A.滴加几滴浓盐酸 B.滴加几滴浓硝酸
C.滴加几滴硫酸铜溶液 D.加入少量锌粒
15、下列反应在常温下均为非自发反应,在高温下仍为非自发反应的是( )
A.Ag2O(s)===2Ag(s)+O2(g)
B.Fe2O3(s)+C(s)===2Fe(s)+CO2(g)
C.N2O4(g)===2NO2(g)
D.6C(s)+6H2O(l)===C6H12O6(s)
16、把HI气体充入密闭容器中在一定条件下发生反应.2HI(g) H2(g)+I2(g),在反应趋向化学反应限度的过程中,下列说法正确的是( )
A.HI的生成速率等于其分解速率 B.HI的生成速率小于其分解速率
C.HI的生成速率大于其分解速率 D.无法判断
17、将 a mol N2 和 3a mol H2 充入绝热的固定容积密闭容器中,发生合成氨反应 N2(g) + 3H2(g) 2NH3(g)。下列选项中说明反应已经达到平衡状态的是( )
①体系的温度不再改变;②体系的压强不再改变;③混合气体密度不再改变;④混合气体的平均摩尔质量不再改变;⑤N2 和 H2 的浓度之比达到 1:3;⑥v(N2)正反应 = 3v(H2)逆反应; ⑦2v(H2)正反应 = 3v(NH3)逆反应;⑧每有一个N≡N 键断裂就有 6个N-H 键形成
A.②④⑤⑥ B.②④⑥⑧ C.①②④⑥ D.①②④⑦
18、在恒温、恒容条件下发生下列反应:2X2O5 (g) 4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
t/s 0 50 100 150
c(X2O5) mol/L 4.00 2.50 2.00 2.00
下列说法错误的是( )
A.T温度下的平衡数为K=64 (mol/L)3,100s时转化率为50%
B.50s 内 X2O5分解速率为 0.03 mol/ (L s)
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则Kl>K2
D.若只将恒容改为恒压,其它条件都不变,则平衡时X2O5的转化率和平衡常数都不变
二、填空题。(2题)
19、二氧化碳的捕集、存储和转化是当今化学研究的热点问题之一。
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解,发生反应,该反应的________(填“>”“<”或“=”,下同)0,_________0,在低温下,该反应________(填“能”或“不能”)自发进行。
(2)的转化途径之一是首先利用太阳能或生物质能分解水制,然后将与转化为甲醇或其他化学产品。你认为该方法需要解决的技术问题有__________(填字母)。
a.开发高效光催化剂
b.将通过光催化剂制取的从反应体系中有效分离,并与发生催化转化
c.二氧化碳及水资源的供应
20、反应M(l)+N(l) ===E(l)+F(l)分别在相同压强和348K、343K、338K条件下进行,起始时均按M与N的物质的量比1:1投料,测得α(M)随时间t的变化关系如图所示。
已知:v正=k正·x(M) x(N),v逆=k逆·x(E) x(F),其中v正、v逆分别为正、逆反应的反应速率,k正、k逆分别为正、逆反应的速率常数,x为各组分的物质的量分数。回答下列问题:
(1)348K时,以物质的量分数表示的化学平衡常数Kx=________(保留2位有效数字)。该温度下,分别按M与N物质的量之比1:1、1:2和2:1进行初始投料,则达到平衡后,初始投料比为________时,M的转化率最大;与按1:1投料相比,按2:1投料时化学平衡常数Kx________。(填“增大”“减小”或“不变”)。
(2)A、B、C、D四点中,v正最大的是________点,v逆最大的是________点。
(3)在曲线①、②、③中,正、逆反应的速率常数值k正-k逆最大的曲线是________。
三、综合题。(2题)
21、(1)真空碳热冶铝法包含很多反应,其中的三个反应如下:
Al2O3(s)+3C(s)= Al2OC(s)+2CO(g) ΔH1
2Al2OC(s)+3C(s)= Al4C3(s)+2CO(g) ΔH2
2Al2O3(s)+9C(s)= Al4C3(s)+6CO(g) ΔH3
则ΔH3=____(用ΔH1、ΔH2表示)。
(2)下列是碳热还原法制锰合金的三个反应,CO与CO2平衡分压比的自然对数值(lnK=2.303lgK)与温度的关系如图所示(已知Kp是用平衡分压代替浓度计算所得的平衡常数,分压=总压×气体的物质的量分数)。
Ⅰ.Mn3C(s)+4CO2(g)3MnO(s)+5CO(g) Kp(Ⅰ)
Ⅱ.Mn(s)+CO2(g) MnO(s)+CO(g) Kp(Ⅱ)
Ⅲ.Mn3C(s)+CO2(g) 3Mn(s)+2CO(g) Kp(Ⅲ)
①ΔH>0的反应是____(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
②1 200 K时,在一体积为2 L的恒容密闭容器中有17.7 g Mn3C(s)和0.4 mol CO2,只发生反应Ⅰ,5 min后达到平衡,此时CO的浓度为0.125 mol/L,则0~5 min内v(CO2)=____。
③在一体积可变的密闭容器中加入一定量的Mn(s)并充入一定量的CO2(g),只发生反应Ⅱ,下列能说明反应Ⅱ达到平衡的是____(填字母)。
A.容器的体积不再改变 B.固体的质量不再改变 C.气体的总质量不再改变
④向恒容密闭容器中加入Mn3C并充入0.1molCO2,若只发生反应Ⅲ,则在A点反应达到平衡,当容器的总压为a kPa时,CO2的转化率为_______;A点对应温度下Kp(Ⅲ)=_______。
22、I.一定的条件下,合成氨反应为:N2(g)+3H2(g)2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
(1)该反应的平衡常数表达式为_____,升高温度,平衡常数____(填“增大”或“减小”或“不变”)。
(2)由图2信息,计算0~10min内该反应的平均速率v(H2)=____,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 ______(填“a”或“b”或“c”或“d”)
(3)图3的a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是_____点,温度T1___T2(填“>”或“=”或“<”)
Ⅱ.如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(1)M电极的材料是________。
(2)通入乙醇的铂电极的电极反应式为:________。
2023—2024学年上学期高二化学鲁科版(2019)选择性必修一第2章 化学反应的方向、限度与速率 课后练习含答案
鲁科版(2019)第2章 化学反应的方向、限度与速率
一、选择题。(18题)
1、已知某化学反应A 2(g) +2B 2(g) = 2AB 2(g)的能量变化如图所示,下列有关叙述中正确的是 ( )
A.该反应是熵增加的反应
B.该反应的ΔH=-(E1-E2) kJ·mol-1
C.该反应的活化能为E2
D.该反应中,反应物分子的键能总和大于生成物分子的键能总和
【答案】D
2、下列事实不能用勒·夏特列原理解释的是( )
A.氯水中存在平衡:Cl2+H2OHCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B.对于反应CO(g)+NO2(g)CO2(g)+NO(g),增大平衡体系的压强,可使颜色变深
C.对于反应2NO2(g)N2O4(g) ΔH<0,升高平衡体系的温度,颜色变深
D.SO2催化氧化成SO3的反应,加入过量的空气
【答案】B
3、如图表示不同温度(T)和压强(p)对可逆反应:
2L(g) 2M(g)+2N(g) △H>0的影响,且p2>p1。则图中纵轴表示的意义可能是( )
①一定条件下L的转化率 ②混合气体中M的百分含量
③混合气体中L的百分含量 ④混合气体的平均摩尔质量
A.①③ B.②④ C.①② D.②③
【答案】C
4、化合物Bilirubin在一定波长的光照下发生分解反应,反应物浓度随反应时间的变化如图所示,计算用反应物表示的4~8min内的平均反应速率和推测反应在16min时反应物的浓度,结果应分别是( )
A.和 B.和
C.和 D.和
【答案】B
5、在不同条件下分别测得反应2SO2+O22SO3的化学反应速率,其中表示该反应进行得最快的是( )
A.v(SO2)=4mol/(L·min) B.v(O2)=3mol/(L·min)
C.v(O2)=0.1mol/(L·s) D.v(SO3)=0.1mol/(L·s)
【答案】C
6、一定温度下,某气态平衡体系的平衡常数表达式为K=,有关该平衡体系的说法正确的是( )
A.升高温度,平衡常数K一定增大
B.增大A浓度,平衡向正反应方向移动
C.增大压强,C体积分数增加
D.升高温度,若B的百分含量减少,则正反应是放热反应
【答案】D
7、H2与ICl的反应分①、②两步进行,其能量曲线如图所示,下列有关说法错误的是( )
A.反应①、反应②均为放热反应
B.反应①、反应②均为氧化还原反应
C.H2与ICl的总反应速率快慢取决于反应②
D.反应H2(g)+2ICl(g)=I2(g)+2HCl(g)的ΔH=-218kJ·mol-1
【答案】C
8、下列反应常温时能自发进行,既能用焓判据又能用熵判据解释的是( )
A.HCl+NH3=NH4Cl B.2Na2O2+2H20=4NaOH+O2↑
C.2KClO3=2KCl+302↑ D.Ba(OH)2 8H20+2NH4Cl=BaCl2+2NH3↑+10H2O
【答案】B
9、有甲、乙、丙三支试管,分别加入下列物质后,观察这三支试管的颜色,其中颜色最浅的是( )
甲:10 mL 0.01 mol·L-1的FeCl3溶液和10 mL 0.01 mol·L-1的KSCN溶液
乙:5 mL水、10 mL 0.01 mol·L-1的FeCl3溶液和5 mL 0.01 mol·L-1的KSCN溶液
丙:10 mL 0.1 mol·L-1的FeCl3溶液和10 mL 0.1 mol·L-1的KSCN溶液
A.甲试管 B.乙试管 C.丙试管 D.无法判断
【答案】B
10、氨是最基本的化工原料之一。工业合成氨的反应为 3H2(g)+N2(g)2NH3(g) H<0,在一定条件下,将H2(g)和N2(g)充入恒容密闭容器中,反应过程中各物质的物质的量浓度随时间的变化如图所示∶
下列叙述正确的是( )
A.图中两次平衡时反应的化学平衡常数不相等
B.第10min时改变的一个条件为加压或加入催化剂
C.可用勒夏特列原理来解释工业合成氨需在高温下进行
D.25至30min时间段,反应的平均速率v(H2)=0.015 mol/(L·min)
【答案】D
11、下列说法错误的是( )
A.大多数化学反应都是由基元反应组成的
B.复杂反应是由基元反应组成的总反应
C.某些基元反应是化学反应的总反应
D.同一反应,在不同条件下的反应历程一定相同
【答案】D
12、“接触法制硫酸”的主要反应是2SO2+O2===2SO3在催化剂表面的反应历程如下:
下列说法不正确的是( )
A.使用催化剂V2O4能同时改变正逆反应速率
B.反应②的活化能比反应①小
C.该反应的中间产物是V2O4
D.过程中既有V-O键的断裂,又有V-O键的形成
【答案】A
13、某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)Z(g)+W(s) ΔH>0。下列叙述正确的是( )
A.加入少量W,逆反应速率增大,正反应速率减小
B.升高温度,平衡逆向移动
C.当容器中气体压强不变时,反应达到平衡
D.反应平衡后加入X,上述反应的ΔH增大
【答案】C
14、3.25 g锌与100 mL 1 mol·L-1的稀硫酸反应,为了加快反应速率而不改变H2的产量,可采取的措施是( )
A.滴加几滴浓盐酸 B.滴加几滴浓硝酸
C.滴加几滴硫酸铜溶液 D.加入少量锌粒
【答案】A
15、下列反应在常温下均为非自发反应,在高温下仍为非自发反应的是( )
A.Ag2O(s)===2Ag(s)+O2(g)
B.Fe2O3(s)+C(s)===2Fe(s)+CO2(g)
C.N2O4(g)===2NO2(g)
D.6C(s)+6H2O(l)===C6H12O6(s)
【答案】D
16、把HI气体充入密闭容器中在一定条件下发生反应.2HI(g) H2(g)+I2(g),在反应趋向化学反应限度的过程中,下列说法正确的是( )
A.HI的生成速率等于其分解速率 B.HI的生成速率小于其分解速率
C.HI的生成速率大于其分解速率 D.无法判断
【答案】B
17、将 a mol N2 和 3a mol H2 充入绝热的固定容积密闭容器中,发生合成氨反应 N2(g) + 3H2(g) 2NH3(g)。下列选项中说明反应已经达到平衡状态的是( )
①体系的温度不再改变;②体系的压强不再改变;③混合气体密度不再改变;④混合气体的平均摩尔质量不再改变;⑤N2 和 H2 的浓度之比达到 1:3;⑥v(N2)正反应 = 3v(H2)逆反应; ⑦2v(H2)正反应 = 3v(NH3)逆反应;⑧每有一个N≡N 键断裂就有 6个N-H 键形成
A.②④⑤⑥ B.②④⑥⑧ C.①②④⑥ D.①②④⑦
【答案】D
18、在恒温、恒容条件下发生下列反应:2X2O5 (g) 4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
t/s 0 50 100 150
c(X2O5) mol/L 4.00 2.50 2.00 2.00
下列说法错误的是( )
A.T温度下的平衡数为K=64 (mol/L)3,100s时转化率为50%
B.50s 内 X2O5分解速率为 0.03 mol/ (L s)
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则Kl>K2
D.若只将恒容改为恒压,其它条件都不变,则平衡时X2O5的转化率和平衡常数都不变
【答案】D
二、填空题。(2题)
19、二氧化碳的捕集、存储和转化是当今化学研究的热点问题之一。
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解,发生反应,该反应的________(填“>”“<”或“=”,下同)0,_________0,在低温下,该反应________(填“能”或“不能”)自发进行。
(2)的转化途径之一是首先利用太阳能或生物质能分解水制,然后将与转化为甲醇或其他化学产品。你认为该方法需要解决的技术问题有__________(填字母)。
a.开发高效光催化剂
b.将通过光催化剂制取的从反应体系中有效分离,并与发生催化转化
c.二氧化碳及水资源的供应
【答案】> > 不能 ab
20、反应M(l)+N(l) ===E(l)+F(l)分别在相同压强和348K、343K、338K条件下进行,起始时均按M与N的物质的量比1:1投料,测得α(M)随时间t的变化关系如图所示。
已知:v正=k正·x(M) x(N),v逆=k逆·x(E) x(F),其中v正、v逆分别为正、逆反应的反应速率,k正、k逆分别为正、逆反应的速率常数,x为各组分的物质的量分数。回答下列问题:
(1)348K时,以物质的量分数表示的化学平衡常数Kx=________(保留2位有效数字)。该温度下,分别按M与N物质的量之比1:1、1:2和2:1进行初始投料,则达到平衡后,初始投料比为________时,M的转化率最大;与按1:1投料相比,按2:1投料时化学平衡常数Kx________。(填“增大”“减小”或“不变”)。
(2)A、B、C、D四点中,v正最大的是________点,v逆最大的是________点。
(3)在曲线①、②、③中,正、逆反应的速率常数值k正-k逆最大的曲线是________。
【答案】3.2 1:2 不变 A C ①
三、综合题。(2题)
21、(1)真空碳热冶铝法包含很多反应,其中的三个反应如下:
Al2O3(s)+3C(s)= Al2OC(s)+2CO(g) ΔH1
2Al2OC(s)+3C(s)= Al4C3(s)+2CO(g) ΔH2
2Al2O3(s)+9C(s)= Al4C3(s)+6CO(g) ΔH3
则ΔH3=____(用ΔH1、ΔH2表示)。
(2)下列是碳热还原法制锰合金的三个反应,CO与CO2平衡分压比的自然对数值(lnK=2.303lgK)与温度的关系如图所示(已知Kp是用平衡分压代替浓度计算所得的平衡常数,分压=总压×气体的物质的量分数)。
Ⅰ.Mn3C(s)+4CO2(g)3MnO(s)+5CO(g) Kp(Ⅰ)
Ⅱ.Mn(s)+CO2(g) MnO(s)+CO(g) Kp(Ⅱ)
Ⅲ.Mn3C(s)+CO2(g) 3Mn(s)+2CO(g) Kp(Ⅲ)
①ΔH>0的反应是____(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
②1 200 K时,在一体积为2 L的恒容密闭容器中有17.7 g Mn3C(s)和0.4 mol CO2,只发生反应Ⅰ,5 min后达到平衡,此时CO的浓度为0.125 mol/L,则0~5 min内v(CO2)=____。
③在一体积可变的密闭容器中加入一定量的Mn(s)并充入一定量的CO2(g),只发生反应Ⅱ,下列能说明反应Ⅱ达到平衡的是____(填字母)。
A.容器的体积不再改变 B.固体的质量不再改变 C.气体的总质量不再改变
④向恒容密闭容器中加入Mn3C并充入0.1molCO2,若只发生反应Ⅲ,则在A点反应达到平衡,当容器的总压为a kPa时,CO2的转化率为_______;A点对应温度下Kp(Ⅲ)=_______。
【答案】2ΔH1+ΔH2 Ⅲ 0.02 mol·L-1·min-1 BC 33.3% 0.5akPa
22、I.一定的条件下,合成氨反应为:N2(g)+3H2(g)2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
(1)该反应的平衡常数表达式为_____,升高温度,平衡常数____(填“增大”或“减小”或“不变”)。
(2)由图2信息,计算0~10min内该反应的平均速率v(H2)=____,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 ______(填“a”或“b”或“c”或“d”)
(3)图3的a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是_____点,温度T1___T2(填“>”或“=”或“<”)
Ⅱ.如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(1)M电极的材料是________。
(2)通入乙醇的铂电极的电极反应式为:________。
【答案】或 减小 0.045mol/(L·min)
d c < 铁 C2H5OH-12e-+16OH-=2CO+11H2O
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
