2024届高三化学一轮复习 -物质的量 气体摩尔体积 课件(共32张PPT)
文档属性
| 名称 | 2024届高三化学一轮复习 -物质的量 气体摩尔体积 课件(共32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 422.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-02 12:37:48 | ||
图片预览











文档简介
(共32张PPT)
第一章 化学计量在实验中的应用
第一节 物质的量 气体摩尔体积
-2-
考纲要求:
1.了解物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(Vm)、阿伏加德罗常数(NA)的含义。
2.能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行有关计算。
3.能正确书写化学方程式,并能进行有关计算。
-3-
导学诱思
(1)1.204×1024个氯化氢分子的物质的量为 ,质量为 。
(2)0.3 mol NH3中所含分子数为 、质子数为 ,
与 g H2O中所含质子数相等。
(3)含0.4 mol Al3+的Al2(SO4)3的物质的量为 ,所含的
的物质的量为 。
(4)1.204×1024个M分子的质量为88 g,则M的摩尔质量为 。
(5)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为 。
2 mol
73 g
1.806×1023
1.806×1024
5.4
0.2 mol
0.6 mol
44 g·mol-1
106 g·mol-1
n
一、物质的量
(1)定义:
(2)符号与单位:
(3)计算公式:
摩尔(mol)
表示含有一定数目粒子的集合体的物理量。是国际单位制中7个基本物理量之一
1)物质的量是物理量,而摩尔是它的单位;
2)物质的量是专有名词,应整体理解,不能理解为物质的数量和物质的质量;
【注意】:
3)适用范围:仅适用于微观粒子,对宏观物质无意义;
微粒:原子、分子、离子、质子、电子、中子或某些特定组合等。
(使用时必须指明是哪一种粒子)
mol -1
二、阿伏加德罗常数
(1)含义:
(2)符号:
(4)注意:
12 g 12C中所含有的碳原子数。
②NA是一个精确值,近似取为6.02×1023 mol-1用于计算
NA
(3)单位:
1mol任何微粒所含的微粒数都是NA个
① NA 这个常数是物理量有单位的。
(5)公式:
NA=N/n
①定义:
②符号和单位:
③计算公式:M=m/n
数值:
单位物质的量的物质所具有的质量叫做摩尔质量。
M
g/mol或kg/mol
以g/mol为单位时,在数值上等于该物质的相对原子质量或相对分子质量(式量)
三、摩尔质量
原子的
相对原子质量
一个原子的质量
1
12
一个12C原子质量
×
注意:
(1)适用于任何一种微观粒子;
(2)纯净物和混合物都有摩尔质量,混合物的摩尔质量一般称为平均摩尔质量;
(3)对具体的物质,其摩尔质量是确定的,与条件、状态、用量都无关。
(4)与相对原子质量(Ar)或相对分子质量(Mr)的关系: 两者数值相等,摩尔质量单位是 g·mol-1 而相对原子质量或相对分子质量单位是1。
摩尔质量的计算
3. 标准状况下气体: M = 22.4 L·mol-1 ×ρ
1. M =NA·m微粒(m微粒为一个微粒的质量)
2. M = M另×D (气体,D为相对密度)
4. M(混) = M1·x1+M2·x2 (x为物质的量分数或体积分数)
考法透析
1.已知物质的量求物质所含粒子数目
此类题型可采用以下解题思路求解物质所含的目标粒子数目:
已知量→物质的量→分析粒子种类及个数→目标粒子数
可应用N= ·NA来计算
(1)若物质为纯净物,可先求物质的量,然后求解目标粒子数目。
(2)若物质为混合物,先求混合物中各物质的最简式,若最简式相同,可先求最简式的物质的量,然后求解目标粒子数目。
如:14g乙烯与丙烯中所含的碳原子数为NA;22gCO2和N2O混合物中所含原子数为1.5NA;常考察的还有O2和O3,NO2和N2O4等。
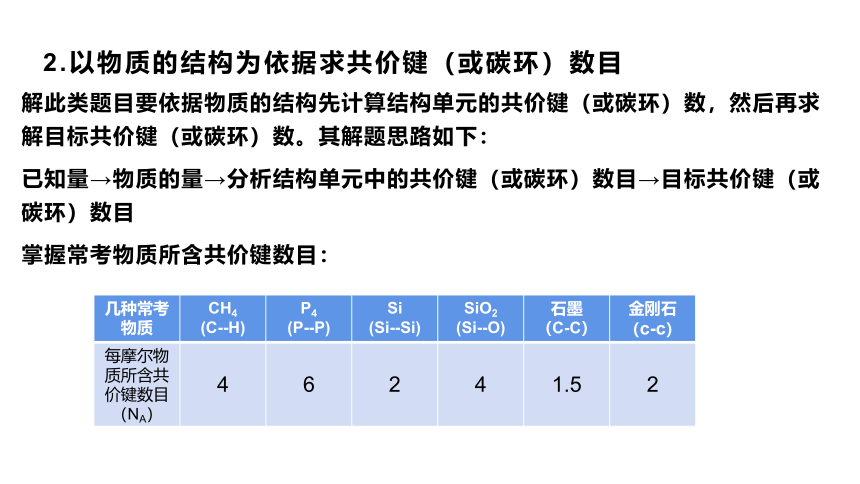
2.以物质的结构为依据求共价键(或碳环)数目
解此类题目要依据物质的结构先计算结构单元的共价键(或碳环)数,然后再求解目标共价键(或碳环)数。其解题思路如下:
已知量→物质的量→分析结构单元中的共价键(或碳环)数目→目标共价键(或碳环)数目
掌握常考物质所含共价键数目:
几种常考物质 CH4 (C--H) P4 (P--P) Si (Si--Si) SiO2 (Si--O) 石墨 (C-C) 金刚石
(c-c)
每摩尔物质所含共价键数目(NA) 4 6 2 4 1.5
2
-12-
气体摩尔体积及阿伏加德罗定律
导学诱思
(1)在标准状况下,6 g H2的体积是 ;
(2)在标准状况下,11.2 L NH3的物质的量为 ;
(3)在标准状况下,44.8 L气体M的质量为88 g,则M的摩尔质量为 。
67.2 L
0.5 mol
44 g·mol-1
1. 影响物质体积大小的因素:
①微粒的大小(种类)
②微粒的数目(n决定)
③微粒的间隔(T.P)
固体、液体:①②, 忽略微粒间隔
气体:②③,忽略微粒大小
五、气体摩尔体积
【说明】:
注意:固体液体体积与温度压强无关,气体体积受温度压强影响,谈论或比较气体体积必须指明温度和压强
1)相同条件下,等物质的量同一物质的不同状态所占的体积关系一般是:
固体 < 液体 < 气体
2)相同条件下,等物质的量不同固体、液体的体积不同。
相同条件下,等物质的量不同气体体积相同。
规律:
-15-
2.气体摩尔体积
(1)定义:单位物质的量的气体所占的体积叫作气体摩尔体积,符号为Vm,常用的单位有L/mol。
(2)数值:在标准状况(0℃、101KPa)下,气体摩尔体积约为22.4L/mol
使用Vm=22.4 L·mol-1时,一定要注意以下几个方面:
①一个条件:标准状况下。
②一个对象:只限于气体,可以是单一气体,也可以是混合气体。
③两个数据:“1 mol”、约“22.4 L”。
(3)计算关系:n= V/Vm
(4)影响因素:气体摩尔体积受温度与压强的影响,在非标况下,其数值可能不等于22.4
-16-
3.阿伏加德罗定律
(1)阿伏伽德罗定律:在同温同压下,同体积的任何气体含有相同数目的分子(或物质的量)。
即:T1=T2、p1=p2、V1=V2→N1=N2。
(2)适用范围:单一气体或相互不反应的混合气体。
-20-
考查角度一 以“物质的量”为中心的计算
方法指导 微粒数、物质的质量、气体的体积通过物质的量联系在一起,做题时要有“求什么先求摩,见什么就化摩”的思想,在运算中看到个数就想到阿伏加德罗常数、看到质量就想到摩尔质量、看到气体体积就想到气体摩尔体积 。
-21-
跟踪训练
1.下列条件下,两种气体分子数一定不相等的是 ( )。
A.相同质量、不同体积的N2O和CO2
B.相同体积、相同密度的CO和C2H4
C.相同温度、相同压强、相同体积的O2和O3
D.相同压强、相同质量的CO和CO2
D
解析:A项中N2O和CO2的摩尔质量均为44 g·mol-1,故质量相同时,分子数一定相等;B项中CO和C2H4的摩尔质量均为28 g·mol-1,体积相同、密度相同,则质量相等,故分子数相等;C项为同温、同压、同体积,则气体所含分子数一定相等;D项中由于CO和CO2的摩尔质量不同,故在此条件下两分子数一定不相等。
-22-
考查角度二 阿伏加德罗定律及推论
方法指导 (1)“三同定一同”,只要温度、压强、气体体积、分子数四项中有三项相同,则第四项也相同。
(2)求气体的摩尔质量M的常用方法:
①根据标准状况下气体的密度(ρ):M=ρ×Vm;
-23-
2.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量小
C.甲的气体摩尔体积比乙的气体摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
B
解析:质量一定的气体,其密度与体积成反比,甲的密度大于乙的密度,则甲的体积小于乙的体积,在同温同压下,物质的量之比等于体积之比,说明甲气体的物质的量小于乙气体的物质的量,则甲的分子数比乙的分子数少,故A项错误,B项正确;同温同压下气体的摩尔体积相等,C项错误;甲气体的物质的量小于乙气体的物质的量,两种气体质量相等,根据 可知,甲的相对分子质量比乙的相对分子质量大,D项错误。
-24-
跨越有关阿伏加德罗常数判断的“六大陷阱”
结合阿伏加德罗常数,判断一定量物质所含某种粒子数目的多少,是高考命题的热点之一。此类试题涉及面广,常与元素化合物知识、电解质溶液、氧化还原反应联系起来进行综合考查,考题有意设置一些易错易混的“陷阱”,考生一不留神便会成为命题设计者的“猎物”。
陷阱一 气体摩尔体积适用条件
22.4 L·mol-1是标准状况下(0 ℃、101 kPa)的气体摩尔体积。若题中出现物质的体积,必须考虑所给物质的状态是否为气体,条件是否为标准状况。
-25-
陷阱二 物质聚集状态
气体摩尔体积适用的对象是气体(包括混合气体)。
CH3Cl标况常温均为气态,其余CH2Cl2、CHCl3、CCl4是油状液体;
CH3OH、CH3CH2OH、CH3COOH
NO2、水、液溴、HF等在标准状况下均不为气态;
SO3在标准状况下为固态,常温常压下为液态;
分子中碳原子数大于4的烃,如己烷、苯等在标准状况下为液态或固态;新戊烷标况下是液态,常温常压下是气态。
陷阱三 物质的微观结构
此类题要弄清楚微粒中相关粒子数(质子数、中子数、电子数)及离子数、电荷数、化学键之间的关系。常涉及:
陷阱四 电解质溶液
此类题要特别注意题目中的隐含条件,如水解、部分电离和反应可逆等。
(1)“已知浓度缺体积”及“已知体积缺浓度”:以上两种情况均无法求解溶液中所含目标粒子的数目;
如25℃时,pH=13的氢氧化钠溶液中所含OH-的数目为0.1NA。
因为缺少溶液中的体积无法计算OH-的数目,故此说法错误。
(2)电离:当溶质为弱电解质时,其在溶液中部分电离,溶液中所含的分子数及电离出的离子数目均无法直接求解。
如1L1mol/L的氨水中有NA个NH4+,错误。
(3)水解:当电解质在溶液中发生水解时,溶液中发生水解的粒子数目无法直接求解;
如将0.1molFeCl3配成1L溶液时,所得溶液中含有0.1NA个Fe3+,错误。
(4)溶剂:当溶剂中也含有所求粒子时,往往习惯性的只考虑溶质中所含粒子,忽视了溶剂中所含粒子而出错。
如10g质量分数为46%的甲酸水溶液中,含氧原子的数目为0.5NA,正确。
-29-
分类比较,突破“电子转移”判断陷阱
1.同一种物质在不同反应中氧化剂、还原剂的判断。如:
(1)Cl2和Fe、Cu等反应,Cl2只作氧化剂,而Cl2和NaOH反应,Cl2既作氧化剂,又作还原剂。
(2)Na2O2与CO2或H2O反应,Na2O2既作氧化剂,又作还原剂,而Na2O2与SO2反 应,Na2O2只作氧化剂。
2.量不同,所表现的化合价不同。如:Fe和HNO3反应,Fe不足,生成Fe3+,Fe过量,生成Fe2+。
3.氧化剂或还原剂不同,所表现的化合价不同。如:Cu和Cl2反应生成CuCl2,而Cu和S反应生成Cu2S。
4.注意氧化还原的顺序。如:向FeI2溶液中通入Cl2,首先氧化I-,再氧化Fe2+。
-31-
陷阱六 忽视可逆反应或反应不能进行到底
要注意隐含的可逆反应,记住反应条件、反应物浓度变化对反应的影响。
1.可逆反应:因为可逆反应进行不完全,当没有给出转化率时,不能求出准确的目标粒子数目。
如某密闭容器中盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子数目为0.6NA。
该反应为可逆反应,进行程度不确定,无法准确求出转移电子数目,故错误。
常见的可逆反应:
2.浓度变化导致反应改变的类型
因为酸的浓度变化使反应停止,难以求出准确的目标粒子数目,如金属与浓稀硝酸的反应、与浓稀硫酸的反应。
如80ml12mol/L的浓盐酸与足量MnO2反应,生成Cl2的分子数为0.24NA。
随着反应的进行,浓盐酸变为稀盐酸,无法准确求解生成Cl2的分子数目,错误。
3.物质组成不能确定的类型
当某些物质混合或反应进行一段时间后,产物的种类变化或物质的量不定,难以求出准确的目标粒子数目
如标准状况下,5.6LNO和5.6L的O2混合后的分子总数为0.5NA。
两种气体混合后生成NO2,若不考虑NO2部分转化为N2O4,气体体积为8.4L,物质的量为0.375mol,但事实上混合气体存在可逆反应NO2 N2O4,故无法准确求解分子数目,错误。
第一章 化学计量在实验中的应用
第一节 物质的量 气体摩尔体积
-2-
考纲要求:
1.了解物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(Vm)、阿伏加德罗常数(NA)的含义。
2.能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行有关计算。
3.能正确书写化学方程式,并能进行有关计算。
-3-
导学诱思
(1)1.204×1024个氯化氢分子的物质的量为 ,质量为 。
(2)0.3 mol NH3中所含分子数为 、质子数为 ,
与 g H2O中所含质子数相等。
(3)含0.4 mol Al3+的Al2(SO4)3的物质的量为 ,所含的
的物质的量为 。
(4)1.204×1024个M分子的质量为88 g,则M的摩尔质量为 。
(5)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为 。
2 mol
73 g
1.806×1023
1.806×1024
5.4
0.2 mol
0.6 mol
44 g·mol-1
106 g·mol-1
n
一、物质的量
(1)定义:
(2)符号与单位:
(3)计算公式:
摩尔(mol)
表示含有一定数目粒子的集合体的物理量。是国际单位制中7个基本物理量之一
1)物质的量是物理量,而摩尔是它的单位;
2)物质的量是专有名词,应整体理解,不能理解为物质的数量和物质的质量;
【注意】:
3)适用范围:仅适用于微观粒子,对宏观物质无意义;
微粒:原子、分子、离子、质子、电子、中子或某些特定组合等。
(使用时必须指明是哪一种粒子)
mol -1
二、阿伏加德罗常数
(1)含义:
(2)符号:
(4)注意:
12 g 12C中所含有的碳原子数。
②NA是一个精确值,近似取为6.02×1023 mol-1用于计算
NA
(3)单位:
1mol任何微粒所含的微粒数都是NA个
① NA 这个常数是物理量有单位的。
(5)公式:
NA=N/n
①定义:
②符号和单位:
③计算公式:M=m/n
数值:
单位物质的量的物质所具有的质量叫做摩尔质量。
M
g/mol或kg/mol
以g/mol为单位时,在数值上等于该物质的相对原子质量或相对分子质量(式量)
三、摩尔质量
原子的
相对原子质量
一个原子的质量
1
12
一个12C原子质量
×
注意:
(1)适用于任何一种微观粒子;
(2)纯净物和混合物都有摩尔质量,混合物的摩尔质量一般称为平均摩尔质量;
(3)对具体的物质,其摩尔质量是确定的,与条件、状态、用量都无关。
(4)与相对原子质量(Ar)或相对分子质量(Mr)的关系: 两者数值相等,摩尔质量单位是 g·mol-1 而相对原子质量或相对分子质量单位是1。
摩尔质量的计算
3. 标准状况下气体: M = 22.4 L·mol-1 ×ρ
1. M =NA·m微粒(m微粒为一个微粒的质量)
2. M = M另×D (气体,D为相对密度)
4. M(混) = M1·x1+M2·x2 (x为物质的量分数或体积分数)
考法透析
1.已知物质的量求物质所含粒子数目
此类题型可采用以下解题思路求解物质所含的目标粒子数目:
已知量→物质的量→分析粒子种类及个数→目标粒子数
可应用N= ·NA来计算
(1)若物质为纯净物,可先求物质的量,然后求解目标粒子数目。
(2)若物质为混合物,先求混合物中各物质的最简式,若最简式相同,可先求最简式的物质的量,然后求解目标粒子数目。
如:14g乙烯与丙烯中所含的碳原子数为NA;22gCO2和N2O混合物中所含原子数为1.5NA;常考察的还有O2和O3,NO2和N2O4等。
2.以物质的结构为依据求共价键(或碳环)数目
解此类题目要依据物质的结构先计算结构单元的共价键(或碳环)数,然后再求解目标共价键(或碳环)数。其解题思路如下:
已知量→物质的量→分析结构单元中的共价键(或碳环)数目→目标共价键(或碳环)数目
掌握常考物质所含共价键数目:
几种常考物质 CH4 (C--H) P4 (P--P) Si (Si--Si) SiO2 (Si--O) 石墨 (C-C) 金刚石
(c-c)
每摩尔物质所含共价键数目(NA) 4 6 2 4 1.5
2
-12-
气体摩尔体积及阿伏加德罗定律
导学诱思
(1)在标准状况下,6 g H2的体积是 ;
(2)在标准状况下,11.2 L NH3的物质的量为 ;
(3)在标准状况下,44.8 L气体M的质量为88 g,则M的摩尔质量为 。
67.2 L
0.5 mol
44 g·mol-1
1. 影响物质体积大小的因素:
①微粒的大小(种类)
②微粒的数目(n决定)
③微粒的间隔(T.P)
固体、液体:①②, 忽略微粒间隔
气体:②③,忽略微粒大小
五、气体摩尔体积
【说明】:
注意:固体液体体积与温度压强无关,气体体积受温度压强影响,谈论或比较气体体积必须指明温度和压强
1)相同条件下,等物质的量同一物质的不同状态所占的体积关系一般是:
固体 < 液体 < 气体
2)相同条件下,等物质的量不同固体、液体的体积不同。
相同条件下,等物质的量不同气体体积相同。
规律:
-15-
2.气体摩尔体积
(1)定义:单位物质的量的气体所占的体积叫作气体摩尔体积,符号为Vm,常用的单位有L/mol。
(2)数值:在标准状况(0℃、101KPa)下,气体摩尔体积约为22.4L/mol
使用Vm=22.4 L·mol-1时,一定要注意以下几个方面:
①一个条件:标准状况下。
②一个对象:只限于气体,可以是单一气体,也可以是混合气体。
③两个数据:“1 mol”、约“22.4 L”。
(3)计算关系:n= V/Vm
(4)影响因素:气体摩尔体积受温度与压强的影响,在非标况下,其数值可能不等于22.4
-16-
3.阿伏加德罗定律
(1)阿伏伽德罗定律:在同温同压下,同体积的任何气体含有相同数目的分子(或物质的量)。
即:T1=T2、p1=p2、V1=V2→N1=N2。
(2)适用范围:单一气体或相互不反应的混合气体。
-20-
考查角度一 以“物质的量”为中心的计算
方法指导 微粒数、物质的质量、气体的体积通过物质的量联系在一起,做题时要有“求什么先求摩,见什么就化摩”的思想,在运算中看到个数就想到阿伏加德罗常数、看到质量就想到摩尔质量、看到气体体积就想到气体摩尔体积 。
-21-
跟踪训练
1.下列条件下,两种气体分子数一定不相等的是 ( )。
A.相同质量、不同体积的N2O和CO2
B.相同体积、相同密度的CO和C2H4
C.相同温度、相同压强、相同体积的O2和O3
D.相同压强、相同质量的CO和CO2
D
解析:A项中N2O和CO2的摩尔质量均为44 g·mol-1,故质量相同时,分子数一定相等;B项中CO和C2H4的摩尔质量均为28 g·mol-1,体积相同、密度相同,则质量相等,故分子数相等;C项为同温、同压、同体积,则气体所含分子数一定相等;D项中由于CO和CO2的摩尔质量不同,故在此条件下两分子数一定不相等。
-22-
考查角度二 阿伏加德罗定律及推论
方法指导 (1)“三同定一同”,只要温度、压强、气体体积、分子数四项中有三项相同,则第四项也相同。
(2)求气体的摩尔质量M的常用方法:
①根据标准状况下气体的密度(ρ):M=ρ×Vm;
-23-
2.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量小
C.甲的气体摩尔体积比乙的气体摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
B
解析:质量一定的气体,其密度与体积成反比,甲的密度大于乙的密度,则甲的体积小于乙的体积,在同温同压下,物质的量之比等于体积之比,说明甲气体的物质的量小于乙气体的物质的量,则甲的分子数比乙的分子数少,故A项错误,B项正确;同温同压下气体的摩尔体积相等,C项错误;甲气体的物质的量小于乙气体的物质的量,两种气体质量相等,根据 可知,甲的相对分子质量比乙的相对分子质量大,D项错误。
-24-
跨越有关阿伏加德罗常数判断的“六大陷阱”
结合阿伏加德罗常数,判断一定量物质所含某种粒子数目的多少,是高考命题的热点之一。此类试题涉及面广,常与元素化合物知识、电解质溶液、氧化还原反应联系起来进行综合考查,考题有意设置一些易错易混的“陷阱”,考生一不留神便会成为命题设计者的“猎物”。
陷阱一 气体摩尔体积适用条件
22.4 L·mol-1是标准状况下(0 ℃、101 kPa)的气体摩尔体积。若题中出现物质的体积,必须考虑所给物质的状态是否为气体,条件是否为标准状况。
-25-
陷阱二 物质聚集状态
气体摩尔体积适用的对象是气体(包括混合气体)。
CH3Cl标况常温均为气态,其余CH2Cl2、CHCl3、CCl4是油状液体;
CH3OH、CH3CH2OH、CH3COOH
NO2、水、液溴、HF等在标准状况下均不为气态;
SO3在标准状况下为固态,常温常压下为液态;
分子中碳原子数大于4的烃,如己烷、苯等在标准状况下为液态或固态;新戊烷标况下是液态,常温常压下是气态。
陷阱三 物质的微观结构
此类题要弄清楚微粒中相关粒子数(质子数、中子数、电子数)及离子数、电荷数、化学键之间的关系。常涉及:
陷阱四 电解质溶液
此类题要特别注意题目中的隐含条件,如水解、部分电离和反应可逆等。
(1)“已知浓度缺体积”及“已知体积缺浓度”:以上两种情况均无法求解溶液中所含目标粒子的数目;
如25℃时,pH=13的氢氧化钠溶液中所含OH-的数目为0.1NA。
因为缺少溶液中的体积无法计算OH-的数目,故此说法错误。
(2)电离:当溶质为弱电解质时,其在溶液中部分电离,溶液中所含的分子数及电离出的离子数目均无法直接求解。
如1L1mol/L的氨水中有NA个NH4+,错误。
(3)水解:当电解质在溶液中发生水解时,溶液中发生水解的粒子数目无法直接求解;
如将0.1molFeCl3配成1L溶液时,所得溶液中含有0.1NA个Fe3+,错误。
(4)溶剂:当溶剂中也含有所求粒子时,往往习惯性的只考虑溶质中所含粒子,忽视了溶剂中所含粒子而出错。
如10g质量分数为46%的甲酸水溶液中,含氧原子的数目为0.5NA,正确。
-29-
分类比较,突破“电子转移”判断陷阱
1.同一种物质在不同反应中氧化剂、还原剂的判断。如:
(1)Cl2和Fe、Cu等反应,Cl2只作氧化剂,而Cl2和NaOH反应,Cl2既作氧化剂,又作还原剂。
(2)Na2O2与CO2或H2O反应,Na2O2既作氧化剂,又作还原剂,而Na2O2与SO2反 应,Na2O2只作氧化剂。
2.量不同,所表现的化合价不同。如:Fe和HNO3反应,Fe不足,生成Fe3+,Fe过量,生成Fe2+。
3.氧化剂或还原剂不同,所表现的化合价不同。如:Cu和Cl2反应生成CuCl2,而Cu和S反应生成Cu2S。
4.注意氧化还原的顺序。如:向FeI2溶液中通入Cl2,首先氧化I-,再氧化Fe2+。
-31-
陷阱六 忽视可逆反应或反应不能进行到底
要注意隐含的可逆反应,记住反应条件、反应物浓度变化对反应的影响。
1.可逆反应:因为可逆反应进行不完全,当没有给出转化率时,不能求出准确的目标粒子数目。
如某密闭容器中盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子数目为0.6NA。
该反应为可逆反应,进行程度不确定,无法准确求出转移电子数目,故错误。
常见的可逆反应:
2.浓度变化导致反应改变的类型
因为酸的浓度变化使反应停止,难以求出准确的目标粒子数目,如金属与浓稀硝酸的反应、与浓稀硫酸的反应。
如80ml12mol/L的浓盐酸与足量MnO2反应,生成Cl2的分子数为0.24NA。
随着反应的进行,浓盐酸变为稀盐酸,无法准确求解生成Cl2的分子数目,错误。
3.物质组成不能确定的类型
当某些物质混合或反应进行一段时间后,产物的种类变化或物质的量不定,难以求出准确的目标粒子数目
如标准状况下,5.6LNO和5.6L的O2混合后的分子总数为0.5NA。
两种气体混合后生成NO2,若不考虑NO2部分转化为N2O4,气体体积为8.4L,物质的量为0.375mol,但事实上混合气体存在可逆反应NO2 N2O4,故无法准确求解分子数目,错误。
同课章节目录
