3.1.2 铁的重要化合物 课件(共17张PPT)
文档属性
| 名称 | 3.1.2 铁的重要化合物 课件(共17张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 25.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-02 15:37:32 | ||
图片预览






文档简介
(共17张PPT)
3.1铁及其化合物(二)
第三章 铁 金属材料
——铁的氢氧化物、铁盐及亚铁盐
教学目标:
1、知识与技能
掌握铁的氢氧化物的制备和性质;能对铁的氢氧化物的变化进行探究;
2、过程与方法
将实验探究与讨论交流密切结合;学习运用比较、归纳、分析、综合的学习方法
3、情感态度价值观
养成务实求真、勇于探索的科学态度,重点培养学生"主动参与、乐于探究、交流合作"的精神
重点: 氢氧化亚铁的制备 、亚铁盐和铁盐的鉴别
难点: 氢氧化亚铁的制备
思考与讨论
实验台上两瓶失去标签的FeCl2溶液和FeCl3溶液,如何鉴别它们?
VS
浅绿色
棕黄色
FeCl3(aq)
FeCl2(aq)
铁的氢氧化物的
制备实验视频:
二、铁的氢氧化物
名称 氢氧化亚铁 氢氧化铁
化学式
物理性质
与酸反应
制法
Fe(OH)2
Fe(OH)3
白色固体、不溶于水
红褐色固体、不溶于水
Fe3++3OH- =Fe(OH)3
Fe2++2OH- =Fe(OH)2
Fe(OH)2+2H+= Fe2++2H2O
Fe(OH)3+3H+= Fe3++3H2O
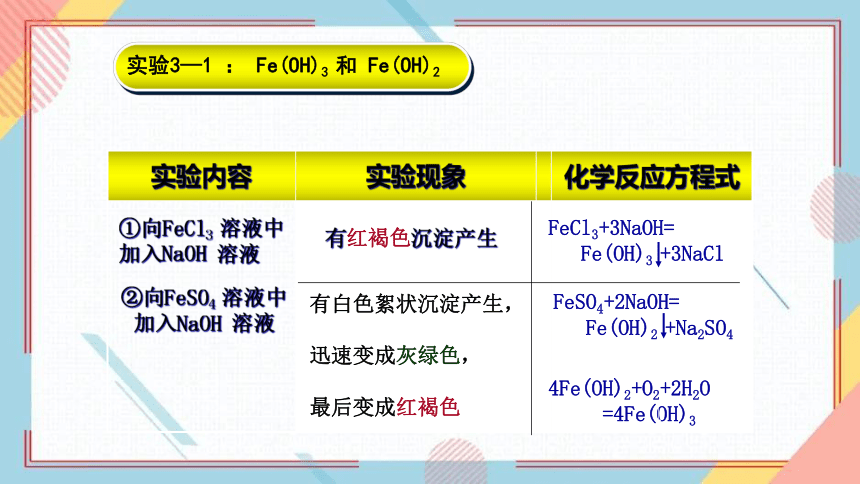
实验内容 实验现象 化学反应方程式
①向FeCl3 溶液中加入NaOH 溶液
②向FeSO4 溶液中加入NaOH 溶液
有红褐色沉淀产生
有白色絮状沉淀产生,
迅速变成灰绿色,
最后变成红褐色
4Fe(OH)2+O2+2H2O
=4Fe(OH)3
FeCl3+3NaOH=
Fe(OH)3 +3NaCl
FeSO4+2NaOH=
Fe(OH)2 +Na2SO4
实验3—1 : Fe(OH)3 和 Fe(OH)2
1、为什么实验中生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色呢?
讨论
Fe2++2OH_ =Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
2、如何才能制备纯净的氢氧化亚铁?
1、使用新配制的FeSO4溶液和NaOH溶液。
2、把配制溶液用的蒸馏水事先加热煮沸一下。
3、加入NaOH溶液的胶头滴管的尖端插入FeSO4溶液液面以下。
4、如果在试管中FeSO4溶液液面上预先注入一层植物油,则生成的Fe(OH)2保存的时间会更长一些。
方案
三、铁盐和亚铁盐
实验3—2
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液变为血红色
溶液颜色无变化
思考:怎样区分FeCl3和FeCl2溶液?
鉴别方法 Fe2+ Fe3+
直接观色
加KSCN溶液
加NaOH溶液
浅绿色
棕黄色
白色沉淀迅速变灰绿色最后呈红褐色
立即产生
红褐色沉淀
无现象
血红色
向盛有 2 mL FeCl3 溶液的试管中加入少量铁粉,振荡试管。充分反应后,滴入几滴KSCN溶液,观察实验现象。把上层清液转移至另一支试管,滴入几滴氯水,又发生了什么变化?
2Fe3++Fe=3Fe2+
2Fe2+ + Cl2=2Fe3++2Cl
如果改变试剂的添加顺序,先向FeCl3 溶液中滴加KSCN溶液,再加入铁粉,会有什么现象?
实验3—3
【实验仪器】试管、胶头滴管;稀HNO3、新制氯水。
你还可以设计哪些实验来实现铁盐和亚铁盐的相互转化?
2Fe3++Cu=2Fe2++Cu2+
2Fe3++2I =2Fe2++I2
2Fe2++H2O2+2H+=2Fe3++2H2O
结论:FeCl3(aq) → KSCN(aq) → 铁粉/铜粉/KI溶液+淀粉溶液/维生素C
2Fe3++Fe=3Fe2+
结论:FeSO4(aq) → KSCN(aq) → 新制氯水/H2O2/KMnO4(H+)/稀HNO3
2Fe2++Cl2=2Fe3++2Cl
归纳总结“铁三角”
铁三角的相互转化
铁三角的应用
课堂练习:
1. 将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶
液没有颜色变化的是: ( )
A.FeS B.Fe2O3 C.FeCl3 D.Fe2(SO4)3
A
A.硫化亚铁和盐酸反应生成的氯化亚铁溶液中没有铁离子,滴加硫氢化钾溶液没有颜色变化,故A正确
B.三氧化二铁与盐酸反应生成了铁离子,滴加硫氢化钾溶液后变红色,故B错误
C.氯化铁溶液中存在铁离子滴加硫氢化钾溶液后变红色溶液,颜色发生了变化,故c错误
D硫酸铁溶液中存在铁离子,滴加硫氢化钾溶液,变红色,溶液颜色发生了变化,故D错误
课堂总结
二、铁的氢氧化物的制备及其化学性质
Fe2++2OH- ==Fe(OH)2
Fe3++3OH- ==Fe(OH)3
制备:
化学性质:
Fe(OH)2+2H+==Fe2++2H2O
Fe(OH)3+3H+==Fe3++3H2O
①与酸反应:
②Fe(OH)2的不稳定性
4Fe(OH)2+O2+2H2O==4Fe(OH)3
(1) Fe3+的检验方法:
①观察溶液颜色:溶液为棕黄色
③加SCN-:Fe3+ + 3SCN- === Fe(SCN)3
(血红色溶液)
三、Fe3+和Fe2+的鉴别
②加OH-:生成红褐色沉淀
(2) Fe2+的检验方法:
①观察溶液颜色:溶液为浅绿色
②加OH- :生成白色沉淀迅速变灰绿色,最后呈红褐色沉淀
③加SCN-后加过氧化氢(或氯水等):先无变化,加 过氧化氢 后溶液变红
作 业
课本P77 第5题 第(6)题
3.1铁及其化合物(二)
第三章 铁 金属材料
——铁的氢氧化物、铁盐及亚铁盐
教学目标:
1、知识与技能
掌握铁的氢氧化物的制备和性质;能对铁的氢氧化物的变化进行探究;
2、过程与方法
将实验探究与讨论交流密切结合;学习运用比较、归纳、分析、综合的学习方法
3、情感态度价值观
养成务实求真、勇于探索的科学态度,重点培养学生"主动参与、乐于探究、交流合作"的精神
重点: 氢氧化亚铁的制备 、亚铁盐和铁盐的鉴别
难点: 氢氧化亚铁的制备
思考与讨论
实验台上两瓶失去标签的FeCl2溶液和FeCl3溶液,如何鉴别它们?
VS
浅绿色
棕黄色
FeCl3(aq)
FeCl2(aq)
铁的氢氧化物的
制备实验视频:
二、铁的氢氧化物
名称 氢氧化亚铁 氢氧化铁
化学式
物理性质
与酸反应
制法
Fe(OH)2
Fe(OH)3
白色固体、不溶于水
红褐色固体、不溶于水
Fe3++3OH- =Fe(OH)3
Fe2++2OH- =Fe(OH)2
Fe(OH)2+2H+= Fe2++2H2O
Fe(OH)3+3H+= Fe3++3H2O
实验内容 实验现象 化学反应方程式
①向FeCl3 溶液中加入NaOH 溶液
②向FeSO4 溶液中加入NaOH 溶液
有红褐色沉淀产生
有白色絮状沉淀产生,
迅速变成灰绿色,
最后变成红褐色
4Fe(OH)2+O2+2H2O
=4Fe(OH)3
FeCl3+3NaOH=
Fe(OH)3 +3NaCl
FeSO4+2NaOH=
Fe(OH)2 +Na2SO4
实验3—1 : Fe(OH)3 和 Fe(OH)2
1、为什么实验中生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色呢?
讨论
Fe2++2OH_ =Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
2、如何才能制备纯净的氢氧化亚铁?
1、使用新配制的FeSO4溶液和NaOH溶液。
2、把配制溶液用的蒸馏水事先加热煮沸一下。
3、加入NaOH溶液的胶头滴管的尖端插入FeSO4溶液液面以下。
4、如果在试管中FeSO4溶液液面上预先注入一层植物油,则生成的Fe(OH)2保存的时间会更长一些。
方案
三、铁盐和亚铁盐
实验3—2
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液变为血红色
溶液颜色无变化
思考:怎样区分FeCl3和FeCl2溶液?
鉴别方法 Fe2+ Fe3+
直接观色
加KSCN溶液
加NaOH溶液
浅绿色
棕黄色
白色沉淀迅速变灰绿色最后呈红褐色
立即产生
红褐色沉淀
无现象
血红色
向盛有 2 mL FeCl3 溶液的试管中加入少量铁粉,振荡试管。充分反应后,滴入几滴KSCN溶液,观察实验现象。把上层清液转移至另一支试管,滴入几滴氯水,又发生了什么变化?
2Fe3++Fe=3Fe2+
2Fe2+ + Cl2=2Fe3++2Cl
如果改变试剂的添加顺序,先向FeCl3 溶液中滴加KSCN溶液,再加入铁粉,会有什么现象?
实验3—3
【实验仪器】试管、胶头滴管;稀HNO3、新制氯水。
你还可以设计哪些实验来实现铁盐和亚铁盐的相互转化?
2Fe3++Cu=2Fe2++Cu2+
2Fe3++2I =2Fe2++I2
2Fe2++H2O2+2H+=2Fe3++2H2O
结论:FeCl3(aq) → KSCN(aq) → 铁粉/铜粉/KI溶液+淀粉溶液/维生素C
2Fe3++Fe=3Fe2+
结论:FeSO4(aq) → KSCN(aq) → 新制氯水/H2O2/KMnO4(H+)/稀HNO3
2Fe2++Cl2=2Fe3++2Cl
归纳总结“铁三角”
铁三角的相互转化
铁三角的应用
课堂练习:
1. 将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶
液没有颜色变化的是: ( )
A.FeS B.Fe2O3 C.FeCl3 D.Fe2(SO4)3
A
A.硫化亚铁和盐酸反应生成的氯化亚铁溶液中没有铁离子,滴加硫氢化钾溶液没有颜色变化,故A正确
B.三氧化二铁与盐酸反应生成了铁离子,滴加硫氢化钾溶液后变红色,故B错误
C.氯化铁溶液中存在铁离子滴加硫氢化钾溶液后变红色溶液,颜色发生了变化,故c错误
D硫酸铁溶液中存在铁离子,滴加硫氢化钾溶液,变红色,溶液颜色发生了变化,故D错误
课堂总结
二、铁的氢氧化物的制备及其化学性质
Fe2++2OH- ==Fe(OH)2
Fe3++3OH- ==Fe(OH)3
制备:
化学性质:
Fe(OH)2+2H+==Fe2++2H2O
Fe(OH)3+3H+==Fe3++3H2O
①与酸反应:
②Fe(OH)2的不稳定性
4Fe(OH)2+O2+2H2O==4Fe(OH)3
(1) Fe3+的检验方法:
①观察溶液颜色:溶液为棕黄色
③加SCN-:Fe3+ + 3SCN- === Fe(SCN)3
(血红色溶液)
三、Fe3+和Fe2+的鉴别
②加OH-:生成红褐色沉淀
(2) Fe2+的检验方法:
①观察溶液颜色:溶液为浅绿色
②加OH- :生成白色沉淀迅速变灰绿色,最后呈红褐色沉淀
③加SCN-后加过氧化氢(或氯水等):先无变化,加 过氧化氢 后溶液变红
作 业
课本P77 第5题 第(6)题
