3.3.1粗盐提纯 从海水中提取镁 课件(共37张PPT) 2023-2024学年上学期高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 3.3.1粗盐提纯 从海水中提取镁 课件(共37张PPT) 2023-2024学年上学期高一化学苏教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-02 15:51:15 | ||
图片预览









文档简介
(共37张PPT)
苏教版(2019) 必修一
粗盐提纯 从海水中提取镁
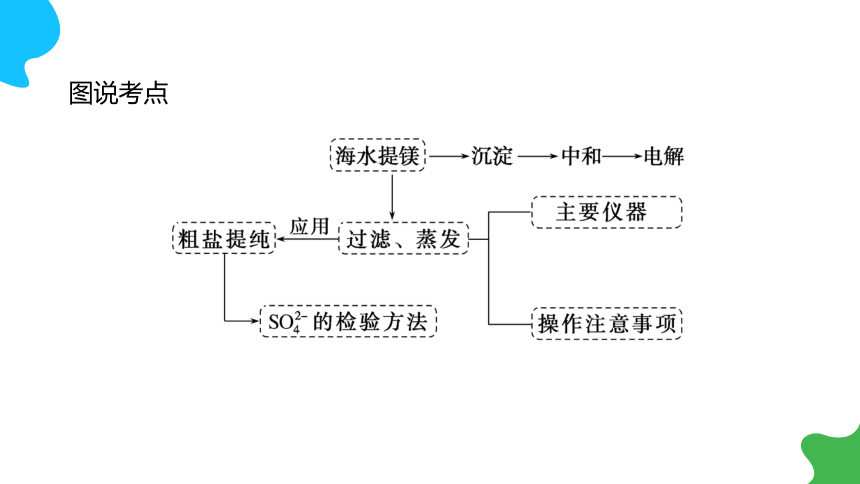
图说考点
[新知预习]
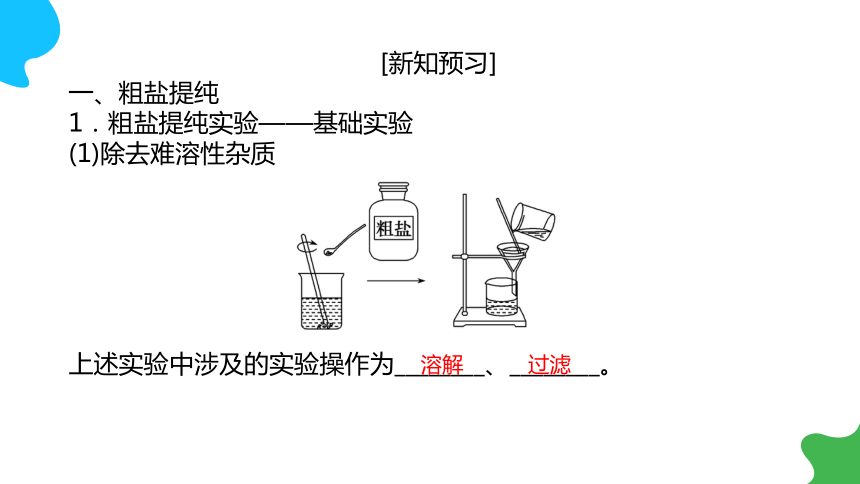
一、粗盐提纯
1.粗盐提纯实验——基础实验
(1)除去难溶性杂质
上述实验中涉及的实验操作为________、________。
溶解
过滤
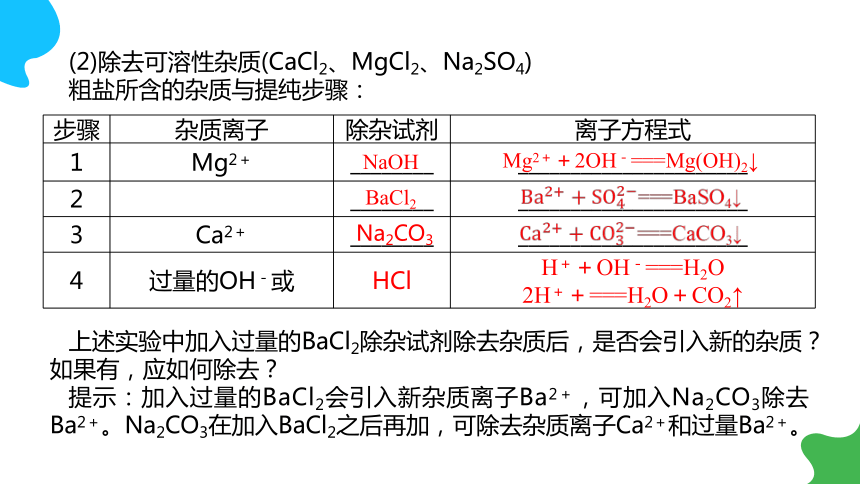
(2)除去可溶性杂质(CaCl2、MgCl2、Na2SO4)
粗盐所含的杂质与提纯步骤:
上述实验中加入过量的BaCl2除杂试剂除去杂质后,是否会引入新的杂质?如果有,应如何除去?
提示:加入过量的BaCl2会引入新杂质离子Ba2+,可加入Na2CO3除去Ba2+。Na2CO3在加入BaCl2之后再加,可除去杂质离子Ca2+和过量Ba2+。
步骤 杂质离子 除杂试剂 离子方程式
1 Mg2+ ________ ______________________
2 ________ ______________________
3 Ca2+ ________ ______________________
4 过量的OH-或 HCl H++OH-===H2O
2H++===H2O+CO2↑
NaOH
Mg2++2OH-===Mg(OH)2↓
BaCl2
===BaSO4↓
Na2CO3
===CaCO3↓
2.粗盐提纯思路
________→过滤→________除杂质→蒸发结晶。
工业上运用物理方法、化学方法将粗盐进行提纯后,就可以获得基础化工原料氯化钠。
溶解
加试剂
二、镁的存在及提取
1.镁的存在:自然界中的镁主要以__________的形式存在于地壳和海水中。海水中镁的总储量约为2.1×1015 t。
2.镁的提取
从海水中提取镁,步骤如下:
(1)煅烧海边贝壳(__________),制成石灰乳。化学方程式:CaCO3CaO+CO2↑,CaO+__________===Ca(OH)2↓。
(2)将石灰乳加入到海水沉淀池中,得到氢氧化镁沉淀。化学方程式:MgCl2+Ca(OH)2===__________+__________,该反应实质上是Mg2+与OH-结合生成Mg(OH)2沉淀的反应,离子方程式: ______________________________。
化合态
石灰石
H2O
Mg(OH)2↓
CaCl2
Mg2++Ca(OH)2===Ca2++Mg(OH)2↓
(3)将氢氧化镁与盐酸反应,化学方程式:__________________________,该反应实质上是_________与_______反应生成Mg2+与H2O,离子方程式:__________________________。所得溶液蒸发结晶可获得六水合氯化镁晶体(MgCl2·6H2O),然后在氯化氢气流中加热,转化成氯化镁。化学方程式:
____________。
(4)电解熔融__________制得金属镁。化学方程式:MgCl2(熔融)__________。
+2HCl===MgCl2+2H2O
Mg(OH)2
H+
Mg(OH)2+2H+===Mg2++2H2O
MgCl2+6H2O↑
氯化镁
Mg+Cl2↑
三、镁的原子结构和性质
1.镁的原子结构
(1)原子结构示意图为__________。
(2)原子结构和性质的关系:
容易_______最外层的_______个电子形成________,表现强_______性。
失去
2
镁离子
还原
2.镁的性质
物理性质 银白色金属,密度较小,熔点较低,硬度较小,有良好的导电性、导热性和延展性,与其他金属易形成性能优良的合金
化学性质 与非金属单质反应 2Mg+O22MgO
3Mg+N2Mg3N2
与酸反应 ①与非氧化性酸反应,如与稀硫酸、盐酸等反应生成氢气:Mg+2H+===Mg2++H2↑
②与氧化性酸反应,如与浓硫酸、硝酸等反应,但不生成氢气,如Mg+2H2SO4(浓)===MgSO4+SO2↑+2H2O(在专题4中会学到)
与CO2反应 2Mg+CO22MgO+C
3.镁的用途
(1)镁合金的密度较小,但硬度和强度都较大,被广泛用于制造火箭、导弹和飞机的部件等。
(2)镁具有较强的还原性,在冶金工业上,常用作还原剂和脱氧剂。
(3)制耐火材料氧化镁。氧化镁的熔点高达2 800 ℃,是优质的耐高温材料。
(4)镁燃烧发出耀眼的白光,因此常被用来制造信号弹。
特别提醒
(1)“二氧化碳不支持燃烧”的说法不是绝对的。二氧化碳对大多数可燃物来说是良好的灭火剂,但对于Na、Mg等可燃物来说则是助燃剂。
(2)镁在常温下易与空气中的氧气反应,生成一层致密的氧化物薄膜,这层氧化物薄膜能够阻止内部的金属继续被氧化,故镁有抗腐蚀性能。
[即时自测]
1.判断正误,正确的打“√”,错误的打“×”
(1)用H2还原MgCl2可得金属镁。( )
(2)工业上通常通过电解MgO来制得金属Mg。( )
(3)将镁条直接放入盐酸中观察镁与盐酸反应现象。( )
(4)燃着的镁条伸入盛CO2的集气瓶中立即熄灭。( )
(5)Mg不能在N2中燃烧。( )
(6)粗盐可直接用作化工原料。( )
×
×
×
×
×
×
2.提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为( )
A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
答案:B
解析:为了使Ba2+完全沉淀,必须加入过量的碳酸钾溶液,过滤,除去碳酸钡沉淀,在滤液中加入适量的硝酸,除去过量的,即可达到目的。
3.广州亚运会开幕式上的礼花,让广州显得更加辉煌、浪漫。其中镁粉可用来制造焰火,工业上制取镁粉的方法是将镁的蒸气进行冷却,其中最适宜的方法是( )
A.在氮气的容器内冷却 B.在水中冷却
C.在氦气的环境里冷却 D.在二氧化碳气体里冷却
答案:C
解析:Mg与N2反应生成Mg3N2,Mg与热水反应,Mg与CO2反应。
4.由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是( )
A.②④⑤③① B.③②④①⑤
C.③④②⑤① D.②④③⑤①
答案:D
解析:由海水中提取镁可知,先在海水中加入熟石灰,使Mg2+变成Mg(OH)2沉淀,过滤得到,然后再加盐酸溶解、浓缩结晶,在一定条件下脱水干燥,最终得到无水氯化镁。
5.分析镁在空气中的燃烧产物,肯定不存在的物质是( )
A.C B.MgO
C.MgCO3 D.Mg3N2
答案:C
解析:镁在空气中燃烧可与CO2反应生成C和MgO,与O2反应生成MgO,与N2反应生成Mg3N2。
提升点1 粗盐提纯
例1 为了除去粗盐中的Ca2+、Mg2+、及泥沙,得到纯净的NaCl,可将粗盐溶于水,在下列操作中选取必要的步骤和正确的操作顺序( )
①过滤 ②加过量的NaOH溶液 ③加过量的盐酸 ④加过量的Na2CO3溶液 ⑤加过量的BaCl2溶液 ⑥加热蒸发
A.④①⑤②①③⑥ B.⑤①④②③⑥
C.②⑤④①③⑥ D.①②⑤④①③⑥
【答案】 D
【解析】 开始时要先过滤,使不溶性泥沙与可溶性物质分开。除Ca2+用,除Mg2+用OH-,除用Ba2+;为将杂质离子全部除去,加入的沉淀剂必须是过量的,这样就引入了新的杂质离子,必须考虑在后面操作中除去。方案很多,但有一个基本思路:要在Ba2+后面加入,最后加入过量盐酸,加热蒸发。故D项正确。
[提升1] 为了除去KCl固体中少量的MgCl2、,可选用Ba(OH)2、HCl和K2CO3三种试剂,按下列步骤操作:
(1)写出三种试剂的化学式:
A________,B________,C________。
(2)根据题意,回答下列问题:
①加入过量A的目的是_______________;
②加入过量B的目的是______________;
③加热煮沸的目的是__________。
(3)操作Ⅰ是________,操作Ⅱ是________。
本题重点分析:①工艺路线;②试剂、用量;③分离操作;④中间产物。这也是解答工艺流程题的4个审题要点。
Ba(OH)2
K2CO3
HCl
除尽Mg2+和
除尽过量的Ba2+
使HCl挥发
过滤
蒸发
解析:当有多种杂质共存时,应认真分析。要使杂质一一除去,必须考虑到所加试剂是过量的,而且过量的试剂在后面步骤中必须能除去,要除去Mg2+,可用含OH-的试剂,除可用含Ba2+的试剂,故先加入Ba(OH)2。加入的过量Ba(OH)2中的Ba2+可用K2CO3除去,过量中的OH-,以及过量K2CO3中的,可用稀盐酸除去,最后加热煮沸可除去HCl。
关键能力
粗盐提纯中各
种试剂的作用
牢记分离和提纯操作中的“四个原则”
①“不增”——不能引入新的杂质;
②“不减”——不能减少被提纯物质;
③“易分离”——原杂质或反应后的杂质易与被提纯物质分离;
④“易复原”——被提纯的物质要容易复原。
提升点2 从海水中提取镁
例2 工业中“从海水中提取镁”的流程如图所示:
其步骤为:
①将海边大量的贝壳煅烧成石灰,并将石灰制成石灰乳;
②将石灰乳加入海水沉淀中经过滤得到Mg(OH)2沉淀;
③在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
④将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
⑤电解熔融的氯化镁可得到Mg。
请回答以下问题:
(1)步骤③中的蒸发是利用风吹日晒来完成的,而实验室中进行蒸发操作需要的主要仪器有________、________、酒精灯、铁架台等。
(2)上述提取镁的流程中,在降低成本、减少污染方面做了一些工作,请写出其中一点:_________________。
(3)有同学认为:步骤②后可加热Mg(OH)2得到MgO,再电解熔融的MgO制取金属镁,这样可简化实验步骤。你同意该同学的想法吗?为什么?
你的观点是________,理由是__________________________。
蒸发皿
玻璃棒
生成的Cl2要回收利用
不同意
MgO熔点高,熔化消耗大量能量
[提升2] 某中学化学兴趣小组设计了四种从海水中提取镁的工艺流程,你认为合理的是( )
A.海水Mg(OH)2Mg
B.海水Mg(OH)2MgCl2溶液―→MgCl2(熔融)Mg
C.海水MgCl2溶液―→MgCl2晶体Mg
D.海水Mg(OH)2MgOMg
答案:B
关键能力
1.从海水中提取镁的工艺流程
2.注意事项
(1)不要直接往海水中加沉淀剂。因为海水中的Mg2+的浓度很小,直接加沉淀剂不利于Mg2+的沉淀,而且会增大沉淀剂的用量,我们可以先将海水浓缩,再加沉淀剂。
(2)从原料来源以及经济等综合角度考虑选用试剂作沉淀剂较好。因为海边有丰富的贝壳,可用来制得。
(3)在Mg(OH)2中先加盐酸反应,再浓缩得MgCl2·6H2O晶体,然后再将MgCl2·6H2O晶体在HCl气流中加热脱水即可得无水MgCl2。
(4)电解产生的Cl2可以循环利用,这样既可以节约资源又可以减轻Cl2任意排放对环境造成的污染。
1.下列各物质含少量杂质,除去这些杂质应选用的试剂或操作方法正确的是( )
A.②④ B.②③④
C.①③④ D.①②③④
序号 物质 杂质 除杂应选用的试剂或操作方法
① KNO3溶液 KOH 加入FeCl3溶液,并过滤
② FeSO4溶液 CuSO4 加入过量铁粉,并过滤
③ H2 CO2 通过盛NaOH溶液的洗气瓶
④ NaNO3固体 CaCO3 溶解、过滤、蒸发
答案:B
解析:①KOH与氯化铁反应生成沉淀和KCl,引入新杂质KCl,不能除杂,故不选;②Fe与硫酸铜反应生成硫酸亚铁和Cu,反应后过滤可分离,故选;③二氧化碳与NaOH反应,而氢气不能,选NaOH溶液、洗气可分离,故选;④碳酸钙不溶于水,硝酸钠溶于水,则溶解后,过滤、蒸发可分离,故选;故选B。
2.关于粗盐提纯的下列说法中正确的是( )
A.溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解
B.当蒸发到蒸发皿中出现较多固体剩余少量液体时,停止加热,利用余热将液体蒸干
C.将制得的食盐熔化电解即为“氯碱工业”
D.为除去粗盐中的Ca2+、Mg2+、,可依次向溶液中加入足量的氢氧化钠溶液、碳酸钠溶液、氯化钡溶液、稀盐酸
答案:B
解析:食盐溶解即可,不能加水太多,若水太多,蒸发需要的时间太长,故A错误;蒸发到蒸发皿中出现较多固体剩余少量液体时,停止加热,利用余热将液体蒸干,故B正确;“氯碱工业”不是电解熔融NaCl,而是电解饱和食盐水,故C错误;碳酸钠一定在氯化钡之后,可除去过量的钡离子,则除去粗盐中的Ca2+、Mg2+、,可依次向溶液中加入足量的氢氧化钠溶液、氯化钡溶液、碳酸钠溶液、稀盐酸,故D错误。故选B。
3.海水中含的MgCl2是Mg的重要来源之一,从海水中提镁,可按如下步骤进行:
(1)将贝壳制成石灰乳
(2)在引入的海水中加入石灰乳、沉降、过滤、洗涤得到Mg(OH)2
(3)将沉淀物与盐酸反应、结晶、过滤、干燥产物
(4)将产物熔融后电解
下列说法中不正确的是( )
A.此法的优点之一是原料来源丰富
B.进行(1)、(2)、(3)步的目的是从海水中提取MgCl2
C.第(4)步会产生氯气
D.以上过程中涉及到复分解反应、化合反应和置换反应
答案:D
解析:原料来源丰富是此法的优点之一,A正确;(1)、(2)、(3)步的目的是从海水中提取MgCl2以便用于第(4)步的电解,B正确;电解MgCl2生成镁和氯气,C正确;此过程中无置换反应,D不正确。
4.从海水中提取镁的流程如图所示(框图中是主要产物):
请回答相关问题:
(1)下列说法不正确的是________(填序号)。
A.上述方法的优点之一是原料丰富
B.进行①②③步骤的目的是富集MgCl2
C.工业上也可用电解熔融氧化镁的方法制取镁
D.电解法冶炼金属要消耗大量的电能
C
(2)海水进入沉淀池前,对海水进行处理有以下两种方案。
方案一:将晒盐后的卤水通入沉淀池。
方案二:将加热蒸发浓缩后的海水通入沉淀池。
你认为方案_______更合理,理由是____________________________ _________________。
(3)步骤③中发生反应的离子方程式是_________________________。
步骤④中发生反应的离子方程式是________________________。
一
加热海水需要大量的能源,浪费了能
源,增加了生产成本
Mg(OH)2+2H+===Mg2++2H2O
MgCl2(熔融)Mg+Cl2↑
解析:(2)由于蒸发浓缩海水需要加热,从而消耗大量的能源,所以方案一更合理。(3)氢氧化镁转化为氯化镁,需要将氢氧化镁溶解在盐酸中,反应的离子方程式是+2H+===Mg2++2H2O;镁是活泼金属,需用电解法冶炼,反应的化学方程式是MgCl2(熔融)Mg+Cl2↑。
感悟
海水提镁的“四步骤”“七反应”
苏教版(2019) 必修一
粗盐提纯 从海水中提取镁
图说考点
[新知预习]
一、粗盐提纯
1.粗盐提纯实验——基础实验
(1)除去难溶性杂质
上述实验中涉及的实验操作为________、________。
溶解
过滤
(2)除去可溶性杂质(CaCl2、MgCl2、Na2SO4)
粗盐所含的杂质与提纯步骤:
上述实验中加入过量的BaCl2除杂试剂除去杂质后,是否会引入新的杂质?如果有,应如何除去?
提示:加入过量的BaCl2会引入新杂质离子Ba2+,可加入Na2CO3除去Ba2+。Na2CO3在加入BaCl2之后再加,可除去杂质离子Ca2+和过量Ba2+。
步骤 杂质离子 除杂试剂 离子方程式
1 Mg2+ ________ ______________________
2 ________ ______________________
3 Ca2+ ________ ______________________
4 过量的OH-或 HCl H++OH-===H2O
2H++===H2O+CO2↑
NaOH
Mg2++2OH-===Mg(OH)2↓
BaCl2
===BaSO4↓
Na2CO3
===CaCO3↓
2.粗盐提纯思路
________→过滤→________除杂质→蒸发结晶。
工业上运用物理方法、化学方法将粗盐进行提纯后,就可以获得基础化工原料氯化钠。
溶解
加试剂
二、镁的存在及提取
1.镁的存在:自然界中的镁主要以__________的形式存在于地壳和海水中。海水中镁的总储量约为2.1×1015 t。
2.镁的提取
从海水中提取镁,步骤如下:
(1)煅烧海边贝壳(__________),制成石灰乳。化学方程式:CaCO3CaO+CO2↑,CaO+__________===Ca(OH)2↓。
(2)将石灰乳加入到海水沉淀池中,得到氢氧化镁沉淀。化学方程式:MgCl2+Ca(OH)2===__________+__________,该反应实质上是Mg2+与OH-结合生成Mg(OH)2沉淀的反应,离子方程式: ______________________________。
化合态
石灰石
H2O
Mg(OH)2↓
CaCl2
Mg2++Ca(OH)2===Ca2++Mg(OH)2↓
(3)将氢氧化镁与盐酸反应,化学方程式:__________________________,该反应实质上是_________与_______反应生成Mg2+与H2O,离子方程式:__________________________。所得溶液蒸发结晶可获得六水合氯化镁晶体(MgCl2·6H2O),然后在氯化氢气流中加热,转化成氯化镁。化学方程式:
____________。
(4)电解熔融__________制得金属镁。化学方程式:MgCl2(熔融)__________。
+2HCl===MgCl2+2H2O
Mg(OH)2
H+
Mg(OH)2+2H+===Mg2++2H2O
MgCl2+6H2O↑
氯化镁
Mg+Cl2↑
三、镁的原子结构和性质
1.镁的原子结构
(1)原子结构示意图为__________。
(2)原子结构和性质的关系:
容易_______最外层的_______个电子形成________,表现强_______性。
失去
2
镁离子
还原
2.镁的性质
物理性质 银白色金属,密度较小,熔点较低,硬度较小,有良好的导电性、导热性和延展性,与其他金属易形成性能优良的合金
化学性质 与非金属单质反应 2Mg+O22MgO
3Mg+N2Mg3N2
与酸反应 ①与非氧化性酸反应,如与稀硫酸、盐酸等反应生成氢气:Mg+2H+===Mg2++H2↑
②与氧化性酸反应,如与浓硫酸、硝酸等反应,但不生成氢气,如Mg+2H2SO4(浓)===MgSO4+SO2↑+2H2O(在专题4中会学到)
与CO2反应 2Mg+CO22MgO+C
3.镁的用途
(1)镁合金的密度较小,但硬度和强度都较大,被广泛用于制造火箭、导弹和飞机的部件等。
(2)镁具有较强的还原性,在冶金工业上,常用作还原剂和脱氧剂。
(3)制耐火材料氧化镁。氧化镁的熔点高达2 800 ℃,是优质的耐高温材料。
(4)镁燃烧发出耀眼的白光,因此常被用来制造信号弹。
特别提醒
(1)“二氧化碳不支持燃烧”的说法不是绝对的。二氧化碳对大多数可燃物来说是良好的灭火剂,但对于Na、Mg等可燃物来说则是助燃剂。
(2)镁在常温下易与空气中的氧气反应,生成一层致密的氧化物薄膜,这层氧化物薄膜能够阻止内部的金属继续被氧化,故镁有抗腐蚀性能。
[即时自测]
1.判断正误,正确的打“√”,错误的打“×”
(1)用H2还原MgCl2可得金属镁。( )
(2)工业上通常通过电解MgO来制得金属Mg。( )
(3)将镁条直接放入盐酸中观察镁与盐酸反应现象。( )
(4)燃着的镁条伸入盛CO2的集气瓶中立即熄灭。( )
(5)Mg不能在N2中燃烧。( )
(6)粗盐可直接用作化工原料。( )
×
×
×
×
×
×
2.提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为( )
A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
答案:B
解析:为了使Ba2+完全沉淀,必须加入过量的碳酸钾溶液,过滤,除去碳酸钡沉淀,在滤液中加入适量的硝酸,除去过量的,即可达到目的。
3.广州亚运会开幕式上的礼花,让广州显得更加辉煌、浪漫。其中镁粉可用来制造焰火,工业上制取镁粉的方法是将镁的蒸气进行冷却,其中最适宜的方法是( )
A.在氮气的容器内冷却 B.在水中冷却
C.在氦气的环境里冷却 D.在二氧化碳气体里冷却
答案:C
解析:Mg与N2反应生成Mg3N2,Mg与热水反应,Mg与CO2反应。
4.由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是( )
A.②④⑤③① B.③②④①⑤
C.③④②⑤① D.②④③⑤①
答案:D
解析:由海水中提取镁可知,先在海水中加入熟石灰,使Mg2+变成Mg(OH)2沉淀,过滤得到,然后再加盐酸溶解、浓缩结晶,在一定条件下脱水干燥,最终得到无水氯化镁。
5.分析镁在空气中的燃烧产物,肯定不存在的物质是( )
A.C B.MgO
C.MgCO3 D.Mg3N2
答案:C
解析:镁在空气中燃烧可与CO2反应生成C和MgO,与O2反应生成MgO,与N2反应生成Mg3N2。
提升点1 粗盐提纯
例1 为了除去粗盐中的Ca2+、Mg2+、及泥沙,得到纯净的NaCl,可将粗盐溶于水,在下列操作中选取必要的步骤和正确的操作顺序( )
①过滤 ②加过量的NaOH溶液 ③加过量的盐酸 ④加过量的Na2CO3溶液 ⑤加过量的BaCl2溶液 ⑥加热蒸发
A.④①⑤②①③⑥ B.⑤①④②③⑥
C.②⑤④①③⑥ D.①②⑤④①③⑥
【答案】 D
【解析】 开始时要先过滤,使不溶性泥沙与可溶性物质分开。除Ca2+用,除Mg2+用OH-,除用Ba2+;为将杂质离子全部除去,加入的沉淀剂必须是过量的,这样就引入了新的杂质离子,必须考虑在后面操作中除去。方案很多,但有一个基本思路:要在Ba2+后面加入,最后加入过量盐酸,加热蒸发。故D项正确。
[提升1] 为了除去KCl固体中少量的MgCl2、,可选用Ba(OH)2、HCl和K2CO3三种试剂,按下列步骤操作:
(1)写出三种试剂的化学式:
A________,B________,C________。
(2)根据题意,回答下列问题:
①加入过量A的目的是_______________;
②加入过量B的目的是______________;
③加热煮沸的目的是__________。
(3)操作Ⅰ是________,操作Ⅱ是________。
本题重点分析:①工艺路线;②试剂、用量;③分离操作;④中间产物。这也是解答工艺流程题的4个审题要点。
Ba(OH)2
K2CO3
HCl
除尽Mg2+和
除尽过量的Ba2+
使HCl挥发
过滤
蒸发
解析:当有多种杂质共存时,应认真分析。要使杂质一一除去,必须考虑到所加试剂是过量的,而且过量的试剂在后面步骤中必须能除去,要除去Mg2+,可用含OH-的试剂,除可用含Ba2+的试剂,故先加入Ba(OH)2。加入的过量Ba(OH)2中的Ba2+可用K2CO3除去,过量中的OH-,以及过量K2CO3中的,可用稀盐酸除去,最后加热煮沸可除去HCl。
关键能力
粗盐提纯中各
种试剂的作用
牢记分离和提纯操作中的“四个原则”
①“不增”——不能引入新的杂质;
②“不减”——不能减少被提纯物质;
③“易分离”——原杂质或反应后的杂质易与被提纯物质分离;
④“易复原”——被提纯的物质要容易复原。
提升点2 从海水中提取镁
例2 工业中“从海水中提取镁”的流程如图所示:
其步骤为:
①将海边大量的贝壳煅烧成石灰,并将石灰制成石灰乳;
②将石灰乳加入海水沉淀中经过滤得到Mg(OH)2沉淀;
③在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
④将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
⑤电解熔融的氯化镁可得到Mg。
请回答以下问题:
(1)步骤③中的蒸发是利用风吹日晒来完成的,而实验室中进行蒸发操作需要的主要仪器有________、________、酒精灯、铁架台等。
(2)上述提取镁的流程中,在降低成本、减少污染方面做了一些工作,请写出其中一点:_________________。
(3)有同学认为:步骤②后可加热Mg(OH)2得到MgO,再电解熔融的MgO制取金属镁,这样可简化实验步骤。你同意该同学的想法吗?为什么?
你的观点是________,理由是__________________________。
蒸发皿
玻璃棒
生成的Cl2要回收利用
不同意
MgO熔点高,熔化消耗大量能量
[提升2] 某中学化学兴趣小组设计了四种从海水中提取镁的工艺流程,你认为合理的是( )
A.海水Mg(OH)2Mg
B.海水Mg(OH)2MgCl2溶液―→MgCl2(熔融)Mg
C.海水MgCl2溶液―→MgCl2晶体Mg
D.海水Mg(OH)2MgOMg
答案:B
关键能力
1.从海水中提取镁的工艺流程
2.注意事项
(1)不要直接往海水中加沉淀剂。因为海水中的Mg2+的浓度很小,直接加沉淀剂不利于Mg2+的沉淀,而且会增大沉淀剂的用量,我们可以先将海水浓缩,再加沉淀剂。
(2)从原料来源以及经济等综合角度考虑选用试剂作沉淀剂较好。因为海边有丰富的贝壳,可用来制得。
(3)在Mg(OH)2中先加盐酸反应,再浓缩得MgCl2·6H2O晶体,然后再将MgCl2·6H2O晶体在HCl气流中加热脱水即可得无水MgCl2。
(4)电解产生的Cl2可以循环利用,这样既可以节约资源又可以减轻Cl2任意排放对环境造成的污染。
1.下列各物质含少量杂质,除去这些杂质应选用的试剂或操作方法正确的是( )
A.②④ B.②③④
C.①③④ D.①②③④
序号 物质 杂质 除杂应选用的试剂或操作方法
① KNO3溶液 KOH 加入FeCl3溶液,并过滤
② FeSO4溶液 CuSO4 加入过量铁粉,并过滤
③ H2 CO2 通过盛NaOH溶液的洗气瓶
④ NaNO3固体 CaCO3 溶解、过滤、蒸发
答案:B
解析:①KOH与氯化铁反应生成沉淀和KCl,引入新杂质KCl,不能除杂,故不选;②Fe与硫酸铜反应生成硫酸亚铁和Cu,反应后过滤可分离,故选;③二氧化碳与NaOH反应,而氢气不能,选NaOH溶液、洗气可分离,故选;④碳酸钙不溶于水,硝酸钠溶于水,则溶解后,过滤、蒸发可分离,故选;故选B。
2.关于粗盐提纯的下列说法中正确的是( )
A.溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解
B.当蒸发到蒸发皿中出现较多固体剩余少量液体时,停止加热,利用余热将液体蒸干
C.将制得的食盐熔化电解即为“氯碱工业”
D.为除去粗盐中的Ca2+、Mg2+、,可依次向溶液中加入足量的氢氧化钠溶液、碳酸钠溶液、氯化钡溶液、稀盐酸
答案:B
解析:食盐溶解即可,不能加水太多,若水太多,蒸发需要的时间太长,故A错误;蒸发到蒸发皿中出现较多固体剩余少量液体时,停止加热,利用余热将液体蒸干,故B正确;“氯碱工业”不是电解熔融NaCl,而是电解饱和食盐水,故C错误;碳酸钠一定在氯化钡之后,可除去过量的钡离子,则除去粗盐中的Ca2+、Mg2+、,可依次向溶液中加入足量的氢氧化钠溶液、氯化钡溶液、碳酸钠溶液、稀盐酸,故D错误。故选B。
3.海水中含的MgCl2是Mg的重要来源之一,从海水中提镁,可按如下步骤进行:
(1)将贝壳制成石灰乳
(2)在引入的海水中加入石灰乳、沉降、过滤、洗涤得到Mg(OH)2
(3)将沉淀物与盐酸反应、结晶、过滤、干燥产物
(4)将产物熔融后电解
下列说法中不正确的是( )
A.此法的优点之一是原料来源丰富
B.进行(1)、(2)、(3)步的目的是从海水中提取MgCl2
C.第(4)步会产生氯气
D.以上过程中涉及到复分解反应、化合反应和置换反应
答案:D
解析:原料来源丰富是此法的优点之一,A正确;(1)、(2)、(3)步的目的是从海水中提取MgCl2以便用于第(4)步的电解,B正确;电解MgCl2生成镁和氯气,C正确;此过程中无置换反应,D不正确。
4.从海水中提取镁的流程如图所示(框图中是主要产物):
请回答相关问题:
(1)下列说法不正确的是________(填序号)。
A.上述方法的优点之一是原料丰富
B.进行①②③步骤的目的是富集MgCl2
C.工业上也可用电解熔融氧化镁的方法制取镁
D.电解法冶炼金属要消耗大量的电能
C
(2)海水进入沉淀池前,对海水进行处理有以下两种方案。
方案一:将晒盐后的卤水通入沉淀池。
方案二:将加热蒸发浓缩后的海水通入沉淀池。
你认为方案_______更合理,理由是____________________________ _________________。
(3)步骤③中发生反应的离子方程式是_________________________。
步骤④中发生反应的离子方程式是________________________。
一
加热海水需要大量的能源,浪费了能
源,增加了生产成本
Mg(OH)2+2H+===Mg2++2H2O
MgCl2(熔融)Mg+Cl2↑
解析:(2)由于蒸发浓缩海水需要加热,从而消耗大量的能源,所以方案一更合理。(3)氢氧化镁转化为氯化镁,需要将氢氧化镁溶解在盐酸中,反应的离子方程式是+2H+===Mg2++2H2O;镁是活泼金属,需用电解法冶炼,反应的化学方程式是MgCl2(熔融)Mg+Cl2↑。
感悟
海水提镁的“四步骤”“七反应”
