7.3.1乙醇与乙酸 课件(共31张PPT)2023-2024学年高一下学期人教版(2019))化学必修第二册
文档属性
| 名称 | 7.3.1乙醇与乙酸 课件(共31张PPT)2023-2024学年高一下学期人教版(2019))化学必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 18.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-02 00:00:00 | ||
图片预览







文档简介
(共31张PPT)
第三节 乙醇与乙酸
第一课时乙醇
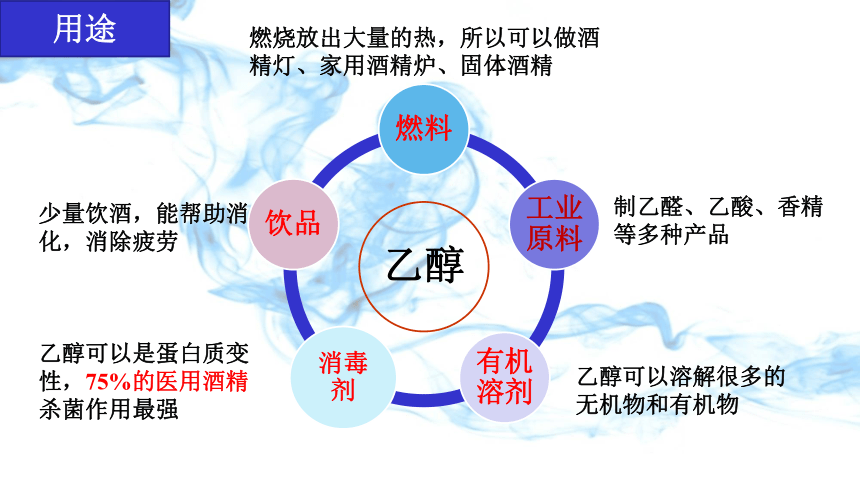
乙醇
燃料
工业原料
有机溶剂
消毒剂
饮品
少量饮酒,能帮助消化,消除疲劳
用途
乙醇可以是蛋白质变性,75%的医用酒精杀菌作用最强
燃烧放出大量的热,所以可以做酒精灯、家用酒精炉、固体酒精
制乙醛、乙酸、香精等多种产品
乙醇可以溶解很多的无机物和有机物
学业要求 核心素养建构
1.知道乙醇的组成、结构、官能团、物理性质及用途。 2.了解官能团与性质的关系,认识羟基与乙醇性质的关系。 3.会运用乙醇的结构分析其化学性质。 1.宏观辨识与微观探析:结合有机化合物中各原子的成键特点,从化学键角度分析推测乙醇的结构、性质和变化,形成“结构决定性质”的观念。
2.科学探究与模型构建:通过设计实验,探究乙醇的结构与性质,建构有机化合物的认知模型。
3.科学态度与社会责任:了解乙醇的用途及对人类健康生活的影响,要合理应用。
活动1:认识乙醇的物理性质
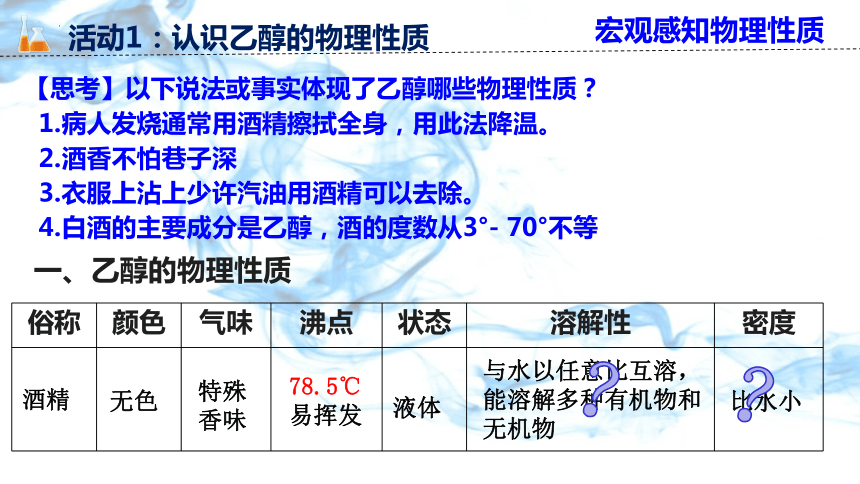
【思考】以下说法或事实体现了乙醇哪些物理性质?
1.病人发烧通常用酒精擦拭全身,用此法降温。
2.酒香不怕巷子深
3.衣服上沾上少许汽油用酒精可以去除。
4.白酒的主要成分是乙醇,酒的度数从3°- 70°不等
一、乙醇的物理性质
俗称 颜色 气味 沸点 状态 溶解性 密度
酒精
无色
特殊香味
78.5℃
易挥发
液体
与水以任意比互溶,能溶解多种有机物和无机物
比水小
?
宏观感知物理性质
?
活动2:探究乙醇的分子结构
经测定乙醇的分子式为C2H6O,那么乙醇分子的结构是怎样的呢?
乙醇的分子式是C2H6O,结合之前学习乙烷的结构
请大家根据碳、氢、氧原子的成键规律,利用球棍模型搭建出乙醇可能的结构模型,并写出结构式。
【思维导航】
微观探析结构
A:
B:
A式、B式在结构上有什么不同呢?(提示:氢原子的成键方式)
回顾所学知识:①钠能保存在煤油中(煤油是主要成分为C10-C16烷烃,主要含C-H) ②钠与H2O反应
微观探析结构
活动2:探究乙醇的分子结构
你能做出什么样的推测?怎样设计实验验证乙醇的结构?
活动2:探究乙醇的分子结构
可以设计怎样的实验去验证乙醇的结构呢?
主要实验仪器及用品:
试管、烧杯、
无水乙醇、金属钠
实验探究化学性质
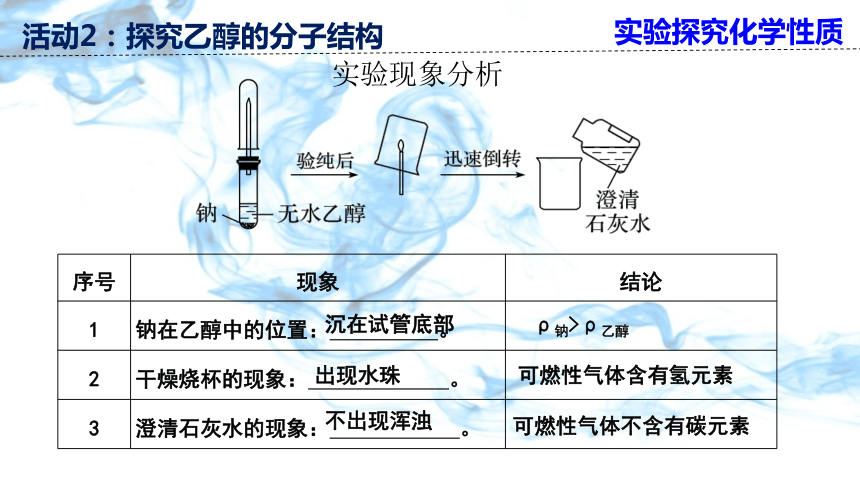
乙醇与钠的反应实验探究
活动2:探究乙醇的分子结构
实验探究化学性质
实验现象分析
序号 现象 结论
1 钠在乙醇中的位置: 。
2 干燥烧杯的现象: 。
3 澄清石灰水的现象: 。
活动2:探究乙醇的分子结构
实验探究化学性质
沉在试管底部
ρ钠>ρ乙醇
出现水珠
可燃性气体含有氢元素
不出现浑浊
可燃性气体不含有碳元素
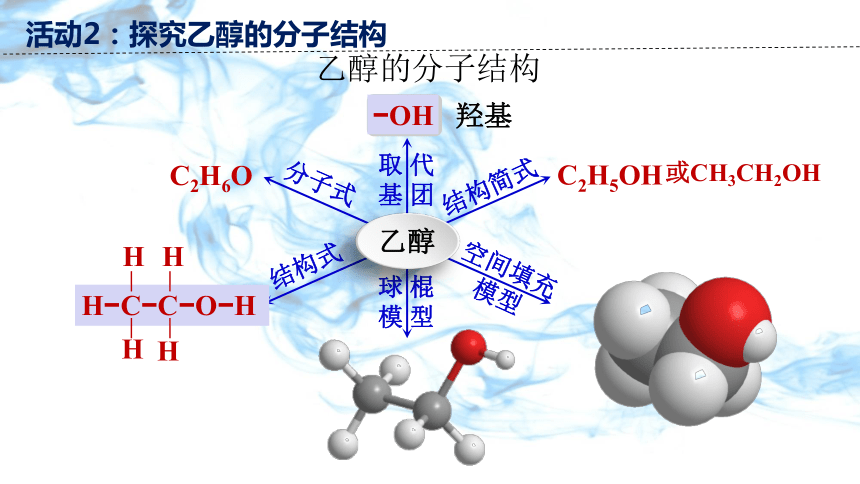
乙醇的分子结构
OH
羟基
C2H6O
取 代
基 团
分子式
结构式
结构简式
空间填充模型
球 棍
模 型
乙醇
H
H C C O H
H
H
H
C2H5OH
或CH3CH2OH
活动2:探究乙醇的分子结构
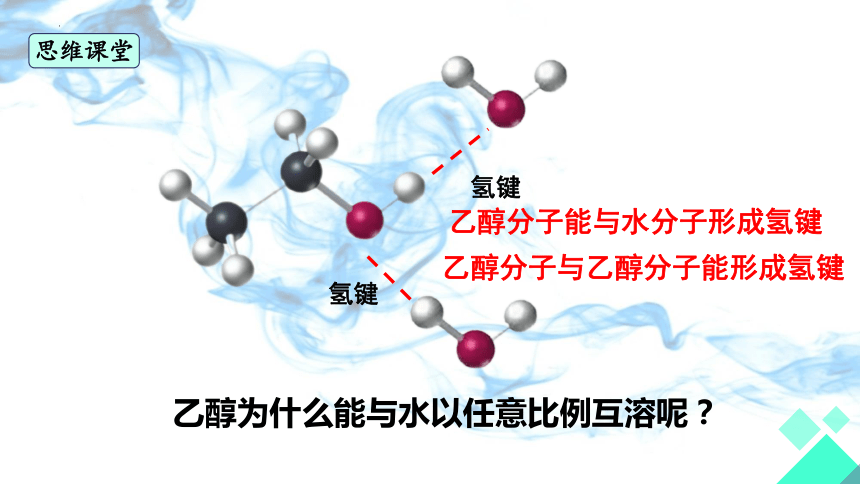
氢键
氢键
乙醇分子能与水分子形成氢键
乙醇分子与乙醇分子能形成氢键
乙醇为什么能与水以任意比例互溶呢?
实验探究
对比钠与水的反应
序号 钠与水 反应的现象 钠与乙醇 反应的现象 结论
1 浮 沉
2 熔化成小球 剧烈,四处游动 块状,未熔化 氢原子活泼性:
水分子>乙醇的羟基
小结
ρ乙醇<ρ钠<ρ水
活动3:探究乙醇的化学性质
1、与活泼金属〔如Na〕反应
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
思考:根据乙醇与活泼金属反应的断键情况,归纳醇分子中羟基与氢气的定量关系。
2-OH~H2
例如1mol 与足量钠反应,生成氢气的物质的量为 mol
1
三、乙醇的化学性质
1.乙醇与活泼金属如钠的反应
2.醇与钠反应的应用:
定性:处理遗漏的钠 ;
定量:测定醇中羟基数目。
小结
活动3:探究乙醇的化学性质
活动3:探究乙醇的化学性质
学习评价1
1.A.B.C三种醇同足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为 3:6:2,则 A.B.C三种醇分子中羟基个数之比为( )
A.2:1:3 B.3:2:1
C.2:6:3 D.3:1:2
A
2、氧化反应
C2H5OH+3O2 2CO2+3H2O
点燃
现象:发出淡蓝色火焰,
并放出大量热。
活动3:探究乙醇的化学性质
酒精火锅
(1) 燃烧反应:
焊接银器、铜器时,表面会生成发黑的氧化膜。工匠师傅说,可以先把银器和铜器在火上烧热,马上蘸一下酒精,铜银会光亮如初。
这其中包含的科学道理是什么呢?
资料卡片
【实验探究2】向试管中加约2mL无水乙醇,取一跟光洁的铜丝绕成螺旋状,置于酒精灯外焰上加热,然后趁热伸入无水乙醇中,反复几次,观察铜丝的变化并闻一闻液体的气味。
活动3:探究乙醇的化学性质
实验操作
实验现象
红色光亮的铜丝灼烧后变为黑色,趁热插入乙醇中,铜丝又变为红色。反复几次,闻到试管中的液体有刺激性气味
现象及原因探究
铜丝
红
Δ
变黑
插入乙醇溶液中
铜丝又变红色,试管中液体有刺激性气味
思考:1.反应机理中铜、氧化铜的作用?
2.写出:反应①、反应②、总反应的化学方程式
①
②
O2
CuO
Cu
CH3CH2OH
CH3CHO +H2O
反应机理
活动3:探究乙醇的化学性质
深度思考探究原理
催化剂
中间产物
①
②
O2
CuO
Cu
CH3CH2OH
CH3CHO +H2O
反应机理
总反应:2CH3CH2OH+O2 2CH3CHO+2H2O
Cu
乙醇的催化氧化反应
或Ag
活动3:探究乙醇的化学性质
深度思考探究原理
反应① 2Cu+O2=2CuO
反应②CuO+CH3CH2OH→Cu+CH3CHO+H2O
焊接银器、铜器时,表面会生成发黑的氧化膜。工匠师傅说,可以先把银器和铜器在火上烧热,马上蘸一下酒精,铜银会光亮如初。
这其中包含的科学道理是什么呢?
资料卡片
活动3:探究乙醇的化学性质
乙醇的催化氧化反应
活动:在纸上画出结构式,表示乙醇催化氧化的过程,说说反应中哪些化学键发生了变化
活动3:探究乙醇的化学性质
深度思考探究原理
+ O2
H C C H
H
O H
H
H
H C C H
O
H
H
2 +O2 2 +2H2O
Cu
活动3:探究乙醇的化学性质
2、氧化反应
(2)催化氧化反应
2CH3CH2OH+O2 2CH3CHO+2H2O
Cu
醇 醛
CH3CH2OH
CH3CHO
CH3COOH
O2/铜
O2
KMnO4/H+
K2Cr2O7/H+
【实验探究3】向试管中加入约1mL酸性高锰酸钾溶液,滴入数滴无水乙醇,振荡,观察现象。
活动3:探究乙醇的化学性质
与强氧化剂反应:CH3CH2OH
CH3COOH
活动3:探究乙醇的化学性质
(3)乙醇被强氧化剂氧化
酸性高锰酸钾溶液
酸性重铬酸钾溶液
CH3CH2OH
CH3COOH
应用:交警判断驾驶员是否酒后驾车
K2Cr2O7(橙黄色)
C2H5OH
Cr2(SO4)3(蓝绿色)
C2H5OH CH3CHO CH3COOH
[O]
[O]
强氧化剂
2、氧化反应
醇
醛
酸
活动3:探究乙醇的化学性质
【资料卡片】
乙醇进入人体后,在乙醇脱氢酶的作用下氧化为乙醛,接着生成的乙醛又在乙醛脱氢酶的作用下被氧化为乙酸,最后转化为二氧化碳和水。如果人体内这两种酶的含量都较多,酒精的代谢速度较快;但如果人体内这两种酶的含量较少,特别是缺少将乙醛氧化成乙酸的乙醛脱氢酶,饮酒后就会引起体内的乙醛积累,导致血管扩张而脸红,同时作用于人的神经系统,人就会产生醉酒现象。
人喝酒为什么会醉?
活动4:归纳总结
和活泼金属反应
羟基—结构决定性质
氧化反应:
〔1〕 燃烧
〔2〕乙醇的催化氧化
〔3〕
乙醇被强氧化剂氧化
1.请写出正丙醇CH3CH2CH2OH与钠反应、催化氧化反应的化学方式
学习评价2
2.请以乙烯为原料制备乙醛,写出每步反应的化学方程式。
总结:乙醇的性质
乙醇的性质 化学反应方程式 键的断裂
1.与钠反应
2.氧化反应 催化氧化
燃烧
与强氧化剂(如KMnO4)反应 乙醇能使酸性高锰酸钾溶液
2C2H5OH+2Na→2C2H5ONa+H2↑
断①键
断①③键
断①②③④⑤键
紫色褪去
学习评价3
作业:
请结合乙醇的学习,以思维导图的形式建构有机化合物的认知模型。
第三节 乙醇与乙酸
第一课时乙醇
乙醇
燃料
工业原料
有机溶剂
消毒剂
饮品
少量饮酒,能帮助消化,消除疲劳
用途
乙醇可以是蛋白质变性,75%的医用酒精杀菌作用最强
燃烧放出大量的热,所以可以做酒精灯、家用酒精炉、固体酒精
制乙醛、乙酸、香精等多种产品
乙醇可以溶解很多的无机物和有机物
学业要求 核心素养建构
1.知道乙醇的组成、结构、官能团、物理性质及用途。 2.了解官能团与性质的关系,认识羟基与乙醇性质的关系。 3.会运用乙醇的结构分析其化学性质。 1.宏观辨识与微观探析:结合有机化合物中各原子的成键特点,从化学键角度分析推测乙醇的结构、性质和变化,形成“结构决定性质”的观念。
2.科学探究与模型构建:通过设计实验,探究乙醇的结构与性质,建构有机化合物的认知模型。
3.科学态度与社会责任:了解乙醇的用途及对人类健康生活的影响,要合理应用。
活动1:认识乙醇的物理性质
【思考】以下说法或事实体现了乙醇哪些物理性质?
1.病人发烧通常用酒精擦拭全身,用此法降温。
2.酒香不怕巷子深
3.衣服上沾上少许汽油用酒精可以去除。
4.白酒的主要成分是乙醇,酒的度数从3°- 70°不等
一、乙醇的物理性质
俗称 颜色 气味 沸点 状态 溶解性 密度
酒精
无色
特殊香味
78.5℃
易挥发
液体
与水以任意比互溶,能溶解多种有机物和无机物
比水小
?
宏观感知物理性质
?
活动2:探究乙醇的分子结构
经测定乙醇的分子式为C2H6O,那么乙醇分子的结构是怎样的呢?
乙醇的分子式是C2H6O,结合之前学习乙烷的结构
请大家根据碳、氢、氧原子的成键规律,利用球棍模型搭建出乙醇可能的结构模型,并写出结构式。
【思维导航】
微观探析结构
A:
B:
A式、B式在结构上有什么不同呢?(提示:氢原子的成键方式)
回顾所学知识:①钠能保存在煤油中(煤油是主要成分为C10-C16烷烃,主要含C-H) ②钠与H2O反应
微观探析结构
活动2:探究乙醇的分子结构
你能做出什么样的推测?怎样设计实验验证乙醇的结构?
活动2:探究乙醇的分子结构
可以设计怎样的实验去验证乙醇的结构呢?
主要实验仪器及用品:
试管、烧杯、
无水乙醇、金属钠
实验探究化学性质
乙醇与钠的反应实验探究
活动2:探究乙醇的分子结构
实验探究化学性质
实验现象分析
序号 现象 结论
1 钠在乙醇中的位置: 。
2 干燥烧杯的现象: 。
3 澄清石灰水的现象: 。
活动2:探究乙醇的分子结构
实验探究化学性质
沉在试管底部
ρ钠>ρ乙醇
出现水珠
可燃性气体含有氢元素
不出现浑浊
可燃性气体不含有碳元素
乙醇的分子结构
OH
羟基
C2H6O
取 代
基 团
分子式
结构式
结构简式
空间填充模型
球 棍
模 型
乙醇
H
H C C O H
H
H
H
C2H5OH
或CH3CH2OH
活动2:探究乙醇的分子结构
氢键
氢键
乙醇分子能与水分子形成氢键
乙醇分子与乙醇分子能形成氢键
乙醇为什么能与水以任意比例互溶呢?
实验探究
对比钠与水的反应
序号 钠与水 反应的现象 钠与乙醇 反应的现象 结论
1 浮 沉
2 熔化成小球 剧烈,四处游动 块状,未熔化 氢原子活泼性:
水分子>乙醇的羟基
小结
ρ乙醇<ρ钠<ρ水
活动3:探究乙醇的化学性质
1、与活泼金属〔如Na〕反应
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
思考:根据乙醇与活泼金属反应的断键情况,归纳醇分子中羟基与氢气的定量关系。
2-OH~H2
例如1mol 与足量钠反应,生成氢气的物质的量为 mol
1
三、乙醇的化学性质
1.乙醇与活泼金属如钠的反应
2.醇与钠反应的应用:
定性:处理遗漏的钠 ;
定量:测定醇中羟基数目。
小结
活动3:探究乙醇的化学性质
活动3:探究乙醇的化学性质
学习评价1
1.A.B.C三种醇同足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为 3:6:2,则 A.B.C三种醇分子中羟基个数之比为( )
A.2:1:3 B.3:2:1
C.2:6:3 D.3:1:2
A
2、氧化反应
C2H5OH+3O2 2CO2+3H2O
点燃
现象:发出淡蓝色火焰,
并放出大量热。
活动3:探究乙醇的化学性质
酒精火锅
(1) 燃烧反应:
焊接银器、铜器时,表面会生成发黑的氧化膜。工匠师傅说,可以先把银器和铜器在火上烧热,马上蘸一下酒精,铜银会光亮如初。
这其中包含的科学道理是什么呢?
资料卡片
【实验探究2】向试管中加约2mL无水乙醇,取一跟光洁的铜丝绕成螺旋状,置于酒精灯外焰上加热,然后趁热伸入无水乙醇中,反复几次,观察铜丝的变化并闻一闻液体的气味。
活动3:探究乙醇的化学性质
实验操作
实验现象
红色光亮的铜丝灼烧后变为黑色,趁热插入乙醇中,铜丝又变为红色。反复几次,闻到试管中的液体有刺激性气味
现象及原因探究
铜丝
红
Δ
变黑
插入乙醇溶液中
铜丝又变红色,试管中液体有刺激性气味
思考:1.反应机理中铜、氧化铜的作用?
2.写出:反应①、反应②、总反应的化学方程式
①
②
O2
CuO
Cu
CH3CH2OH
CH3CHO +H2O
反应机理
活动3:探究乙醇的化学性质
深度思考探究原理
催化剂
中间产物
①
②
O2
CuO
Cu
CH3CH2OH
CH3CHO +H2O
反应机理
总反应:2CH3CH2OH+O2 2CH3CHO+2H2O
Cu
乙醇的催化氧化反应
或Ag
活动3:探究乙醇的化学性质
深度思考探究原理
反应① 2Cu+O2=2CuO
反应②CuO+CH3CH2OH→Cu+CH3CHO+H2O
焊接银器、铜器时,表面会生成发黑的氧化膜。工匠师傅说,可以先把银器和铜器在火上烧热,马上蘸一下酒精,铜银会光亮如初。
这其中包含的科学道理是什么呢?
资料卡片
活动3:探究乙醇的化学性质
乙醇的催化氧化反应
活动:在纸上画出结构式,表示乙醇催化氧化的过程,说说反应中哪些化学键发生了变化
活动3:探究乙醇的化学性质
深度思考探究原理
+ O2
H C C H
H
O H
H
H
H C C H
O
H
H
2 +O2 2 +2H2O
Cu
活动3:探究乙醇的化学性质
2、氧化反应
(2)催化氧化反应
2CH3CH2OH+O2 2CH3CHO+2H2O
Cu
醇 醛
CH3CH2OH
CH3CHO
CH3COOH
O2/铜
O2
KMnO4/H+
K2Cr2O7/H+
【实验探究3】向试管中加入约1mL酸性高锰酸钾溶液,滴入数滴无水乙醇,振荡,观察现象。
活动3:探究乙醇的化学性质
与强氧化剂反应:CH3CH2OH
CH3COOH
活动3:探究乙醇的化学性质
(3)乙醇被强氧化剂氧化
酸性高锰酸钾溶液
酸性重铬酸钾溶液
CH3CH2OH
CH3COOH
应用:交警判断驾驶员是否酒后驾车
K2Cr2O7(橙黄色)
C2H5OH
Cr2(SO4)3(蓝绿色)
C2H5OH CH3CHO CH3COOH
[O]
[O]
强氧化剂
2、氧化反应
醇
醛
酸
活动3:探究乙醇的化学性质
【资料卡片】
乙醇进入人体后,在乙醇脱氢酶的作用下氧化为乙醛,接着生成的乙醛又在乙醛脱氢酶的作用下被氧化为乙酸,最后转化为二氧化碳和水。如果人体内这两种酶的含量都较多,酒精的代谢速度较快;但如果人体内这两种酶的含量较少,特别是缺少将乙醛氧化成乙酸的乙醛脱氢酶,饮酒后就会引起体内的乙醛积累,导致血管扩张而脸红,同时作用于人的神经系统,人就会产生醉酒现象。
人喝酒为什么会醉?
活动4:归纳总结
和活泼金属反应
羟基—结构决定性质
氧化反应:
〔1〕 燃烧
〔2〕乙醇的催化氧化
〔3〕
乙醇被强氧化剂氧化
1.请写出正丙醇CH3CH2CH2OH与钠反应、催化氧化反应的化学方式
学习评价2
2.请以乙烯为原料制备乙醛,写出每步反应的化学方程式。
总结:乙醇的性质
乙醇的性质 化学反应方程式 键的断裂
1.与钠反应
2.氧化反应 催化氧化
燃烧
与强氧化剂(如KMnO4)反应 乙醇能使酸性高锰酸钾溶液
2C2H5OH+2Na→2C2H5ONa+H2↑
断①键
断①③键
断①②③④⑤键
紫色褪去
学习评价3
作业:
请结合乙醇的学习,以思维导图的形式建构有机化合物的认知模型。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
