4.3.金属的腐蚀与防护 课件(共16张PPT)2023—2024学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.3.金属的腐蚀与防护 课件(共16张PPT)2023—2024学年上学期高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-02 00:00:00 | ||
图片预览





文档简介
(共16张PPT)
金属的腐蚀与防护
第三节
第四章
化学反应与电能
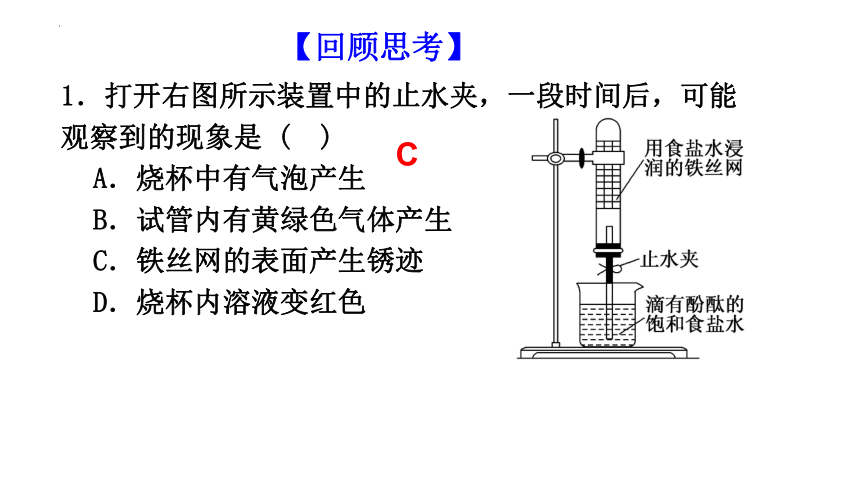
【回顾思考】
1.打开右图所示装置中的止水夹,一段时间后,可能观察到的现象是 ( )
A.烧杯中有气泡产生
B.试管内有黄绿色气体产生
C.铁丝网的表面产生锈迹
D.烧杯内溶液变红色
C
2.下列关于金属腐蚀的叙述中,正确的是( )
A.金属被腐蚀的本质是M+nH2O =M(OH)n+n/2H2↑
B.马口铁(镀锡铁)镀层破损后,首先是镀层被氧化
C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀
D.常温下,置于空气中的金属主要发生化学腐蚀
C
【思考与交流】
试分析上述装置中的Fe是否被腐蚀,为什么?
这对我们防止金属腐蚀有什么启发?
饱和NaCl溶液
饱和NaCl溶液
石墨
【任务1】水中的钢闸门容易生锈,请利用电化学知识设计保护钢闸门的方案,画出装置简图。
电化学模型运用 金属的电化学防护
实验4-4(1):以Fe作保护电极,Zn作辅助电极,以经过酸化的3%NaCl溶液作电解质溶液,按图4-26所示连接装置。观察电流表指针的变化,以及烧杯中两个电极附近发生的现象。
思考1:如何证明Fe未被腐蚀?
思考2:如何检验Fe电极区是否含有Fe2+?
资料卡片
赤血盐:铁氰化钾,K3[Fe(CN)6];其水溶液呈黄色。
遇Fe2+生成深蓝色沉淀,可用于Fe2+ 的检验。
过一段时间,用胶头滴管从Fe电极区域取少量溶液于试管中,再向试管中滴入2滴K3[Fe(CN)6](铁氰化钾)溶液,观察试管中溶液颜色的变化。
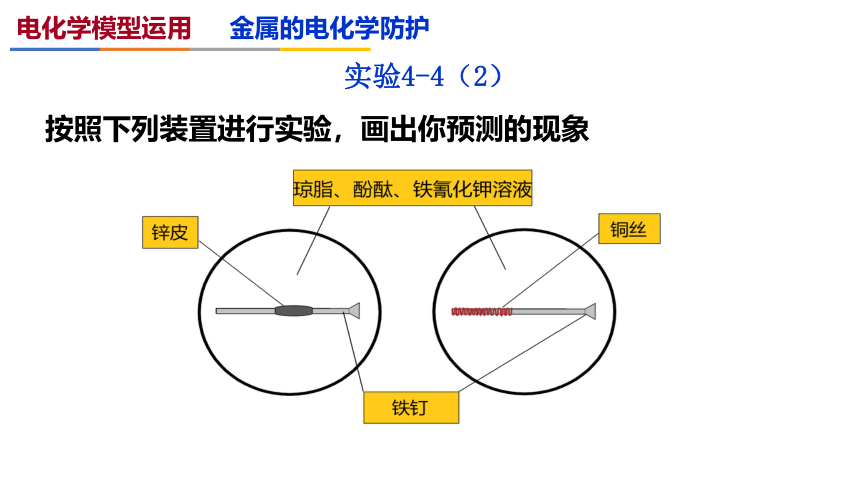
实验4-4(2)
按照下列装置进行实验,画出你预测的现象
电化学模型运用 金属的电化学防护
电化学模型运用 金属的电化学防护
Zn
Fe
Cu
Fe
Fe电极附近变红
Cu电极附近变红,
Fe极附近出现蓝色
铁钉的裸露部分周围溶液没有特征蓝色物质生成。铁钉周围变红,说明氧气在铁的表面得电子,生成了氢氧根离子,铁做正极,证明了原电池保护。
铁钉的裸露部分周围有亚铁离子生成,氧气在铜丝的表面得到电子,生成氢氧根离子,铜丝附近变红。铁没有得到保护。
想一想:通过以上实验,你能得出什么结论?
电化学模型运用 金属的电化学防护
1.牺牲阳极法
原理:
应用 原理,让被保护金属作 极,
找另一种活泼性较强金属作 级
原电池
正
负
船身上装锌块
电化学模型运用 金属的电化学防护
2.外加电流法
原理:应用 原理,让______________作阴极,
____________作阳级
电解池
被保护金属
惰性电极
应用:钢铁闸门,高压线铁架,地下管道连接直流电源的负极。
思考讨论1:教材P111【思考与讨论】
牺牲阳极法 外加电流法
原理
保护方法
保护电流
注意事项
牺牲阳极法和外加电流法的比较
原电池
电解池
使被保护的金属与比它活泼的金属接触,被保护的金属做正极。
使被保护的金属与电源负
极接触,被保护的金属做
阴极。
较小
较大
负极(阳极)材料需要定期更换
辅助阳极需要定期检查
【知识拓展】
结合生活思考,金属防护的方法还有哪些?
1、改变金属材料的组成:制成不锈钢。
2、在金属表面覆盖保护层:
采用喷油漆、涂油脂、电镀、喷镀或表面钝化(钢铁表面发蓝)等其他方法 使金属与空气、水等物质隔离,以防止金属腐蚀。
思考与讨论2:教材P109【思考与讨论】
常用的白铁皮是在薄钢板表面镀上一层锌,罐装食品用的马口铁是在薄钢板表面镀上一层锡。
若上述两种钢铁制品的表面出现破损时,请分析并说明白铁皮、马口铁的腐蚀情况。谁更耐腐蚀?
【学以致用】
1、海港码头的钢制管桩会受到海水的长期侵袭,常用外加电流法对其进行保护(如下图所示,其中高硅铸铁为惰性辅助阳 极)。下列有关叙述中错误的是( )
A.高硅铸铁是作为损耗阳极材料发挥作用的
B.通电后,外电路的电子被强制流向钢制管柱
C.保护电流应该根据环境条件变化进行调整
D.通电后是钢制管柱表面的腐蚀电流接近零
A
保护电流应根据环境(pH值,离子浓度,温度)变化
迁移
教材P111第1自然段
2. 如图所示,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为 ______________________
⑤④②①③⑥
试小结在同一电解质溶液中,同一金属腐蚀的快慢规律?
电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极
3、相同材质的铁在图中四种情况下最不易被腐蚀的是 ( )
C
4、下列关于如图所示的实验装置的判断中错误的是( )
A.若X为碳棒,开关K置于A处可减缓铁的腐蚀
B.若X为锌棒,开关K置于A或B处都可减缓铁的腐蚀
C.若X为锌棒,开关K置于B处时,为牺牲阳极的阴极保护法
D.若X为碳棒,开关K置于B处时,铁电极上发生的反应为2H++2e-=H2↑
D
金属的腐蚀与防护
第三节
第四章
化学反应与电能
【回顾思考】
1.打开右图所示装置中的止水夹,一段时间后,可能观察到的现象是 ( )
A.烧杯中有气泡产生
B.试管内有黄绿色气体产生
C.铁丝网的表面产生锈迹
D.烧杯内溶液变红色
C
2.下列关于金属腐蚀的叙述中,正确的是( )
A.金属被腐蚀的本质是M+nH2O =M(OH)n+n/2H2↑
B.马口铁(镀锡铁)镀层破损后,首先是镀层被氧化
C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀
D.常温下,置于空气中的金属主要发生化学腐蚀
C
【思考与交流】
试分析上述装置中的Fe是否被腐蚀,为什么?
这对我们防止金属腐蚀有什么启发?
饱和NaCl溶液
饱和NaCl溶液
石墨
【任务1】水中的钢闸门容易生锈,请利用电化学知识设计保护钢闸门的方案,画出装置简图。
电化学模型运用 金属的电化学防护
实验4-4(1):以Fe作保护电极,Zn作辅助电极,以经过酸化的3%NaCl溶液作电解质溶液,按图4-26所示连接装置。观察电流表指针的变化,以及烧杯中两个电极附近发生的现象。
思考1:如何证明Fe未被腐蚀?
思考2:如何检验Fe电极区是否含有Fe2+?
资料卡片
赤血盐:铁氰化钾,K3[Fe(CN)6];其水溶液呈黄色。
遇Fe2+生成深蓝色沉淀,可用于Fe2+ 的检验。
过一段时间,用胶头滴管从Fe电极区域取少量溶液于试管中,再向试管中滴入2滴K3[Fe(CN)6](铁氰化钾)溶液,观察试管中溶液颜色的变化。
实验4-4(2)
按照下列装置进行实验,画出你预测的现象
电化学模型运用 金属的电化学防护
电化学模型运用 金属的电化学防护
Zn
Fe
Cu
Fe
Fe电极附近变红
Cu电极附近变红,
Fe极附近出现蓝色
铁钉的裸露部分周围溶液没有特征蓝色物质生成。铁钉周围变红,说明氧气在铁的表面得电子,生成了氢氧根离子,铁做正极,证明了原电池保护。
铁钉的裸露部分周围有亚铁离子生成,氧气在铜丝的表面得到电子,生成氢氧根离子,铜丝附近变红。铁没有得到保护。
想一想:通过以上实验,你能得出什么结论?
电化学模型运用 金属的电化学防护
1.牺牲阳极法
原理:
应用 原理,让被保护金属作 极,
找另一种活泼性较强金属作 级
原电池
正
负
船身上装锌块
电化学模型运用 金属的电化学防护
2.外加电流法
原理:应用 原理,让______________作阴极,
____________作阳级
电解池
被保护金属
惰性电极
应用:钢铁闸门,高压线铁架,地下管道连接直流电源的负极。
思考讨论1:教材P111【思考与讨论】
牺牲阳极法 外加电流法
原理
保护方法
保护电流
注意事项
牺牲阳极法和外加电流法的比较
原电池
电解池
使被保护的金属与比它活泼的金属接触,被保护的金属做正极。
使被保护的金属与电源负
极接触,被保护的金属做
阴极。
较小
较大
负极(阳极)材料需要定期更换
辅助阳极需要定期检查
【知识拓展】
结合生活思考,金属防护的方法还有哪些?
1、改变金属材料的组成:制成不锈钢。
2、在金属表面覆盖保护层:
采用喷油漆、涂油脂、电镀、喷镀或表面钝化(钢铁表面发蓝)等其他方法 使金属与空气、水等物质隔离,以防止金属腐蚀。
思考与讨论2:教材P109【思考与讨论】
常用的白铁皮是在薄钢板表面镀上一层锌,罐装食品用的马口铁是在薄钢板表面镀上一层锡。
若上述两种钢铁制品的表面出现破损时,请分析并说明白铁皮、马口铁的腐蚀情况。谁更耐腐蚀?
【学以致用】
1、海港码头的钢制管桩会受到海水的长期侵袭,常用外加电流法对其进行保护(如下图所示,其中高硅铸铁为惰性辅助阳 极)。下列有关叙述中错误的是( )
A.高硅铸铁是作为损耗阳极材料发挥作用的
B.通电后,外电路的电子被强制流向钢制管柱
C.保护电流应该根据环境条件变化进行调整
D.通电后是钢制管柱表面的腐蚀电流接近零
A
保护电流应根据环境(pH值,离子浓度,温度)变化
迁移
教材P111第1自然段
2. 如图所示,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为 ______________________
⑤④②①③⑥
试小结在同一电解质溶液中,同一金属腐蚀的快慢规律?
电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极
3、相同材质的铁在图中四种情况下最不易被腐蚀的是 ( )
C
4、下列关于如图所示的实验装置的判断中错误的是( )
A.若X为碳棒,开关K置于A处可减缓铁的腐蚀
B.若X为锌棒,开关K置于A或B处都可减缓铁的腐蚀
C.若X为锌棒,开关K置于B处时,为牺牲阳极的阴极保护法
D.若X为碳棒,开关K置于B处时,铁电极上发生的反应为2H++2e-=H2↑
D
