3.2 分子晶体与共价晶体 课件(共29张PPT)2023-2024学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.2 分子晶体与共价晶体 课件(共29张PPT)2023-2024学年下学期高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 8.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-03 15:00:52 | ||
图片预览





文档简介
(共29张PPT)
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
概念辨析
微观剖析
性质对比
总结归纳
目录
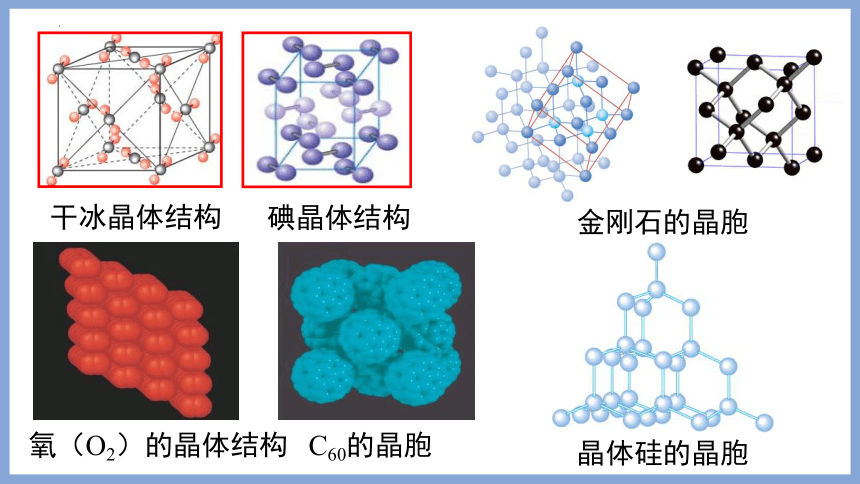
碘晶体结构
干冰晶体结构
氧(O2)的晶体结构
C60的晶胞
金刚石的晶胞
晶体硅的晶胞
1
/ 概念辨析 /
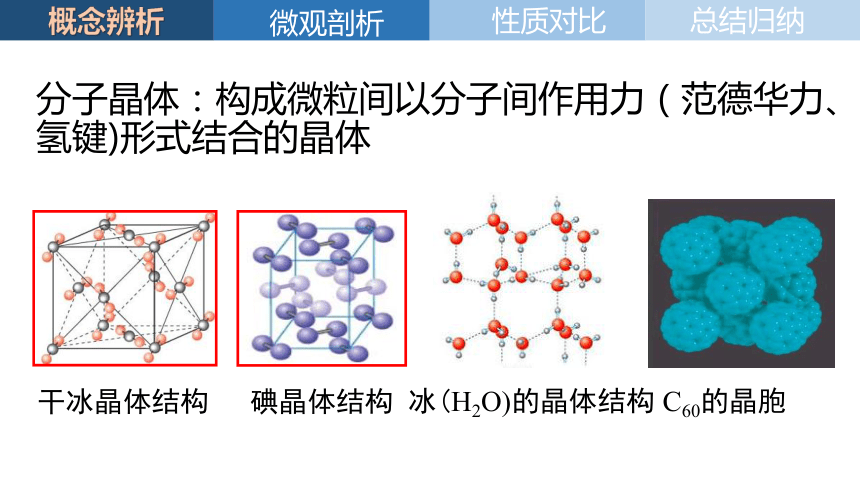
分子晶体:构成微粒间以分子间作用力(范德华力、氢键)形式结合的晶体
概念辨析
微观剖析
性质对比
总结归纳
碘晶体结构
干冰晶体结构
冰(H2O)的晶体结构
C60的晶胞
概念辨析
微观剖析
性质对比
总结归纳
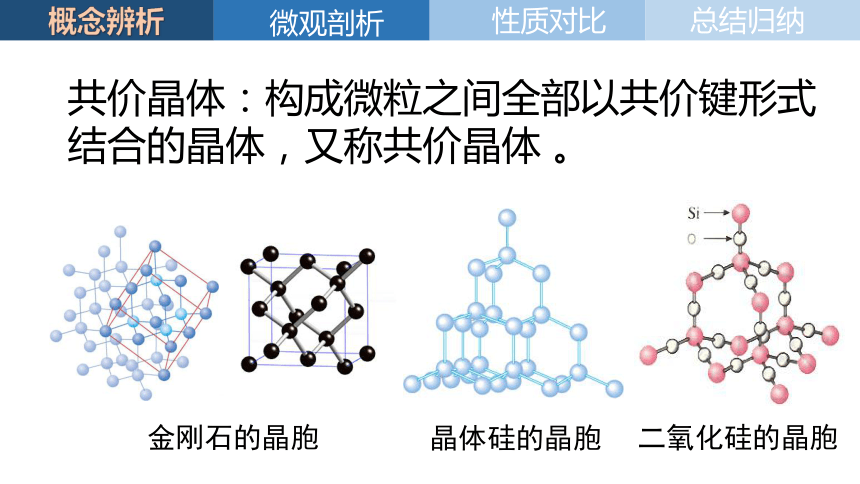
共价晶体:构成微粒之间全部以共价键形式结合的晶体,又称共价晶体 。
金刚石的晶胞
晶体硅的晶胞
二氧化硅的晶胞
概念辨析
微观剖析
性质对比
总结归纳
常见的分子晶体:
(1)所有非金属氢化物,如水、氟化氢、氨、氯化氢、甲烷等;
(2)部分非金属单质,如卤素(X2)、氧(O2)、硫(S8)、氮(N2)、白磷 (P4)、碳60 (C60)、稀有气体等;
(3)部分非金属氧化物,如CO2 、P4O6 、P4O10 、SO2 等;
(4)几乎所有的酸;
(5)绝大多数有机物的晶体,如乙醇、冰醋酸、蔗糖。
概念辨析
微观剖析
性质对比
总结归纳
常见共价晶体:
(1)某些单质:硼(B)、金刚石(C)、硅(Si)、锗(Ge)、灰锡(Sn)等
(2)某些非金属化合物:SiC、BN等
(3)某些氧化物:SiO2、刚玉(Al2O3)等
概念辨析
微观剖析
性质对比
总结归纳
以下晶体中哪些属于分子晶体,哪些是共价晶体?
S、 H2SO4、 C60、 尿素、 He 、
NH3、 SiO2、 SO2、 P4O6、 P4、
Cl2、 C(金刚石)、 H2S、 冰醋酸
锗(Ge)、BN
2
/ 微观剖析 /
概念辨析
微观剖析
性质对比
总结归纳
汽化或融化时破坏哪些作用力?
分子晶体化学式就是分子式
原子晶体化学式是最简整数比
概念辨析
微观剖析
性质对比
总结归纳
1.共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是( )
A.干冰 B.二氧化硅 C.氢氧化钠 D.碘
2.下列各组物质所形成的晶体中,属于分子晶体且分子内只含有极性共价键的是( )
A.CO2 B.O2 C.NH4Cl D.Ar
B
A
概念辨析
微观剖析
性质对比
总结归纳
3.下列关于晶体中存在的作用力的说法中一定正确的是( )
A.共价晶体中一定存在极性共价键
B.分子晶体中一定存在分子间作用力
C.硫磺晶体和冰晶体中存在的分子间作用力完全相同
D.只有共价晶体中存在共价键
B
3
/ 性质对比 /
某些分子晶体的熔点
分子晶体 氧 氮 白磷 水 干冰 硫化氢 乙酸 尿素
熔点/℃ -218.3 -210.1 44.2 0 -78.5 -85.6 16.7 132.7
概念辨析
微观剖析
性质对比
总结归纳
某些共价晶体的熔点
键 C-C C-Si Si-Si
键长/pm 154 188 235
键能/(kJ/mol) 347.7 ? 226
原子晶体 金刚石 氮化硼 碳化硅 氧化铝 二氧化硅 硅 锗
熔点/℃ 3900 3000 2700 2030 1723 1410 1211
概念辨析
微观剖析
性质对比
总结归纳
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ 3900 3000 2700 1710 1410 1211
硬度* 10 9.5 9.5 7 6.5 6.0
硬度:衡量固体软硬程度的指标
分子晶体硬度较小,共价晶体硬度较大
1.下列晶体:①H2O ②HCl ③ HBr ④HI ⑤CO ⑥N2 ⑦H2 熔沸点由高到低的顺序是( )
A.①②③④⑤⑥⑦ B.④③②①⑤⑥⑦
C.①④③②⑤⑥⑦ D.⑦⑥⑤④③②①
概念辨析
微观剖析
性质对比
总结归纳
〖练习〗
C
概念辨析
微观剖析
性质对比
总结归纳
2.[课标Ⅰ理综2016.37改编]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。
(1)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
。
GeCl4 GeBr4 GeI4
熔点/℃ -49.5 26 146
沸点/℃ 83.1 186 约400
GeCl4、GeBr4、GeI4熔沸点依次增大,分子结构相似,相对分子质量依次增大,分子间作用力逐渐增强
概念辨析
微观剖析
性质对比
总结归纳
2.[课标Ⅰ理综2016.37改编]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。
(2)C、Si、Ge单晶具有相似的结构,微粒之间存在的作用力是 ,请分析三种晶体熔点变化规律及原因。
共价键
C、Si、Ge单晶熔点依次减小,三者都为原子晶体,熔化时破坏共价键,随半径增大,键长增加,键能减小,故熔沸点降低
(3)氧化锗是白色粉末,其六方晶系的相对密度为4.228g/cm3,熔点为1115℃,氧化锗的晶体类型为 。
原子晶体
概念辨析
微观剖析
性质对比
总结归纳
溶解性:
分子晶体溶解性一般符合“相似相溶”规律,即极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。
共价晶体不溶于任何溶剂
概念辨析
微观剖析
性质对比
总结归纳
S、 H2SO4、 C60、 尿素、 He 、
NH3、 SiO2、 SO2、 P4O6、 P、
Cl2、 C(金刚石)、 H2S、 冰醋酸
锗(Ge)、BN 、 单晶硅
分子晶体不导电,有些分子晶体在水溶液中能导电
共价晶体一般不导电,硅、锗是半导体
导电性
4
/ 总结归纳 /
小结:
晶体类型 共价晶体 分子晶体
概念
组成微粒
作用力
熔沸点
硬度
溶解性
导电性
相邻原子间以共价键相结合而形成空间网状结构
分子间以分子间作用力结合
原子
分子
共价键
分子间作用力
很高
较低
很大
较小
不溶于任何溶剂
遵循相似相溶原理
不导电,个别为半导体
如硅、锗
固体和熔化状态都不导电,部分溶于水导电如HCl
概念辨析
微观剖析
性质对比
总结归纳
1.分析下列物质的物理性质,可判断其固态时属于分子晶体的是( )
A.碳化铝,黄色晶体,熔点2200℃,熔融态不导电
B.石英,无色晶体,熔点1750℃,熔融态不导电
C.五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中
D.溴化钾,无色晶体,熔融时或溶于水中都能导电
C
概念辨析
微观剖析
性质对比
总结归纳
2.有下列物质:①水晶 ②冰醋酸 ③氧化钙 ④白磷 ⑤晶体氩 ⑥氢氧化钠 ⑦铝 ⑧金刚石 ⑨过氧化钠 ⑩碳化硅 干冰 过氧化氢,根据要求填空(填序号)。
(1)属于共价晶体的是 。
(2)不存在共价键的分子晶体是 。
(3)由极性分子构成的晶体是 ,属于分子晶体的单质是 。
(4)在一定条件下,能导电且不发生化学变化的是 ,受热熔化需克服共价键的是 。
①⑧⑩
⑤
②
④⑤
⑦
①⑧⑩
概念辨析
微观剖析
性质对比
总结归纳
5.在40GPa高压下,用激光器加热到1800K时,人们成功制得了原子晶体二氧化碳,下列关于原子晶体CO2的推断不正确的是( )
A.二氧化碳原子晶体有很高的熔、沸点,有很大的硬度
B.二氧化碳原子晶体易气化,可用作制冷剂
C.二氧化碳原子晶体硬度大,可用于耐磨材料
D.该共价键晶体中含有极性键
B
概念辨析
微观剖析
性质对比
总结归纳
下课!
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
概念辨析
微观剖析
性质对比
总结归纳
目录
碘晶体结构
干冰晶体结构
氧(O2)的晶体结构
C60的晶胞
金刚石的晶胞
晶体硅的晶胞
1
/ 概念辨析 /
分子晶体:构成微粒间以分子间作用力(范德华力、氢键)形式结合的晶体
概念辨析
微观剖析
性质对比
总结归纳
碘晶体结构
干冰晶体结构
冰(H2O)的晶体结构
C60的晶胞
概念辨析
微观剖析
性质对比
总结归纳
共价晶体:构成微粒之间全部以共价键形式结合的晶体,又称共价晶体 。
金刚石的晶胞
晶体硅的晶胞
二氧化硅的晶胞
概念辨析
微观剖析
性质对比
总结归纳
常见的分子晶体:
(1)所有非金属氢化物,如水、氟化氢、氨、氯化氢、甲烷等;
(2)部分非金属单质,如卤素(X2)、氧(O2)、硫(S8)、氮(N2)、白磷 (P4)、碳60 (C60)、稀有气体等;
(3)部分非金属氧化物,如CO2 、P4O6 、P4O10 、SO2 等;
(4)几乎所有的酸;
(5)绝大多数有机物的晶体,如乙醇、冰醋酸、蔗糖。
概念辨析
微观剖析
性质对比
总结归纳
常见共价晶体:
(1)某些单质:硼(B)、金刚石(C)、硅(Si)、锗(Ge)、灰锡(Sn)等
(2)某些非金属化合物:SiC、BN等
(3)某些氧化物:SiO2、刚玉(Al2O3)等
概念辨析
微观剖析
性质对比
总结归纳
以下晶体中哪些属于分子晶体,哪些是共价晶体?
S、 H2SO4、 C60、 尿素、 He 、
NH3、 SiO2、 SO2、 P4O6、 P4、
Cl2、 C(金刚石)、 H2S、 冰醋酸
锗(Ge)、BN
2
/ 微观剖析 /
概念辨析
微观剖析
性质对比
总结归纳
汽化或融化时破坏哪些作用力?
分子晶体化学式就是分子式
原子晶体化学式是最简整数比
概念辨析
微观剖析
性质对比
总结归纳
1.共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是( )
A.干冰 B.二氧化硅 C.氢氧化钠 D.碘
2.下列各组物质所形成的晶体中,属于分子晶体且分子内只含有极性共价键的是( )
A.CO2 B.O2 C.NH4Cl D.Ar
B
A
概念辨析
微观剖析
性质对比
总结归纳
3.下列关于晶体中存在的作用力的说法中一定正确的是( )
A.共价晶体中一定存在极性共价键
B.分子晶体中一定存在分子间作用力
C.硫磺晶体和冰晶体中存在的分子间作用力完全相同
D.只有共价晶体中存在共价键
B
3
/ 性质对比 /
某些分子晶体的熔点
分子晶体 氧 氮 白磷 水 干冰 硫化氢 乙酸 尿素
熔点/℃ -218.3 -210.1 44.2 0 -78.5 -85.6 16.7 132.7
概念辨析
微观剖析
性质对比
总结归纳
某些共价晶体的熔点
键 C-C C-Si Si-Si
键长/pm 154 188 235
键能/(kJ/mol) 347.7 ? 226
原子晶体 金刚石 氮化硼 碳化硅 氧化铝 二氧化硅 硅 锗
熔点/℃ 3900 3000 2700 2030 1723 1410 1211
概念辨析
微观剖析
性质对比
总结归纳
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ 3900 3000 2700 1710 1410 1211
硬度* 10 9.5 9.5 7 6.5 6.0
硬度:衡量固体软硬程度的指标
分子晶体硬度较小,共价晶体硬度较大
1.下列晶体:①H2O ②HCl ③ HBr ④HI ⑤CO ⑥N2 ⑦H2 熔沸点由高到低的顺序是( )
A.①②③④⑤⑥⑦ B.④③②①⑤⑥⑦
C.①④③②⑤⑥⑦ D.⑦⑥⑤④③②①
概念辨析
微观剖析
性质对比
总结归纳
〖练习〗
C
概念辨析
微观剖析
性质对比
总结归纳
2.[课标Ⅰ理综2016.37改编]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。
(1)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
。
GeCl4 GeBr4 GeI4
熔点/℃ -49.5 26 146
沸点/℃ 83.1 186 约400
GeCl4、GeBr4、GeI4熔沸点依次增大,分子结构相似,相对分子质量依次增大,分子间作用力逐渐增强
概念辨析
微观剖析
性质对比
总结归纳
2.[课标Ⅰ理综2016.37改编]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。
(2)C、Si、Ge单晶具有相似的结构,微粒之间存在的作用力是 ,请分析三种晶体熔点变化规律及原因。
共价键
C、Si、Ge单晶熔点依次减小,三者都为原子晶体,熔化时破坏共价键,随半径增大,键长增加,键能减小,故熔沸点降低
(3)氧化锗是白色粉末,其六方晶系的相对密度为4.228g/cm3,熔点为1115℃,氧化锗的晶体类型为 。
原子晶体
概念辨析
微观剖析
性质对比
总结归纳
溶解性:
分子晶体溶解性一般符合“相似相溶”规律,即极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。
共价晶体不溶于任何溶剂
概念辨析
微观剖析
性质对比
总结归纳
S、 H2SO4、 C60、 尿素、 He 、
NH3、 SiO2、 SO2、 P4O6、 P、
Cl2、 C(金刚石)、 H2S、 冰醋酸
锗(Ge)、BN 、 单晶硅
分子晶体不导电,有些分子晶体在水溶液中能导电
共价晶体一般不导电,硅、锗是半导体
导电性
4
/ 总结归纳 /
小结:
晶体类型 共价晶体 分子晶体
概念
组成微粒
作用力
熔沸点
硬度
溶解性
导电性
相邻原子间以共价键相结合而形成空间网状结构
分子间以分子间作用力结合
原子
分子
共价键
分子间作用力
很高
较低
很大
较小
不溶于任何溶剂
遵循相似相溶原理
不导电,个别为半导体
如硅、锗
固体和熔化状态都不导电,部分溶于水导电如HCl
概念辨析
微观剖析
性质对比
总结归纳
1.分析下列物质的物理性质,可判断其固态时属于分子晶体的是( )
A.碳化铝,黄色晶体,熔点2200℃,熔融态不导电
B.石英,无色晶体,熔点1750℃,熔融态不导电
C.五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中
D.溴化钾,无色晶体,熔融时或溶于水中都能导电
C
概念辨析
微观剖析
性质对比
总结归纳
2.有下列物质:①水晶 ②冰醋酸 ③氧化钙 ④白磷 ⑤晶体氩 ⑥氢氧化钠 ⑦铝 ⑧金刚石 ⑨过氧化钠 ⑩碳化硅 干冰 过氧化氢,根据要求填空(填序号)。
(1)属于共价晶体的是 。
(2)不存在共价键的分子晶体是 。
(3)由极性分子构成的晶体是 ,属于分子晶体的单质是 。
(4)在一定条件下,能导电且不发生化学变化的是 ,受热熔化需克服共价键的是 。
①⑧⑩
⑤
②
④⑤
⑦
①⑧⑩
概念辨析
微观剖析
性质对比
总结归纳
5.在40GPa高压下,用激光器加热到1800K时,人们成功制得了原子晶体二氧化碳,下列关于原子晶体CO2的推断不正确的是( )
A.二氧化碳原子晶体有很高的熔、沸点,有很大的硬度
B.二氧化碳原子晶体易气化,可用作制冷剂
C.二氧化碳原子晶体硬度大,可用于耐磨材料
D.该共价键晶体中含有极性键
B
概念辨析
微观剖析
性质对比
总结归纳
下课!
