3.3 盐类的水解 第2课时 课件(34张PPT)-2023-2024学年高二化学(人教版2019选择性必修1)
文档属性
| 名称 | 3.3 盐类的水解 第2课时 课件(34张PPT)-2023-2024学年高二化学(人教版2019选择性必修1) |

|
|
| 格式 | pptx | ||
| 文件大小 | 26.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-03 00:00:00 | ||
图片预览











文档简介
(共34张PPT)
第三节 盐类的水解
第2课时
第三章
水溶液中的离子反应与平衡
盐类水解的应用
2
影响盐类水解的主要因素
1
本节重、难点
书上说:纯碱的水溶液可用于餐具油污的去除,而且用热水溶解的纯碱溶液去除油污的效果更好,这是为什么呢?
大鹿化学工作室
对于强酸弱碱盐来说,生成盐的弱碱碱性越弱,该盐的水解程度越大
对于强碱弱酸盐来说,生成盐的弱酸酸性越弱,该盐的水解程度越大
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
温故知新
强碱
弱酸盐
CH3COO- + H2O CH3COOH + OH-
25 ℃时, K = 5.71×10-8
Kw
Ka
Kh=
NH4+ + H2O NH3·H2O + H+
25 ℃时, K = 5.74×10-8
Kw
Kb
Kh=
强酸
弱碱盐
酸(或碱)越弱,其对应的弱酸阴离子(或弱碱阳离子)的水解程度越大,溶液的碱性(或酸性)越强,即越弱越水解
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
温故知新
外因:反应条件
内因:盐的性质
盐类水解程度的大小
(主要因素)
从反应条件考虑,影响盐类水解平衡的因素可能有哪些?
项目一:预测反应条件对FeCl3水解平衡的影响
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
Fe3+ + 3H2O Fe(OH)3 + 3H+
预测1:温度升高,平衡向吸热方向移动
预测2:增大反应物浓度,平衡正向移动
预测3:增大生成物浓度,平衡逆向移动
大鹿化学工作室
理论论证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
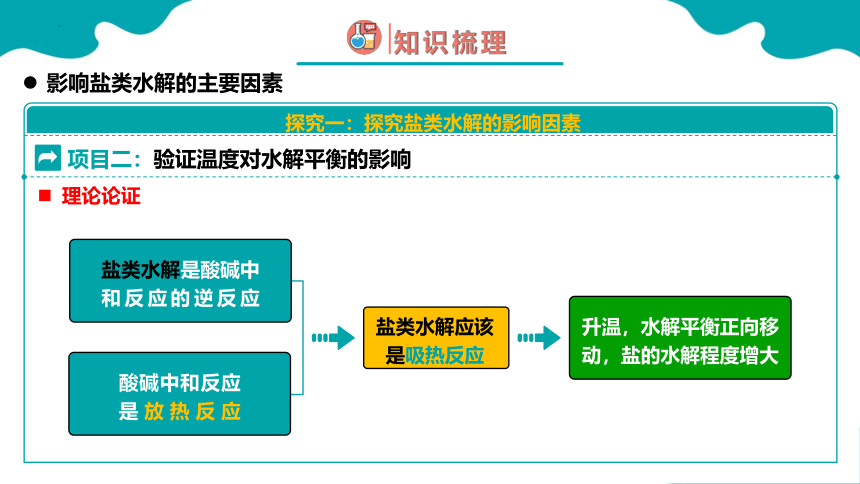
项目二:验证温度对水解平衡的影响
升温,水解平衡正向移动,盐的水解程度增大
盐类水解应该是吸热反应
酸碱中和反应是放热反应
盐类水解是酸碱中和反应的逆反应
实验论证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目二:验证温度对水解平衡的影响
实验论证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目二:验证温度对水解平衡的影响
加热
颜色加深
实验结论:升温,水解平衡正向移动,盐的水解程度增大
温故知新
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目三:验证反应物浓度对水解平衡的影响
m A(g) + n B(g) p C(g) + q D(g)
对于可逆反应:
Q=
cp(C) cq(D)
cm(A) cn(B)
浓度商
任意时刻,反应中各物质的浓度幂之积的比值
同一温度下:
是否平衡或平衡移动的方向,可用该时刻浓度商Q与K比较大小来判断
Q = K ,处于化学平衡状态
Q < K ,向正反应方向进行
Q > K ,向逆反应方向进行
数据论证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目三:验证反应物浓度对水解平衡的影响
Fe3+ + 3H2O Fe(OH)3 + 3H+
操作 平衡移动方向 Fe3+水解程度 c(Fe3+)
加水稀释10倍
加FeCl3晶体
向右
增大
减小
= 0.01K
< K
c(Fe3+)
K =
c3(H+)
(0.1)3
0.1
c(Fe3+)
Q =
c3(H+)
实验论证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目三:验证反应物浓度对水解平衡的影响
实验论证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目五:验证浓度对水解平衡的影响
加水稀释至100 mL
pH增大,颜色变浅
从数据和实验两方面验证可知:加水对于FeCl3水解平衡向右边移动,H+增多的,可为什么pH增大呢?
平衡体系中加水,水的体积的增加量大于平衡正移的量。则在 FeCl3溶液中加水,水解平衡右移,H+数增多,但pH 增大。
数据论证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目三:验证反应物浓度对水解平衡的影响
Fe3+ + 3H2O Fe(OH)3 + 3H+
操作 平衡移动方向 Fe3+水解程度 c(Fe3+)
加水稀释10倍
加FeCl3晶体
向右
增大
减小
< K
c(Fe3+)
K =
c3(H+)
c(Fe3+)
Q =
c3(H+)
向右
增大
减小
数据论证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目三:验证反应物浓度对水解平衡的影响
Fe3+ + 3H2O Fe(OH)3 + 3H+
操作 平衡移动方向 Fe3+水解程度 c(Fe3+)
加水稀释10倍
加FeCl3晶体
向右
增大
减小
向右
增大
设c mol/L Fe3+ 水解的转化率为x
K=
c·(1-x)
(c·3x )3
27c2·x3
1-x
=
温度不变,故K不变
加FeCl3晶体,c(Fe3+)增大
故Fe3+ 水解的转化率为x减小
实验验证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目四:验证生成物浓度对水解平衡的影响
实验验证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目四:验证生成物浓度对水解平衡的影响
通入HCl气体
颜色变浅
实验结论: c(H+)增大,水解平衡逆向移动,Fe3+水解程度减小
OH-
Fe3+ + 3H2O Fe(OH)3 + 3H+
c(H+)减小,水解平衡正向移动,Fe3+水解程度增大,颜色加深
H2O
思考:若向FeCl3溶液中加入少量浓碱(NaOH),溶液颜色如何变化呢?
大鹿化学工作室
明矾作净水剂
日常生活
盐类水解的应用
探究二:应用水解平衡原理解决问题
在生活、生产和科学研究中,人们常运用盐类水解的原理来解决实际问题
明矾[KAl(SO4)2·12H2O]
分析:Al3+水解生成的Al(OH)3(胶体)具有吸附性,可以使水中细小的悬浮颗粒聚集成较大的颗粒而沉降,从而除去水中的悬浮物,起到净水的作用。
Al3+ + 3H2O Al(OH)3 (胶体) + 3H+
泡沫灭火器原理
日常生活
盐类水解的应用
探究二:应用水解平衡原理解决问题
在生活、生产和科学研究中,人们常运用盐类水解的原理来解决实际问题
泡沫灭火器
分析:通过筒体内酸性溶液与碱性溶液混合发生化学反应,将生成的泡沫压出喷嘴,喷射出去进行灭火的。
一般不用Na2CO3,反应速率慢!
Al3+ + 3HCO3- Al(OH)3 ↓+ 3CO2↑
配制易水解的盐溶液
化学实验
盐类水解的应用
探究二:应用水解平衡原理解决问题
在生活、生产和科学研究中,人们常运用盐类水解的原理来解决实际问题
分析:增大c(H+),可抑制Fe3+的水解
方法:先将FeCl3晶体溶解在较浓盐酸中,再加水稀释到所需浓度
FeCl3溶液
Fe3+ + 3H2O Fe(OH)3 + 3H+
化学实验
盐类水解的应用
探究二:应用水解平衡原理解决问题
在生活、生产和科学研究中,人们常运用盐类水解的原理来解决实际问题
制备某些胶体
Fe3+ + 3H2O Fe(OH)3 (胶体) + 3H+
氢氧化铁胶体制备
分析:加热可使上述平衡右移
方法:向40 mL沸腾的蒸馏水中逐滴加入5~6滴饱和FeCl3溶液,继续煮沸至液体呈红褐色,停止加热
化学实验
盐类水解的应用
探究二:应用水解平衡原理解决问题
在生活、生产和科学研究中,人们常运用盐类水解的原理来解决实际问题
制备某些无机化合物
二氧化钛粉末
分析:TiCl4 + (x+2)H2O TiO2·xH2O + 4HCl
改变条件使上述平衡右移
方法:在制备时加入大量的水,同时加热,促使水解趋于完全,所得TiO2·xH2O经焙烧可得TiO2
TiCl4 + (x+2)H2O TiO2·xH2O ↓ + 4HCl
工农生产
盐类水解的应用
探究二:应用水解平衡原理解决问题
在生活、生产和科学研究中,人们常运用盐类水解的原理来解决实际问题
铵态氮肥与草木灰(主要成分为K2CO3)混合使用会大大降低氮肥的肥效
草木灰中CO32-与H+反应,使c(H+)减小,水解平衡向右移动,生成NH3·H2O,NH3·H2O分解产生NH3逸出,造成肥效损失
NH4+ + H2O NH3·H2O + H+
工农生产
盐类水解的应用
探究二:应用水解平衡原理解决问题
在生活、生产和科学研究中,人们常运用盐类水解的原理来解决实际问题
NH4Cl溶液与ZnCl2溶液可作焊接时的除锈剂
NH4++H2O NH3·H2O+H+
Zn2++2H2O Zn(OH)2+2H+
分析:金属焊接前利用NH4Cl 溶液或ZnCl2溶液除锈,原因是NH4+、Zn2+水解使溶液呈酸性
书上说:纯碱的水溶液可用于餐具油污的去除,而且用热水溶解的纯碱溶液去除油污的效果更好,这是为什么呢?
去油污的是OH-,Na2CO3水解可以生成OH- ,所以Na2CO3溶液可以清理油污。水解反应是吸热的,升温促进Na2CO3水解,使溶液中的c(OH-)增大,去污效果更好
H >0
CO32- + H2O HCO3- + OH-
可乐除水垢
方法:在水壶里倒上可乐,稍微没过有水垢的地方。接着,给水壶加热,加热好后把可乐倒出来,水垢就清除了。
原理:可乐含有大量的二氧化碳,碳酸钙和水在通入二氧化碳的时候反应生成可溶性的碳酸氢钙。即:CaCO3+H2O+CO2==2Ca(HCO3)2
1.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY
B.HX、HY、HZ
C.HZ、HY、HX
D.HY、HZ、HX
答案 B
解析 利用盐类水解规律“越弱越水解,谁强显谁性”,结合同浓度三种酸对应的钠盐的溶液的pH可推知,碱性越强则对应的酸越弱。
2.下列关于FeCl3水解的说法错误的是( )
A.在FeCl3稀溶液中,水解达到平衡时,无论加FeCl3饱和溶液还是加水稀释,平衡均向右移动
B.浓度为5 mol·L-1和0.5 mol·L-1的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者小于后者
C.其他条件相同时,同浓度的FeCl3溶液在50 ℃和20 ℃时发生水解,50 ℃时Fe3+的水解程度比20 ℃时的小
D.为抑制Fe3+的水解,更好地保存FeCl3溶液,应加少量盐酸
答案 C
解析 增大FeCl3的浓度,水解平衡向右移动,但Fe3+水解程度减小,加水稀释,水解平衡向右移动,Fe3+水解程度增大,A、B项均正确;盐类水解是吸热过程,温度升高,水解程度增大,C项错误;Fe3+水解后溶液呈酸性,增大H+的浓度可抑制Fe3+的水解,D项正确。
3.在空气中直接蒸发下列盐的溶液:①Fe2(SO4)3;②Na2CO3;③KCl;④CuCl2;⑤NaHCO3 可以得到相应盐的晶体(可以含有结晶水)的是( )
A.①②③ B.①③⑤ C.②④ D.①③④⑤
答案 A
解析 ①加热Fe2(SO4)3溶液时虽发生水解,但硫酸难挥发,蒸发Fe2(SO4)3溶液可得到Fe2(SO4)3晶体,故正确;②加热Na2CO3溶液水解生成NaOH,但NaOH和空气中的CO2反应又得到Na2CO3晶体,故正确;③KCl性质稳定,加热其溶液可得到KCl晶体,故正确;④加热CuCl2溶液水解生成氢氧化铜和HCl,HCl易挥发,得到氢氧化铜晶体,故错误;⑤NaHCO3不稳定,加热易分解生成Na2CO3,故错误。
4.下列关于盐类水解的应用中,说法正确的是( )
A.加热蒸干Na2CO3溶液,最后可以得到NaOH和Na2CO3的混合固体
B.除去MgCl2溶液中的Fe3+,可以加入NaOH固体
C.明矾净水的原理:Al3++3H2O Al(OH)3(胶体)+3H+
D.加热蒸干KCl溶液,最后得到KOH固体(不考虑与CO2的反应)
答案 C
解析 加热蒸干Na2CO3溶液,最后得到Na2CO3固体,A错误;镁离子、铁离子均能与
OH-反应生成沉淀,所以不能用NaOH除去MgCl2溶液中的Fe3+,B错误;明矾在水中电离出铝离子,铝离子水解生成的氢氧化铝胶体具有吸附性,即Al3++3H2O Al(OH)3(胶体)+
3H+,C正确;KCl不水解,加热蒸干KCl溶液,最后得到KCl固体,D错误。
5.下列说法中正确的是( )
A.AlCl3溶液和Al2(SO4)3溶液分别加热、蒸发、浓缩结晶、灼烧,所得固体的成分相同
B.实验室配制FeCl3溶液时,往往在FeCl3溶液中加入少量的硫酸
C.向CuCl2溶液中加入CuO,调节pH可除去溶液中混有的Fe3+
D.用Na2CO3和Al2(SO4)3两种溶液可作泡沫灭火剂
答案 C
解析 AlCl3溶液和Al2(SO4)2溶液分别加热、蒸发、浓缩结晶、灼烧,前者得到Al2O3,后者得到Al2(SO4)3,所得固体的成分不相同,故A错误;配制FeCl3溶液时,应将FeCl3固体溶解在盐酸中,再加水稀释到所需的浓度,若溶于硫酸,会引入杂质离子SO,故B错误;Fe3++3H2O Fe(OH)3+3H+,向CuCl2溶液中加入CuO,消耗H+,使上述水解平衡正向移动生成氢氧化铁沉淀,达到通过调节pH除去溶液中混有的Fe3+的目的,故C正确;泡沫灭火器中常使用的原料是NaHCO3和Al2(SO4)3,故D错误。
第三节
盐类水解
第2课时
影响盐类水解的主要因素
盐类水解的应用
日常生活中:净水剂,泡沫灭火器
化学实验:配制溶液、制备某些物质
内因:盐本身的性质
外因:温度、浓度、外加酸、碱、盐
工农业生产中:化肥的使用、焊接工业
第三节 盐类的水解
第2课时
第三章
水溶液中的离子反应与平衡
盐类水解的应用
2
影响盐类水解的主要因素
1
本节重、难点
书上说:纯碱的水溶液可用于餐具油污的去除,而且用热水溶解的纯碱溶液去除油污的效果更好,这是为什么呢?
大鹿化学工作室
对于强酸弱碱盐来说,生成盐的弱碱碱性越弱,该盐的水解程度越大
对于强碱弱酸盐来说,生成盐的弱酸酸性越弱,该盐的水解程度越大
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
温故知新
强碱
弱酸盐
CH3COO- + H2O CH3COOH + OH-
25 ℃时, K = 5.71×10-8
Kw
Ka
Kh=
NH4+ + H2O NH3·H2O + H+
25 ℃时, K = 5.74×10-8
Kw
Kb
Kh=
强酸
弱碱盐
酸(或碱)越弱,其对应的弱酸阴离子(或弱碱阳离子)的水解程度越大,溶液的碱性(或酸性)越强,即越弱越水解
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
温故知新
外因:反应条件
内因:盐的性质
盐类水解程度的大小
(主要因素)
从反应条件考虑,影响盐类水解平衡的因素可能有哪些?
项目一:预测反应条件对FeCl3水解平衡的影响
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
Fe3+ + 3H2O Fe(OH)3 + 3H+
预测1:温度升高,平衡向吸热方向移动
预测2:增大反应物浓度,平衡正向移动
预测3:增大生成物浓度,平衡逆向移动
大鹿化学工作室
理论论证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目二:验证温度对水解平衡的影响
升温,水解平衡正向移动,盐的水解程度增大
盐类水解应该是吸热反应
酸碱中和反应是放热反应
盐类水解是酸碱中和反应的逆反应
实验论证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目二:验证温度对水解平衡的影响
实验论证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目二:验证温度对水解平衡的影响
加热
颜色加深
实验结论:升温,水解平衡正向移动,盐的水解程度增大
温故知新
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目三:验证反应物浓度对水解平衡的影响
m A(g) + n B(g) p C(g) + q D(g)
对于可逆反应:
Q=
cp(C) cq(D)
cm(A) cn(B)
浓度商
任意时刻,反应中各物质的浓度幂之积的比值
同一温度下:
是否平衡或平衡移动的方向,可用该时刻浓度商Q与K比较大小来判断
Q = K ,处于化学平衡状态
Q < K ,向正反应方向进行
Q > K ,向逆反应方向进行
数据论证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目三:验证反应物浓度对水解平衡的影响
Fe3+ + 3H2O Fe(OH)3 + 3H+
操作 平衡移动方向 Fe3+水解程度 c(Fe3+)
加水稀释10倍
加FeCl3晶体
向右
增大
减小
= 0.01K
< K
c(Fe3+)
K =
c3(H+)
(0.1)3
0.1
c(Fe3+)
Q =
c3(H+)
实验论证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目三:验证反应物浓度对水解平衡的影响
实验论证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目五:验证浓度对水解平衡的影响
加水稀释至100 mL
pH增大,颜色变浅
从数据和实验两方面验证可知:加水对于FeCl3水解平衡向右边移动,H+增多的,可为什么pH增大呢?
平衡体系中加水,水的体积的增加量大于平衡正移的量。则在 FeCl3溶液中加水,水解平衡右移,H+数增多,但pH 增大。
数据论证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目三:验证反应物浓度对水解平衡的影响
Fe3+ + 3H2O Fe(OH)3 + 3H+
操作 平衡移动方向 Fe3+水解程度 c(Fe3+)
加水稀释10倍
加FeCl3晶体
向右
增大
减小
< K
c(Fe3+)
K =
c3(H+)
c(Fe3+)
Q =
c3(H+)
向右
增大
减小
数据论证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目三:验证反应物浓度对水解平衡的影响
Fe3+ + 3H2O Fe(OH)3 + 3H+
操作 平衡移动方向 Fe3+水解程度 c(Fe3+)
加水稀释10倍
加FeCl3晶体
向右
增大
减小
向右
增大
设c mol/L Fe3+ 水解的转化率为x
K=
c·(1-x)
(c·3x )3
27c2·x3
1-x
=
温度不变,故K不变
加FeCl3晶体,c(Fe3+)增大
故Fe3+ 水解的转化率为x减小
实验验证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目四:验证生成物浓度对水解平衡的影响
实验验证
影响盐类水解的主要因素
探究一:探究盐类水解的影响因素
项目四:验证生成物浓度对水解平衡的影响
通入HCl气体
颜色变浅
实验结论: c(H+)增大,水解平衡逆向移动,Fe3+水解程度减小
OH-
Fe3+ + 3H2O Fe(OH)3 + 3H+
c(H+)减小,水解平衡正向移动,Fe3+水解程度增大,颜色加深
H2O
思考:若向FeCl3溶液中加入少量浓碱(NaOH),溶液颜色如何变化呢?
大鹿化学工作室
明矾作净水剂
日常生活
盐类水解的应用
探究二:应用水解平衡原理解决问题
在生活、生产和科学研究中,人们常运用盐类水解的原理来解决实际问题
明矾[KAl(SO4)2·12H2O]
分析:Al3+水解生成的Al(OH)3(胶体)具有吸附性,可以使水中细小的悬浮颗粒聚集成较大的颗粒而沉降,从而除去水中的悬浮物,起到净水的作用。
Al3+ + 3H2O Al(OH)3 (胶体) + 3H+
泡沫灭火器原理
日常生活
盐类水解的应用
探究二:应用水解平衡原理解决问题
在生活、生产和科学研究中,人们常运用盐类水解的原理来解决实际问题
泡沫灭火器
分析:通过筒体内酸性溶液与碱性溶液混合发生化学反应,将生成的泡沫压出喷嘴,喷射出去进行灭火的。
一般不用Na2CO3,反应速率慢!
Al3+ + 3HCO3- Al(OH)3 ↓+ 3CO2↑
配制易水解的盐溶液
化学实验
盐类水解的应用
探究二:应用水解平衡原理解决问题
在生活、生产和科学研究中,人们常运用盐类水解的原理来解决实际问题
分析:增大c(H+),可抑制Fe3+的水解
方法:先将FeCl3晶体溶解在较浓盐酸中,再加水稀释到所需浓度
FeCl3溶液
Fe3+ + 3H2O Fe(OH)3 + 3H+
化学实验
盐类水解的应用
探究二:应用水解平衡原理解决问题
在生活、生产和科学研究中,人们常运用盐类水解的原理来解决实际问题
制备某些胶体
Fe3+ + 3H2O Fe(OH)3 (胶体) + 3H+
氢氧化铁胶体制备
分析:加热可使上述平衡右移
方法:向40 mL沸腾的蒸馏水中逐滴加入5~6滴饱和FeCl3溶液,继续煮沸至液体呈红褐色,停止加热
化学实验
盐类水解的应用
探究二:应用水解平衡原理解决问题
在生活、生产和科学研究中,人们常运用盐类水解的原理来解决实际问题
制备某些无机化合物
二氧化钛粉末
分析:TiCl4 + (x+2)H2O TiO2·xH2O + 4HCl
改变条件使上述平衡右移
方法:在制备时加入大量的水,同时加热,促使水解趋于完全,所得TiO2·xH2O经焙烧可得TiO2
TiCl4 + (x+2)H2O TiO2·xH2O ↓ + 4HCl
工农生产
盐类水解的应用
探究二:应用水解平衡原理解决问题
在生活、生产和科学研究中,人们常运用盐类水解的原理来解决实际问题
铵态氮肥与草木灰(主要成分为K2CO3)混合使用会大大降低氮肥的肥效
草木灰中CO32-与H+反应,使c(H+)减小,水解平衡向右移动,生成NH3·H2O,NH3·H2O分解产生NH3逸出,造成肥效损失
NH4+ + H2O NH3·H2O + H+
工农生产
盐类水解的应用
探究二:应用水解平衡原理解决问题
在生活、生产和科学研究中,人们常运用盐类水解的原理来解决实际问题
NH4Cl溶液与ZnCl2溶液可作焊接时的除锈剂
NH4++H2O NH3·H2O+H+
Zn2++2H2O Zn(OH)2+2H+
分析:金属焊接前利用NH4Cl 溶液或ZnCl2溶液除锈,原因是NH4+、Zn2+水解使溶液呈酸性
书上说:纯碱的水溶液可用于餐具油污的去除,而且用热水溶解的纯碱溶液去除油污的效果更好,这是为什么呢?
去油污的是OH-,Na2CO3水解可以生成OH- ,所以Na2CO3溶液可以清理油污。水解反应是吸热的,升温促进Na2CO3水解,使溶液中的c(OH-)增大,去污效果更好
H >0
CO32- + H2O HCO3- + OH-
可乐除水垢
方法:在水壶里倒上可乐,稍微没过有水垢的地方。接着,给水壶加热,加热好后把可乐倒出来,水垢就清除了。
原理:可乐含有大量的二氧化碳,碳酸钙和水在通入二氧化碳的时候反应生成可溶性的碳酸氢钙。即:CaCO3+H2O+CO2==2Ca(HCO3)2
1.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY
B.HX、HY、HZ
C.HZ、HY、HX
D.HY、HZ、HX
答案 B
解析 利用盐类水解规律“越弱越水解,谁强显谁性”,结合同浓度三种酸对应的钠盐的溶液的pH可推知,碱性越强则对应的酸越弱。
2.下列关于FeCl3水解的说法错误的是( )
A.在FeCl3稀溶液中,水解达到平衡时,无论加FeCl3饱和溶液还是加水稀释,平衡均向右移动
B.浓度为5 mol·L-1和0.5 mol·L-1的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者小于后者
C.其他条件相同时,同浓度的FeCl3溶液在50 ℃和20 ℃时发生水解,50 ℃时Fe3+的水解程度比20 ℃时的小
D.为抑制Fe3+的水解,更好地保存FeCl3溶液,应加少量盐酸
答案 C
解析 增大FeCl3的浓度,水解平衡向右移动,但Fe3+水解程度减小,加水稀释,水解平衡向右移动,Fe3+水解程度增大,A、B项均正确;盐类水解是吸热过程,温度升高,水解程度增大,C项错误;Fe3+水解后溶液呈酸性,增大H+的浓度可抑制Fe3+的水解,D项正确。
3.在空气中直接蒸发下列盐的溶液:①Fe2(SO4)3;②Na2CO3;③KCl;④CuCl2;⑤NaHCO3 可以得到相应盐的晶体(可以含有结晶水)的是( )
A.①②③ B.①③⑤ C.②④ D.①③④⑤
答案 A
解析 ①加热Fe2(SO4)3溶液时虽发生水解,但硫酸难挥发,蒸发Fe2(SO4)3溶液可得到Fe2(SO4)3晶体,故正确;②加热Na2CO3溶液水解生成NaOH,但NaOH和空气中的CO2反应又得到Na2CO3晶体,故正确;③KCl性质稳定,加热其溶液可得到KCl晶体,故正确;④加热CuCl2溶液水解生成氢氧化铜和HCl,HCl易挥发,得到氢氧化铜晶体,故错误;⑤NaHCO3不稳定,加热易分解生成Na2CO3,故错误。
4.下列关于盐类水解的应用中,说法正确的是( )
A.加热蒸干Na2CO3溶液,最后可以得到NaOH和Na2CO3的混合固体
B.除去MgCl2溶液中的Fe3+,可以加入NaOH固体
C.明矾净水的原理:Al3++3H2O Al(OH)3(胶体)+3H+
D.加热蒸干KCl溶液,最后得到KOH固体(不考虑与CO2的反应)
答案 C
解析 加热蒸干Na2CO3溶液,最后得到Na2CO3固体,A错误;镁离子、铁离子均能与
OH-反应生成沉淀,所以不能用NaOH除去MgCl2溶液中的Fe3+,B错误;明矾在水中电离出铝离子,铝离子水解生成的氢氧化铝胶体具有吸附性,即Al3++3H2O Al(OH)3(胶体)+
3H+,C正确;KCl不水解,加热蒸干KCl溶液,最后得到KCl固体,D错误。
5.下列说法中正确的是( )
A.AlCl3溶液和Al2(SO4)3溶液分别加热、蒸发、浓缩结晶、灼烧,所得固体的成分相同
B.实验室配制FeCl3溶液时,往往在FeCl3溶液中加入少量的硫酸
C.向CuCl2溶液中加入CuO,调节pH可除去溶液中混有的Fe3+
D.用Na2CO3和Al2(SO4)3两种溶液可作泡沫灭火剂
答案 C
解析 AlCl3溶液和Al2(SO4)2溶液分别加热、蒸发、浓缩结晶、灼烧,前者得到Al2O3,后者得到Al2(SO4)3,所得固体的成分不相同,故A错误;配制FeCl3溶液时,应将FeCl3固体溶解在盐酸中,再加水稀释到所需的浓度,若溶于硫酸,会引入杂质离子SO,故B错误;Fe3++3H2O Fe(OH)3+3H+,向CuCl2溶液中加入CuO,消耗H+,使上述水解平衡正向移动生成氢氧化铁沉淀,达到通过调节pH除去溶液中混有的Fe3+的目的,故C正确;泡沫灭火器中常使用的原料是NaHCO3和Al2(SO4)3,故D错误。
第三节
盐类水解
第2课时
影响盐类水解的主要因素
盐类水解的应用
日常生活中:净水剂,泡沫灭火器
化学实验:配制溶液、制备某些物质
内因:盐本身的性质
外因:温度、浓度、外加酸、碱、盐
工农业生产中:化肥的使用、焊接工业
