3.3 盐类的水解 第1课时 课件(31张PPT)-2023-2024学年高二化学(人教版2019选择性必修1)
文档属性
| 名称 | 3.3 盐类的水解 第1课时 课件(31张PPT)-2023-2024学年高二化学(人教版2019选择性必修1) |  | |
| 格式 | pptx | ||
| 文件大小 | 13.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-03 16:49:33 | ||
图片预览









文档简介
(共31张PPT)
第三节 盐类的水解
第1课时
第三章
水溶液中的离子反应与平衡
盐类水解方程式的书写
2
盐溶液的酸碱性
1
本节重点
盐溶液呈现不同酸碱性的原因
3
本节难点
碳酸钠俗称纯碱,但它并不是碱而是盐,为什么Na2CO3可被当作 “碱”使用呢?
Na2CO3是日常生活中常用的盐,俗称纯碱,常在面点加工时用于中和酸,也常用于油污的清洗等。
盐类的水解
探究一:盐类组成与其溶液酸碱性的关系
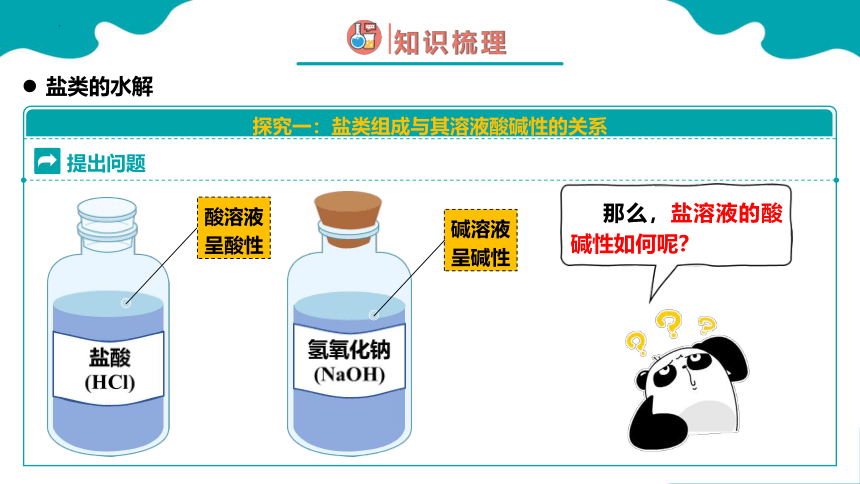
提出问题
那么,盐溶液的酸碱性如何呢?
酸溶液
呈酸性
碱溶液
呈碱性
大鹿化学工作室
思考:哪些方法可以测试上表所列盐溶液的酸碱性呢?
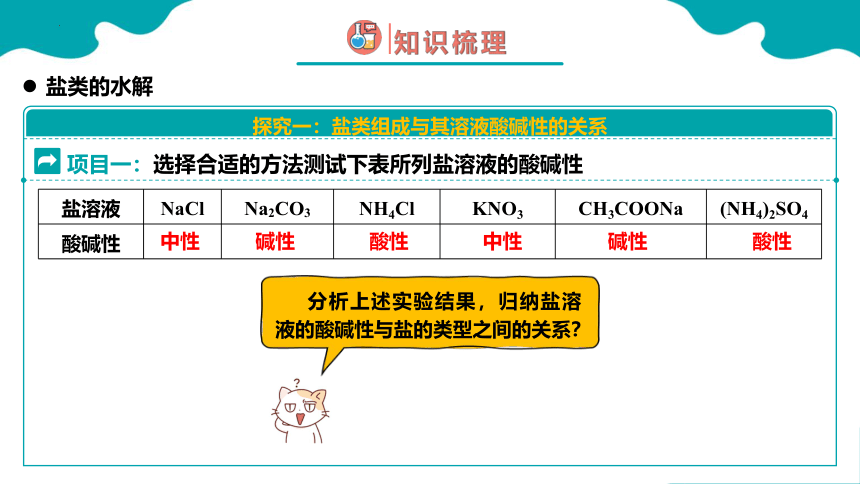
项目一:选择合适的方法测试下表所列盐溶液的酸碱性
盐溶液 NaCl Na2CO3 NH4Cl KNO3 CH3COONa (NH4)2SO4
酸碱性
盐类的水解
探究一:盐类组成与其溶液酸碱性的关系
项目一:选择合适的方法测试下表所列盐溶液的酸碱性
盐溶液 NaCl Na2CO3 NH4Cl KNO3 CH3COONa (NH4)2SO4
酸碱性
盐类的水解
探究一:盐类组成与其溶液酸碱性的关系
pH试纸法
酸碱指示剂法
pH计法
盐类的水解
探究一:盐类组成与其溶液酸碱性的关系
项目一:选择合适的方法测试下表所列盐溶液的酸碱性
CH3COONa溶液
NaCl溶液
NH4Cl溶液
项目一:选择合适的方法测试下表所列盐溶液的酸碱性
盐溶液 NaCl Na2CO3 NH4Cl KNO3 CH3COONa (NH4)2SO4
酸碱性
盐类的水解
探究一:盐类组成与其溶液酸碱性的关系
中性
碱性
酸性
中性
碱性
酸性
分析上述实验结果,归纳盐溶液的酸碱性与盐的类型之间的关系?
项目一:选择合适的方法测试下表所列盐溶液的酸碱性
盐溶液 NaCl Na2CO3 NH4Cl KNO3 CH3COONa (NH4)2SO4
酸碱性
盐类的水解
探究一:盐类组成与其溶液酸碱性的关系
中性
碱性
酸性
中性
碱性
酸性
强酸
强碱盐
结果和讨论
NH4Cl
(NH4)2SO4
盐的类型
项目一:选择合适的方法测试下表所列盐溶液的酸碱性
盐溶液 NaCl Na2CO3 NH4Cl KNO3 CH3COONa (NH4)2SO4
酸碱性
盐的类型
c(H+)和c(OH-)的相对大小
盐类的水解
探究一:盐类组成与其溶液酸碱性的关系
中性
碱性
酸性
中性
碱性
酸性
强酸
强碱盐
强酸
弱碱盐
强碱
弱酸盐
强酸
强碱盐
强碱
弱酸盐
强酸
强碱盐
c(H+)
=
c(OH-)
c(H+)
>
c(OH-)
c(H+)
<
c(OH-)
c(H+)
=
c(OH-)
c(H+)
>
c(OH-)
c(H+)
<
c(OH-)
溶液呈酸性、碱性还是中性,取决于溶液中c(H+)和c(OH-)的相对大小。那么,是什么原因造成不同类型的盐溶液中c(H+)和c(OH-)相对大小的差异呢?
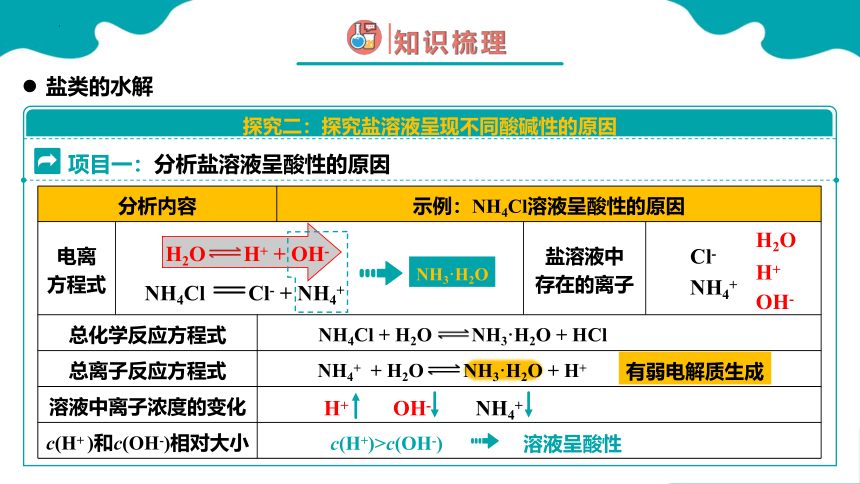
项目一:分析盐溶液呈酸性的原因
盐类的水解
探究二:探究盐溶液呈现不同酸碱性的原因
分析内容 示例:NH4Cl溶液呈酸性的原因 电离 方程式 盐溶液中 存在的离子
总化学反应方程式 总离子反应方程式 溶液中离子浓度的变化 c(H+ )和c(OH-)相对大小 H2O H+ + OH-
NH4Cl Cl- + NH4+
NH3·H2O
c(H+)>c(OH-)
H2O
OH-
Cl-
NH4+
NH4Cl + H2O NH3·H2O + HCl
H+
H+
OH-
NH4+
溶液呈酸性
有弱电解质生成
NH4+ + H2O NH3·H2O + H+
分析内容 示例:CH3COONa溶液呈碱性的原因 电离 方程式 盐溶液中 存在的离子
总化学反应方程式 总离子反应方程式 溶液中离子浓度的变化 c(H+ )和c(OH-)相对大小 H2O OH- + H+
项目一:分析盐溶液呈酸性的原因
盐类的水解
探究二:探究盐溶液呈现不同酸碱性的原因
CH3COOH
c(H+)H2O
OH-
CH3COO-
Na+
H+
H+
OH-
CH3COO-
溶液呈碱性
有弱电解质生成
CH3COONa CH3COO- + Na+
CH3COO- + H2O CH3COOH + OH-
CH3COONa + H2O CH3COOH + NaOH
分析内容 示例:NaCl溶液呈中性的原因 电离 方程式 盐溶液中 存在的离子
总化学反应方程式 总离子反应方程式 溶液中离子浓度的变化 c(H+ )和c(OH-)相对大小 H2O OH- + H+
项目一:分析盐溶液呈酸性的原因
盐类的水解
探究二:探究盐溶液呈现不同酸碱性的原因
水的电离平衡不发生移动,溶液中c(H+)=c(OH-),呈中性
H2O
OH-
Cl-
Na+
H+
NaCl Cl- + Na+
无弱电解质生成
无
盐类的水解
探究二:探究盐溶液呈现不同酸碱性的原因
归纳总结
NaCl
H2O OH- + H+
无弱电解质生成
NH4Cl
H2O OH- + H+
有弱电解质生成
CH3COONa
H2O OH- + H+
有弱电解质生成
在水溶液中,盐电离出来的离子与水电离出来的H+或或OH-合生成弱电解质的反应
盐类的水解
盐类的水解
盐 + 水 酸 + 碱
盐类水解反应过程总结
溶液呈碱性或酸性、中性
水的电离程度增大
盐
电
离
弱酸的阴离子→结合H+
弱碱的阳离子→结合OH-
破坏了水的电离平衡
水解反应的实质
水解反应的表达
生成弱电解质,破坏、促进水的电离
盐类的水解
水解反应的特点
可逆反应
水解反应的程度很微弱
酸碱中和反应的逆反应
吸热反应
盐类水解反应的规律
强酸强碱盐不水解,溶液呈中性,溶液的 pH=7
如 NaCl、KNO3等
如Cu(NO3)2等,水解的离子是Cu2+
如Na2CO3等,水解的离子是CO32-
强酸弱碱盐水解,溶液呈酸性,溶液的 pH<7
强碱弱酸盐水解,溶液呈碱性,溶液的 pH>7
速记口诀:有弱才水解,越弱越水解;谁强显谁性,同强显中性
宏观:
Al2(SO4)3为强酸弱碱盐,溶液呈酸性
微观:
盐电离产生的Al3+与溶液中的OH-结合生成弱碱Al(OH)3,使溶液中c(H+)>c(OH-),溶液呈酸性
思考:Al2(SO4)3溶液呈酸性、碱性还是中性?
盐类的水解
探究二:探究盐溶液呈现不同酸碱性的原因
项目二:根据醋酸钠水解反应的离子方程式, 写出水解平衡的平衡常数表达式
CH3COO- + H2O CH3COOH + OH-
Kh=
c(CH3COOH)·c(OH-)
c(CH3COO-)
当水解达到平衡时,溶液中还存在以下关系:
Ka=
c(CH3COO-)·c(H+)
c(CH3COOH)
将以上关系代入Kh的表达式,得到如下关系:
c(H+)·c(OH-)
Ka
=
Kw
Ka
Kh=
Kw
Ka
Kh=
强碱
弱酸盐
Kw
Kb
Kh=
强酸
弱碱盐
弱酸或弱碱的电离常数越小,其生成的盐水解程度就越大
思考:25 ℃时,CH3COOH的电离常数 Ka=1.75×10-5,HClO的电离常数Ka=2.98×10-8,比较同浓度时CH3COONa溶液与NaClO溶液碱性。
Kw
Ka
Kh=
强碱
弱酸盐
CH3COO- + H2O CH3COOH + OH-
ClO- + H2O HClO + OH-
Kw
Ka
Kh1=
=
10-14
1.75×10-5
Kw
Ka
Kh2=
=
10-14
2.98×10-8
≈
5.7×10-10
≈
3.4×10-7
Kh2> Kh1
同浓度的醋酸钠和次氯酸钠溶液中,次氯酸钠溶液的碱性更强
盐类水解是可逆反应,要写“ ”,而不用“ ”
盐类的水解
探究三:盐类水解的离子方程式
一般模式
盐的
离子
水
弱酸
(弱碱)
(H+)
OH-
盐类水解的程度很小,书写时,不标“↓”或“↑”
类型三
多元弱酸强碱盐
盐类的水解
探究三:盐类水解的离子方程式
分类分析
类型一
一元强酸弱碱盐
示例:NHCl4水解的离子方程式:
NH4+ + H2O NH3·H2O + H+
类型二
一元强碱弱酸盐
示例:CH3COONa水解的离子方程式:
CH3COO- + H2O CH3COOH + OH-
示例:Na2CO3水解的离子方程式:
注意:多元弱酸盐的阴离子水解是分步进行的,以第一步为主
CO32-+H2O HCO3- + OH- (主) 、HCO3- +H2O H2CO3 + OH- (次)
类型五
相互促进的水解
盐类的水解
探究三:盐类水解的离子方程式
分类分析
阴、阳离子均水解,二者相互促进,水解程度较大,水解反应一般能进行到底,书写水解离子方程式时要用“=”“↑”“↓”等
示例:
Na2S溶液与AlCl3溶液混合后的离子方程式:
NaHCO3溶液与AlCl3溶液混合后的离子方程式:
类型四
多元强酸弱碱盐水解
Fe3+ + 3H2O Fe(OH)3 + 3H+
注意:多元弱碱的阳离子水解较复杂,按一步水解处理
示例: FeCl3水解的离子方程式:
3HCO3- + Al3+ = 3CO2↑ + Al(OH)3↓
3S2- + 2Al3+ + 6H2O=3H2S↑ + 2Al(OH)3↓
思考:Na2CO3的水解过程,请写出相应水解反应的离子方程式吗?
Na2CO3溶液呈碱性
Na2CO3的水解是分两步进行的,第一步CO32- 水解
Na2CO3 2Na+ + CO32-
H2O OH- + H+
HCO3-
H2O OH- + H+
HCO3- + H2O H2CO3 + OH-
CO32- + H2O HCO3- + OH-
酸碱电子理论
酸碱电子理论,也称广义酸碱理论、路易斯酸碱理论,它认为:凡是可以接受外来电子对的分子、基团或离子为酸;凡可以提供电子对的分子、离子或原子团为碱。它认为酸碱反应的实质是形成配位键生成酸碱配合物的过程。
吉尔伯特·路易斯
大鹿化学工作室
1.(2020·浙江选考)水溶液呈酸性的是( )
A.NaCl B.NaHSO4 C.HCOONa D.NaHCO3
答案 B
解析 NaCl是强酸强碱盐,不能水解,其水溶液呈中性,A不符合题意;NaHSO4是强酸的酸式盐,属于强电解质,在水溶液中的电离方程式为NaHSO4===Na++H++SO42-,故其水溶液呈酸性,B符合题意;HCOONa属于强碱弱酸盐,在水溶液中可以完全电离,电离产生的HCOO-可以发生水解,其水解的离子方程式为HCOO-+H2O HCOOH+OH-,故其水溶液呈碱性,C不符合题意;NaHCO3是强碱弱酸盐,既能发生电离又能发生水解,但其水解程度大于电离程度,故其水溶液呈碱性,D不符合题意。
2.下图表示的是某离子X与水的反应过程,离子X可能是( )
A.CO32- B.HCO3- C.Na+ D.NH4+
答案 D
解析 离子X的水解反应生成H+,由图可知X只能是NH4+ 。
3.下列反应不属于水解反应或水解方程式不正确的是( )
①HCl+H2O H3O++Cl-
②AlCl3+3H2O=== Al(OH)3+3HCl
③Na2CO3+2H2O H2CO3+2NaOH
④碳酸氢钠溶液:HCO+H2O CO+H3O+
⑤NH4Cl溶于D2O中:NH+D2O NH3·D2O+H+
A.①②③④ B.①②③ C.②③⑤ D.全部
答案 D
解析 氯化氢不能发生水解反应,①错误;氯化铝水解的方程式应用“ ”连接,②错误;CO32-应分步水解,③错误;
碳酸氢根离子的水解方程式为HCO3-+H2O H2CO3+OH-,④错误;NH4Cl溶于D2O中的离子方程式为NH+D2O NH3·DHO+D+,⑤错误。
4.室温下,0.5 mol·L-1相同体积的下列四种溶液①KCl、②FeCl3、③HF、④Na2CO3,其中所含阳离子数由多到少的顺序是( )
A.④>①=②>③ B.①>④>②>③
C.④>①>③>② D.④>②>①>③
答案 D
解析 电解质在水中以电离为主,水解是极其微弱的,所以四种物质中Na2CO3电离的阳离子数一定最多,HF为弱电解质,电离出的H+一定最少,先排除B、C项,再观察KCl和FeCl3,如果只考虑电离,二者电离的阳离子数应相等,但Fe3+存在水解且一个Fe3+水解可生成三个H+,导致其溶液中阳离子数增多。
5.25 ℃时,有关浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液的判断不正确的是( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.加入等量NaOH固体,恢复到原温度,c(CO32-)均增大
答案 C
解析 两种溶液中均存在水的电离平衡,NaHCO3溶液中还存在HCO3- H++CO32-及HCO3- +H2O H2CO3+OH-,Na2CO3溶液中还存在CO32- +H2O HCO3- +OH-,故A正确;两种溶液中均存在Na+、CO32- 、HCO3- 、H2CO3、OH-、H+、H2O,故B正确;浓度相同时,CO32-的水解程度大于HCO3- ,故Na2CO3溶液中的c(OH-)更大,故C错误;向NaHCO3溶液中加入NaOH固体,HCO+OH-=== H2O+CO,c(CO32-)增大,Na2CO3溶液中加入NaOH固体,导致CO32-的水解平衡逆向移动,c(CO32-)增大,故D正确。
第三节
盐类水解
第1课时
盐溶液的酸碱性
盐类水解方程式的书写
盐类水解程度一般很小,水解时通常不生成沉淀和气体,书写水解的离子方程式时,一般用可逆反应连接,产物不标“↑”或“↓”
多元弱酸根离子的水解分步进行,水解以第一步为主
探究盐溶液的酸碱性
理论分析:盐溶液呈酸碱性的原因
盐类水解
多元弱碱阳离子水解反应过程复杂,只要求一步写到底
弱酸弱碱盐中阴、阳离子水解相互促进
第三节 盐类的水解
第1课时
第三章
水溶液中的离子反应与平衡
盐类水解方程式的书写
2
盐溶液的酸碱性
1
本节重点
盐溶液呈现不同酸碱性的原因
3
本节难点
碳酸钠俗称纯碱,但它并不是碱而是盐,为什么Na2CO3可被当作 “碱”使用呢?
Na2CO3是日常生活中常用的盐,俗称纯碱,常在面点加工时用于中和酸,也常用于油污的清洗等。
盐类的水解
探究一:盐类组成与其溶液酸碱性的关系
提出问题
那么,盐溶液的酸碱性如何呢?
酸溶液
呈酸性
碱溶液
呈碱性
大鹿化学工作室
思考:哪些方法可以测试上表所列盐溶液的酸碱性呢?
项目一:选择合适的方法测试下表所列盐溶液的酸碱性
盐溶液 NaCl Na2CO3 NH4Cl KNO3 CH3COONa (NH4)2SO4
酸碱性
盐类的水解
探究一:盐类组成与其溶液酸碱性的关系
项目一:选择合适的方法测试下表所列盐溶液的酸碱性
盐溶液 NaCl Na2CO3 NH4Cl KNO3 CH3COONa (NH4)2SO4
酸碱性
盐类的水解
探究一:盐类组成与其溶液酸碱性的关系
pH试纸法
酸碱指示剂法
pH计法
盐类的水解
探究一:盐类组成与其溶液酸碱性的关系
项目一:选择合适的方法测试下表所列盐溶液的酸碱性
CH3COONa溶液
NaCl溶液
NH4Cl溶液
项目一:选择合适的方法测试下表所列盐溶液的酸碱性
盐溶液 NaCl Na2CO3 NH4Cl KNO3 CH3COONa (NH4)2SO4
酸碱性
盐类的水解
探究一:盐类组成与其溶液酸碱性的关系
中性
碱性
酸性
中性
碱性
酸性
分析上述实验结果,归纳盐溶液的酸碱性与盐的类型之间的关系?
项目一:选择合适的方法测试下表所列盐溶液的酸碱性
盐溶液 NaCl Na2CO3 NH4Cl KNO3 CH3COONa (NH4)2SO4
酸碱性
盐类的水解
探究一:盐类组成与其溶液酸碱性的关系
中性
碱性
酸性
中性
碱性
酸性
强酸
强碱盐
结果和讨论
NH4Cl
(NH4)2SO4
盐的类型
项目一:选择合适的方法测试下表所列盐溶液的酸碱性
盐溶液 NaCl Na2CO3 NH4Cl KNO3 CH3COONa (NH4)2SO4
酸碱性
盐的类型
c(H+)和c(OH-)的相对大小
盐类的水解
探究一:盐类组成与其溶液酸碱性的关系
中性
碱性
酸性
中性
碱性
酸性
强酸
强碱盐
强酸
弱碱盐
强碱
弱酸盐
强酸
强碱盐
强碱
弱酸盐
强酸
强碱盐
c(H+)
=
c(OH-)
c(H+)
>
c(OH-)
c(H+)
<
c(OH-)
c(H+)
=
c(OH-)
c(H+)
>
c(OH-)
c(H+)
<
c(OH-)
溶液呈酸性、碱性还是中性,取决于溶液中c(H+)和c(OH-)的相对大小。那么,是什么原因造成不同类型的盐溶液中c(H+)和c(OH-)相对大小的差异呢?
项目一:分析盐溶液呈酸性的原因
盐类的水解
探究二:探究盐溶液呈现不同酸碱性的原因
分析内容 示例:NH4Cl溶液呈酸性的原因 电离 方程式 盐溶液中 存在的离子
总化学反应方程式 总离子反应方程式 溶液中离子浓度的变化 c(H+ )和c(OH-)相对大小 H2O H+ + OH-
NH4Cl Cl- + NH4+
NH3·H2O
c(H+)>c(OH-)
H2O
OH-
Cl-
NH4+
NH4Cl + H2O NH3·H2O + HCl
H+
H+
OH-
NH4+
溶液呈酸性
有弱电解质生成
NH4+ + H2O NH3·H2O + H+
分析内容 示例:CH3COONa溶液呈碱性的原因 电离 方程式 盐溶液中 存在的离子
总化学反应方程式 总离子反应方程式 溶液中离子浓度的变化 c(H+ )和c(OH-)相对大小 H2O OH- + H+
项目一:分析盐溶液呈酸性的原因
盐类的水解
探究二:探究盐溶液呈现不同酸碱性的原因
CH3COOH
c(H+)
OH-
CH3COO-
Na+
H+
H+
OH-
CH3COO-
溶液呈碱性
有弱电解质生成
CH3COONa CH3COO- + Na+
CH3COO- + H2O CH3COOH + OH-
CH3COONa + H2O CH3COOH + NaOH
分析内容 示例:NaCl溶液呈中性的原因 电离 方程式 盐溶液中 存在的离子
总化学反应方程式 总离子反应方程式 溶液中离子浓度的变化 c(H+ )和c(OH-)相对大小 H2O OH- + H+
项目一:分析盐溶液呈酸性的原因
盐类的水解
探究二:探究盐溶液呈现不同酸碱性的原因
水的电离平衡不发生移动,溶液中c(H+)=c(OH-),呈中性
H2O
OH-
Cl-
Na+
H+
NaCl Cl- + Na+
无弱电解质生成
无
盐类的水解
探究二:探究盐溶液呈现不同酸碱性的原因
归纳总结
NaCl
H2O OH- + H+
无弱电解质生成
NH4Cl
H2O OH- + H+
有弱电解质生成
CH3COONa
H2O OH- + H+
有弱电解质生成
在水溶液中,盐电离出来的离子与水电离出来的H+或或OH-合生成弱电解质的反应
盐类的水解
盐类的水解
盐 + 水 酸 + 碱
盐类水解反应过程总结
溶液呈碱性或酸性、中性
水的电离程度增大
盐
电
离
弱酸的阴离子→结合H+
弱碱的阳离子→结合OH-
破坏了水的电离平衡
水解反应的实质
水解反应的表达
生成弱电解质,破坏、促进水的电离
盐类的水解
水解反应的特点
可逆反应
水解反应的程度很微弱
酸碱中和反应的逆反应
吸热反应
盐类水解反应的规律
强酸强碱盐不水解,溶液呈中性,溶液的 pH=7
如 NaCl、KNO3等
如Cu(NO3)2等,水解的离子是Cu2+
如Na2CO3等,水解的离子是CO32-
强酸弱碱盐水解,溶液呈酸性,溶液的 pH<7
强碱弱酸盐水解,溶液呈碱性,溶液的 pH>7
速记口诀:有弱才水解,越弱越水解;谁强显谁性,同强显中性
宏观:
Al2(SO4)3为强酸弱碱盐,溶液呈酸性
微观:
盐电离产生的Al3+与溶液中的OH-结合生成弱碱Al(OH)3,使溶液中c(H+)>c(OH-),溶液呈酸性
思考:Al2(SO4)3溶液呈酸性、碱性还是中性?
盐类的水解
探究二:探究盐溶液呈现不同酸碱性的原因
项目二:根据醋酸钠水解反应的离子方程式, 写出水解平衡的平衡常数表达式
CH3COO- + H2O CH3COOH + OH-
Kh=
c(CH3COOH)·c(OH-)
c(CH3COO-)
当水解达到平衡时,溶液中还存在以下关系:
Ka=
c(CH3COO-)·c(H+)
c(CH3COOH)
将以上关系代入Kh的表达式,得到如下关系:
c(H+)·c(OH-)
Ka
=
Kw
Ka
Kh=
Kw
Ka
Kh=
强碱
弱酸盐
Kw
Kb
Kh=
强酸
弱碱盐
弱酸或弱碱的电离常数越小,其生成的盐水解程度就越大
思考:25 ℃时,CH3COOH的电离常数 Ka=1.75×10-5,HClO的电离常数Ka=2.98×10-8,比较同浓度时CH3COONa溶液与NaClO溶液碱性。
Kw
Ka
Kh=
强碱
弱酸盐
CH3COO- + H2O CH3COOH + OH-
ClO- + H2O HClO + OH-
Kw
Ka
Kh1=
=
10-14
1.75×10-5
Kw
Ka
Kh2=
=
10-14
2.98×10-8
≈
5.7×10-10
≈
3.4×10-7
Kh2> Kh1
同浓度的醋酸钠和次氯酸钠溶液中,次氯酸钠溶液的碱性更强
盐类水解是可逆反应,要写“ ”,而不用“ ”
盐类的水解
探究三:盐类水解的离子方程式
一般模式
盐的
离子
水
弱酸
(弱碱)
(H+)
OH-
盐类水解的程度很小,书写时,不标“↓”或“↑”
类型三
多元弱酸强碱盐
盐类的水解
探究三:盐类水解的离子方程式
分类分析
类型一
一元强酸弱碱盐
示例:NHCl4水解的离子方程式:
NH4+ + H2O NH3·H2O + H+
类型二
一元强碱弱酸盐
示例:CH3COONa水解的离子方程式:
CH3COO- + H2O CH3COOH + OH-
示例:Na2CO3水解的离子方程式:
注意:多元弱酸盐的阴离子水解是分步进行的,以第一步为主
CO32-+H2O HCO3- + OH- (主) 、HCO3- +H2O H2CO3 + OH- (次)
类型五
相互促进的水解
盐类的水解
探究三:盐类水解的离子方程式
分类分析
阴、阳离子均水解,二者相互促进,水解程度较大,水解反应一般能进行到底,书写水解离子方程式时要用“=”“↑”“↓”等
示例:
Na2S溶液与AlCl3溶液混合后的离子方程式:
NaHCO3溶液与AlCl3溶液混合后的离子方程式:
类型四
多元强酸弱碱盐水解
Fe3+ + 3H2O Fe(OH)3 + 3H+
注意:多元弱碱的阳离子水解较复杂,按一步水解处理
示例: FeCl3水解的离子方程式:
3HCO3- + Al3+ = 3CO2↑ + Al(OH)3↓
3S2- + 2Al3+ + 6H2O=3H2S↑ + 2Al(OH)3↓
思考:Na2CO3的水解过程,请写出相应水解反应的离子方程式吗?
Na2CO3溶液呈碱性
Na2CO3的水解是分两步进行的,第一步CO32- 水解
Na2CO3 2Na+ + CO32-
H2O OH- + H+
HCO3-
H2O OH- + H+
HCO3- + H2O H2CO3 + OH-
CO32- + H2O HCO3- + OH-
酸碱电子理论
酸碱电子理论,也称广义酸碱理论、路易斯酸碱理论,它认为:凡是可以接受外来电子对的分子、基团或离子为酸;凡可以提供电子对的分子、离子或原子团为碱。它认为酸碱反应的实质是形成配位键生成酸碱配合物的过程。
吉尔伯特·路易斯
大鹿化学工作室
1.(2020·浙江选考)水溶液呈酸性的是( )
A.NaCl B.NaHSO4 C.HCOONa D.NaHCO3
答案 B
解析 NaCl是强酸强碱盐,不能水解,其水溶液呈中性,A不符合题意;NaHSO4是强酸的酸式盐,属于强电解质,在水溶液中的电离方程式为NaHSO4===Na++H++SO42-,故其水溶液呈酸性,B符合题意;HCOONa属于强碱弱酸盐,在水溶液中可以完全电离,电离产生的HCOO-可以发生水解,其水解的离子方程式为HCOO-+H2O HCOOH+OH-,故其水溶液呈碱性,C不符合题意;NaHCO3是强碱弱酸盐,既能发生电离又能发生水解,但其水解程度大于电离程度,故其水溶液呈碱性,D不符合题意。
2.下图表示的是某离子X与水的反应过程,离子X可能是( )
A.CO32- B.HCO3- C.Na+ D.NH4+
答案 D
解析 离子X的水解反应生成H+,由图可知X只能是NH4+ 。
3.下列反应不属于水解反应或水解方程式不正确的是( )
①HCl+H2O H3O++Cl-
②AlCl3+3H2O=== Al(OH)3+3HCl
③Na2CO3+2H2O H2CO3+2NaOH
④碳酸氢钠溶液:HCO+H2O CO+H3O+
⑤NH4Cl溶于D2O中:NH+D2O NH3·D2O+H+
A.①②③④ B.①②③ C.②③⑤ D.全部
答案 D
解析 氯化氢不能发生水解反应,①错误;氯化铝水解的方程式应用“ ”连接,②错误;CO32-应分步水解,③错误;
碳酸氢根离子的水解方程式为HCO3-+H2O H2CO3+OH-,④错误;NH4Cl溶于D2O中的离子方程式为NH+D2O NH3·DHO+D+,⑤错误。
4.室温下,0.5 mol·L-1相同体积的下列四种溶液①KCl、②FeCl3、③HF、④Na2CO3,其中所含阳离子数由多到少的顺序是( )
A.④>①=②>③ B.①>④>②>③
C.④>①>③>② D.④>②>①>③
答案 D
解析 电解质在水中以电离为主,水解是极其微弱的,所以四种物质中Na2CO3电离的阳离子数一定最多,HF为弱电解质,电离出的H+一定最少,先排除B、C项,再观察KCl和FeCl3,如果只考虑电离,二者电离的阳离子数应相等,但Fe3+存在水解且一个Fe3+水解可生成三个H+,导致其溶液中阳离子数增多。
5.25 ℃时,有关浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液的判断不正确的是( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.加入等量NaOH固体,恢复到原温度,c(CO32-)均增大
答案 C
解析 两种溶液中均存在水的电离平衡,NaHCO3溶液中还存在HCO3- H++CO32-及HCO3- +H2O H2CO3+OH-,Na2CO3溶液中还存在CO32- +H2O HCO3- +OH-,故A正确;两种溶液中均存在Na+、CO32- 、HCO3- 、H2CO3、OH-、H+、H2O,故B正确;浓度相同时,CO32-的水解程度大于HCO3- ,故Na2CO3溶液中的c(OH-)更大,故C错误;向NaHCO3溶液中加入NaOH固体,HCO+OH-=== H2O+CO,c(CO32-)增大,Na2CO3溶液中加入NaOH固体,导致CO32-的水解平衡逆向移动,c(CO32-)增大,故D正确。
第三节
盐类水解
第1课时
盐溶液的酸碱性
盐类水解方程式的书写
盐类水解程度一般很小,水解时通常不生成沉淀和气体,书写水解的离子方程式时,一般用可逆反应连接,产物不标“↑”或“↓”
多元弱酸根离子的水解分步进行,水解以第一步为主
探究盐溶液的酸碱性
理论分析:盐溶液呈酸碱性的原因
盐类水解
多元弱碱阳离子水解反应过程复杂,只要求一步写到底
弱酸弱碱盐中阴、阳离子水解相互促进
