北京101中学2023-2024学年高二上学期统练一化学试题(含答案)
文档属性
| 名称 | 北京101中学2023-2024学年高二上学期统练一化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 877.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-04 08:13:47 | ||
图片预览

文档简介
北京101中学2023-2024学年高二上学期统练一
化学
2023年9月20日
友情提示:
本试卷分为Ⅰ卷、Ⅱ卷两部分,共16道小题,共8页,满分100分;答题时间为50分钟;请将答案写在答题纸上。
Ⅰ卷 选择题(共56分)
(共14道小题,每小题只有一个选项符合题意,每小题4分。)
1.下列物质的应用与氧化还原反应无关的是( )。
A.呼吸面具中用过氧化钠作供氧剂
B.面团中加入小苏打,蒸出的馒头疏松多孔
C.葡萄糖在人体内代谢,可为生命活动提供能量
D.维生素C能促进补铁剂(有效成分)的吸收
2.用下列仪器或装置进行相应实验,能达到实验目的的是( )。
A.除去中的少量 B.配制一定物质的量浓度的硫酸溶液 C.制取氨气 D.检验淀粉水解生成了葡萄糖
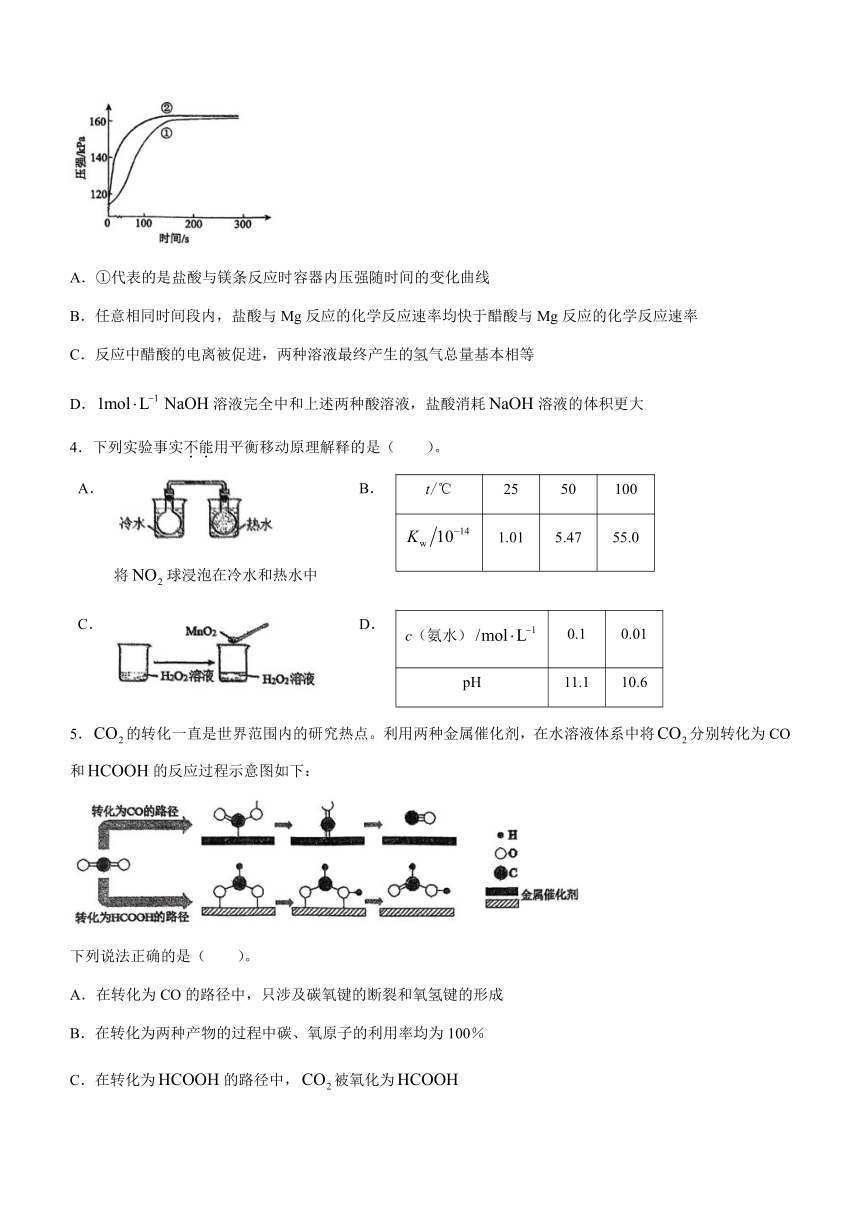
3.在两个密闭的锥形瓶中,形状相同的镁条(过量)分别与的盐酸和醋酸反应,测得容器内压强随时间的变化曲线如下图。下列说法正确的是( )。
A.①代表的是盐酸与镁条反应时容器内压强随时间的变化曲线
B.任意相同时间段内,盐酸与Mg反应的化学反应速率均快于醋酸与Mg反应的化学反应速率
C.反应中醋酸的电离被促进,两种溶液最终产生的氢气总量基本相等
D.溶液完全中和上述两种酸溶液,盐酸消耗溶液的体积更大
4.下列实验事实不能用平衡移动原理解释的是( )。
A. 将球浸泡在冷水和热水中 B. t/℃25501001.015.4755.0
C. D. c(氨水)0.10.01pH11.110.6
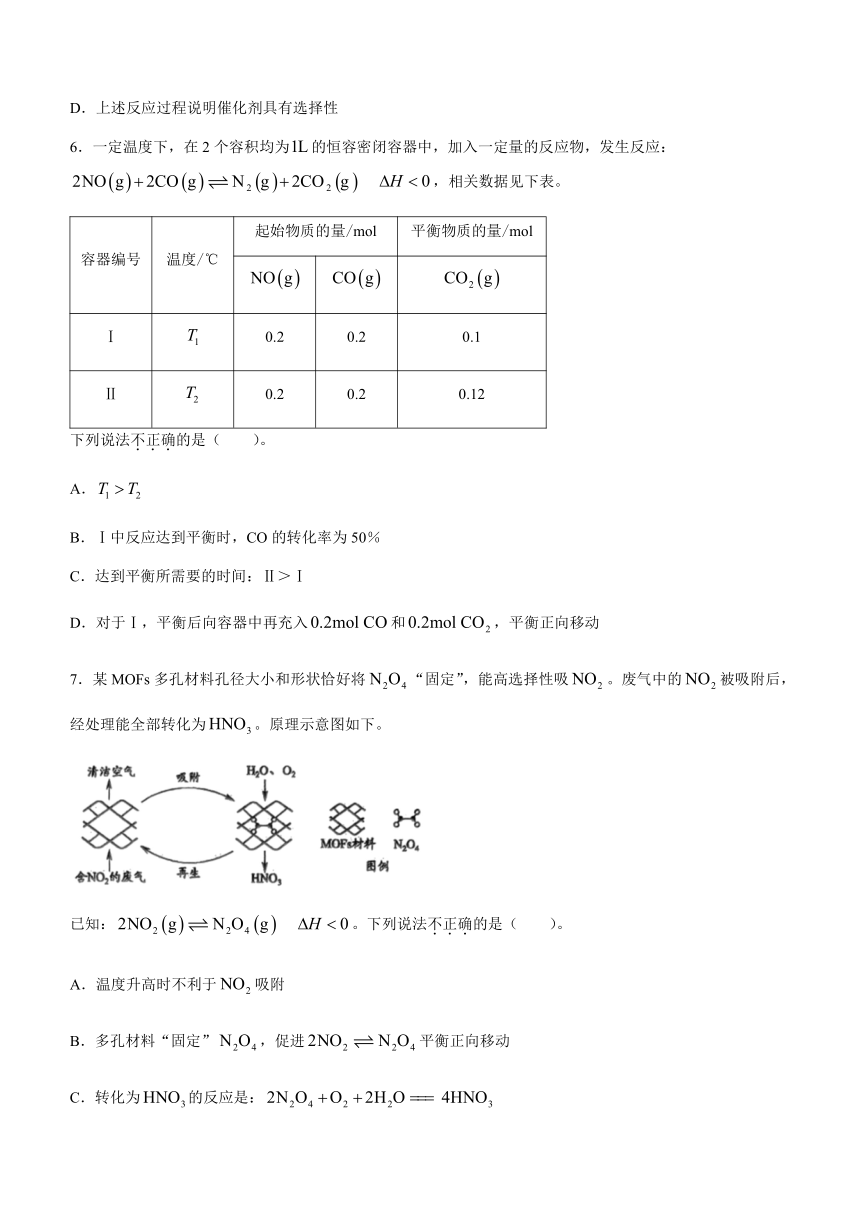
5.的转化一直是世界范围内的研究热点。利用两种金属催化剂,在水溶液体系中将分别转化为CO和的反应过程示意图如下:
下列说法正确的是( )。
A.在转化为CO的路径中,只涉及碳氧键的断裂和氧氢键的形成
B.在转化为两种产物的过程中碳、氧原子的利用率均为100%
C.在转化为的路径中,被氧化为
D.上述反应过程说明催化剂具有选择性
6.一定温度下,在2个容积均为的恒容密闭容器中,加入一定量的反应物,发生反应: ,相关数据见下表。
容器编号 温度/℃ 起始物质的量/mol 平衡物质的量/mol
Ⅰ 0.2 0.2 0.1
Ⅱ 0.2 0.2 0.12
下列说法不正确的是( )。
A.
B.Ⅰ中反应达到平衡时,CO的转化率为50%
C.达到平衡所需要的时间:Ⅱ>Ⅰ
D.对于Ⅰ,平衡后向容器中再充入和,平衡正向移动
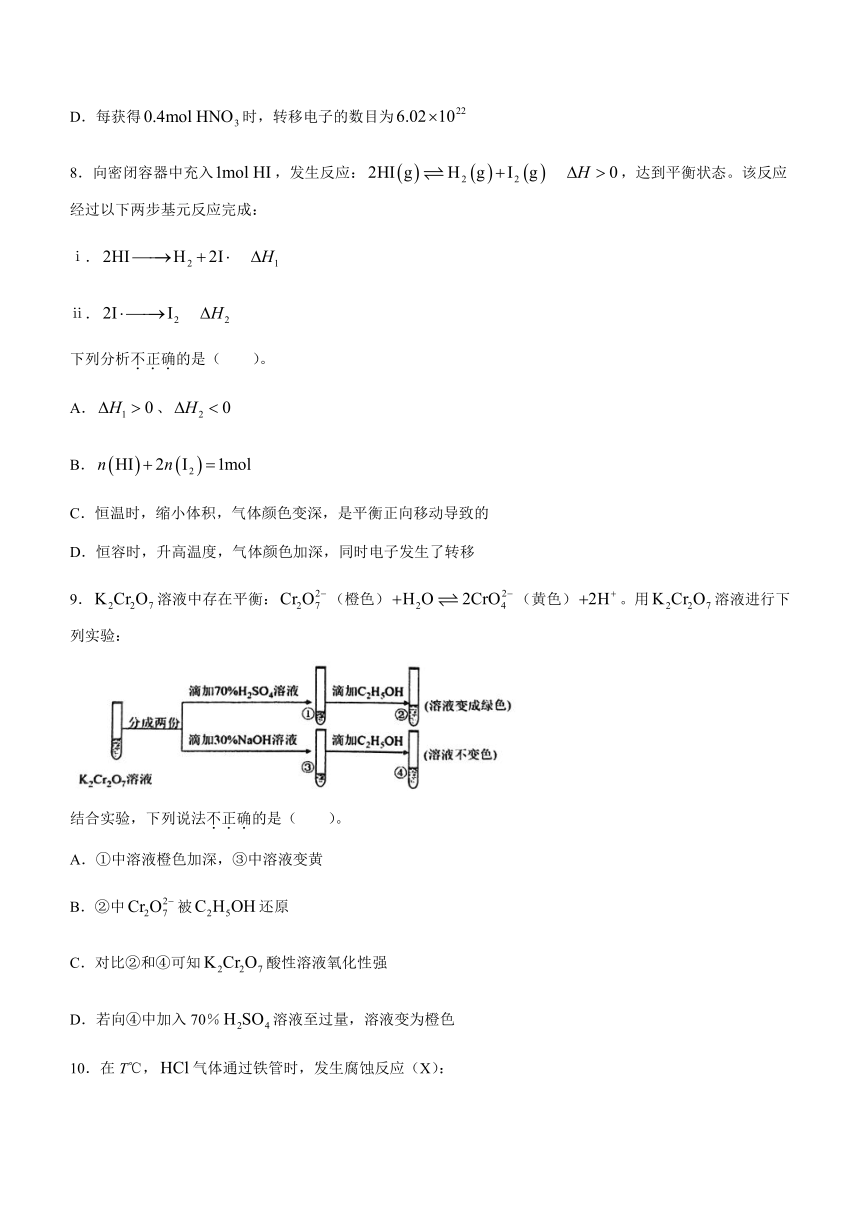
7.某MOFs多孔材料孔径大小和形状恰好将“固定”,能高选择性吸。废气中的被吸附后,经处理能全部转化为。原理示意图如下。
已知: 。下列说法不正确的是( )。
A.温度升高时不利于吸附
B.多孔材料“固定”,促进平衡正向移动
C.转化为的反应是:
D.每获得时,转移电子的数目为
8.向密闭容器中充入,发生反应: ,达到平衡状态。该反应经过以下两步基元反应完成:
ⅰ.
ⅱ.
下列分析不正确的是( )。
A.、
B.
C.恒温时,缩小体积,气体颜色变深,是平衡正向移动导致的
D.恒容时,升高温度,气体颜色加深,同时电子发生了转移
9.溶液中存在平衡:(橙色)(黄色)。用溶液进行下列实验:
结合实验,下列说法不正确的是( )。
A.①中溶液橙色加深,③中溶液变黄
B.②中被还原
C.对比②和④可知酸性溶液氧化性强
D.若向④中加入70%溶液至过量,溶液变为橙色
10.在T℃,气体通过铁管时,发生腐蚀反应(X):
反应X:
下列分析不正确的是( )。
A.降低反应温度,可减缓反应X的速率
B.在气体中加入一定量能起到防护铁管的作用
C.反应X的可通过如下反应获得:
D.T℃时,若气体混合物中,铁管被腐蚀
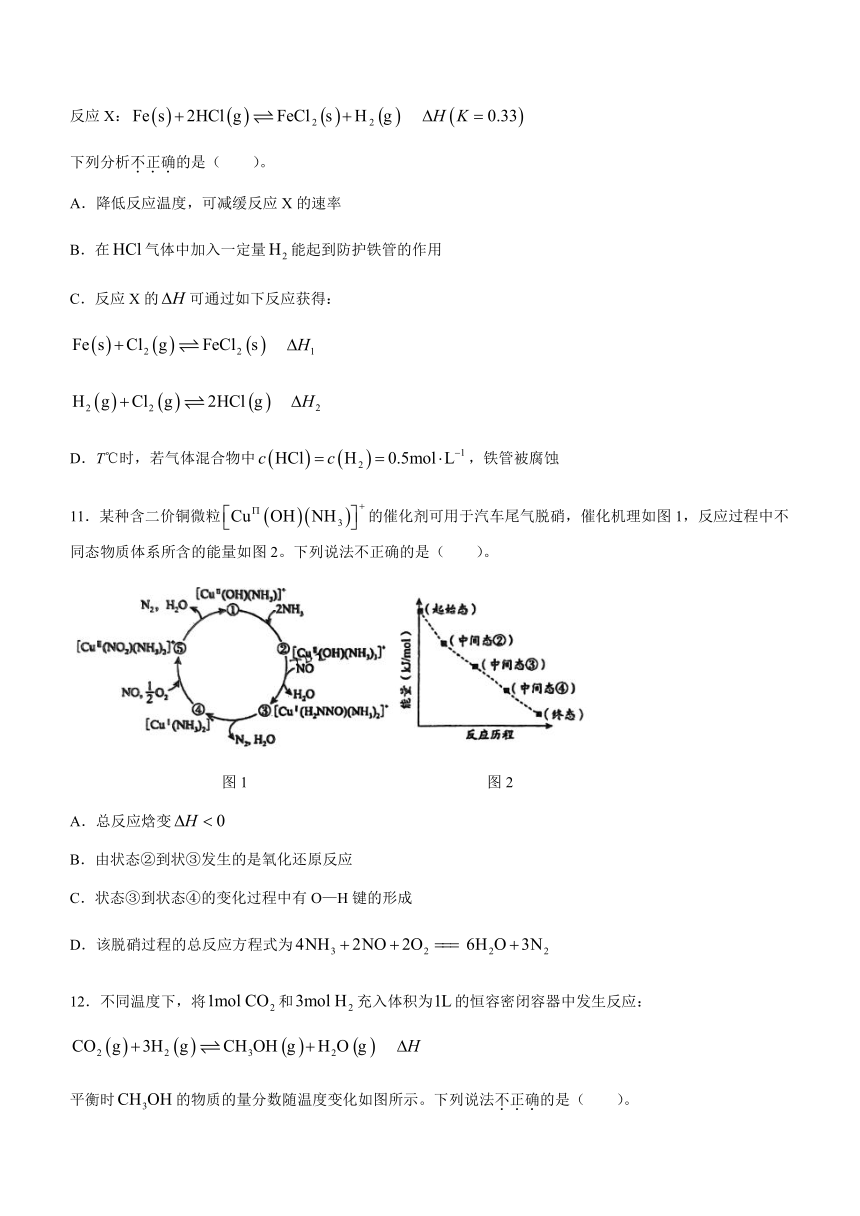
11.某种含二价铜微粒的催化剂可用于汽车尾气脱硝,催化机理如图1,反应过程中不同态物质体系所含的能量如图2。下列说法不正确的是( )。
图1 图2
A.总反应焓变
B.由状态②到状③发生的是氧化还原反应
C.状态③到状态④的变化过程中有O—H键的形成
D.该脱硝过程的总反应方程式为
12.不同温度下,将和充入体积为的恒容密闭容器中发生反应:
平衡时的物质的量分数随温度变化如图所示。下列说法不正确的是( )。
A.该反应的
B.240℃时,该反应的化学平衡常数
C.240℃时,若充入和,平衡时的物质的量分数大于25%
D.240℃时,若起始时充入、、、,反应向正反应方向进行
13.电离常数是研究电解质在水溶液中的行为的重要工具。现有HX、和三种酸,各酸及其盐之间不发生氧化还原反应,它们的电离常数如下表所示。
酸 电离常数(25℃)
HX
下列说法正确的是( )。
A.三种酸的强弱关系:
B.电离的方程式为:
C.溶液与过量HX反应的离子方程式:
D.25℃时,浓度均为的和溶液的pH:
14.某小组同学欲通过实验探究影响金属与酸反应速率的因素,进行下列实验。
实验装置 序号 实验操作 实验现象
实验1 取下胶塞,放入一小片验金属钠,迅速塞上胶塞 钠浮在液面上并来回移动,表面出现有白色固体;白色固体逐渐沉到烧杯底部,液体不沸腾;气球迅速鼓起,时测量气球直径约为
实验2 取下胶塞,放入与钠表面积基本相同的镁条,迅速塞上胶塞 镁条开始时下沉,很快上浮至液面,片刻后液体呈沸腾状,同时产生大量白雾;气球迅速鼓起,时测量气球直径约为
下列说法不正确的是( )。
A.实验1获得的白色小颗粒可用焰色反应检验其中的Na元素
B.对比实验1与实验2,能说明同温下的溶解度比的小
C.对比实验1与实验2,不能说明钠比镁的金属活动性强
D.金属钠、镁与盐酸反应的速率与生成物状态等因素有关
Ⅱ卷 非选择题(共44分)
15.(共23分)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
(1)反应Ⅰ:
反应Ⅲ:
反应Ⅱ的热化学方程式:__________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,在平衡体系中物质的量分数随温度的变化关系如图所示。
______(填“>”或“<”),得出该结论的理由是__________。
(3)可以作为水溶液中歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
ⅰ.
ⅱ.__________===__________+__________
(4)探究ⅰ、ⅱ反应速率与歧化反应速率的关系,实验如下:分别将饱和溶液加入到下列试剂中,密闭放置观察现象。(已知:易溶解在KI溶液中)
序号 A B C D
试剂组成
实验现象 溶液变黄,一段时间后出现浑浊 溶液变黄,出现浑浊较A快 无明显现象 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快
①B是A的对比实验,则__________。
②比较A、B、C,可得出的结论是__________。
③实验表明,的歧化反应速率D>A,结合ⅰ、ⅱ反应速率解释原因:__________。
16.(共21分)某实验小组在验证氧化时发现异常现象,并对其进行深入探究。
实验Ⅰ:
装置与操作 现象
逐滴滴加溶液 溶液立即变红,继续滴加溶液,红色变浅并逐渐褪去
(1)实验Ⅰ中溶液变红是因为与发生了反应,其离子方程式是__________。
(2)探究实验Ⅰ中红色褪去的原因:取反应后溶液,__________(填实验操作和现象),证明溶液中有,而几乎无。
(3)研究发现,酸性溶液中能氧化,但反应很慢且无明显现象,而实验1中褪色相对较快,由此推测能加快与的反应。通过实验Ⅱ和Ⅲ得到了证实。参照实验Ⅱ的图例,在虛线框内补全实验Ⅲ。
实验Ⅱ:
实验Ⅲ:
(4)查阅资料:加快与反应的主要机理如下:
ⅰ.
ⅱ.
ⅲ.·OH(羟基自由基)具有强氧化性,能直接氧化。
为探究对与反应速率的影响,设计实验如下:
实验Ⅳ:
①。对比实验Ⅳ和Ⅱ得出结论:在本实验条件下,__________。
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验Ⅰ中溶液先变红后褪色的原因:__________。
③实验Ⅰ~Ⅳ中均有生成,小组同学推测可能是与溶液中其他微粒相互作用生成的,这些微粒有__________。
北京101中学2023-2024学年高二上学期统练一
参考答案
2023年9月20日
Ⅰ卷 选择题(共56分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14
B A C C A D D C D D D B C B
Ⅱ卷 非选择题(共44分)
评分标准,除特殊标明外,每空4分
15.(共23分)
(1)
(2)>(2分)
反应Ⅱ是气体物质的量减小的反应,温度一定时,增大压强使反应正向移动,的物质的量增大,体系总物质的量减小,的物质的量分数增大
(3) (3分)
(4)①0.4(2分)
②是歧化反应的催化剂,单独存在时不具有催化作用,但可以加快歧化反应速率
③反应ⅱ比ⅰ快;D中由反应ⅱ产生的使反应ⅰ加快
16.(共21分)
(1)(3分)
(2)滴加溶液,溶液变红(3分)
(3)
(4)①也能加速与的反应,且效果比更好
②刚滴入时,ⅱ反应速率快,生成的迅速与结合,溶液立即变红;
继续滴加,升高,加快·OH氧化,使得降低,
平衡逆向移动,红色褪去
③·OH、、(3分)
化学
2023年9月20日
友情提示:
本试卷分为Ⅰ卷、Ⅱ卷两部分,共16道小题,共8页,满分100分;答题时间为50分钟;请将答案写在答题纸上。
Ⅰ卷 选择题(共56分)
(共14道小题,每小题只有一个选项符合题意,每小题4分。)
1.下列物质的应用与氧化还原反应无关的是( )。
A.呼吸面具中用过氧化钠作供氧剂
B.面团中加入小苏打,蒸出的馒头疏松多孔
C.葡萄糖在人体内代谢,可为生命活动提供能量
D.维生素C能促进补铁剂(有效成分)的吸收
2.用下列仪器或装置进行相应实验,能达到实验目的的是( )。
A.除去中的少量 B.配制一定物质的量浓度的硫酸溶液 C.制取氨气 D.检验淀粉水解生成了葡萄糖
3.在两个密闭的锥形瓶中,形状相同的镁条(过量)分别与的盐酸和醋酸反应,测得容器内压强随时间的变化曲线如下图。下列说法正确的是( )。
A.①代表的是盐酸与镁条反应时容器内压强随时间的变化曲线
B.任意相同时间段内,盐酸与Mg反应的化学反应速率均快于醋酸与Mg反应的化学反应速率
C.反应中醋酸的电离被促进,两种溶液最终产生的氢气总量基本相等
D.溶液完全中和上述两种酸溶液,盐酸消耗溶液的体积更大
4.下列实验事实不能用平衡移动原理解释的是( )。
A. 将球浸泡在冷水和热水中 B. t/℃25501001.015.4755.0
C. D. c(氨水)0.10.01pH11.110.6
5.的转化一直是世界范围内的研究热点。利用两种金属催化剂,在水溶液体系中将分别转化为CO和的反应过程示意图如下:
下列说法正确的是( )。
A.在转化为CO的路径中,只涉及碳氧键的断裂和氧氢键的形成
B.在转化为两种产物的过程中碳、氧原子的利用率均为100%
C.在转化为的路径中,被氧化为
D.上述反应过程说明催化剂具有选择性
6.一定温度下,在2个容积均为的恒容密闭容器中,加入一定量的反应物,发生反应: ,相关数据见下表。
容器编号 温度/℃ 起始物质的量/mol 平衡物质的量/mol
Ⅰ 0.2 0.2 0.1
Ⅱ 0.2 0.2 0.12
下列说法不正确的是( )。
A.
B.Ⅰ中反应达到平衡时,CO的转化率为50%
C.达到平衡所需要的时间:Ⅱ>Ⅰ
D.对于Ⅰ,平衡后向容器中再充入和,平衡正向移动
7.某MOFs多孔材料孔径大小和形状恰好将“固定”,能高选择性吸。废气中的被吸附后,经处理能全部转化为。原理示意图如下。
已知: 。下列说法不正确的是( )。
A.温度升高时不利于吸附
B.多孔材料“固定”,促进平衡正向移动
C.转化为的反应是:
D.每获得时,转移电子的数目为
8.向密闭容器中充入,发生反应: ,达到平衡状态。该反应经过以下两步基元反应完成:
ⅰ.
ⅱ.
下列分析不正确的是( )。
A.、
B.
C.恒温时,缩小体积,气体颜色变深,是平衡正向移动导致的
D.恒容时,升高温度,气体颜色加深,同时电子发生了转移
9.溶液中存在平衡:(橙色)(黄色)。用溶液进行下列实验:
结合实验,下列说法不正确的是( )。
A.①中溶液橙色加深,③中溶液变黄
B.②中被还原
C.对比②和④可知酸性溶液氧化性强
D.若向④中加入70%溶液至过量,溶液变为橙色
10.在T℃,气体通过铁管时,发生腐蚀反应(X):
反应X:
下列分析不正确的是( )。
A.降低反应温度,可减缓反应X的速率
B.在气体中加入一定量能起到防护铁管的作用
C.反应X的可通过如下反应获得:
D.T℃时,若气体混合物中,铁管被腐蚀
11.某种含二价铜微粒的催化剂可用于汽车尾气脱硝,催化机理如图1,反应过程中不同态物质体系所含的能量如图2。下列说法不正确的是( )。
图1 图2
A.总反应焓变
B.由状态②到状③发生的是氧化还原反应
C.状态③到状态④的变化过程中有O—H键的形成
D.该脱硝过程的总反应方程式为
12.不同温度下,将和充入体积为的恒容密闭容器中发生反应:
平衡时的物质的量分数随温度变化如图所示。下列说法不正确的是( )。
A.该反应的
B.240℃时,该反应的化学平衡常数
C.240℃时,若充入和,平衡时的物质的量分数大于25%
D.240℃时,若起始时充入、、、,反应向正反应方向进行
13.电离常数是研究电解质在水溶液中的行为的重要工具。现有HX、和三种酸,各酸及其盐之间不发生氧化还原反应,它们的电离常数如下表所示。
酸 电离常数(25℃)
HX
下列说法正确的是( )。
A.三种酸的强弱关系:
B.电离的方程式为:
C.溶液与过量HX反应的离子方程式:
D.25℃时,浓度均为的和溶液的pH:
14.某小组同学欲通过实验探究影响金属与酸反应速率的因素,进行下列实验。
实验装置 序号 实验操作 实验现象
实验1 取下胶塞,放入一小片验金属钠,迅速塞上胶塞 钠浮在液面上并来回移动,表面出现有白色固体;白色固体逐渐沉到烧杯底部,液体不沸腾;气球迅速鼓起,时测量气球直径约为
实验2 取下胶塞,放入与钠表面积基本相同的镁条,迅速塞上胶塞 镁条开始时下沉,很快上浮至液面,片刻后液体呈沸腾状,同时产生大量白雾;气球迅速鼓起,时测量气球直径约为
下列说法不正确的是( )。
A.实验1获得的白色小颗粒可用焰色反应检验其中的Na元素
B.对比实验1与实验2,能说明同温下的溶解度比的小
C.对比实验1与实验2,不能说明钠比镁的金属活动性强
D.金属钠、镁与盐酸反应的速率与生成物状态等因素有关
Ⅱ卷 非选择题(共44分)
15.(共23分)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
(1)反应Ⅰ:
反应Ⅲ:
反应Ⅱ的热化学方程式:__________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,在平衡体系中物质的量分数随温度的变化关系如图所示。
______(填“>”或“<”),得出该结论的理由是__________。
(3)可以作为水溶液中歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
ⅰ.
ⅱ.__________===__________+__________
(4)探究ⅰ、ⅱ反应速率与歧化反应速率的关系,实验如下:分别将饱和溶液加入到下列试剂中,密闭放置观察现象。(已知:易溶解在KI溶液中)
序号 A B C D
试剂组成
实验现象 溶液变黄,一段时间后出现浑浊 溶液变黄,出现浑浊较A快 无明显现象 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快
①B是A的对比实验,则__________。
②比较A、B、C,可得出的结论是__________。
③实验表明,的歧化反应速率D>A,结合ⅰ、ⅱ反应速率解释原因:__________。
16.(共21分)某实验小组在验证氧化时发现异常现象,并对其进行深入探究。
实验Ⅰ:
装置与操作 现象
逐滴滴加溶液 溶液立即变红,继续滴加溶液,红色变浅并逐渐褪去
(1)实验Ⅰ中溶液变红是因为与发生了反应,其离子方程式是__________。
(2)探究实验Ⅰ中红色褪去的原因:取反应后溶液,__________(填实验操作和现象),证明溶液中有,而几乎无。
(3)研究发现,酸性溶液中能氧化,但反应很慢且无明显现象,而实验1中褪色相对较快,由此推测能加快与的反应。通过实验Ⅱ和Ⅲ得到了证实。参照实验Ⅱ的图例,在虛线框内补全实验Ⅲ。
实验Ⅱ:
实验Ⅲ:
(4)查阅资料:加快与反应的主要机理如下:
ⅰ.
ⅱ.
ⅲ.·OH(羟基自由基)具有强氧化性,能直接氧化。
为探究对与反应速率的影响,设计实验如下:
实验Ⅳ:
①。对比实验Ⅳ和Ⅱ得出结论:在本实验条件下,__________。
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验Ⅰ中溶液先变红后褪色的原因:__________。
③实验Ⅰ~Ⅳ中均有生成,小组同学推测可能是与溶液中其他微粒相互作用生成的,这些微粒有__________。
北京101中学2023-2024学年高二上学期统练一
参考答案
2023年9月20日
Ⅰ卷 选择题(共56分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14
B A C C A D D C D D D B C B
Ⅱ卷 非选择题(共44分)
评分标准,除特殊标明外,每空4分
15.(共23分)
(1)
(2)>(2分)
反应Ⅱ是气体物质的量减小的反应,温度一定时,增大压强使反应正向移动,的物质的量增大,体系总物质的量减小,的物质的量分数增大
(3) (3分)
(4)①0.4(2分)
②是歧化反应的催化剂,单独存在时不具有催化作用,但可以加快歧化反应速率
③反应ⅱ比ⅰ快;D中由反应ⅱ产生的使反应ⅰ加快
16.(共21分)
(1)(3分)
(2)滴加溶液,溶液变红(3分)
(3)
(4)①也能加速与的反应,且效果比更好
②刚滴入时,ⅱ反应速率快,生成的迅速与结合,溶液立即变红;
继续滴加,升高,加快·OH氧化,使得降低,
平衡逆向移动,红色褪去
③·OH、、(3分)
同课章节目录
