1.3.4 氧化还原反应方程式配平课件(共18张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.4 氧化还原反应方程式配平课件(共18张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-04 08:18:35 | ||
图片预览





文档简介
(共18张PPT)
第三节 氧化还原反应
第四课时
氧化还原反应方程式的配平
第一章 物质及其变化
1.氧化还原方程式的配平原则
(1)电子守恒:
氧化剂得电子总数等于还原剂失电子总数
化合价降低总数等于化合价升高总数确定。
(2)原子守恒:
根据质量守恒,反应前后原子的种类和个数不变。
(3)电荷守恒:
对于离子方程式,反应前后,阴、阳离子所带的
负、正电荷的代数和相等。
氧化还原反应方程式配平
教师点拨:20分钟
升4
降1
最小公倍数为4
1
(1)标价态:写化学式,标出变价元素化合价(找一升一降)
4
(2)列变化:标出反应前后元素化合价的变化
(3)依据等升降 配系数
求升、降总数的最小公倍数,乘数作为配平系数
(4)配其它物质:观察法,依据原子守恒配其它物质的化学计量系数
4
1
2
N守恒,配NO2
C守恒,配CO2
H守恒,配H2O
检查氧守恒
(5)查守恒 :左右两边电荷守恒、原子守恒
改单线为等号,注条件
氧化还原反应方程式的配平步骤
0 +5 +4 +4
①标价态 ②列变化 ③等升降 ④配系数 ⑤查守恒
升2
降3
最小公倍数为6
3
3
2
2
N没变价
非氧化还原部分
N全变价
氧化还原部分
等升降配的是氧化还原部分 (变价的N)
N守恒 配HNO3的系数还要加上未变价的N
升2
降3
3
2
3
8
4
4
配平技巧:尽量找完全变价的
↑
↑
正向配平类 (从等式左边配)
0 +5 +2+5 +2
8
0 +5 +2+5 +2
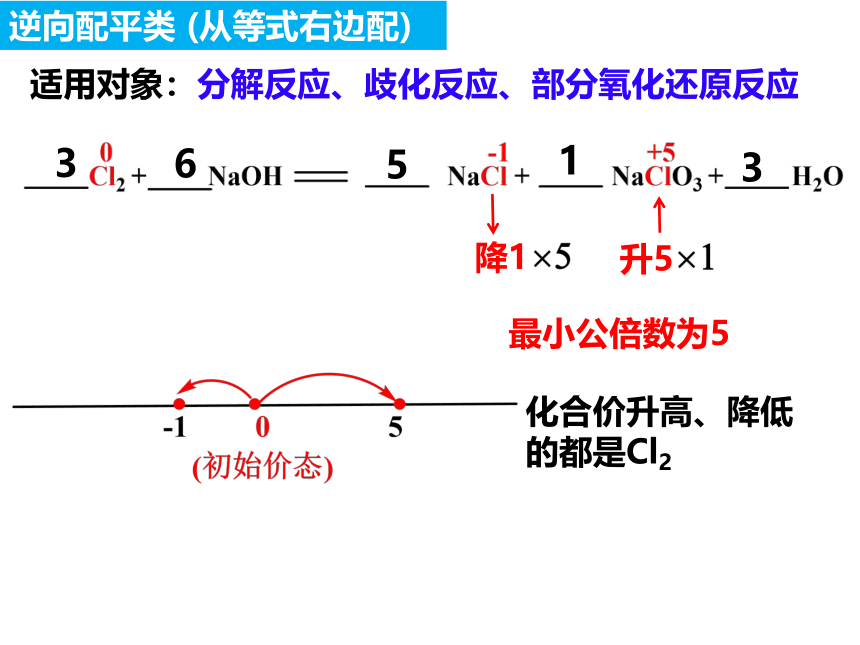
适用对象:分解反应、歧化反应、部分氧化还原反应
化合价升高、降低的都是Cl2
降1
升5
最小公倍数为5
5
1
6
3
3
逆向配平类 (从等式右边配)
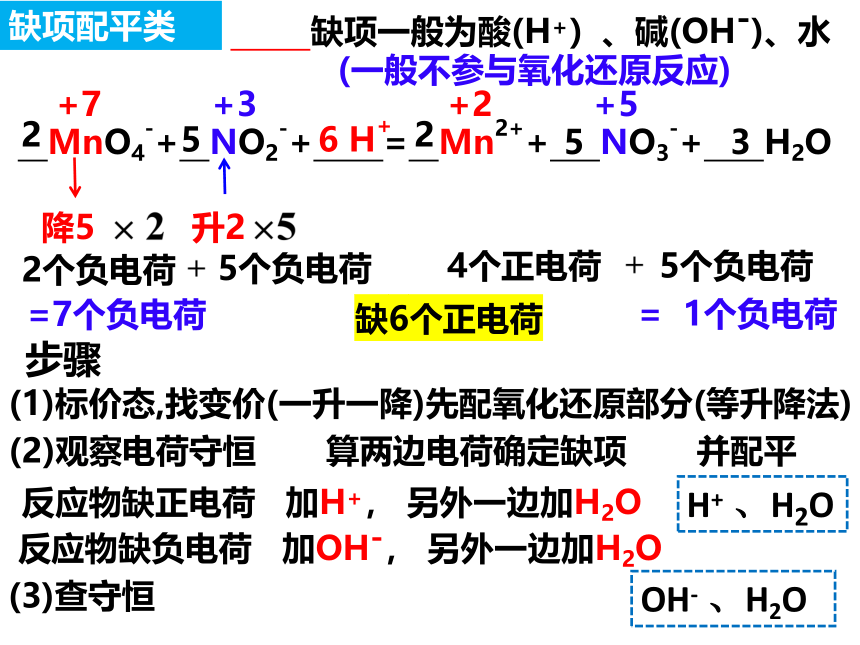
MnO4-+ NO2-+ = Mn2++ NO3-+ H2O
缺项一般为酸(H+)、碱(OH-)、水
(一般不参与氧化还原反应)
步骤
(1)标价态,找变价(一升一降)先配氧化还原部分(等升降法)
(2)观察电荷守恒 算两边电荷确定缺项 并配平
反应物缺正电荷 加H+, 另外一边加H2O
反应物缺负电荷 加OH-, 另外一边加H2O
降5
升2
2
5
2
5
2个负电荷
5个负电荷
4个正电荷
5个负电荷
= 1个负电荷
=7个负电荷
缺6个正电荷
6 H+
3
H+ 、H2O
OH- 、H2O
(3)查守恒
缺项配平类
+7 +3 +2 +5
3
5
6
3
1
逆向配平类
1
4
1
1
2
1
3
10
3
5
实战演练
根据下列各组信息,完成有关问题:(1)根据反应
Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O,
回答下列问题:①还原产物是________。②未被还原的硝酸与参加反应的总硝酸的质量之比为________。
NO2
1:2
实战演练
(2)氢能是一种极具发展潜力的清洁能源,以太阳能为热源,热化学硫碳循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示:
反应Ⅰ的化学方程式:___________________________________
SO2+I2+2H2O=H2SO4+2HI
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子程式______________________________________________。
②每生成1个转移________个电子,若反应过程中转移了3个电子,则生产________个还原产物。
3
1.5
常用的消毒剂有双氧水、医用酒精以及含氯消毒剂。其中含氯消毒剂的家族最庞大、应用最广泛。实验室制备Cl2有三种常用方法:
a.MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
b.KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O
c.KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
(1)写出反应a对应的离子方程式:
_____________________________________________。
(2)配平反应b的方程式。
KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(3)当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是________反应(填“a”“b”“c”下同);当得到等质量的Cl2时,消耗HCl的质量最多的是________反应。
常用的消毒剂有双氧水、医用酒精以及含氯消毒剂。其中含氯消毒剂的家族最庞大、应用最广泛。实验室制备Cl2有三种常用方法:
a.MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
b.KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O
c.KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
c
a
1.反应3NO2+H2O===2HNO3+NO中,当有2e-转移时,被氧化的物质与被还原的物质的个数比是( )
A.1∶1 B.2∶1
C.1∶2 D.3∶1
B
2.某已经配平的氧化还原反应=2X2++5Z2+8H2O,有关m和X元素的化合价取值合理的是( )
A.7,+5 B.4,+7
C.4,+6 D.3,+5
B
由电荷守恒
16-10-2n=4,则n=1
由得失电子总数相等可得
10=2(x-2),则x=+7
实战演练
3.若锌与稀硝酸反应时,其反应的化学方程式为4Zn+10HNO3=aZn(NO3)2+bM+cH2O,则a、b、c、M可能分别为( )
A.4、5、5、NO2↑
B.4、2、4、NO2↑
C.4、1、3、NH4NO3
D.4、3、5、NO↑
C
实战演练
4.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650 mg/L。现用氯氧化法处理,发生如下反应(其中N均为-3价、O均为-2价):KCN+2KOH+Cl2=KOCN+2KCl+H2O。该反应中,被氧化的元素是________,氧化产物是________。处理上述废水20.0 L,使KCN完全转化为KOCN,至少需氯气________g。
C
KOCN
14.2
+2
0
+4
-1
实战演练
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。
请用单线桥法标出电子转移方向和数目:
2KOCN+4KOH+3Cl2=2CO2↑+N2↑+6KCl+2H2O
-3
0
0
-1
第三节 氧化还原反应
第四课时
氧化还原反应方程式的配平
第一章 物质及其变化
1.氧化还原方程式的配平原则
(1)电子守恒:
氧化剂得电子总数等于还原剂失电子总数
化合价降低总数等于化合价升高总数确定。
(2)原子守恒:
根据质量守恒,反应前后原子的种类和个数不变。
(3)电荷守恒:
对于离子方程式,反应前后,阴、阳离子所带的
负、正电荷的代数和相等。
氧化还原反应方程式配平
教师点拨:20分钟
升4
降1
最小公倍数为4
1
(1)标价态:写化学式,标出变价元素化合价(找一升一降)
4
(2)列变化:标出反应前后元素化合价的变化
(3)依据等升降 配系数
求升、降总数的最小公倍数,乘数作为配平系数
(4)配其它物质:观察法,依据原子守恒配其它物质的化学计量系数
4
1
2
N守恒,配NO2
C守恒,配CO2
H守恒,配H2O
检查氧守恒
(5)查守恒 :左右两边电荷守恒、原子守恒
改单线为等号,注条件
氧化还原反应方程式的配平步骤
0 +5 +4 +4
①标价态 ②列变化 ③等升降 ④配系数 ⑤查守恒
升2
降3
最小公倍数为6
3
3
2
2
N没变价
非氧化还原部分
N全变价
氧化还原部分
等升降配的是氧化还原部分 (变价的N)
N守恒 配HNO3的系数还要加上未变价的N
升2
降3
3
2
3
8
4
4
配平技巧:尽量找完全变价的
↑
↑
正向配平类 (从等式左边配)
0 +5 +2+5 +2
8
0 +5 +2+5 +2
适用对象:分解反应、歧化反应、部分氧化还原反应
化合价升高、降低的都是Cl2
降1
升5
最小公倍数为5
5
1
6
3
3
逆向配平类 (从等式右边配)
MnO4-+ NO2-+ = Mn2++ NO3-+ H2O
缺项一般为酸(H+)、碱(OH-)、水
(一般不参与氧化还原反应)
步骤
(1)标价态,找变价(一升一降)先配氧化还原部分(等升降法)
(2)观察电荷守恒 算两边电荷确定缺项 并配平
反应物缺正电荷 加H+, 另外一边加H2O
反应物缺负电荷 加OH-, 另外一边加H2O
降5
升2
2
5
2
5
2个负电荷
5个负电荷
4个正电荷
5个负电荷
= 1个负电荷
=7个负电荷
缺6个正电荷
6 H+
3
H+ 、H2O
OH- 、H2O
(3)查守恒
缺项配平类
+7 +3 +2 +5
3
5
6
3
1
逆向配平类
1
4
1
1
2
1
3
10
3
5
实战演练
根据下列各组信息,完成有关问题:(1)根据反应
Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O,
回答下列问题:①还原产物是________。②未被还原的硝酸与参加反应的总硝酸的质量之比为________。
NO2
1:2
实战演练
(2)氢能是一种极具发展潜力的清洁能源,以太阳能为热源,热化学硫碳循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示:
反应Ⅰ的化学方程式:___________________________________
SO2+I2+2H2O=H2SO4+2HI
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子程式______________________________________________。
②每生成1个转移________个电子,若反应过程中转移了3个电子,则生产________个还原产物。
3
1.5
常用的消毒剂有双氧水、医用酒精以及含氯消毒剂。其中含氯消毒剂的家族最庞大、应用最广泛。实验室制备Cl2有三种常用方法:
a.MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
b.KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O
c.KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
(1)写出反应a对应的离子方程式:
_____________________________________________。
(2)配平反应b的方程式。
KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(3)当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是________反应(填“a”“b”“c”下同);当得到等质量的Cl2时,消耗HCl的质量最多的是________反应。
常用的消毒剂有双氧水、医用酒精以及含氯消毒剂。其中含氯消毒剂的家族最庞大、应用最广泛。实验室制备Cl2有三种常用方法:
a.MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
b.KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O
c.KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
c
a
1.反应3NO2+H2O===2HNO3+NO中,当有2e-转移时,被氧化的物质与被还原的物质的个数比是( )
A.1∶1 B.2∶1
C.1∶2 D.3∶1
B
2.某已经配平的氧化还原反应=2X2++5Z2+8H2O,有关m和X元素的化合价取值合理的是( )
A.7,+5 B.4,+7
C.4,+6 D.3,+5
B
由电荷守恒
16-10-2n=4,则n=1
由得失电子总数相等可得
10=2(x-2),则x=+7
实战演练
3.若锌与稀硝酸反应时,其反应的化学方程式为4Zn+10HNO3=aZn(NO3)2+bM+cH2O,则a、b、c、M可能分别为( )
A.4、5、5、NO2↑
B.4、2、4、NO2↑
C.4、1、3、NH4NO3
D.4、3、5、NO↑
C
实战演练
4.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650 mg/L。现用氯氧化法处理,发生如下反应(其中N均为-3价、O均为-2价):KCN+2KOH+Cl2=KOCN+2KCl+H2O。该反应中,被氧化的元素是________,氧化产物是________。处理上述废水20.0 L,使KCN完全转化为KOCN,至少需氯气________g。
C
KOCN
14.2
+2
0
+4
-1
实战演练
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。
请用单线桥法标出电子转移方向和数目:
2KOCN+4KOH+3Cl2=2CO2↑+N2↑+6KCl+2H2O
-3
0
0
-1
