人教版化学必修一第四章第一节原子结构与元素周期表(共54张ppt)
文档属性
| 名称 | 人教版化学必修一第四章第一节原子结构与元素周期表(共54张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 10.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-05 08:54:38 | ||
图片预览




文档简介
(共54张PPT)
第一节 原子结构与元素周期表
第1课时
第四章 物质结构 元素周期律
2
1
本节重点
本节难点
原子的构成
原子核外电子排布
原子结构的探索历程
1803年,道尔顿提出:构成物质的最小粒子是原子,原子是不可再分的实心球体。
1897年,汤姆生在原子内部发现了电子,人们终于抛弃了原子不可分割的陈旧观念。
1911年,卢瑟福通过精密的实验证明在原子中心有一个极小的核,电子绕核做高速旋转。
实心球模型
枣糕模型
行星有核模型
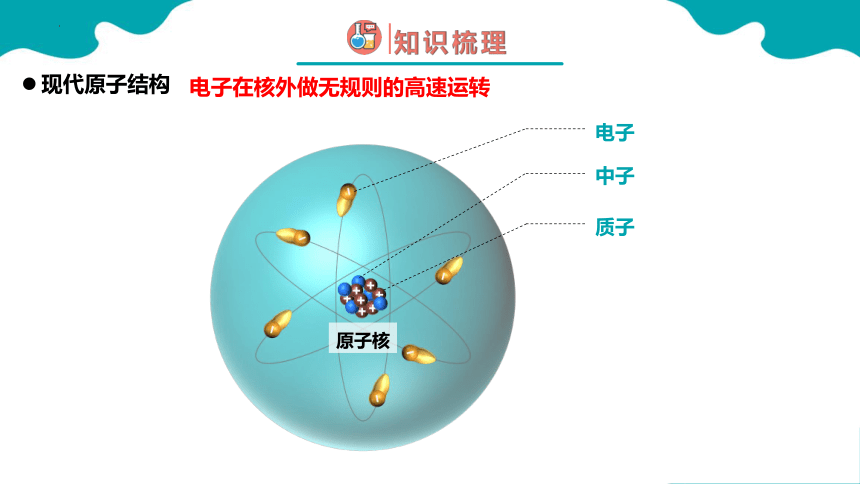
电子在核外做无规则的高速运转
现代原子结构
电子
中子
质子
原子核
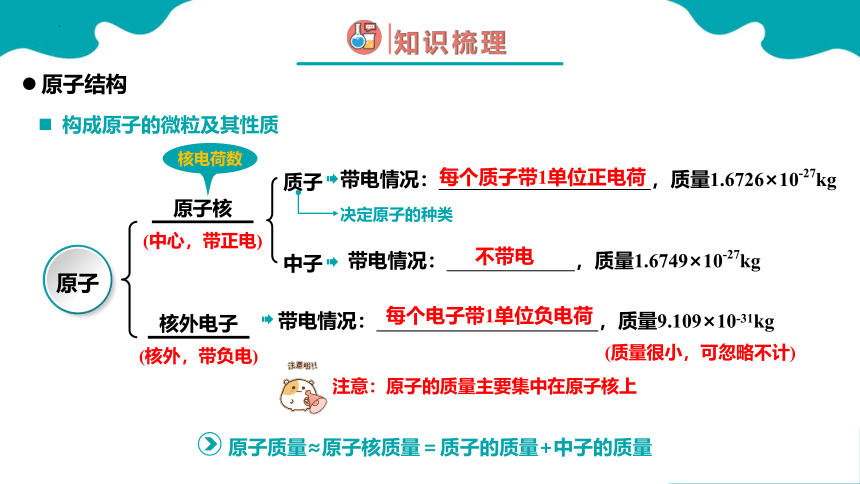
构成原子的微粒及其性质
原子结构
带电情况: ,质量1.6726×10-27kg
质子
中子
(中心,带正电)
(核外,带负电)
原子核
原子
核外电子
每个质子带1单位正电荷
不带电
每个电子带1单位负电荷
核电荷数
带电情况: ,质量1.6749×10-27kg
决定原子的种类
带电情况: ,质量9.109×10-31kg
(质量很小,可忽略不计)
原子质量≈原子核质量=质子的质量+中子的质量
注意:原子的质量主要集中在原子核上
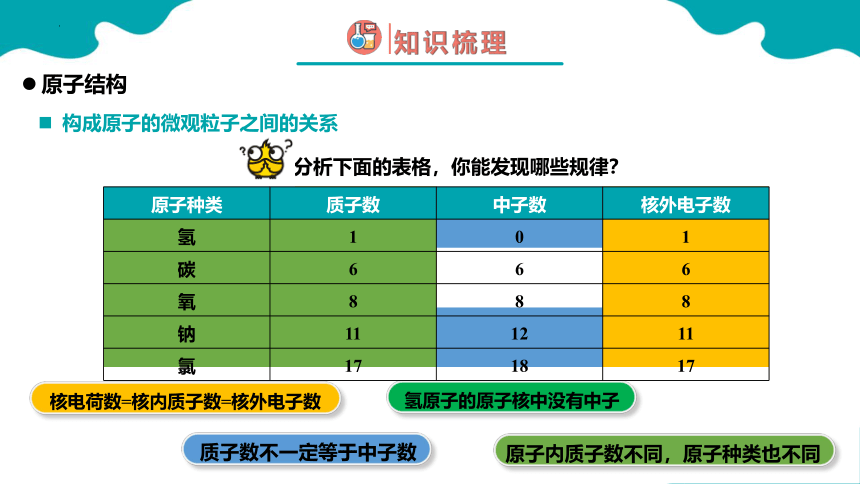
分析下面的表格,你能发现哪些规律?
核电荷数=核内质子数=核外电子数
质子数不一定等于中子数
氢原子的原子核中没有中子
原子内质子数不同,原子种类也不同
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
构成原子的微观粒子之间的关系
原子结构
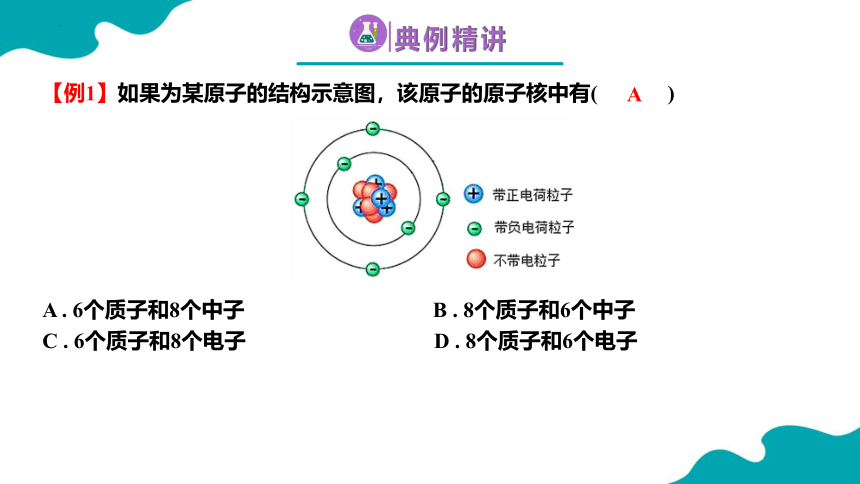
【例1】如果为某原子的结构示意图,该原子的原子核中有( )
A . 6个质子和8个中子 B . 8个质子和6个中子
C . 6个质子和8个电子 D . 8个质子和6个电子
A
结论:
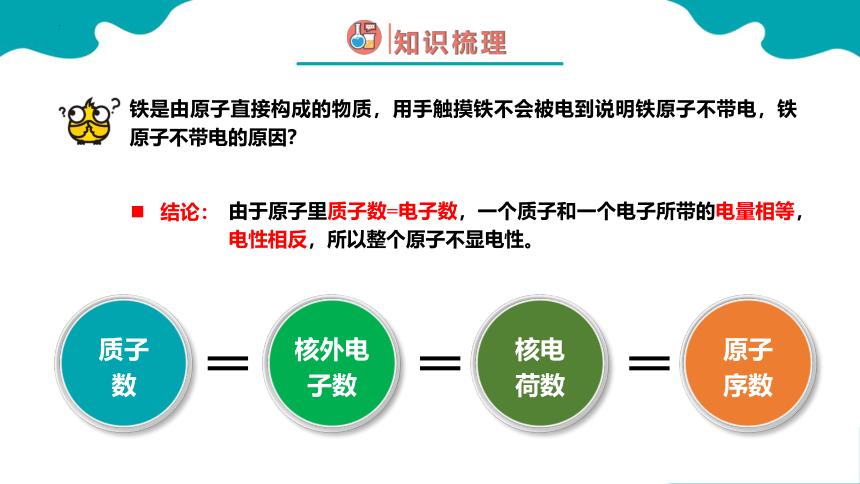
铁是由原子直接构成的物质,用手触摸铁不会被电到说明铁原子不带电,铁原子不带电的原因?
质子数
核电荷数
原子序数
核外电子数
由于原子里质子数=电子数,一个质子和一个电子所带的电量相等,电性相反,所以整个原子不显电性。
如果忽略电子的质量,质子、中子的相对质量分别取其近似整数值,那么,原子的相对质量在数值上与原子核内的质子数和中子数有什么关系?
质量数
相对原子质量≈质子数+中子数
将原子核内所有_____和_____的相对质量取近似___________,所得的数值叫做质量数,常用____表示
质子
中子
整数值相加
A
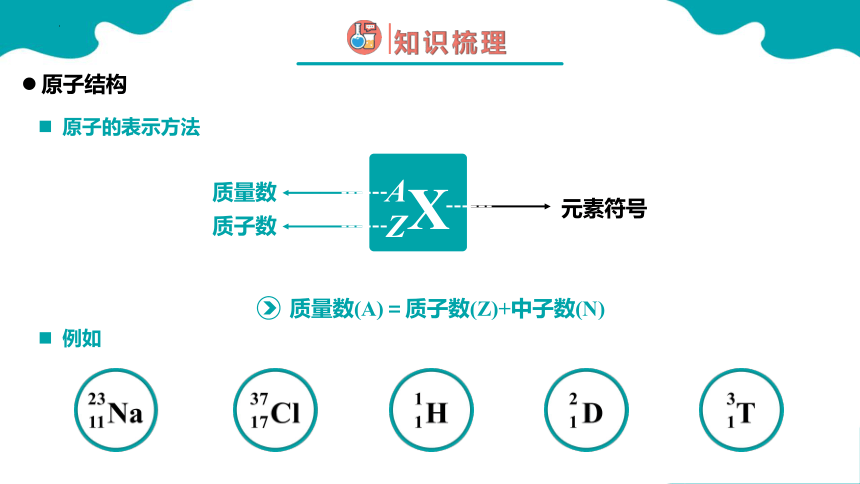
原子的表示方法
原子结构
X
Z
A
质量数
质子数
元素符号
质量数(A)=质子数(Z)+中子数(N)
例如
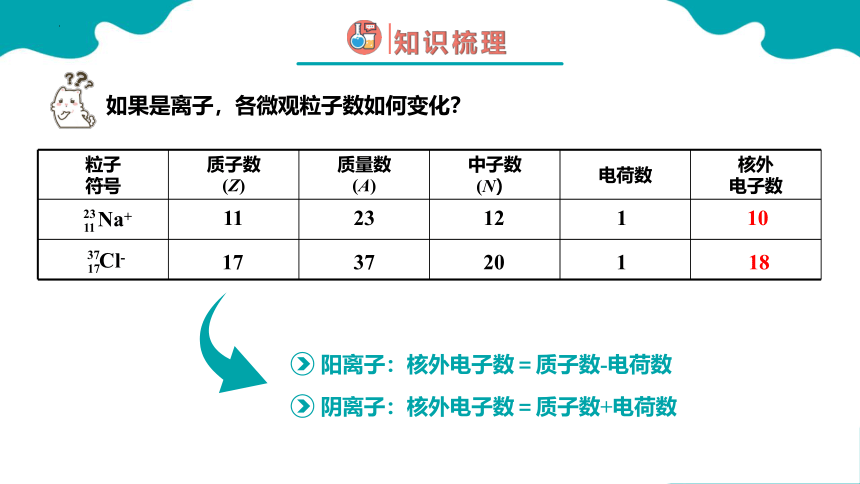
如果是离子,各微观粒子数如何变化?
粒子 符号 质子数 (Z) 质量数 (A) 中子数 (N) 电荷数 核外
电子数
Na+
11
23
Cl-
17
37
17
37
20
11
23
12
1
18
1
10
阳离子:核外电子数=质子数-电荷数
阴离子:核外电子数=质子数+电荷数
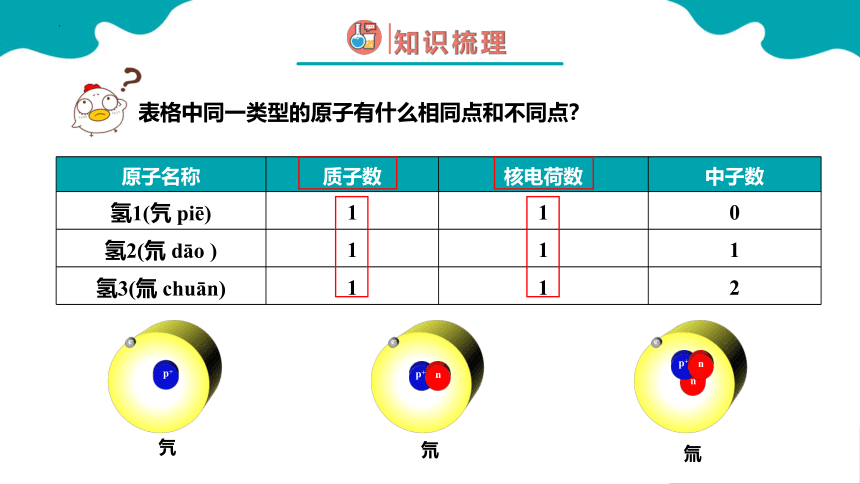
原子名称 质子数 核电荷数 中子数
氢1(氕 piē) 1 1 0
氢2(氘 dāo ) 1 1 1
氢3(氚 chuān) 1 1 2
表格中同一类型的原子有什么相同点和不同点?
氕
e-
p+
氘
e-
p+
n
氚
e-
p+
n
n
核素
原子结构
它们是同一种元素吗?为什么?
氕
e-
p+
氘
e-
p+
n
氚
e-
p+
n
n
元素是具有相同质子数(核电荷数)的一类原子的总称。
具有一定数目质子和一定数目中子的一种原子
元素
核素
核素
同位素
原子结构
质子数相同而中子数不同的同一元素的不同原子互称为同位素。
氕
e-
p+
氘
e-
p+
n
氚
e-
p+
n
n
定义:
即同一元素的不同核素互称为同位素
能源、农业、医疗、考古等方面都有重要应用。
同位素
原子结构
PART 1
氧元素
O
16
8
O
17
8
O
18
8
PART 2
碳元素
C
12
6
C
13
6
C
14
6
PART 3
铀元素
U
234
92
U
235
92
U
238
92
例如:
用途:
电子层模型示意图
原子核外电子排布
电子按照能量高低在核外分层进行运动能量低离核近,能量高离核远
核外电子的运动区域由内到外依次为第一至七层
电子的运动规律:
电子层:
不是真实存在的,只是为了研究方便假设的
N
M
L
K
原子核
电子层
原子核外电子排布
不同电子层的表示及能量关系
各电子层由内到外 电子层数 1 2 3 4 5 6 7
字母代号 ___ ___ ___ ___ ___ ___ ___
离核远近 由___到___ 能量高低 由___到___ K
L
M
N
O
P
Q
近
远
低
高
原子核外电子的排布
氧
镁
氯
钠
核外电子排布规律
电子总是尽可能先从_____排起,当一层_____后再填充下一层,即按K→L→M……顺序排列。
K层为最外层时最多容纳的电子数为___,除K层外,其他各层为最外层时,最多容纳的电子数为___。
K层为次外层时,所排电子数为___,除K层外,其他各层为次外层时,最多容纳的电子数为____。
内层
充满
2
8
2
18
核外电子排布的表示方法——原子结构示意图
原子核
核电荷数
电子层
各层上的电子数
原子核外电子排布
钠的原子结构示意图
画出氧原子、铝原子、氯原子的原子结构示意图
原子结构示意图
核外电子排布的表示方法——原子结构示意图
原子核外电子排布
【例1】观察1~18号元素的原子结构特点,并回答下列问题:
(1)最外层电子数为1的原子有___________;最外层电子数为2的原子有_____________。
(2)最外层电子数与次外层电子数相等的原子有________。
(3)最外层电子数是次外层电子数2倍的原子有____,3倍的原子有____。
H、Li、Na
He、Be、Mg
Be、Ar
C
O
【例1】观察1~18号元素的原子结构特点,并回答下列问题:
(4)次外层电子数是最外层电子数2倍的原子有______。
(5)电子层数与最外层电子数相等的原子有__________。
(6)最外层电子数是电子层数2倍的原子有__________。
Li、Si
H、Be、Al
He、C、S
简单离子中,质子数与核外电子数的关系
阳离子(Rm+) 质子数>电子数 质子数=电子数+m
阴离子(Rm-) 质子数<电子数 质子数=电子数-m
与Ne电子层结构相同的阳离子有:Na+、Mg2+、Al3+;阴离子有:F-、O2-、N3-等。
总结
原子核外电子排布
1911年,卢瑟福用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔,发现:
金箔散射实验
大多数α粒子能穿透金箔而不改变原来的运动方向;
一小部分α粒子改变了原来的运动方向;
有极少数α粒子被弹了回来。
原子不是一个实心球体
金的原子核带正电荷
金原子核的质量很大
1.在原子结构研究的历史中,提出“葡萄干面包式”原子结构模型的是( )
A.卢瑟福 B.道尔顿 C.玻尔 D.汤姆孙
D
2.下列说法中正确的是( )
A.在多电子的原子里,能量高的电子通常在离核近的区域内运动
B.核外电子总是先排在能量低的电子层上,例如只有M层排满后才排N层
C.某原子M层电子数为L层电子数的4倍
D.某离子的核电荷数与其最外层电子数相等
D
3.某元素原子的原子核外有三个电子层,最外层电子数是4。该原子核内的质子数是( )
A.14 B.15 C.16 D.17
A
4.某元素原子的最外层电子数是次外层的m倍(m为大于1的整数),则该原子的核外电子总数为( )
A.2m B.2m+10 C.2m+2 D.m+2
C
5.已知A、B、C三种元素的原子中,质子数为A(1)三种元素的元素符号:
A________;B________;C________。
(2)画出三种元素的原子结构示意图:
A________;B________;C_________。
C
Si
Cl
第一节
原子结构与元素周期表
第1课时
原子的构成
原子核外电子排布
原子结构的探索历程
构成原子的微粒及其性质
构成原子的微观粒子之间的关系
原子的表示方法
核素
同位素
电子的运动规律
电子层
不同电子层的表示及能量关系
核外电子排布的表示方法——原子结构示意图
第一节 原子结构与元素周期表
第2课时
第四章 物质结构 元素周期律
2
1
本节重、难点
元素周期表的发展历程
元素周期表的编排原则与结构
自118号元素发现之后,科学界一直在讨论一个问题,元素周期表第七周期已经被填满,是否证明所有化学元素已经被集齐?元素周期表到底有没有尽头?
斯维尔德罗夫市的工程师C·霍斯特,声称自己发现了一个新元素。经测验,其元素质量是氢元素的299倍,即原子量为299,很可能就是尚未出现的119号元素,经证实后,俄罗斯科学家宣布,他们已经找到了打开第八元素周期的钥匙——119号元素。
元素周期表的发展历程
元素周期表的编排原则与结构
1789 年,拉瓦锡曾运用分类比较法,撰写了世界第一部现代化学教科书《化学基本论述(Traité élémentaire de chimie)》,就当时他所确认的33 种元素(部分为单质和化合物)进行过分类研究,在这本书中他列出了世界第一个现代化学元素列表《Tableau des Substances simples》。
简单中性物质:光、热、氧、氮、氢
简单的非金属物质:硫、磷、碳、盐酸基、氢氟酸基、硼酸基
简单的金属物质:锑、银、铋、铜、钴、锰、汞、金、铂、铅、锌、锡、铁、钼、镍、钨
简单的碱性物质:石灰、镁土、铝土、钡土、硅土
元素周期表的发展历程
元素周期表的编排原则与结构
1829年,德国的德贝莱纳(Johann Wolfgang D bereiner,1780—1849)首先发表了“三元素组”的假说。他发现,在许多元素中分别存在着一组特别相似的三种元素,把这样的三元素称为“三兄弟元素组”。当时由于发现的元素只有54个,德贝莱纳的分类仅限于局部元素的分组,没能把所有元素作为一个整体来进行研究。但他对元素进行归纳分类的工作,对后人有一定的启发。
①锂、钠、钾
②钙、锶、钡
③卤素组(氯、溴、碘)
④硫、硒、碲
⑤锰、铬、铁
Li Na K
Cl Br I
S Se Te
Ca Sr Ba
Mn Cr Fe
三元素组
元素周期表的发展历程
元素周期表的编排原则与结构
1865 年,纽兰兹对元素的分类进行了另一番研究。他把元素按原子量大小顺序排列后,发现“从任何一个元素起,每隔8个元素就与第一个元素的性质相似”。这类似于八度音程,纽兰兹称其为“八音律”。
元素周期表的发展历程
元素周期表的编排原则与结构
1869 年2月,门捷列夫发表了他的第一张元素周期律图表,初步实现了元素的系统化和科学分类。该表包括了当时已发现的63 种元素,并大胆预言了3 种未知元素的存在,指出按照原子量排列起来的元素,在性质上呈现出明显的周期性。
门捷列夫第一张元素周期表
门捷列夫第二张元素周期表
仔细观察教材附加的元素周期表,你能发现什么规律?
1.每周期开头的是什么类型元素?靠近尾部的是什么类型元素?结尾又是什么类型的元素?
2.元素周期表上共有几个横行和几个纵行?共有几个周期和几个族?
3.每种元素符号前都有一个数字,这些数字叫做什么?它的排列有什么规律?
4.根据每种元素的图示,你能确定元素的哪些信息?
金属
元素周期表的起始:
稀有
气体
非金属
元素周期表
金属元素
非金属元素
稀有气体元素
周期序数 包含元素种类 起止元素
1 2
2 8
3 8
4 18
5 18
6 32
7 32
1H~2He
3Li~10Ne
11Na~18Ar
19K~36Kr
37Rb~54Xe
55Cs~86Rn
87Fr~118Og
元素周期表的起始:
元素周期表
把___________相同的元素,按_______________的顺序从左到右排列。
电子层数目
原子序数递增
元素周期表
元素周期表的编排原则
原子序数:
按照元素在周期表中的顺序给元素编的序号。
原子序数=
核电荷数=
核内质子数=
核外电子数
横行原则:
一层
二层
三层
元素周期表
元素周期表的编排原则
把不同横行中_____________相同的元素,按______________的顺序由上而下排列。
最外层电子数
电子层数递增
纵列原则:
原子序数:
按照元素在周期表中的顺序给元素编的序号。
原子序数=
核电荷数=
核内质子数=
核外电子数
【例1】科学家用钙离子撞击放射性元素锫(Bk),产生了质子数为117的超重元素Ts。Ts的原子结构示意图如下,试判断它在元素周期表中的位置。
第七周期,第VIIA族
元素周期表的结构
周期:
每一横行叫一周期,共7个周期。
元素周期表
7个周期
(7个横行)
短周期
第四、五、六、七周期,每周期所含元素的种类数分别是 :____、_____、_____ 、_____ 。
第一、二、三周期,每周期所含元素的种类数分别是:____、_____、_____。
长周期:
2
8
8
18
18
32
32
元素周期表的结构
族:
每一纵行叫一族。
元素周期表
个数 元素周期表中有___个纵列,共有____个族 特点 主族元素的族序数=_____________ 分类 主族 共有___个,包括第____________________________________族
副族 共有___个,包括第ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB族
Ⅷ族 包括第__________三个纵列
0族 占据元素周期表的第___纵列,最外层电子数为__(He为2)
18
16
最外层电子数
7
ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA
7
8、9、10
18
8
族 别名
第ⅠA族(除氢外) _______元素
第ⅦA族 _____元素
0族 稀有气体元素
碱金属
卤族
元素周期表的结构
族:
每一纵行叫一族。
元素周期表
常见族的别称
氧
16.00
8
O
元素周期表中元素的信息
原子序数
元素符号
核电荷数
核内质子数
核外电子数
元素周期表
相对原子质量
元素名称
元素周期表的意义
为寻找新元素提供了理论依据;
由于在元素周期表中位置越靠近的元素性质越相似,可以启发人们在元素周期表的一定的区域寻找新物质(如农药、催化剂、半导体材料等)。
学习和研究化学的重要工具;
元素周期表
不一定,可能是第ⅡA族,也可能是0族或副族元素。
ⅢB共32种元素。
第六周期ⅢB为镧系,共15种元素;第七周期ⅢB为锕系,共15种元素,比四、五周期多出14种元素。
请同学们认真思考,并回答下列问题:
最外层电子数是2的元素一定为第ⅡA族的元素吗?
问题1
在现行周期表中第四、五、六、七周期均有18列,为什么第四、五周期各有18种元素,而第六、七周期各有32种元素?
问题2
含有元素种类最多的族是哪一族?
问题3
第二、三周期差1,第四、五周期差11,原因是中间隔10格过渡元素,第六、七周期差25,原因是中间隔10格过渡元素,且ⅢB一格为15种元素。
同周期的第ⅡA、ⅢA元素间原子序数差值可能为多少?并说明原因。
问题4
各种元素周期表
塔式
螺旋时钟式
树式
层式
螺旋式
透视式
环式
放射式
三角形式
八角形
1.下列关于元素周期表的叙述正确的是( )
A.元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里
程碑之一
B.元素所在周期数等于它的电子层数,所在的族序数等于它的最外层电
子数
C.元素周期表有7个横行即7个周期,18个纵列即18个族
D.某种元素的相对原子质量取整数值,就是其原子序数
A
2.下列元素中,不属于主族元素的是( )
A.H B.He C.N D.Cl
B
3.元素周期表揭示了化学元素间的内在联系,下列有关元素周期表的说法不正确的是( )
A.俄国化学家门捷列夫编制了第一张元素周期表
B.周期表中最外层电子数相同的元素都排列在同一列中
C.周期表中一共有18列,但只有16个族
D.随着人们的认识发展,周期表也在不断地发展变化着
B
4.假设x是第ⅡB族中某元素的原子序数,那么原子序数为x+1的元素位于( )
A.第ⅠB族 B.第ⅢB族
C.第ⅢA族 D.第ⅡA族
C
5.某同学为1~18号元素设计了一种扇形图(如图),其实就是目前仍在使用的扇形周期表的一部分,下列有关说法不正确的是( )
A.每个小扇区就是长式周期表的一个族
B.此扇形周期表中只显示了三个周期
C.扇形周期表拆下扇子顶螺丝可以转换
为现行的长式周期表
D.扇形周期表考虑镧系和锕系应有九个周期
D
(1)写出A、B、C三种元素的名称_____、_____、_____。
(2)B位于元素周期表中第____周期_____族。
(3)C的原子结构示意图为________。
6.A、B、C为短周期元素,在周期表中所处的位置如表所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
A C
B
氮
硫
氟
三
ⅥA
7.如图所示是一种扇形元素周期表的一部分:
请对照现行周期表回答:
(1)写出编号①、②、⑤、⑦、⑧对应
元素的名称。
氢、钠、氧、硫、氯
(2)该扇形元素周期表的编排原则是什么?
与现行元素周期表类似,按扇形由内向外依次排列1~7周期元素,一周期为一层;不再划分族,将结构、性质类似元素从左向右排列,共18列。
第一节
原子结构与元素周期表
第2课时
元素周期表的起始
元素周期表的编排原则
元素周期表的发展历程
原子序数
横行原则
纵列原则
元素周期表的结构
周期:每一横行叫一周期,共7个周期
族:每一纵行叫一族
元素周期表中元素的信息
元素周期表的意义
THANKS
谢谢聆听
第一节 原子结构与元素周期表
第1课时
第四章 物质结构 元素周期律
2
1
本节重点
本节难点
原子的构成
原子核外电子排布
原子结构的探索历程
1803年,道尔顿提出:构成物质的最小粒子是原子,原子是不可再分的实心球体。
1897年,汤姆生在原子内部发现了电子,人们终于抛弃了原子不可分割的陈旧观念。
1911年,卢瑟福通过精密的实验证明在原子中心有一个极小的核,电子绕核做高速旋转。
实心球模型
枣糕模型
行星有核模型
电子在核外做无规则的高速运转
现代原子结构
电子
中子
质子
原子核
构成原子的微粒及其性质
原子结构
带电情况: ,质量1.6726×10-27kg
质子
中子
(中心,带正电)
(核外,带负电)
原子核
原子
核外电子
每个质子带1单位正电荷
不带电
每个电子带1单位负电荷
核电荷数
带电情况: ,质量1.6749×10-27kg
决定原子的种类
带电情况: ,质量9.109×10-31kg
(质量很小,可忽略不计)
原子质量≈原子核质量=质子的质量+中子的质量
注意:原子的质量主要集中在原子核上
分析下面的表格,你能发现哪些规律?
核电荷数=核内质子数=核外电子数
质子数不一定等于中子数
氢原子的原子核中没有中子
原子内质子数不同,原子种类也不同
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
构成原子的微观粒子之间的关系
原子结构
【例1】如果为某原子的结构示意图,该原子的原子核中有( )
A . 6个质子和8个中子 B . 8个质子和6个中子
C . 6个质子和8个电子 D . 8个质子和6个电子
A
结论:
铁是由原子直接构成的物质,用手触摸铁不会被电到说明铁原子不带电,铁原子不带电的原因?
质子数
核电荷数
原子序数
核外电子数
由于原子里质子数=电子数,一个质子和一个电子所带的电量相等,电性相反,所以整个原子不显电性。
如果忽略电子的质量,质子、中子的相对质量分别取其近似整数值,那么,原子的相对质量在数值上与原子核内的质子数和中子数有什么关系?
质量数
相对原子质量≈质子数+中子数
将原子核内所有_____和_____的相对质量取近似___________,所得的数值叫做质量数,常用____表示
质子
中子
整数值相加
A
原子的表示方法
原子结构
X
Z
A
质量数
质子数
元素符号
质量数(A)=质子数(Z)+中子数(N)
例如
如果是离子,各微观粒子数如何变化?
粒子 符号 质子数 (Z) 质量数 (A) 中子数 (N) 电荷数 核外
电子数
Na+
11
23
Cl-
17
37
17
37
20
11
23
12
1
18
1
10
阳离子:核外电子数=质子数-电荷数
阴离子:核外电子数=质子数+电荷数
原子名称 质子数 核电荷数 中子数
氢1(氕 piē) 1 1 0
氢2(氘 dāo ) 1 1 1
氢3(氚 chuān) 1 1 2
表格中同一类型的原子有什么相同点和不同点?
氕
e-
p+
氘
e-
p+
n
氚
e-
p+
n
n
核素
原子结构
它们是同一种元素吗?为什么?
氕
e-
p+
氘
e-
p+
n
氚
e-
p+
n
n
元素是具有相同质子数(核电荷数)的一类原子的总称。
具有一定数目质子和一定数目中子的一种原子
元素
核素
核素
同位素
原子结构
质子数相同而中子数不同的同一元素的不同原子互称为同位素。
氕
e-
p+
氘
e-
p+
n
氚
e-
p+
n
n
定义:
即同一元素的不同核素互称为同位素
能源、农业、医疗、考古等方面都有重要应用。
同位素
原子结构
PART 1
氧元素
O
16
8
O
17
8
O
18
8
PART 2
碳元素
C
12
6
C
13
6
C
14
6
PART 3
铀元素
U
234
92
U
235
92
U
238
92
例如:
用途:
电子层模型示意图
原子核外电子排布
电子按照能量高低在核外分层进行运动能量低离核近,能量高离核远
核外电子的运动区域由内到外依次为第一至七层
电子的运动规律:
电子层:
不是真实存在的,只是为了研究方便假设的
N
M
L
K
原子核
电子层
原子核外电子排布
不同电子层的表示及能量关系
各电子层由内到外 电子层数 1 2 3 4 5 6 7
字母代号 ___ ___ ___ ___ ___ ___ ___
离核远近 由___到___ 能量高低 由___到___ K
L
M
N
O
P
Q
近
远
低
高
原子核外电子的排布
氧
镁
氯
钠
核外电子排布规律
电子总是尽可能先从_____排起,当一层_____后再填充下一层,即按K→L→M……顺序排列。
K层为最外层时最多容纳的电子数为___,除K层外,其他各层为最外层时,最多容纳的电子数为___。
K层为次外层时,所排电子数为___,除K层外,其他各层为次外层时,最多容纳的电子数为____。
内层
充满
2
8
2
18
核外电子排布的表示方法——原子结构示意图
原子核
核电荷数
电子层
各层上的电子数
原子核外电子排布
钠的原子结构示意图
画出氧原子、铝原子、氯原子的原子结构示意图
原子结构示意图
核外电子排布的表示方法——原子结构示意图
原子核外电子排布
【例1】观察1~18号元素的原子结构特点,并回答下列问题:
(1)最外层电子数为1的原子有___________;最外层电子数为2的原子有_____________。
(2)最外层电子数与次外层电子数相等的原子有________。
(3)最外层电子数是次外层电子数2倍的原子有____,3倍的原子有____。
H、Li、Na
He、Be、Mg
Be、Ar
C
O
【例1】观察1~18号元素的原子结构特点,并回答下列问题:
(4)次外层电子数是最外层电子数2倍的原子有______。
(5)电子层数与最外层电子数相等的原子有__________。
(6)最外层电子数是电子层数2倍的原子有__________。
Li、Si
H、Be、Al
He、C、S
简单离子中,质子数与核外电子数的关系
阳离子(Rm+) 质子数>电子数 质子数=电子数+m
阴离子(Rm-) 质子数<电子数 质子数=电子数-m
与Ne电子层结构相同的阳离子有:Na+、Mg2+、Al3+;阴离子有:F-、O2-、N3-等。
总结
原子核外电子排布
1911年,卢瑟福用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔,发现:
金箔散射实验
大多数α粒子能穿透金箔而不改变原来的运动方向;
一小部分α粒子改变了原来的运动方向;
有极少数α粒子被弹了回来。
原子不是一个实心球体
金的原子核带正电荷
金原子核的质量很大
1.在原子结构研究的历史中,提出“葡萄干面包式”原子结构模型的是( )
A.卢瑟福 B.道尔顿 C.玻尔 D.汤姆孙
D
2.下列说法中正确的是( )
A.在多电子的原子里,能量高的电子通常在离核近的区域内运动
B.核外电子总是先排在能量低的电子层上,例如只有M层排满后才排N层
C.某原子M层电子数为L层电子数的4倍
D.某离子的核电荷数与其最外层电子数相等
D
3.某元素原子的原子核外有三个电子层,最外层电子数是4。该原子核内的质子数是( )
A.14 B.15 C.16 D.17
A
4.某元素原子的最外层电子数是次外层的m倍(m为大于1的整数),则该原子的核外电子总数为( )
A.2m B.2m+10 C.2m+2 D.m+2
C
5.已知A、B、C三种元素的原子中,质子数为A
A________;B________;C________。
(2)画出三种元素的原子结构示意图:
A________;B________;C_________。
C
Si
Cl
第一节
原子结构与元素周期表
第1课时
原子的构成
原子核外电子排布
原子结构的探索历程
构成原子的微粒及其性质
构成原子的微观粒子之间的关系
原子的表示方法
核素
同位素
电子的运动规律
电子层
不同电子层的表示及能量关系
核外电子排布的表示方法——原子结构示意图
第一节 原子结构与元素周期表
第2课时
第四章 物质结构 元素周期律
2
1
本节重、难点
元素周期表的发展历程
元素周期表的编排原则与结构
自118号元素发现之后,科学界一直在讨论一个问题,元素周期表第七周期已经被填满,是否证明所有化学元素已经被集齐?元素周期表到底有没有尽头?
斯维尔德罗夫市的工程师C·霍斯特,声称自己发现了一个新元素。经测验,其元素质量是氢元素的299倍,即原子量为299,很可能就是尚未出现的119号元素,经证实后,俄罗斯科学家宣布,他们已经找到了打开第八元素周期的钥匙——119号元素。
元素周期表的发展历程
元素周期表的编排原则与结构
1789 年,拉瓦锡曾运用分类比较法,撰写了世界第一部现代化学教科书《化学基本论述(Traité élémentaire de chimie)》,就当时他所确认的33 种元素(部分为单质和化合物)进行过分类研究,在这本书中他列出了世界第一个现代化学元素列表《Tableau des Substances simples》。
简单中性物质:光、热、氧、氮、氢
简单的非金属物质:硫、磷、碳、盐酸基、氢氟酸基、硼酸基
简单的金属物质:锑、银、铋、铜、钴、锰、汞、金、铂、铅、锌、锡、铁、钼、镍、钨
简单的碱性物质:石灰、镁土、铝土、钡土、硅土
元素周期表的发展历程
元素周期表的编排原则与结构
1829年,德国的德贝莱纳(Johann Wolfgang D bereiner,1780—1849)首先发表了“三元素组”的假说。他发现,在许多元素中分别存在着一组特别相似的三种元素,把这样的三元素称为“三兄弟元素组”。当时由于发现的元素只有54个,德贝莱纳的分类仅限于局部元素的分组,没能把所有元素作为一个整体来进行研究。但他对元素进行归纳分类的工作,对后人有一定的启发。
①锂、钠、钾
②钙、锶、钡
③卤素组(氯、溴、碘)
④硫、硒、碲
⑤锰、铬、铁
Li Na K
Cl Br I
S Se Te
Ca Sr Ba
Mn Cr Fe
三元素组
元素周期表的发展历程
元素周期表的编排原则与结构
1865 年,纽兰兹对元素的分类进行了另一番研究。他把元素按原子量大小顺序排列后,发现“从任何一个元素起,每隔8个元素就与第一个元素的性质相似”。这类似于八度音程,纽兰兹称其为“八音律”。
元素周期表的发展历程
元素周期表的编排原则与结构
1869 年2月,门捷列夫发表了他的第一张元素周期律图表,初步实现了元素的系统化和科学分类。该表包括了当时已发现的63 种元素,并大胆预言了3 种未知元素的存在,指出按照原子量排列起来的元素,在性质上呈现出明显的周期性。
门捷列夫第一张元素周期表
门捷列夫第二张元素周期表
仔细观察教材附加的元素周期表,你能发现什么规律?
1.每周期开头的是什么类型元素?靠近尾部的是什么类型元素?结尾又是什么类型的元素?
2.元素周期表上共有几个横行和几个纵行?共有几个周期和几个族?
3.每种元素符号前都有一个数字,这些数字叫做什么?它的排列有什么规律?
4.根据每种元素的图示,你能确定元素的哪些信息?
金属
元素周期表的起始:
稀有
气体
非金属
元素周期表
金属元素
非金属元素
稀有气体元素
周期序数 包含元素种类 起止元素
1 2
2 8
3 8
4 18
5 18
6 32
7 32
1H~2He
3Li~10Ne
11Na~18Ar
19K~36Kr
37Rb~54Xe
55Cs~86Rn
87Fr~118Og
元素周期表的起始:
元素周期表
把___________相同的元素,按_______________的顺序从左到右排列。
电子层数目
原子序数递增
元素周期表
元素周期表的编排原则
原子序数:
按照元素在周期表中的顺序给元素编的序号。
原子序数=
核电荷数=
核内质子数=
核外电子数
横行原则:
一层
二层
三层
元素周期表
元素周期表的编排原则
把不同横行中_____________相同的元素,按______________的顺序由上而下排列。
最外层电子数
电子层数递增
纵列原则:
原子序数:
按照元素在周期表中的顺序给元素编的序号。
原子序数=
核电荷数=
核内质子数=
核外电子数
【例1】科学家用钙离子撞击放射性元素锫(Bk),产生了质子数为117的超重元素Ts。Ts的原子结构示意图如下,试判断它在元素周期表中的位置。
第七周期,第VIIA族
元素周期表的结构
周期:
每一横行叫一周期,共7个周期。
元素周期表
7个周期
(7个横行)
短周期
第四、五、六、七周期,每周期所含元素的种类数分别是 :____、_____、_____ 、_____ 。
第一、二、三周期,每周期所含元素的种类数分别是:____、_____、_____。
长周期:
2
8
8
18
18
32
32
元素周期表的结构
族:
每一纵行叫一族。
元素周期表
个数 元素周期表中有___个纵列,共有____个族 特点 主族元素的族序数=_____________ 分类 主族 共有___个,包括第____________________________________族
副族 共有___个,包括第ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB族
Ⅷ族 包括第__________三个纵列
0族 占据元素周期表的第___纵列,最外层电子数为__(He为2)
18
16
最外层电子数
7
ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA
7
8、9、10
18
8
族 别名
第ⅠA族(除氢外) _______元素
第ⅦA族 _____元素
0族 稀有气体元素
碱金属
卤族
元素周期表的结构
族:
每一纵行叫一族。
元素周期表
常见族的别称
氧
16.00
8
O
元素周期表中元素的信息
原子序数
元素符号
核电荷数
核内质子数
核外电子数
元素周期表
相对原子质量
元素名称
元素周期表的意义
为寻找新元素提供了理论依据;
由于在元素周期表中位置越靠近的元素性质越相似,可以启发人们在元素周期表的一定的区域寻找新物质(如农药、催化剂、半导体材料等)。
学习和研究化学的重要工具;
元素周期表
不一定,可能是第ⅡA族,也可能是0族或副族元素。
ⅢB共32种元素。
第六周期ⅢB为镧系,共15种元素;第七周期ⅢB为锕系,共15种元素,比四、五周期多出14种元素。
请同学们认真思考,并回答下列问题:
最外层电子数是2的元素一定为第ⅡA族的元素吗?
问题1
在现行周期表中第四、五、六、七周期均有18列,为什么第四、五周期各有18种元素,而第六、七周期各有32种元素?
问题2
含有元素种类最多的族是哪一族?
问题3
第二、三周期差1,第四、五周期差11,原因是中间隔10格过渡元素,第六、七周期差25,原因是中间隔10格过渡元素,且ⅢB一格为15种元素。
同周期的第ⅡA、ⅢA元素间原子序数差值可能为多少?并说明原因。
问题4
各种元素周期表
塔式
螺旋时钟式
树式
层式
螺旋式
透视式
环式
放射式
三角形式
八角形
1.下列关于元素周期表的叙述正确的是( )
A.元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里
程碑之一
B.元素所在周期数等于它的电子层数,所在的族序数等于它的最外层电
子数
C.元素周期表有7个横行即7个周期,18个纵列即18个族
D.某种元素的相对原子质量取整数值,就是其原子序数
A
2.下列元素中,不属于主族元素的是( )
A.H B.He C.N D.Cl
B
3.元素周期表揭示了化学元素间的内在联系,下列有关元素周期表的说法不正确的是( )
A.俄国化学家门捷列夫编制了第一张元素周期表
B.周期表中最外层电子数相同的元素都排列在同一列中
C.周期表中一共有18列,但只有16个族
D.随着人们的认识发展,周期表也在不断地发展变化着
B
4.假设x是第ⅡB族中某元素的原子序数,那么原子序数为x+1的元素位于( )
A.第ⅠB族 B.第ⅢB族
C.第ⅢA族 D.第ⅡA族
C
5.某同学为1~18号元素设计了一种扇形图(如图),其实就是目前仍在使用的扇形周期表的一部分,下列有关说法不正确的是( )
A.每个小扇区就是长式周期表的一个族
B.此扇形周期表中只显示了三个周期
C.扇形周期表拆下扇子顶螺丝可以转换
为现行的长式周期表
D.扇形周期表考虑镧系和锕系应有九个周期
D
(1)写出A、B、C三种元素的名称_____、_____、_____。
(2)B位于元素周期表中第____周期_____族。
(3)C的原子结构示意图为________。
6.A、B、C为短周期元素,在周期表中所处的位置如表所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
A C
B
氮
硫
氟
三
ⅥA
7.如图所示是一种扇形元素周期表的一部分:
请对照现行周期表回答:
(1)写出编号①、②、⑤、⑦、⑧对应
元素的名称。
氢、钠、氧、硫、氯
(2)该扇形元素周期表的编排原则是什么?
与现行元素周期表类似,按扇形由内向外依次排列1~7周期元素,一周期为一层;不再划分族,将结构、性质类似元素从左向右排列,共18列。
第一节
原子结构与元素周期表
第2课时
元素周期表的起始
元素周期表的编排原则
元素周期表的发展历程
原子序数
横行原则
纵列原则
元素周期表的结构
周期:每一横行叫一周期,共7个周期
族:每一纵行叫一族
元素周期表中元素的信息
元素周期表的意义
THANKS
谢谢聆听
