人教版化学必修一第三章 铁 金属材料 第二节 金属材料 课件(共27张ppt)
文档属性
| 名称 | 人教版化学必修一第三章 铁 金属材料 第二节 金属材料 课件(共27张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 21.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-05 08:56:55 | ||
图片预览






文档简介
(共27张PPT)
第三章 铁 金属材料
第2课时
第二节 金属材料
铝和氧化铝的性质及转化
2
铝和铝合金
1
本节重点
本节难点
铝的化学性质比较活泼,为什么我们通常看见铁生锈而没有看到铝生锈?
铝锅
铁锅
铝和铝合金
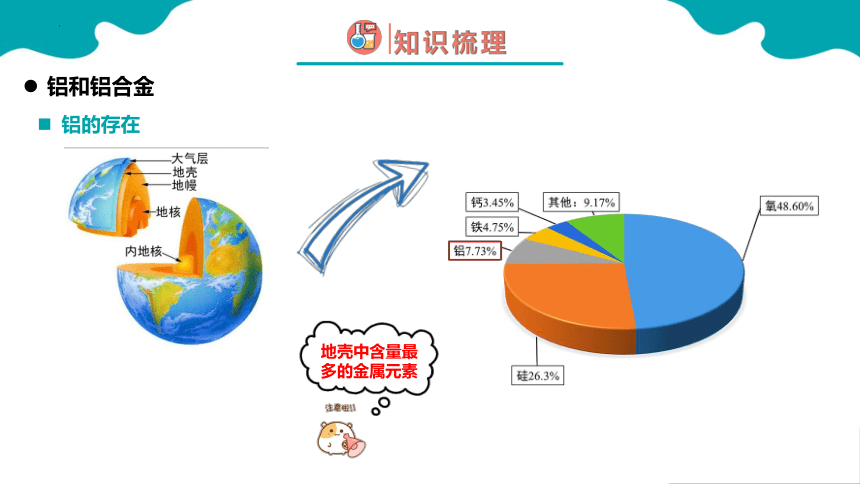
铝的存在
地壳中含量最多的金属元素
铝和铝合金
铝的物理性质
金属铝
常温下为固体
银白色金属
延展性好
质地软
具有金属光泽
是电和热的良导体
铝和铝合金
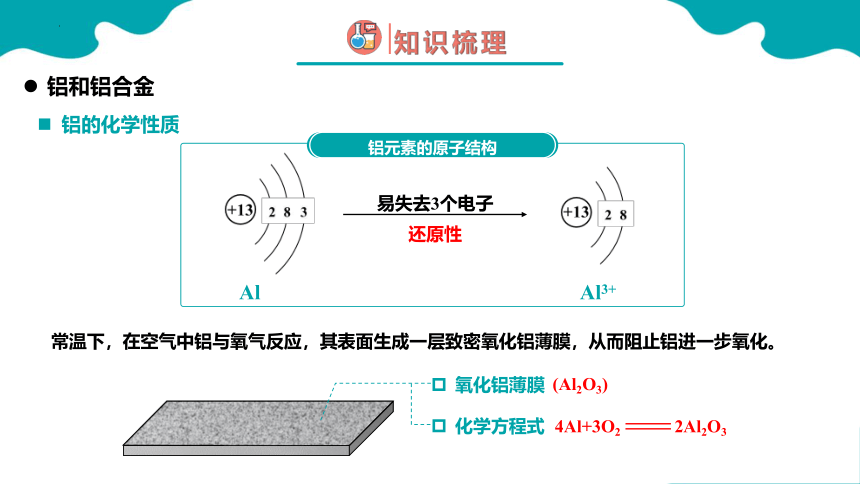
铝的化学性质
常温下,在空气中铝与氧气反应,其表面生成一层致密氧化铝薄膜,从而阻止铝进一步氧化。
4Al+3O2 2Al2O3
易失去3个电子
Al
Al3+
还原性
铝元素的原子结构
氧化铝薄膜
(Al2O3)
化学方程式
铝被氧化后在表明生成一层致密的氧化层,阻止铝继续被氧化,因此铝具有良好的抗腐蚀性。而铁被氧化后,在表面形成疏松多孔的铁锈,能吸收水分和二氧化碳以及氧气,加速内部铁的持续氧化。
铝的化学性质比较活泼,为什么我们通常看见铁生锈而没有看到铝生锈?
铝锅
铁锅
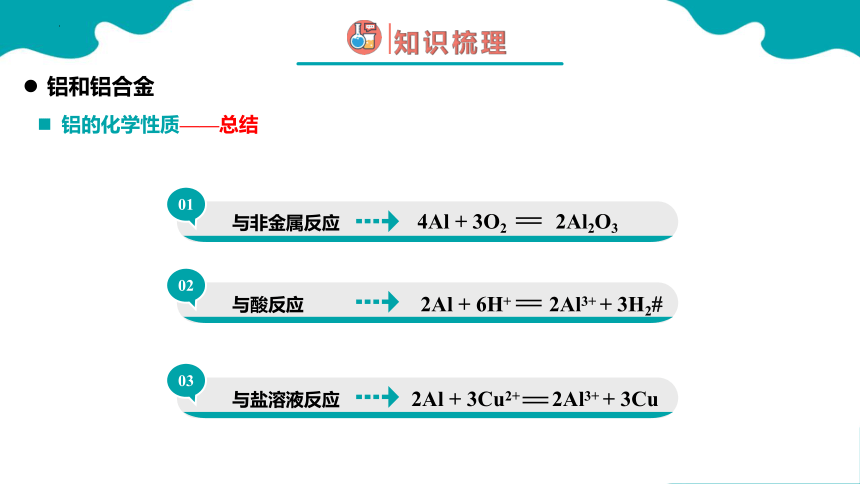
与非金属反应
01
铝和铝合金
铝的化学性质——总结
02
与酸反应
03
与盐溶液反应
2Al + 6H+ 2Al3+ + 3H2
4Al + 3O2 2Al2O3
2Al + 3Cu2+ 2Al3+ + 3Cu
铝制餐具为何不宜用来蒸煮或长时间存放酸性或碱性食品?
铝和铝合金
铝、氧化铝的性质——与酸反应
实验探究
探究:在一支试管中加入5mL盐酸,再向试管中放入一小块铝片。观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象
铝和铝合金
铝、氧化铝的性质——与酸反应
铝、氧化铝与稀盐酸反应
实验现象 开始不太明显,铝片_________,有无色气泡冒出,将点燃的木条放在试管口有_______
化学方程式
离子方程式
Al2O3+6HCl===2AlCl3+3H2O、2Al+6HCl===2AlCl3+3H2↑
Al2O3+6H+===2Al3++3H2O、2Al+6H+===2Al3++3H2↑
逐渐溶解
爆鸣声
铝和铝合金
实验探究
探究:在两支试管中分别加入少量的NaOH溶液,然后向其中一支试管中放入一小块铝片,向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。观察现象。过一段时间后,将点燃的木条分别放在两支试管口。你观察到什么现象
铝、氧化铝的性质——与碱反应
铝和铝合金
铝、氧化铝的性质——与碱反应
实验现象 试管①中一开始无气泡产生,一段时间后,铝片______,有无色气泡冒出,试管②中铝片溶解,立即产生无色气泡,将点燃的木条放在试管口,都有_______
化学方程式 _____________________________________________________________________
离子方程式 _______________________________________________________________
铝、氧化铝与氢氧化钠反应
溶解
爆鸣声
Al2O3+2NaOH===2NaAlO2+H2O、2Al+2NaOH+2H2O===2NaAlO2+3H2↑
Al2O3+2OH-===2AlO2-+H2O、2Al+2OH-+2H2O===2AlO2-+3H2↑
铝和铝合金
铝、氧化铝的性质——总结
铝表面有某种物质,能与盐酸和氢氧化钠溶液反应,但不能产生气体;表面的物质反应完全之后,内部的铝能与盐酸和氢氧化钠溶液继续反应生成可燃性气体。
铝既能与稀盐酸反应又能与NaOH溶液反应,都生成___和氢气。
氧化铝既能与稀盐酸反应又能与NaOH溶液反应,都生成___和水。
盐
盐
实验结论
Al2O3+6H+===2Al3++3H2O
Al2O3+2OH-===2AlO2-+H2O
2Al+6H+===2Al3++3H2↑
2Al+2OH-+2H2O===2AlO2-+3H2↑
Al2O3溶于盐酸:_____________________________。
Al2O3溶于NaOH溶液:________________________________________。
铝和铝合金
铝、氧化铝的性质
两性氧化物:
既能与酸反应生成_______,又能与碱反应生成________的氧化物,如Al2O3。
两性氧化物、两性氢氧化物
两性氢氧化物:
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,如Al(OH)3。
Al(OH)3溶于盐酸:_________________________________________。
Al(OH)3溶于NaOH溶液:____________________________________。
盐和水
盐和水
Al2O3+6H+===2Al3++3H2O
2Al+2OH-+2H2O===2AlO2-+3H2↑
Al(OH)3+3HCl===AlCl3+3H2O
Al(OH)3+NaOH===NaAlO2+2H2O
铝制餐具为何不宜用来蒸煮或长时间存放酸性或碱性食品?
由于Al和Al2O3均能与酸、碱反应,因此铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物。
【例1】向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中发生的离子反应有____________(填字母)。
A.
B.
C.
D.
ABC
铝合金是目前用途广泛的合金之一,硬铝是在铝中添加了一定比例的___、____、____、___,密度___,强度___,具有较强抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
Cu
Mg
Mn
Si
小
高
铝和铝合金
铝合金
铝锅对人体有害吗
铝不是人体必需的元素,而铝锅对人体有无危害,主要取决于铝锅的使用方式以及使用频率。通常情况下,在蒸煮料理时使用铝锅,基本上对于人体并无危害。但长期使用铝锅可能造成铝元素在体内潴留,当累积到一定程度后,对人体具有一定程度的危害,可能引起机体缺钙、过早衰老、消化功能紊乱、贫血、肝肾损伤等一系列负面影响。
1.镁铝合金质优体轻,又不易锈蚀,大量用于航空工业、造船工业、日用化工等领域。下列关于镁铝合金性质的叙述中,不正确的是( )
A.此合金的熔点比镁和铝的熔点都低
B.此合金能全部溶解于足量稀盐酸中
C.此合金能全部溶解于足量氢氧化钠溶液中
D.此合金的硬度比镁和铝的硬度都大
D
2.下列有关厨房铝制品的使用中,你认为合理的是( )
A.盛放食醋
B.烧煮开水
C.用金属丝擦洗表面的污垢
D.用碱水洗涤
B
3.在天平的左右两个托盘上放有两个烧杯,两个烧杯中分别盛有盐酸和氢氧化钠溶液,天平处于平衡状态,当分别向两烧杯中加入等质量的铝(酸和碱都是足量的)充分反应后( )
A.天平保持平衡 B.左高右低
C.左低右高 D.无法确定
A
4.等量镁铝合金粉末分别与下列四种过量物质充分反应,放出氢气最多的是( )
A.NaOH溶液 B.稀硫酸
C.蔗糖溶液 D.NaCl溶液
B
5.向某溶液中加入铝粉能放出H2,下列各组离子一定不能在该溶液中大量共存的是( )
A.
B.
C.
D.
B
6.有关铝和它的化合物的说法错误的是( )
A.用于熔化烧碱的坩埚,可用Al2O3这种材料制成
B.铝能在空气中稳定存在是因为其表面覆盖着一层保护膜
C.氧化铝是一种高熔点物质,是一种较好的耐火材料
D.氧化铝是一种两性氧化物,既能与强酸反应,也能与强碱反应
A
7.用铁、铝的混合物进行如下实验:
(1)操作X的名称是________。
(2)气体A是________。
(3)A与Cl2混合光照可能发生爆炸,生成________(填化学式),A在该反应中作为__________(填“氧化剂”或“还原剂”)。
(4)溶液B中阴离子除OH-外还有________,溶液D中存在的金属离子为________。
过滤
H2
HCl
还原剂
AlO2-
Fe2+
第二节
金属材料
第2课时
铝
铝合金
存在
物理性质
化学性质
硬铝
铝、氧化铝的性质——与酸反应
铝、氧化铝的性质——与碱反应
THANKS
谢谢聆听
第三章 铁 金属材料
第2课时
第二节 金属材料
铝和氧化铝的性质及转化
2
铝和铝合金
1
本节重点
本节难点
铝的化学性质比较活泼,为什么我们通常看见铁生锈而没有看到铝生锈?
铝锅
铁锅
铝和铝合金
铝的存在
地壳中含量最多的金属元素
铝和铝合金
铝的物理性质
金属铝
常温下为固体
银白色金属
延展性好
质地软
具有金属光泽
是电和热的良导体
铝和铝合金
铝的化学性质
常温下,在空气中铝与氧气反应,其表面生成一层致密氧化铝薄膜,从而阻止铝进一步氧化。
4Al+3O2 2Al2O3
易失去3个电子
Al
Al3+
还原性
铝元素的原子结构
氧化铝薄膜
(Al2O3)
化学方程式
铝被氧化后在表明生成一层致密的氧化层,阻止铝继续被氧化,因此铝具有良好的抗腐蚀性。而铁被氧化后,在表面形成疏松多孔的铁锈,能吸收水分和二氧化碳以及氧气,加速内部铁的持续氧化。
铝的化学性质比较活泼,为什么我们通常看见铁生锈而没有看到铝生锈?
铝锅
铁锅
与非金属反应
01
铝和铝合金
铝的化学性质——总结
02
与酸反应
03
与盐溶液反应
2Al + 6H+ 2Al3+ + 3H2
4Al + 3O2 2Al2O3
2Al + 3Cu2+ 2Al3+ + 3Cu
铝制餐具为何不宜用来蒸煮或长时间存放酸性或碱性食品?
铝和铝合金
铝、氧化铝的性质——与酸反应
实验探究
探究:在一支试管中加入5mL盐酸,再向试管中放入一小块铝片。观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象
铝和铝合金
铝、氧化铝的性质——与酸反应
铝、氧化铝与稀盐酸反应
实验现象 开始不太明显,铝片_________,有无色气泡冒出,将点燃的木条放在试管口有_______
化学方程式
离子方程式
Al2O3+6HCl===2AlCl3+3H2O、2Al+6HCl===2AlCl3+3H2↑
Al2O3+6H+===2Al3++3H2O、2Al+6H+===2Al3++3H2↑
逐渐溶解
爆鸣声
铝和铝合金
实验探究
探究:在两支试管中分别加入少量的NaOH溶液,然后向其中一支试管中放入一小块铝片,向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。观察现象。过一段时间后,将点燃的木条分别放在两支试管口。你观察到什么现象
铝、氧化铝的性质——与碱反应
铝和铝合金
铝、氧化铝的性质——与碱反应
实验现象 试管①中一开始无气泡产生,一段时间后,铝片______,有无色气泡冒出,试管②中铝片溶解,立即产生无色气泡,将点燃的木条放在试管口,都有_______
化学方程式 _____________________________________________________________________
离子方程式 _______________________________________________________________
铝、氧化铝与氢氧化钠反应
溶解
爆鸣声
Al2O3+2NaOH===2NaAlO2+H2O、2Al+2NaOH+2H2O===2NaAlO2+3H2↑
Al2O3+2OH-===2AlO2-+H2O、2Al+2OH-+2H2O===2AlO2-+3H2↑
铝和铝合金
铝、氧化铝的性质——总结
铝表面有某种物质,能与盐酸和氢氧化钠溶液反应,但不能产生气体;表面的物质反应完全之后,内部的铝能与盐酸和氢氧化钠溶液继续反应生成可燃性气体。
铝既能与稀盐酸反应又能与NaOH溶液反应,都生成___和氢气。
氧化铝既能与稀盐酸反应又能与NaOH溶液反应,都生成___和水。
盐
盐
实验结论
Al2O3+6H+===2Al3++3H2O
Al2O3+2OH-===2AlO2-+H2O
2Al+6H+===2Al3++3H2↑
2Al+2OH-+2H2O===2AlO2-+3H2↑
Al2O3溶于盐酸:_____________________________。
Al2O3溶于NaOH溶液:________________________________________。
铝和铝合金
铝、氧化铝的性质
两性氧化物:
既能与酸反应生成_______,又能与碱反应生成________的氧化物,如Al2O3。
两性氧化物、两性氢氧化物
两性氢氧化物:
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,如Al(OH)3。
Al(OH)3溶于盐酸:_________________________________________。
Al(OH)3溶于NaOH溶液:____________________________________。
盐和水
盐和水
Al2O3+6H+===2Al3++3H2O
2Al+2OH-+2H2O===2AlO2-+3H2↑
Al(OH)3+3HCl===AlCl3+3H2O
Al(OH)3+NaOH===NaAlO2+2H2O
铝制餐具为何不宜用来蒸煮或长时间存放酸性或碱性食品?
由于Al和Al2O3均能与酸、碱反应,因此铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物。
【例1】向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中发生的离子反应有____________(填字母)。
A.
B.
C.
D.
ABC
铝合金是目前用途广泛的合金之一,硬铝是在铝中添加了一定比例的___、____、____、___,密度___,强度___,具有较强抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
Cu
Mg
Mn
Si
小
高
铝和铝合金
铝合金
铝锅对人体有害吗
铝不是人体必需的元素,而铝锅对人体有无危害,主要取决于铝锅的使用方式以及使用频率。通常情况下,在蒸煮料理时使用铝锅,基本上对于人体并无危害。但长期使用铝锅可能造成铝元素在体内潴留,当累积到一定程度后,对人体具有一定程度的危害,可能引起机体缺钙、过早衰老、消化功能紊乱、贫血、肝肾损伤等一系列负面影响。
1.镁铝合金质优体轻,又不易锈蚀,大量用于航空工业、造船工业、日用化工等领域。下列关于镁铝合金性质的叙述中,不正确的是( )
A.此合金的熔点比镁和铝的熔点都低
B.此合金能全部溶解于足量稀盐酸中
C.此合金能全部溶解于足量氢氧化钠溶液中
D.此合金的硬度比镁和铝的硬度都大
D
2.下列有关厨房铝制品的使用中,你认为合理的是( )
A.盛放食醋
B.烧煮开水
C.用金属丝擦洗表面的污垢
D.用碱水洗涤
B
3.在天平的左右两个托盘上放有两个烧杯,两个烧杯中分别盛有盐酸和氢氧化钠溶液,天平处于平衡状态,当分别向两烧杯中加入等质量的铝(酸和碱都是足量的)充分反应后( )
A.天平保持平衡 B.左高右低
C.左低右高 D.无法确定
A
4.等量镁铝合金粉末分别与下列四种过量物质充分反应,放出氢气最多的是( )
A.NaOH溶液 B.稀硫酸
C.蔗糖溶液 D.NaCl溶液
B
5.向某溶液中加入铝粉能放出H2,下列各组离子一定不能在该溶液中大量共存的是( )
A.
B.
C.
D.
B
6.有关铝和它的化合物的说法错误的是( )
A.用于熔化烧碱的坩埚,可用Al2O3这种材料制成
B.铝能在空气中稳定存在是因为其表面覆盖着一层保护膜
C.氧化铝是一种高熔点物质,是一种较好的耐火材料
D.氧化铝是一种两性氧化物,既能与强酸反应,也能与强碱反应
A
7.用铁、铝的混合物进行如下实验:
(1)操作X的名称是________。
(2)气体A是________。
(3)A与Cl2混合光照可能发生爆炸,生成________(填化学式),A在该反应中作为__________(填“氧化剂”或“还原剂”)。
(4)溶液B中阴离子除OH-外还有________,溶液D中存在的金属离子为________。
过滤
H2
HCl
还原剂
AlO2-
Fe2+
第二节
金属材料
第2课时
铝
铝合金
存在
物理性质
化学性质
硬铝
铝、氧化铝的性质——与酸反应
铝、氧化铝的性质——与碱反应
THANKS
谢谢聆听
