江苏省盐城市重点中学2023-2024学年高三上学期开学考试化学试题(原卷版+解析版)
文档属性
| 名称 | 江苏省盐城市重点中学2023-2024学年高三上学期开学考试化学试题(原卷版+解析版) |  | |
| 格式 | docx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-05 11:14:04 | ||
图片预览




文档简介
盐城市重点中学2023-2024学年高三上学期开学考试
化学试题
考试时间:75分钟;分值:满分100分。
相对原子质量为:
一、单项选择题(本题共14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1. 近年来,我国在材料的开发和应用方面取得了举世瞩目的成就。下列属于金属材料的是
A.盾构机钻头刀刃的硬质钨合金 B.浙大科学家用冰制作出的“冰光纤” C.中科院研发的8英寸石墨烯晶圆 D.天和核心舱电推系统用到的氮化硼陶瓷
A. A B. B C. C D. D
2. 设为阿伏加德罗常数的值,下列说法正确的是
A. 溶液中,分子的数目为
B. 重水中所含质子数为
C. 足量的浓盐酸与反应,转移电子的数目为
D. 葡萄糖中,C原子的数目为
3. 下列有关溶液配制的叙述正确的是
A. 配制0.400 0 mol·L-1的NaOH溶液,称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,立即转移至250 mL容量瓶中定容
B. 用已准确称量的KBrO3固体配制一定体积的0.1 mol·L-1 KBrO3溶液时,用到的玻璃仪器有烧杯、玻璃棒、容量瓶和胶头滴管
C. 量取27.2 mL 18.4 mol·L-1浓硫酸于烧杯中,加水稀释、冷却后转移至500 mL容量瓶中即可得1.0 mol·L-1的H2SO4溶液
D. 称取0.158 g KMnO4固体,放入100 mL 容量瓶中,加水溶解并稀释至刻度,即可得到0.010 mol·L-1的KMnO4溶液
4. 下列有关物质的性质与用途正确且具有对应关系的是
A. 铁粉与氧化铝发生的铝热反应可用于焊接铁轨
B. 氯化铝是一种电解质,现在大规模用于电解法制铝
C. 明矾能水解生成胶体,可用作净水剂
D. 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块减缓其腐蚀
5. 常温下,下列各组离子在指定溶液中能大量共存的是
A 氨水溶液:Na+、K+、OH-、NO
B. 盐酸溶液:Na+、K+、SO、SiO
C. KMnO4溶液:NH、Na+、NO、I-
D. AgNO3溶液:NH、Mg2+、Cl-、SO
6. 下列转化在给定条件下不能实现的是
A. 饱和
B.
C.
D.
7. 能正确表示下列反应的离子方程式是
A. 溶液与少量溶液反应:
B. 电解水溶液:
C. 乙醇与酸性溶液反应:
D. 溶液中滴加稀氨水:
8. 下列A~D四组反应中,其中Ⅰ和Ⅱ可用同一个离子方程式表示的是
选项 Ⅰ Ⅱ
A 把金属铁放入稀硫酸中 把金属铁放入稀硝酸中
B 溶液中加入足量的溶液 溶液中加入足量的溶液
C 将通入的溶液中 将通入的溶液中
D 溶液与溶液反应恰好呈中性 溶液与溶液反应使恰好沉淀
A. A B. B C. C D. D
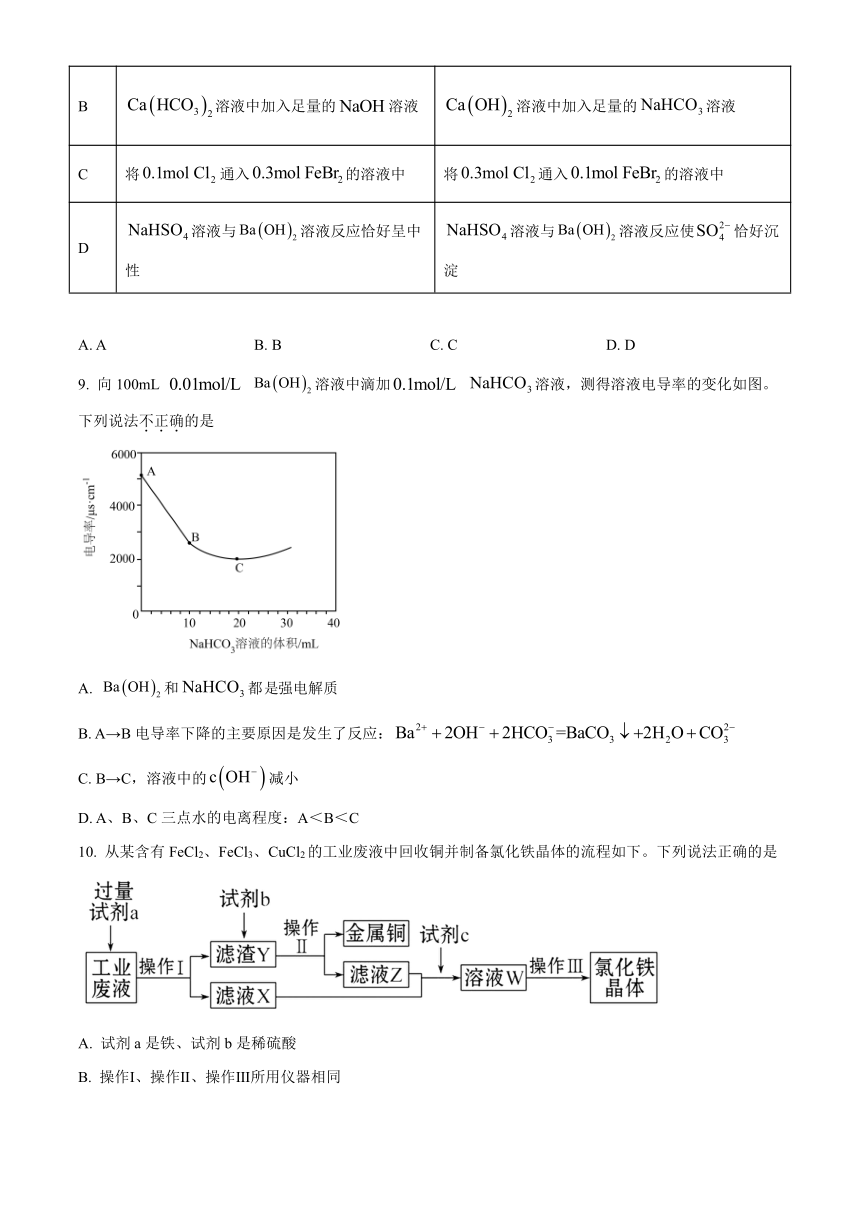
9. 向100mL 溶液中滴加 溶液,测得溶液电导率的变化如图。下列说法不正确的是
A. 和都强电解质
B. A→B电导率下降的主要原因是发生了反应:
C. B→C,溶液中的减小
D. A、B、C三点水的电离程度:A<B<C
10. 从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下。下列说法正确的是
A. 试剂a是铁、试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
C. 试剂c是氯气,相应的反应为2Fe2++Cl2=2Fe3++2Cl-
D. 用酸性KMnO4溶液可检验溶液W中是否含有Fe2+
11. 下列“类比”合理的是
A. Na与反应生成和,则Fe与反应生成和
B. 与盐酸反应生成和,则与盐酸反应生成和
C 溶液与反应生成和,则溶液与反应生成
D. 常温下Cu片可溶于浓硝酸中并放出红棕色气体,Fe片与浓硝酸反应更剧烈
12. 由下列实验操作及现象不能得出相应结论的是
实验操作 现象 结论
A 向KBr、KI混合溶液中依次加入少量氯水和,振荡,静置 溶液分层,下层呈紫红色 氧化性:
B 在火焰上灼烧搅拌过某无色溶液的铁丝 火焰出现黄色 溶液中含元素
C 用pH计测定pH: ①溶液 ②溶液 pH:①>② 酸性弱于
D 将一块未经打磨的铝片剪成相同的两小片,相同温度下分别投入5.0mL浓度均为2.0mol/L的溶液和溶液中 溶液中无明显现象;溶液中反应剧烈,铝片表面有红色物质生成 则能加速破坏铝片表面的氧化膜
A. A B. B C. C D. D
13. 工业上以软锰矿(主要成分是,含有、等少量杂质)为主要原料制备高性能的磁性材料碳酸锰,其工业流程如图。下列说法错误的是
A. 浸锰过程中与反应的离子方程式为
B. 过滤Ⅰ所得滤液中主要存在的金属阳离子为和
C. 滤渣Ⅱ的主要成分含有
D. 向过滤Ⅱ所得的滤液中加入溶液发生反应的主要离子方程式为
14. 工业生产中除去电石渣浆(含)中的并制取硫酸盐的一种常用流程如下图。下列说法正确的是
A. 碱性条件下,氧化性:
B. 过程Ⅰ中氧化剂和还原剂的物质的量之比为
C. 过程Ⅱ中,反应的离子方程式为
D. 将转化为理论上需要的体积为(标准状况)
二、非选择题(共58分)
15. 回答下列问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后,溶液中大量存在的阳离子有_______(填离子符号)。
(2)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、、Cl-、中的4种离子,且均为1mol。向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。则溶液中存在的离子是_______。
(3)高铁酸钾是一种既能杀菌消海、又能絮凝净水的水处理剂。其工业制备反应为(未配平),每生成,转移的电子数为_______。
(4)自然界中Cr主要以价和价形式存在。中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将还原。其离子方程式为_______。
16. 某磁性材料广泛应用于磁记录、催化等领域。一种制备该材料的流程如下:
已知反应原理为:①
②
③
(1)用溶液和溶液制备反应的离子方程式为_______。
(2)当时,产率极低的原因是_______。
(3)图1为回流时间与产率的关系图,图2为回流所得产品的X射线衍射图。回流所得产品中产生杂质可能的原因_______。
(4)一定条件下焙烧可制得负载型催化剂。准确称取负载型催化剂样品,置于锥形瓶中,加入适量稀盐酸,加热溶解后,滴加稍过量的溶液(将还原为),充分反应后,除去过量。用溶液滴定至终点(滴定过程中与反应生成和),消耗溶液。计算该负载型催化剂的负载量_____ (写出计算过程)。 [负载量=×100%]
17. 全球对锂资源的需求不断增长,“盐湖提锂”越来越受到重视。某兴趣小组取盐湖水进行浓缩和初步除杂后,得到浓缩卤水(含有、、和少量、),并设计了以下流程通过制备碳酸锂来提取锂。
25℃时相关物质的参数如下,回答下列问题:
的溶解度:
化合物
(1)“沉淀1”为_______。
(2)向“滤液1”中加入适量固体的目的是_______。
(3)为提高的析出量和纯度,“操作A”依次为_______、_______、洗涤。
(4)有同学建议用“侯氏制碱法”的原理制备。查阅资料后,发现文献对常温下的有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究的性质,将饱和溶液与饱和溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下_______(填“稳定”或“不稳定”),有关反应的离子方程式为_______。
(5)他们结合(4)的探究结果,拟将原流程中向“滤液2”加入改为通入。这一改动能否达到相同的效果,作出你的判断并给出理由:_______。
(6)在高温条件下,、葡萄糖和可制备电极材料,同时生成CO和H2O,该反应的化学方程式为_______。
18. 在处理NO废气的过程中,催化剂会逐渐失活变为。某小组为解决这一问题,实验研究和之间的相互转化。
资料:Ⅰ.
Ⅱ.
Ⅲ.和在酸性条件下均能生成
(1)探究的还原性
实验Ⅰ 粉红色的溶液或溶液在空气中久置,无明显变化。
实验Ⅱ 向溶液中滴入2滴酸性溶液,无明显变化。
实验Ⅲ 按如图装置进行实验,观察到电压表指针偏转。
①甲同学根据实验Ⅲ得出结论:能被酸性溶液氧化乙同学补充实验Ⅳ,_______(补全实验操作及现象),否定了该观点。
②探究碱性条件下Co(Ⅱ)的还原性,进行实验。
ⅱ中反应化学方程式是_______。
③根据氧化还原反应规律解释还原性:在碱性条件下,与、反应,使和均降低,但_______降低的程度更大,还原剂的还原性增强。
(2)探究的氧化性
①根据实验Ⅲ和Ⅳ推测氧化性:,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,_______(补全实验操作及现象),反应的离子方程式是_______。
②向Ⅴ中得到的棕褐色沉淀中,滴加溶液,加入催化剂,产生无色气泡,该气体是_______。
盐城市重点中学2023-2024学年高三上学期开学考试
化学试题 答案解析
考试时间:75分钟;分值:满分100分。
相对原子质量为:
一、单项选择题(本题共14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1. 近年来,我国在材料的开发和应用方面取得了举世瞩目的成就。下列属于金属材料的是
A.盾构机钻头刀刃的硬质钨合金 B.浙大科学家用冰制作出的“冰光纤” C.中科院研发的8英寸石墨烯晶圆 D.天和核心舱电推系统用到的氮化硼陶瓷
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A.钨合金属于金属材料,故A项正确;
B.冰的化学式是H2O,“冰光纤”属于无机非金属材料,故B项不正确;
C.石墨烯晶圆的主要成分是C,属于无机非金属材料,故C项不正确;
D.氮化硼陶瓷属于无机非金属材料,故D项不正确;
答案选A。
2. 设为阿伏加德罗常数的值,下列说法正确的是
A. 溶液中,分子的数目为
B. 重水中所含质子数为
C. 足量的浓盐酸与反应,转移电子的数目为
D. 葡萄糖中,C原子的数目为
【答案】D
【解析】
【详解】A.HCl是强酸,在溶液中全部以H+和Cl-的形成存在,故溶液中,分子的数目0,A错误;
B.重水中所含质子数为=0.9,B错误;
C.根据反应方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,故足量的浓盐酸与8.7g即=0.1mol反应,转移电子的数目为,C错误;
D.葡萄糖中,C原子的数目为=,D正确;
故答案为:D。
3. 下列有关溶液配制的叙述正确的是
A. 配制0.400 0 mol·L-1的NaOH溶液,称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,立即转移至250 mL容量瓶中定容
B. 用已准确称量的KBrO3固体配制一定体积的0.1 mol·L-1 KBrO3溶液时,用到的玻璃仪器有烧杯、玻璃棒、容量瓶和胶头滴管
C. 量取27.2 mL 18.4 mol·L-1浓硫酸于烧杯中,加水稀释、冷却后转移至500 mL容量瓶中即可得1.0 mol·L-1的H2SO4溶液
D. 称取0.158 g KMnO4固体,放入100 mL 容量瓶中,加水溶解并稀释至刻度,即可得到0.010 mol·L-1的KMnO4溶液
【答案】B
【解析】
【详解】A.n(NaOH)=m/M=4.0g÷40g/mol=0.1mol。NaOH在溶解时会放出大量热,因此需要冷却至室温后再转移到250mL容量瓶中,并且洗涤烧杯和玻璃棒2~3次,将洗涤液也转移到容量瓶中,以减小误差,A错误;
B.用已准确称量的KBrO3固体配制一定体积的0.1 mol·L-1 KBrO3溶液时,溶解时用到烧杯、玻璃棒,转移到容量瓶中,再用胶头滴管定容,B正确;
C.浓硫酸稀释时需要将浓硫酸沿烧杯内壁缓慢倒入蒸馏水中,并用玻璃棒不断搅拌,C错误;
D.容量瓶不能作为溶解容器,应在烧杯中进行溶解,D错误。
故本题选B。
4. 下列有关物质的性质与用途正确且具有对应关系的是
A. 铁粉与氧化铝发生的铝热反应可用于焊接铁轨
B. 氯化铝是一种电解质,现在大规模用于电解法制铝
C. 明矾能水解生成胶体,可用作净水剂
D. 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块减缓其腐蚀
【答案】C
【解析】
【详解】A.铁粉与氧化铝不反应,而是铝粉和氧化铁发生的铝热反应可用于焊接铁轨,A不合题意;
B.氯化铝是共价化合物,熔融的氯化铝不能导电,故现在大规模用于电解法制铝是电解熔融的氧化铝而不是氯化铝,B不合题意;
C.明矾能水解生成Al(OH)3胶体,胶体具有很强的吸附能力,可以吸附水中的悬浮杂质,故明矾可用作净水剂,C符合题意;
D.牺牲阳极的阴极保护法是用一个比保护的金属更活泼的金属作负极,失去电子,铜的金属活泼性比铁的差,不可在海轮外壳上装若干铜块减缓其腐蚀,而是要接一个锌块,D不合题意;
故答案为:C。
5. 常温下,下列各组离子在指定溶液中能大量共存的是
A. 氨水溶液:Na+、K+、OH-、NO
B. 盐酸溶液:Na+、K+、SO、SiO
C. KMnO4溶液:NH、Na+、NO、I-
D. AgNO3溶液:NH、Mg2+、Cl-、SO
【答案】A
【解析】
【详解】A.在0.1mol/L氨水中,四种离子可以大量共存,A选;
B.在0.1mol/L盐酸中含有大量氢离子,四种离子中硅酸根可以与氢离子反应生成硅酸沉淀,故不能共存,B不选;
C.具有强氧化性,可以将碘离子氧化成碘单质,故不能共存,C不选;
D.在0.1mol/L硝酸银溶液中,银离子可以与氯离子、硫酸根离子反应生成氯化银、硫酸银沉淀,不能共存,D不选;
故选A。
6. 下列转化在给定条件下不能实现的是
A. 饱和
B.
C.
D
【答案】A
【解析】
【详解】A.饱和NaCl溶液与CO2不反应,A符合题意;
B.MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓,Mg(OH)2MgO+H2O,B不合题意;
C.Fe+2HCl=FeCl2+H2↑,2FeCl2+Cl2=2FeCl3,2FeCl3+Fe=3FeCl2,C不合题意;
D.2NaOH+CO2=Na2CO3+H2O,Na2CO3+H2O+CO2=2NaHCO3,NaHCO3+NaOH=Na2CO3+H2O,D不合题意;
故答案为:A。
7. 能正确表示下列反应的离子方程式是
A. 溶液与少量溶液反应:
B. 电解水溶液:
C. 乙醇与酸性溶液反应:
D. 溶液中滴加稀氨水:
【答案】C
【解析】
【详解】A.溶液与少量溶液反应生成BaSO4和Fe(OH)2沉淀,故该离子方程式为:,A错误;
B.电解MgCl2水溶液将生成Mg(OH)2沉淀,该离子方程式为:,B错误;
C.乙醇与酸性溶液反应的离子方程式为:,C正确;
D.氨水在离子方程式书写时不能拆,故溶液中滴加稀氨水的离子方程式为:,D错误;
故答案为:C。
8. 下列A~D四组反应中,其中Ⅰ和Ⅱ可用同一个离子方程式表示的是
选项 Ⅰ Ⅱ
A 把金属铁放入稀硫酸中 把金属铁放入稀硝酸中
B 溶液中加入足量的溶液 溶液中加入足量的溶液
C 将通入的溶液中 将通入的溶液中
D 溶液与溶液反应恰好呈中性 溶液与溶液反应使恰好沉淀
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A.把金属铁放入稀硫酸中的离子方程式为:Fe+2H+=Fe2++H2↑,把金属铁放入稀硝酸中的离子方程式为:Fe+4H++=Fe3++NO↑+2H2O,A不合题意;
B.溶液中加入足量的溶液的离子方程式为:Ca2++2+2OH-=CaCO3↓+2H2O+,溶液中加入足量的溶液的离子方程式为:Ca2++2+2OH-=CaCO3↓+2H2O+,B符合题意;
C.将通入的溶液中的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,将通入的溶液中的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,C不合题意;
D.溶液与溶液反应恰好呈中性的离子方程式为:Ba2++2OH-+2H++=BaSO4↓+2H2O,溶液与溶液反应使恰好沉淀的离子方程式为:Ba2++OH-+H++=BaSO4↓+H2O,D不合题意;
故答案为:B。
9. 向100mL 溶液中滴加 溶液,测得溶液电导率的变化如图。下列说法不正确的是
A. 和都是强电解质
B. A→B电导率下降的主要原因是发生了反应:
C. B→C,溶液中的减小
D. A、B、C三点水的电离程度:A<B<C
【答案】B
【解析】
【详解】A. 和在溶液中均完全电离,均属于强电解质,故A正确;
B.A→B加入的物质的量小于的物质的量,发生的反应为,故B错误;
C.B→C时加入的继续消耗氢氧根离子,C点两者恰好完全反应,因此B→C溶液中减小,故C正确;
D.酸或碱抑制水的电离,含有弱离子的盐水解促进水的电离,A点溶液中全部是,水的电离受到抑制,电离程度最小,B点为反应一半点,氢氧化钡还有剩余,C点和恰好完全反应,因此水的电离程度:A<B<C,故D正确;
答案选B。
10. 从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下。下列说法正确的是
A. 试剂a是铁、试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
C. 试剂c是氯气,相应的反应为2Fe2++Cl2=2Fe3++2Cl-
D. 用酸性KMnO4溶液可检验溶液W中是否含有Fe2+
【答案】C
【解析】
【分析】
【详解】A.由最终要得到的氯化铁及流程图知b是盐酸,A错误;
B.操作Ⅰ和操作Ⅱ是过滤,操作Ⅲ为蒸发结晶,所用仪器有差异,B错误;
C.滤液Z和X中均含有氯化亚铁,因此c为氯气,C正确;
D.高锰酸钾能氧化氯离子而褪色,因此不能用于检验是否含有亚铁离子,D错误;
故选C。
11. 下列“类比”合理的是
A. Na与反应生成和,则Fe与反应生成和
B. 与盐酸反应生成和,则与盐酸反应生成和
C. 溶液与反应生成和,则溶液与反应生成
D. 常温下Cu片可溶于浓硝酸中并放出红棕色气体,Fe片与浓硝酸反应更剧烈
【答案】B
【解析】
【详解】A.Fe与H2O(g)反应生成Fe3O4和H2,“类比”不合理,故A错误;
B.Na3N与盐酸发生水解反应生成NaCl和NH4Cl,则Mg3N2与盐酸反应生成MgCl2和NH4Cl,“类比”合理,故B正确;
C.NaClO溶液具有强氧化性,将SO2氧化反应生成Na2SO4,“类比”不合理,故C错误;
D.常温下,Fe片与浓硝酸会钝化,故D错误;
故选B。
12. 由下列实验操作及现象不能得出相应结论的是
实验操作 现象 结论
A 向KBr、KI混合溶液中依次加入少量氯水和,振荡,静置 溶液分层,下层呈紫红色 氧化性:
B 在火焰上灼烧搅拌过某无色溶液的铁丝 火焰出现黄色 溶液中含元素
C 用pH计测定pH: ①溶液 ②溶液 pH:①>② 酸性弱于
D 将一块未经打磨的铝片剪成相同的两小片,相同温度下分别投入5.0mL浓度均为2.0mol/L的溶液和溶液中 溶液中无明显现象;溶液中反应剧烈,铝片表面有红色物质生成 则能加速破坏铝片表面的氧化膜
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A.向、混合溶液中依次加入少量氯水和,振荡,静置,溶液分层,下层呈紫红色,则是氯水将碘离子氧化得到碘单质,能得出氧化性:,故A不符合题意;
B.在火焰上灼烧搅拌过某无色溶液的铁丝,火焰出现黄色,能推出溶液中含有钠元素,故B不符合题意;
C.溶液与溶液浓度未知,不能通过的大小来分析与的酸性强弱,只有同浓度的两种溶液才能比较,故C符合题意;
D.根据题意说明,两溶液的单一变量是阴离子的种类,从现象可说明能加速破坏铝片表面的氧化膜,故D不符合题意;
故选C。
13. 工业上以软锰矿(主要成分是,含有、等少量杂质)为主要原料制备高性能的磁性材料碳酸锰,其工业流程如图。下列说法错误的是
A. 浸锰过程中与反应的离子方程式为
B. 过滤Ⅰ所得滤液中主要存在的金属阳离子为和
C. 滤渣Ⅱ的主要成分含有
D. 向过滤Ⅱ所得的滤液中加入溶液发生反应的主要离子方程式为
【答案】D
【解析】
【分析】浸锰过程通入过量的SO2,将Mn4+和Fe3+还原成Mn2+和Fe2+,过滤Ⅰ所得滤渣为SiO2,加入MnO2氧化,此时溶液中可以被氧化的物质有Fe2+和未反应的SO2,调pH是为了将上一步氧化生成的Fe3+沉淀下来与Mn2+分离,加入NH4HCO3溶液将Mn2+沉淀下来,再经过一系列步骤可得到纯的MnCO3。
【详解】A.根据上述分析可知,浸锰过程通入过量的SO2,将Mn4+和Fe3+还原成Mn2+和Fe2+,反应的离子方程式为:Fe2O3+SO2+2H+=2Fe2++SO+H2O,A正确;
B.过量的SO2,将Mn4+和Fe3+还原成Mn2+和Fe2+,因此过滤I所得滤液中主要存在的金属阳离子为Mn2+和Fe2+,B正确;
C.调pH=3.7,将Fe3+转化为氢氧化铁沉淀,过滤,滤渣Ⅱ的主要成分含有Fe(OH)3,C正确;
D.滤液为硫酸锰溶液,向滤液种加入适量NH4HCO3溶液,生成MnCO3沉淀,同时二氧化碳生成,发生的反应为:Mn2++2HCO=MnCO3↓+CO2↑+H2O,D错误;
故选D。
14. 工业生产中除去电石渣浆(含)中的并制取硫酸盐的一种常用流程如下图。下列说法正确的是
A. 碱性条件下,氧化性:
B. 过程Ⅰ中氧化剂和还原剂的物质的量之比为
C. 过程Ⅱ中,反应的离子方程式为
D. 将转化为理论上需要的体积为(标准状况)
【答案】C
【解析】
【分析】由流程可知,CaO与硫酸锰反应生成Mn(OH)2,通入氧气生成,过程Ⅰ中反应的离子方程式为2Mn(OH)2+O2+4OH-=2+4H2O;与S2-反应生,进而与氧气反应生成,过程Ⅱ中反应的离子方程式为4+2S2-+9H2O═+4Mn(OH)2↓+10OH-,以此解答该题。
【详解】A.由分析可知,碱性条件下,O2能将Mn(OH)2氧化,能将S2-氧化为,故氧化性:,A错误;
B.由分析可知,过程Ⅰ中反应的离子方程式为2Mn(OH)2+O2+4OH-=2+4H2O,故过程Ⅰ中氧化剂O2和还原剂Mn(OH)2的物质的量之比为,B错误;
C.由分析可知,过程Ⅱ中,反应的离子方程式为,C正确;
D.根据得失电子守恒1mol×8=n(O2)×4,n(O2)=2mol,将1molS2-转化为理论上需要O2的体积2mol×22.4L/mol=44.8L,D错误;
故答案为:C。
二、非选择题(共58分)
15. 回答下列问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后,溶液中大量存在的阳离子有_______(填离子符号)。
(2)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、、Cl-、中的4种离子,且均为1mol。向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。则溶液中存在的离子是_______。
(3)高铁酸钾是一种既能杀菌消海、又能絮凝净水的水处理剂。其工业制备反应为(未配平),每生成,转移的电子数为_______。
(4)自然界中Cr主要以价和价形式存在。中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将还原。其离子方程式为_______。
【答案】(1)Fe2+、Fe3+、H+
(2)Na+、Fe2+、、
(3)1.806×1024
(4)3++8H+= 2Cr3++3+4H2O
【解析】
【小问1详解】
FeC在足量的空气中高温煅烧,生成有磁性的固体Y,可知Y为Fe3O4,溶于过量的盐酸反应生成氯化亚铁、氯化铁,溶液有剩余的HCl,所以溶液中大量存在的阳离子为Fe2+、Fe3+、H+,故答案为:Fe2+、Fe3+、H+;
小问2详解】
向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变,则一定发生Fe2+、的氧化还原反应生成硝酸铁和NO,阴离子种类不变,说明原溶液中原来已经存在,则不含Ba2+,又溶液中含有四种离子,反应生成了Fe3+,所含离子的物质的量均为1mol,由电荷守恒可知,含有带一个单位正电荷的阳离子,即一定含有Na+,由上述推断可知,该溶液中所含的离子为:Na+、Fe2+、、,故答案为:Na+、Fe2+、、;
【小问3详解】
Fe由+3价被氧化为+6价,故每生成,转移的电子数为3×6.02×1023=1.806×1024个,故答案为:1.806×1024;
【小问4详解】
自然界中Cr主要以价和价形式存在。中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将还原,即被还原为Cr3+,被氧化为,故该反应的其离子方程式为3++8H+= 2Cr3++3+4H2O,故答案为:3++8H+= 2Cr3++3+4H2O。
16. 某磁性材料广泛应用于磁记录、催化等领域。一种制备该材料流程如下:
已知反应原理为:①
②
③
(1)用溶液和溶液制备反应的离子方程式为_______。
(2)当时,产率极低的原因是_______。
(3)图1为回流时间与产率的关系图,图2为回流所得产品的X射线衍射图。回流所得产品中产生杂质可能的原因_______。
(4)一定条件下焙烧可制得负载型催化剂。准确称取负载型催化剂样品,置于锥形瓶中,加入适量稀盐酸,加热溶解后,滴加稍过量的溶液(将还原为),充分反应后,除去过量。用溶液滴定至终点(滴定过程中与反应生成和),消耗溶液。计算该负载型催化剂的负载量_____ (写出计算过程)。 [负载量=×100%]
【答案】(1)4Fe2++8OH-Fe/Fe3O4+4H2O
(2)氢氧根离子浓度小,难以生成Fe(OH)2
(3)Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O反应速率慢
(4)28.8%
【解析】
【小问1详解】
FeCl2溶液和KOH溶液在100℃条件下反应生成Fe/Fe3O4、KCl、H2O,用FeCl2溶液和KOH溶液制备Fe/Fe3O4反应的离子方程式为4Fe2++8OH-Fe/Fe3O4+4H2O,故答案为:4Fe2++8OH-Fe/Fe3O4+4H2O;
【小问2详解】
当pH<2时,溶液为酸性,氢氧根离子浓度小,难以生成Fe(OH)2,所以Fe/Fe3O4产率极低,故答案为:氢氧根离子浓度小,难以生成Fe(OH)2;
【小问3详解】
Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O反应速率慢,所以回流1h所得产品Fe/Fe3O4中产生杂质,故答案为:Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O反应速率慢;
【小问4详解】
滴定过程中与Fe2+反应生成Cr3+和Fe3+的离子方程式为:14H+++6Fe2+=2Cr3++6Fe3++7H2O,n()=c()V()=5.000×10-2mol/L×24.00×10-3L=1.2×10-3mol,参加反应的各物质的物质的量之比等于化学计量数之比,则n(Fe2+)=6n()=6×1.2×10-3mol=7.2×10-3mol,根据Fe原子守恒可得关系式:Fe2O3~2Fe3+~2Fe2+,则n(Fe2O3)=0.5n(Fe2+)=0.5×7.2×10-3mol=3.600×10-3mol,m(Fe2O3)=n(Fe2O3)M(Fe2O3)=3.600×10-3mol×160g/mol=0.576g,负载量=×100%=×100%=28.8%,故答案为:28.8%。
17. 全球对锂资源的需求不断增长,“盐湖提锂”越来越受到重视。某兴趣小组取盐湖水进行浓缩和初步除杂后,得到浓缩卤水(含有、、和少量、),并设计了以下流程通过制备碳酸锂来提取锂。
25℃时相关物质的参数如下,回答下列问题:
的溶解度:
化合物
(1)“沉淀1”为_______。
(2)向“滤液1”中加入适量固体的目的是_______。
(3)为提高的析出量和纯度,“操作A”依次为_______、_______、洗涤。
(4)有同学建议用“侯氏制碱法”的原理制备。查阅资料后,发现文献对常温下的有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究的性质,将饱和溶液与饱和溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下_______(填“稳定”或“不稳定”),有关反应的离子方程式为_______。
(5)他们结合(4)的探究结果,拟将原流程中向“滤液2”加入改为通入。这一改动能否达到相同的效果,作出你的判断并给出理由:_______。
(6)在高温条件下,、葡萄糖和可制备电极材料,同时生成CO和H2O,该反应的化学方程式为_______。
【答案】(1)Mg(OH)2
(2)将Ca2+转化成CaCO3沉淀除去,且不引入新杂质
(3) ①. 蒸发结晶 ②. 趁热过滤
(4) ①. 不稳定 ②. 2Li++2=Li2CO3↓+CO2↑+H2O
(5)能达到相同效果,如果改为通入过量的CO2,LiOH转化为LiHCO3,结合(4)的探究结果知,LiHCO3会很快分解产生Li2CO3,所以这一改动能达到相同的效果
(6)6Li2CO3+C6H12O6+12FePO412LiFePO4+6CO↑+6H2O+6CO2↑
【解析】
【分析】浓缩卤水中含有Na+、Li+、Cl-和少量Mg2+、Ca2+,向浓缩卤水中加入石灰乳,Mg2+生成Mg(OH)2沉淀,过滤后得到的沉淀1为Mg(OH)2,向滤液1中加入Li2CO3,Ca2+转化为CaCO3沉淀,然后过滤洗涤得到沉淀2为CaCO3,CaCO3热分解、水合得到石灰乳;滤液2中加入Na2CO3,Li+转化为Li2CO3沉淀,过滤后得到Li2CO3,滤液3中含有Na+、Cl-和过量的CO32-,Li2CO3通过一系列操作得到Li,据此分析解题。
【小问1详解】
浓缩卤水中含有Mg2+,Mg2+和石灰乳反应生成Mg(OH)2沉淀,所以沉淀1为Mg(OH)2,故答案为:Mg(OH)2;
【小问2详解】
滤液1中含有Ca2+,根据LiOH的溶解度及溶度积常数知,Li2CO3能和Ca2+反应生成CaCO3,发生沉淀的转化,所以加入Li2CO3的目的是将Ca2+转化成CaCO3沉淀除去,同时不引入新杂质,故答案为:将Ca2+转化成CaCO3沉淀除去,且不引入新杂质;
【小问3详解】
由Li2CO3的溶解度曲线可知,Li2CO3的溶解度随着温度的升高而减小,为提高Li2CO3的析出量和纯度,需要在较高温度下析出并过滤得到沉淀,即依次蒸发结晶、趁热过滤、洗涤,故答案为:蒸发结晶;趁热过滤;
【小问4详解】
饱和LiCl和饱和NaHCO3等体积混合后,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀,说明开始时生成LiHCO3和NaCl,随后LiHCO3分解产生了CO2和Li2CO3,所以LiHCO3不稳定,发生的反应为Li++=LiHCO3、2LiHCO3=Li2CO3↓+CO2↑+H2O,则总离子方程式为2Li++2=Li2CO3↓+CO2↑+H2O,故答案为:不稳定;2Li++2=Li2CO3↓+CO2↑+H2O;
【小问5详解】
“滤液2”中含有LiOH,加入Na2CO3,目的是将LiOH转化为Li2CO3,若改为通入过量的CO2,则LiOH转化为LiHCO3,结合(4)的探究结果,LiHCO3也会很快分解产生Li2CO3,所以这一改动能达到相同的效果,故答案为:能达到相同效果;如果改为通入过量的CO2,LiOH转化为LiHCO3,结合(4)的探究结果知,LiHCO3会很快分解产生Li2CO3,所以这一改动能达到相同的效果。
【小问6详解】
在高温条件下,、葡萄糖和可制备电极材料,同时生成CO和H2O,根据氧化还原反应配平可得,该反应的化学方程式为6Li2CO3+C6H12O6+12FePO412LiFePO4+6CO↑+6H2O+6CO2↑,故答案为:6Li2CO3+C6H12O6+12FePO412LiFePO4+6CO↑+6H2O+6CO2↑。
18. 在处理NO废气的过程中,催化剂会逐渐失活变为。某小组为解决这一问题,实验研究和之间的相互转化。
资料:Ⅰ.
Ⅱ.
Ⅲ.和在酸性条件下均能生成
(1)探究的还原性
实验Ⅰ 粉红色的溶液或溶液在空气中久置,无明显变化。
实验Ⅱ 向溶液中滴入2滴酸性溶液,无明显变化。
实验Ⅲ 按如图装置进行实验,观察到电压表指针偏转。
①甲同学根据实验Ⅲ得出结论:能被酸性溶液氧化。乙同学补充实验Ⅳ,_______(补全实验操作及现象),否定了该观点。
②探究碱性条件下Co(Ⅱ)的还原性,进行实验。
ⅱ中反应的化学方程式是_______。
③根据氧化还原反应规律解释还原性:在碱性条件下,与、反应,使和均降低,但_______降低的程度更大,还原剂的还原性增强。
(2)探究的氧化性
①根据实验Ⅲ和Ⅳ推测氧化性:,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,_______(补全实验操作及现象),反应的离子方程式是_______。
②向Ⅴ中得到棕褐色沉淀中,滴加溶液,加入催化剂,产生无色气泡,该气体是_______。
【答案】(1) ①. 将实验Ⅲ中的0.1mol/LCoCl2溶液替换为0.2mol/LNaCl溶液进行实验,指针偏转幅度与实验Ⅲ相同 ②. 4CO(OH)2+O2+2H2O=4Co(OH)3 ③. c(Co3+)
(2) ①. 加入适量盐酸,棕褐色沉淀溶解,产生黄色有刺激性气味的气体,溶液变为粉红色 ②. 2CO(OH)3+6H++2Cl-=2Co2++Cl2↑+6H2O ③. O2
【解析】
【小问1详解】
①乙同学补充实验Ⅳ,设计不含Co2+但氯离子浓度相同的溶液代替0.1mol/LCoCl2进行实验,如将实验Ⅲ中的0.1mol/LCoCl2溶液替换为0.2mol/LNaCl溶液进行实验,指针偏转幅度与实验Ⅲ相同,从而否定甲同学实验Ⅲ得出结论:Co2+可以被酸性KMnO4溶液氧化;故答案为:将实验Ⅲ中的0.1mol/LCoCl2溶液替换为0.2mol/LNaCl溶液进行实验,指针偏转幅度与实验Ⅲ相同;
②ⅱ中蓝色沉淀Co(OH)2在空气中缓慢反应被氧化生成棕褐色沉淀Co(OH)3,反应的化学方程式是4CO(OH)2+O2+2H2O=4Co(OH)3;故答案为:4CO(OH)2+O2+2H2O=4Co(OH)3;
③根据氧化还原反应规律解释还原性Co(OH)2>Co2+:Co2+-e-═Co3+在碱性条件下,OH-与Co2+、Co3+反应,使c(Co2+)和c(Co3+)均降低,但c(Co3+)降低的程度更大,还原剂的还原性增强;故答案为:c(Co3+);
【小问2详解】
①向Ⅴ中得到的棕褐色沉淀中,加入适量盐酸,棕褐色沉淀溶解,产生黄色有刺激性气味的气体,溶液变为粉红色,证明:实验Ⅲ和Ⅳ推测氧化性:Co3+>Cl2;实验中酸性条件下Co (OH)3将氯离子氧化成氯气,反应的离子方程式是:2Co(OH)3+6H++2Cl-=2Co2++Cl2↑+6H2O;故答案为:加入适量盐酸,棕褐色沉淀溶解,产生黄色有刺激性气味的气体,溶液变为粉红色;2Co (OH)3+6H++2Cl-=2Co2++Cl2↑+6H2O;
②向Ⅴ中得到的棕褐色沉淀中,滴加H2SO4溶液,加入催化剂,产生无色气泡,该气体是O2;故答案为:O2。
化学试题
考试时间:75分钟;分值:满分100分。
相对原子质量为:
一、单项选择题(本题共14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1. 近年来,我国在材料的开发和应用方面取得了举世瞩目的成就。下列属于金属材料的是
A.盾构机钻头刀刃的硬质钨合金 B.浙大科学家用冰制作出的“冰光纤” C.中科院研发的8英寸石墨烯晶圆 D.天和核心舱电推系统用到的氮化硼陶瓷
A. A B. B C. C D. D
2. 设为阿伏加德罗常数的值,下列说法正确的是
A. 溶液中,分子的数目为
B. 重水中所含质子数为
C. 足量的浓盐酸与反应,转移电子的数目为
D. 葡萄糖中,C原子的数目为
3. 下列有关溶液配制的叙述正确的是
A. 配制0.400 0 mol·L-1的NaOH溶液,称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,立即转移至250 mL容量瓶中定容
B. 用已准确称量的KBrO3固体配制一定体积的0.1 mol·L-1 KBrO3溶液时,用到的玻璃仪器有烧杯、玻璃棒、容量瓶和胶头滴管
C. 量取27.2 mL 18.4 mol·L-1浓硫酸于烧杯中,加水稀释、冷却后转移至500 mL容量瓶中即可得1.0 mol·L-1的H2SO4溶液
D. 称取0.158 g KMnO4固体,放入100 mL 容量瓶中,加水溶解并稀释至刻度,即可得到0.010 mol·L-1的KMnO4溶液
4. 下列有关物质的性质与用途正确且具有对应关系的是
A. 铁粉与氧化铝发生的铝热反应可用于焊接铁轨
B. 氯化铝是一种电解质,现在大规模用于电解法制铝
C. 明矾能水解生成胶体,可用作净水剂
D. 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块减缓其腐蚀
5. 常温下,下列各组离子在指定溶液中能大量共存的是
A 氨水溶液:Na+、K+、OH-、NO
B. 盐酸溶液:Na+、K+、SO、SiO
C. KMnO4溶液:NH、Na+、NO、I-
D. AgNO3溶液:NH、Mg2+、Cl-、SO
6. 下列转化在给定条件下不能实现的是
A. 饱和
B.
C.
D.
7. 能正确表示下列反应的离子方程式是
A. 溶液与少量溶液反应:
B. 电解水溶液:
C. 乙醇与酸性溶液反应:
D. 溶液中滴加稀氨水:
8. 下列A~D四组反应中,其中Ⅰ和Ⅱ可用同一个离子方程式表示的是
选项 Ⅰ Ⅱ
A 把金属铁放入稀硫酸中 把金属铁放入稀硝酸中
B 溶液中加入足量的溶液 溶液中加入足量的溶液
C 将通入的溶液中 将通入的溶液中
D 溶液与溶液反应恰好呈中性 溶液与溶液反应使恰好沉淀
A. A B. B C. C D. D
9. 向100mL 溶液中滴加 溶液,测得溶液电导率的变化如图。下列说法不正确的是
A. 和都强电解质
B. A→B电导率下降的主要原因是发生了反应:
C. B→C,溶液中的减小
D. A、B、C三点水的电离程度:A<B<C
10. 从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下。下列说法正确的是
A. 试剂a是铁、试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
C. 试剂c是氯气,相应的反应为2Fe2++Cl2=2Fe3++2Cl-
D. 用酸性KMnO4溶液可检验溶液W中是否含有Fe2+
11. 下列“类比”合理的是
A. Na与反应生成和,则Fe与反应生成和
B. 与盐酸反应生成和,则与盐酸反应生成和
C 溶液与反应生成和,则溶液与反应生成
D. 常温下Cu片可溶于浓硝酸中并放出红棕色气体,Fe片与浓硝酸反应更剧烈
12. 由下列实验操作及现象不能得出相应结论的是
实验操作 现象 结论
A 向KBr、KI混合溶液中依次加入少量氯水和,振荡,静置 溶液分层,下层呈紫红色 氧化性:
B 在火焰上灼烧搅拌过某无色溶液的铁丝 火焰出现黄色 溶液中含元素
C 用pH计测定pH: ①溶液 ②溶液 pH:①>② 酸性弱于
D 将一块未经打磨的铝片剪成相同的两小片,相同温度下分别投入5.0mL浓度均为2.0mol/L的溶液和溶液中 溶液中无明显现象;溶液中反应剧烈,铝片表面有红色物质生成 则能加速破坏铝片表面的氧化膜
A. A B. B C. C D. D
13. 工业上以软锰矿(主要成分是,含有、等少量杂质)为主要原料制备高性能的磁性材料碳酸锰,其工业流程如图。下列说法错误的是
A. 浸锰过程中与反应的离子方程式为
B. 过滤Ⅰ所得滤液中主要存在的金属阳离子为和
C. 滤渣Ⅱ的主要成分含有
D. 向过滤Ⅱ所得的滤液中加入溶液发生反应的主要离子方程式为
14. 工业生产中除去电石渣浆(含)中的并制取硫酸盐的一种常用流程如下图。下列说法正确的是
A. 碱性条件下,氧化性:
B. 过程Ⅰ中氧化剂和还原剂的物质的量之比为
C. 过程Ⅱ中,反应的离子方程式为
D. 将转化为理论上需要的体积为(标准状况)
二、非选择题(共58分)
15. 回答下列问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后,溶液中大量存在的阳离子有_______(填离子符号)。
(2)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、、Cl-、中的4种离子,且均为1mol。向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。则溶液中存在的离子是_______。
(3)高铁酸钾是一种既能杀菌消海、又能絮凝净水的水处理剂。其工业制备反应为(未配平),每生成,转移的电子数为_______。
(4)自然界中Cr主要以价和价形式存在。中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将还原。其离子方程式为_______。
16. 某磁性材料广泛应用于磁记录、催化等领域。一种制备该材料的流程如下:
已知反应原理为:①
②
③
(1)用溶液和溶液制备反应的离子方程式为_______。
(2)当时,产率极低的原因是_______。
(3)图1为回流时间与产率的关系图,图2为回流所得产品的X射线衍射图。回流所得产品中产生杂质可能的原因_______。
(4)一定条件下焙烧可制得负载型催化剂。准确称取负载型催化剂样品,置于锥形瓶中,加入适量稀盐酸,加热溶解后,滴加稍过量的溶液(将还原为),充分反应后,除去过量。用溶液滴定至终点(滴定过程中与反应生成和),消耗溶液。计算该负载型催化剂的负载量_____ (写出计算过程)。 [负载量=×100%]
17. 全球对锂资源的需求不断增长,“盐湖提锂”越来越受到重视。某兴趣小组取盐湖水进行浓缩和初步除杂后,得到浓缩卤水(含有、、和少量、),并设计了以下流程通过制备碳酸锂来提取锂。
25℃时相关物质的参数如下,回答下列问题:
的溶解度:
化合物
(1)“沉淀1”为_______。
(2)向“滤液1”中加入适量固体的目的是_______。
(3)为提高的析出量和纯度,“操作A”依次为_______、_______、洗涤。
(4)有同学建议用“侯氏制碱法”的原理制备。查阅资料后,发现文献对常温下的有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究的性质,将饱和溶液与饱和溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下_______(填“稳定”或“不稳定”),有关反应的离子方程式为_______。
(5)他们结合(4)的探究结果,拟将原流程中向“滤液2”加入改为通入。这一改动能否达到相同的效果,作出你的判断并给出理由:_______。
(6)在高温条件下,、葡萄糖和可制备电极材料,同时生成CO和H2O,该反应的化学方程式为_______。
18. 在处理NO废气的过程中,催化剂会逐渐失活变为。某小组为解决这一问题,实验研究和之间的相互转化。
资料:Ⅰ.
Ⅱ.
Ⅲ.和在酸性条件下均能生成
(1)探究的还原性
实验Ⅰ 粉红色的溶液或溶液在空气中久置,无明显变化。
实验Ⅱ 向溶液中滴入2滴酸性溶液,无明显变化。
实验Ⅲ 按如图装置进行实验,观察到电压表指针偏转。
①甲同学根据实验Ⅲ得出结论:能被酸性溶液氧化乙同学补充实验Ⅳ,_______(补全实验操作及现象),否定了该观点。
②探究碱性条件下Co(Ⅱ)的还原性,进行实验。
ⅱ中反应化学方程式是_______。
③根据氧化还原反应规律解释还原性:在碱性条件下,与、反应,使和均降低,但_______降低的程度更大,还原剂的还原性增强。
(2)探究的氧化性
①根据实验Ⅲ和Ⅳ推测氧化性:,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,_______(补全实验操作及现象),反应的离子方程式是_______。
②向Ⅴ中得到的棕褐色沉淀中,滴加溶液,加入催化剂,产生无色气泡,该气体是_______。
盐城市重点中学2023-2024学年高三上学期开学考试
化学试题 答案解析
考试时间:75分钟;分值:满分100分。
相对原子质量为:
一、单项选择题(本题共14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1. 近年来,我国在材料的开发和应用方面取得了举世瞩目的成就。下列属于金属材料的是
A.盾构机钻头刀刃的硬质钨合金 B.浙大科学家用冰制作出的“冰光纤” C.中科院研发的8英寸石墨烯晶圆 D.天和核心舱电推系统用到的氮化硼陶瓷
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A.钨合金属于金属材料,故A项正确;
B.冰的化学式是H2O,“冰光纤”属于无机非金属材料,故B项不正确;
C.石墨烯晶圆的主要成分是C,属于无机非金属材料,故C项不正确;
D.氮化硼陶瓷属于无机非金属材料,故D项不正确;
答案选A。
2. 设为阿伏加德罗常数的值,下列说法正确的是
A. 溶液中,分子的数目为
B. 重水中所含质子数为
C. 足量的浓盐酸与反应,转移电子的数目为
D. 葡萄糖中,C原子的数目为
【答案】D
【解析】
【详解】A.HCl是强酸,在溶液中全部以H+和Cl-的形成存在,故溶液中,分子的数目0,A错误;
B.重水中所含质子数为=0.9,B错误;
C.根据反应方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,故足量的浓盐酸与8.7g即=0.1mol反应,转移电子的数目为,C错误;
D.葡萄糖中,C原子的数目为=,D正确;
故答案为:D。
3. 下列有关溶液配制的叙述正确的是
A. 配制0.400 0 mol·L-1的NaOH溶液,称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,立即转移至250 mL容量瓶中定容
B. 用已准确称量的KBrO3固体配制一定体积的0.1 mol·L-1 KBrO3溶液时,用到的玻璃仪器有烧杯、玻璃棒、容量瓶和胶头滴管
C. 量取27.2 mL 18.4 mol·L-1浓硫酸于烧杯中,加水稀释、冷却后转移至500 mL容量瓶中即可得1.0 mol·L-1的H2SO4溶液
D. 称取0.158 g KMnO4固体,放入100 mL 容量瓶中,加水溶解并稀释至刻度,即可得到0.010 mol·L-1的KMnO4溶液
【答案】B
【解析】
【详解】A.n(NaOH)=m/M=4.0g÷40g/mol=0.1mol。NaOH在溶解时会放出大量热,因此需要冷却至室温后再转移到250mL容量瓶中,并且洗涤烧杯和玻璃棒2~3次,将洗涤液也转移到容量瓶中,以减小误差,A错误;
B.用已准确称量的KBrO3固体配制一定体积的0.1 mol·L-1 KBrO3溶液时,溶解时用到烧杯、玻璃棒,转移到容量瓶中,再用胶头滴管定容,B正确;
C.浓硫酸稀释时需要将浓硫酸沿烧杯内壁缓慢倒入蒸馏水中,并用玻璃棒不断搅拌,C错误;
D.容量瓶不能作为溶解容器,应在烧杯中进行溶解,D错误。
故本题选B。
4. 下列有关物质的性质与用途正确且具有对应关系的是
A. 铁粉与氧化铝发生的铝热反应可用于焊接铁轨
B. 氯化铝是一种电解质,现在大规模用于电解法制铝
C. 明矾能水解生成胶体,可用作净水剂
D. 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块减缓其腐蚀
【答案】C
【解析】
【详解】A.铁粉与氧化铝不反应,而是铝粉和氧化铁发生的铝热反应可用于焊接铁轨,A不合题意;
B.氯化铝是共价化合物,熔融的氯化铝不能导电,故现在大规模用于电解法制铝是电解熔融的氧化铝而不是氯化铝,B不合题意;
C.明矾能水解生成Al(OH)3胶体,胶体具有很强的吸附能力,可以吸附水中的悬浮杂质,故明矾可用作净水剂,C符合题意;
D.牺牲阳极的阴极保护法是用一个比保护的金属更活泼的金属作负极,失去电子,铜的金属活泼性比铁的差,不可在海轮外壳上装若干铜块减缓其腐蚀,而是要接一个锌块,D不合题意;
故答案为:C。
5. 常温下,下列各组离子在指定溶液中能大量共存的是
A. 氨水溶液:Na+、K+、OH-、NO
B. 盐酸溶液:Na+、K+、SO、SiO
C. KMnO4溶液:NH、Na+、NO、I-
D. AgNO3溶液:NH、Mg2+、Cl-、SO
【答案】A
【解析】
【详解】A.在0.1mol/L氨水中,四种离子可以大量共存,A选;
B.在0.1mol/L盐酸中含有大量氢离子,四种离子中硅酸根可以与氢离子反应生成硅酸沉淀,故不能共存,B不选;
C.具有强氧化性,可以将碘离子氧化成碘单质,故不能共存,C不选;
D.在0.1mol/L硝酸银溶液中,银离子可以与氯离子、硫酸根离子反应生成氯化银、硫酸银沉淀,不能共存,D不选;
故选A。
6. 下列转化在给定条件下不能实现的是
A. 饱和
B.
C.
D
【答案】A
【解析】
【详解】A.饱和NaCl溶液与CO2不反应,A符合题意;
B.MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓,Mg(OH)2MgO+H2O,B不合题意;
C.Fe+2HCl=FeCl2+H2↑,2FeCl2+Cl2=2FeCl3,2FeCl3+Fe=3FeCl2,C不合题意;
D.2NaOH+CO2=Na2CO3+H2O,Na2CO3+H2O+CO2=2NaHCO3,NaHCO3+NaOH=Na2CO3+H2O,D不合题意;
故答案为:A。
7. 能正确表示下列反应的离子方程式是
A. 溶液与少量溶液反应:
B. 电解水溶液:
C. 乙醇与酸性溶液反应:
D. 溶液中滴加稀氨水:
【答案】C
【解析】
【详解】A.溶液与少量溶液反应生成BaSO4和Fe(OH)2沉淀,故该离子方程式为:,A错误;
B.电解MgCl2水溶液将生成Mg(OH)2沉淀,该离子方程式为:,B错误;
C.乙醇与酸性溶液反应的离子方程式为:,C正确;
D.氨水在离子方程式书写时不能拆,故溶液中滴加稀氨水的离子方程式为:,D错误;
故答案为:C。
8. 下列A~D四组反应中,其中Ⅰ和Ⅱ可用同一个离子方程式表示的是
选项 Ⅰ Ⅱ
A 把金属铁放入稀硫酸中 把金属铁放入稀硝酸中
B 溶液中加入足量的溶液 溶液中加入足量的溶液
C 将通入的溶液中 将通入的溶液中
D 溶液与溶液反应恰好呈中性 溶液与溶液反应使恰好沉淀
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A.把金属铁放入稀硫酸中的离子方程式为:Fe+2H+=Fe2++H2↑,把金属铁放入稀硝酸中的离子方程式为:Fe+4H++=Fe3++NO↑+2H2O,A不合题意;
B.溶液中加入足量的溶液的离子方程式为:Ca2++2+2OH-=CaCO3↓+2H2O+,溶液中加入足量的溶液的离子方程式为:Ca2++2+2OH-=CaCO3↓+2H2O+,B符合题意;
C.将通入的溶液中的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,将通入的溶液中的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,C不合题意;
D.溶液与溶液反应恰好呈中性的离子方程式为:Ba2++2OH-+2H++=BaSO4↓+2H2O,溶液与溶液反应使恰好沉淀的离子方程式为:Ba2++OH-+H++=BaSO4↓+H2O,D不合题意;
故答案为:B。
9. 向100mL 溶液中滴加 溶液,测得溶液电导率的变化如图。下列说法不正确的是
A. 和都是强电解质
B. A→B电导率下降的主要原因是发生了反应:
C. B→C,溶液中的减小
D. A、B、C三点水的电离程度:A<B<C
【答案】B
【解析】
【详解】A. 和在溶液中均完全电离,均属于强电解质,故A正确;
B.A→B加入的物质的量小于的物质的量,发生的反应为,故B错误;
C.B→C时加入的继续消耗氢氧根离子,C点两者恰好完全反应,因此B→C溶液中减小,故C正确;
D.酸或碱抑制水的电离,含有弱离子的盐水解促进水的电离,A点溶液中全部是,水的电离受到抑制,电离程度最小,B点为反应一半点,氢氧化钡还有剩余,C点和恰好完全反应,因此水的电离程度:A<B<C,故D正确;
答案选B。
10. 从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下。下列说法正确的是
A. 试剂a是铁、试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
C. 试剂c是氯气,相应的反应为2Fe2++Cl2=2Fe3++2Cl-
D. 用酸性KMnO4溶液可检验溶液W中是否含有Fe2+
【答案】C
【解析】
【分析】
【详解】A.由最终要得到的氯化铁及流程图知b是盐酸,A错误;
B.操作Ⅰ和操作Ⅱ是过滤,操作Ⅲ为蒸发结晶,所用仪器有差异,B错误;
C.滤液Z和X中均含有氯化亚铁,因此c为氯气,C正确;
D.高锰酸钾能氧化氯离子而褪色,因此不能用于检验是否含有亚铁离子,D错误;
故选C。
11. 下列“类比”合理的是
A. Na与反应生成和,则Fe与反应生成和
B. 与盐酸反应生成和,则与盐酸反应生成和
C. 溶液与反应生成和,则溶液与反应生成
D. 常温下Cu片可溶于浓硝酸中并放出红棕色气体,Fe片与浓硝酸反应更剧烈
【答案】B
【解析】
【详解】A.Fe与H2O(g)反应生成Fe3O4和H2,“类比”不合理,故A错误;
B.Na3N与盐酸发生水解反应生成NaCl和NH4Cl,则Mg3N2与盐酸反应生成MgCl2和NH4Cl,“类比”合理,故B正确;
C.NaClO溶液具有强氧化性,将SO2氧化反应生成Na2SO4,“类比”不合理,故C错误;
D.常温下,Fe片与浓硝酸会钝化,故D错误;
故选B。
12. 由下列实验操作及现象不能得出相应结论的是
实验操作 现象 结论
A 向KBr、KI混合溶液中依次加入少量氯水和,振荡,静置 溶液分层,下层呈紫红色 氧化性:
B 在火焰上灼烧搅拌过某无色溶液的铁丝 火焰出现黄色 溶液中含元素
C 用pH计测定pH: ①溶液 ②溶液 pH:①>② 酸性弱于
D 将一块未经打磨的铝片剪成相同的两小片,相同温度下分别投入5.0mL浓度均为2.0mol/L的溶液和溶液中 溶液中无明显现象;溶液中反应剧烈,铝片表面有红色物质生成 则能加速破坏铝片表面的氧化膜
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A.向、混合溶液中依次加入少量氯水和,振荡,静置,溶液分层,下层呈紫红色,则是氯水将碘离子氧化得到碘单质,能得出氧化性:,故A不符合题意;
B.在火焰上灼烧搅拌过某无色溶液的铁丝,火焰出现黄色,能推出溶液中含有钠元素,故B不符合题意;
C.溶液与溶液浓度未知,不能通过的大小来分析与的酸性强弱,只有同浓度的两种溶液才能比较,故C符合题意;
D.根据题意说明,两溶液的单一变量是阴离子的种类,从现象可说明能加速破坏铝片表面的氧化膜,故D不符合题意;
故选C。
13. 工业上以软锰矿(主要成分是,含有、等少量杂质)为主要原料制备高性能的磁性材料碳酸锰,其工业流程如图。下列说法错误的是
A. 浸锰过程中与反应的离子方程式为
B. 过滤Ⅰ所得滤液中主要存在的金属阳离子为和
C. 滤渣Ⅱ的主要成分含有
D. 向过滤Ⅱ所得的滤液中加入溶液发生反应的主要离子方程式为
【答案】D
【解析】
【分析】浸锰过程通入过量的SO2,将Mn4+和Fe3+还原成Mn2+和Fe2+,过滤Ⅰ所得滤渣为SiO2,加入MnO2氧化,此时溶液中可以被氧化的物质有Fe2+和未反应的SO2,调pH是为了将上一步氧化生成的Fe3+沉淀下来与Mn2+分离,加入NH4HCO3溶液将Mn2+沉淀下来,再经过一系列步骤可得到纯的MnCO3。
【详解】A.根据上述分析可知,浸锰过程通入过量的SO2,将Mn4+和Fe3+还原成Mn2+和Fe2+,反应的离子方程式为:Fe2O3+SO2+2H+=2Fe2++SO+H2O,A正确;
B.过量的SO2,将Mn4+和Fe3+还原成Mn2+和Fe2+,因此过滤I所得滤液中主要存在的金属阳离子为Mn2+和Fe2+,B正确;
C.调pH=3.7,将Fe3+转化为氢氧化铁沉淀,过滤,滤渣Ⅱ的主要成分含有Fe(OH)3,C正确;
D.滤液为硫酸锰溶液,向滤液种加入适量NH4HCO3溶液,生成MnCO3沉淀,同时二氧化碳生成,发生的反应为:Mn2++2HCO=MnCO3↓+CO2↑+H2O,D错误;
故选D。
14. 工业生产中除去电石渣浆(含)中的并制取硫酸盐的一种常用流程如下图。下列说法正确的是
A. 碱性条件下,氧化性:
B. 过程Ⅰ中氧化剂和还原剂的物质的量之比为
C. 过程Ⅱ中,反应的离子方程式为
D. 将转化为理论上需要的体积为(标准状况)
【答案】C
【解析】
【分析】由流程可知,CaO与硫酸锰反应生成Mn(OH)2,通入氧气生成,过程Ⅰ中反应的离子方程式为2Mn(OH)2+O2+4OH-=2+4H2O;与S2-反应生,进而与氧气反应生成,过程Ⅱ中反应的离子方程式为4+2S2-+9H2O═+4Mn(OH)2↓+10OH-,以此解答该题。
【详解】A.由分析可知,碱性条件下,O2能将Mn(OH)2氧化,能将S2-氧化为,故氧化性:,A错误;
B.由分析可知,过程Ⅰ中反应的离子方程式为2Mn(OH)2+O2+4OH-=2+4H2O,故过程Ⅰ中氧化剂O2和还原剂Mn(OH)2的物质的量之比为,B错误;
C.由分析可知,过程Ⅱ中,反应的离子方程式为,C正确;
D.根据得失电子守恒1mol×8=n(O2)×4,n(O2)=2mol,将1molS2-转化为理论上需要O2的体积2mol×22.4L/mol=44.8L,D错误;
故答案为:C。
二、非选择题(共58分)
15. 回答下列问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后,溶液中大量存在的阳离子有_______(填离子符号)。
(2)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、、Cl-、中的4种离子,且均为1mol。向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。则溶液中存在的离子是_______。
(3)高铁酸钾是一种既能杀菌消海、又能絮凝净水的水处理剂。其工业制备反应为(未配平),每生成,转移的电子数为_______。
(4)自然界中Cr主要以价和价形式存在。中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将还原。其离子方程式为_______。
【答案】(1)Fe2+、Fe3+、H+
(2)Na+、Fe2+、、
(3)1.806×1024
(4)3++8H+= 2Cr3++3+4H2O
【解析】
【小问1详解】
FeC在足量的空气中高温煅烧,生成有磁性的固体Y,可知Y为Fe3O4,溶于过量的盐酸反应生成氯化亚铁、氯化铁,溶液有剩余的HCl,所以溶液中大量存在的阳离子为Fe2+、Fe3+、H+,故答案为:Fe2+、Fe3+、H+;
小问2详解】
向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变,则一定发生Fe2+、的氧化还原反应生成硝酸铁和NO,阴离子种类不变,说明原溶液中原来已经存在,则不含Ba2+,又溶液中含有四种离子,反应生成了Fe3+,所含离子的物质的量均为1mol,由电荷守恒可知,含有带一个单位正电荷的阳离子,即一定含有Na+,由上述推断可知,该溶液中所含的离子为:Na+、Fe2+、、,故答案为:Na+、Fe2+、、;
【小问3详解】
Fe由+3价被氧化为+6价,故每生成,转移的电子数为3×6.02×1023=1.806×1024个,故答案为:1.806×1024;
【小问4详解】
自然界中Cr主要以价和价形式存在。中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将还原,即被还原为Cr3+,被氧化为,故该反应的其离子方程式为3++8H+= 2Cr3++3+4H2O,故答案为:3++8H+= 2Cr3++3+4H2O。
16. 某磁性材料广泛应用于磁记录、催化等领域。一种制备该材料流程如下:
已知反应原理为:①
②
③
(1)用溶液和溶液制备反应的离子方程式为_______。
(2)当时,产率极低的原因是_______。
(3)图1为回流时间与产率的关系图,图2为回流所得产品的X射线衍射图。回流所得产品中产生杂质可能的原因_______。
(4)一定条件下焙烧可制得负载型催化剂。准确称取负载型催化剂样品,置于锥形瓶中,加入适量稀盐酸,加热溶解后,滴加稍过量的溶液(将还原为),充分反应后,除去过量。用溶液滴定至终点(滴定过程中与反应生成和),消耗溶液。计算该负载型催化剂的负载量_____ (写出计算过程)。 [负载量=×100%]
【答案】(1)4Fe2++8OH-Fe/Fe3O4+4H2O
(2)氢氧根离子浓度小,难以生成Fe(OH)2
(3)Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O反应速率慢
(4)28.8%
【解析】
【小问1详解】
FeCl2溶液和KOH溶液在100℃条件下反应生成Fe/Fe3O4、KCl、H2O,用FeCl2溶液和KOH溶液制备Fe/Fe3O4反应的离子方程式为4Fe2++8OH-Fe/Fe3O4+4H2O,故答案为:4Fe2++8OH-Fe/Fe3O4+4H2O;
【小问2详解】
当pH<2时,溶液为酸性,氢氧根离子浓度小,难以生成Fe(OH)2,所以Fe/Fe3O4产率极低,故答案为:氢氧根离子浓度小,难以生成Fe(OH)2;
【小问3详解】
Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O反应速率慢,所以回流1h所得产品Fe/Fe3O4中产生杂质,故答案为:Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O反应速率慢;
【小问4详解】
滴定过程中与Fe2+反应生成Cr3+和Fe3+的离子方程式为:14H+++6Fe2+=2Cr3++6Fe3++7H2O,n()=c()V()=5.000×10-2mol/L×24.00×10-3L=1.2×10-3mol,参加反应的各物质的物质的量之比等于化学计量数之比,则n(Fe2+)=6n()=6×1.2×10-3mol=7.2×10-3mol,根据Fe原子守恒可得关系式:Fe2O3~2Fe3+~2Fe2+,则n(Fe2O3)=0.5n(Fe2+)=0.5×7.2×10-3mol=3.600×10-3mol,m(Fe2O3)=n(Fe2O3)M(Fe2O3)=3.600×10-3mol×160g/mol=0.576g,负载量=×100%=×100%=28.8%,故答案为:28.8%。
17. 全球对锂资源的需求不断增长,“盐湖提锂”越来越受到重视。某兴趣小组取盐湖水进行浓缩和初步除杂后,得到浓缩卤水(含有、、和少量、),并设计了以下流程通过制备碳酸锂来提取锂。
25℃时相关物质的参数如下,回答下列问题:
的溶解度:
化合物
(1)“沉淀1”为_______。
(2)向“滤液1”中加入适量固体的目的是_______。
(3)为提高的析出量和纯度,“操作A”依次为_______、_______、洗涤。
(4)有同学建议用“侯氏制碱法”的原理制备。查阅资料后,发现文献对常温下的有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究的性质,将饱和溶液与饱和溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下_______(填“稳定”或“不稳定”),有关反应的离子方程式为_______。
(5)他们结合(4)的探究结果,拟将原流程中向“滤液2”加入改为通入。这一改动能否达到相同的效果,作出你的判断并给出理由:_______。
(6)在高温条件下,、葡萄糖和可制备电极材料,同时生成CO和H2O,该反应的化学方程式为_______。
【答案】(1)Mg(OH)2
(2)将Ca2+转化成CaCO3沉淀除去,且不引入新杂质
(3) ①. 蒸发结晶 ②. 趁热过滤
(4) ①. 不稳定 ②. 2Li++2=Li2CO3↓+CO2↑+H2O
(5)能达到相同效果,如果改为通入过量的CO2,LiOH转化为LiHCO3,结合(4)的探究结果知,LiHCO3会很快分解产生Li2CO3,所以这一改动能达到相同的效果
(6)6Li2CO3+C6H12O6+12FePO412LiFePO4+6CO↑+6H2O+6CO2↑
【解析】
【分析】浓缩卤水中含有Na+、Li+、Cl-和少量Mg2+、Ca2+,向浓缩卤水中加入石灰乳,Mg2+生成Mg(OH)2沉淀,过滤后得到的沉淀1为Mg(OH)2,向滤液1中加入Li2CO3,Ca2+转化为CaCO3沉淀,然后过滤洗涤得到沉淀2为CaCO3,CaCO3热分解、水合得到石灰乳;滤液2中加入Na2CO3,Li+转化为Li2CO3沉淀,过滤后得到Li2CO3,滤液3中含有Na+、Cl-和过量的CO32-,Li2CO3通过一系列操作得到Li,据此分析解题。
【小问1详解】
浓缩卤水中含有Mg2+,Mg2+和石灰乳反应生成Mg(OH)2沉淀,所以沉淀1为Mg(OH)2,故答案为:Mg(OH)2;
【小问2详解】
滤液1中含有Ca2+,根据LiOH的溶解度及溶度积常数知,Li2CO3能和Ca2+反应生成CaCO3,发生沉淀的转化,所以加入Li2CO3的目的是将Ca2+转化成CaCO3沉淀除去,同时不引入新杂质,故答案为:将Ca2+转化成CaCO3沉淀除去,且不引入新杂质;
【小问3详解】
由Li2CO3的溶解度曲线可知,Li2CO3的溶解度随着温度的升高而减小,为提高Li2CO3的析出量和纯度,需要在较高温度下析出并过滤得到沉淀,即依次蒸发结晶、趁热过滤、洗涤,故答案为:蒸发结晶;趁热过滤;
【小问4详解】
饱和LiCl和饱和NaHCO3等体积混合后,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀,说明开始时生成LiHCO3和NaCl,随后LiHCO3分解产生了CO2和Li2CO3,所以LiHCO3不稳定,发生的反应为Li++=LiHCO3、2LiHCO3=Li2CO3↓+CO2↑+H2O,则总离子方程式为2Li++2=Li2CO3↓+CO2↑+H2O,故答案为:不稳定;2Li++2=Li2CO3↓+CO2↑+H2O;
【小问5详解】
“滤液2”中含有LiOH,加入Na2CO3,目的是将LiOH转化为Li2CO3,若改为通入过量的CO2,则LiOH转化为LiHCO3,结合(4)的探究结果,LiHCO3也会很快分解产生Li2CO3,所以这一改动能达到相同的效果,故答案为:能达到相同效果;如果改为通入过量的CO2,LiOH转化为LiHCO3,结合(4)的探究结果知,LiHCO3会很快分解产生Li2CO3,所以这一改动能达到相同的效果。
【小问6详解】
在高温条件下,、葡萄糖和可制备电极材料,同时生成CO和H2O,根据氧化还原反应配平可得,该反应的化学方程式为6Li2CO3+C6H12O6+12FePO412LiFePO4+6CO↑+6H2O+6CO2↑,故答案为:6Li2CO3+C6H12O6+12FePO412LiFePO4+6CO↑+6H2O+6CO2↑。
18. 在处理NO废气的过程中,催化剂会逐渐失活变为。某小组为解决这一问题,实验研究和之间的相互转化。
资料:Ⅰ.
Ⅱ.
Ⅲ.和在酸性条件下均能生成
(1)探究的还原性
实验Ⅰ 粉红色的溶液或溶液在空气中久置,无明显变化。
实验Ⅱ 向溶液中滴入2滴酸性溶液,无明显变化。
实验Ⅲ 按如图装置进行实验,观察到电压表指针偏转。
①甲同学根据实验Ⅲ得出结论:能被酸性溶液氧化。乙同学补充实验Ⅳ,_______(补全实验操作及现象),否定了该观点。
②探究碱性条件下Co(Ⅱ)的还原性,进行实验。
ⅱ中反应的化学方程式是_______。
③根据氧化还原反应规律解释还原性:在碱性条件下,与、反应,使和均降低,但_______降低的程度更大,还原剂的还原性增强。
(2)探究的氧化性
①根据实验Ⅲ和Ⅳ推测氧化性:,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,_______(补全实验操作及现象),反应的离子方程式是_______。
②向Ⅴ中得到棕褐色沉淀中,滴加溶液,加入催化剂,产生无色气泡,该气体是_______。
【答案】(1) ①. 将实验Ⅲ中的0.1mol/LCoCl2溶液替换为0.2mol/LNaCl溶液进行实验,指针偏转幅度与实验Ⅲ相同 ②. 4CO(OH)2+O2+2H2O=4Co(OH)3 ③. c(Co3+)
(2) ①. 加入适量盐酸,棕褐色沉淀溶解,产生黄色有刺激性气味的气体,溶液变为粉红色 ②. 2CO(OH)3+6H++2Cl-=2Co2++Cl2↑+6H2O ③. O2
【解析】
【小问1详解】
①乙同学补充实验Ⅳ,设计不含Co2+但氯离子浓度相同的溶液代替0.1mol/LCoCl2进行实验,如将实验Ⅲ中的0.1mol/LCoCl2溶液替换为0.2mol/LNaCl溶液进行实验,指针偏转幅度与实验Ⅲ相同,从而否定甲同学实验Ⅲ得出结论:Co2+可以被酸性KMnO4溶液氧化;故答案为:将实验Ⅲ中的0.1mol/LCoCl2溶液替换为0.2mol/LNaCl溶液进行实验,指针偏转幅度与实验Ⅲ相同;
②ⅱ中蓝色沉淀Co(OH)2在空气中缓慢反应被氧化生成棕褐色沉淀Co(OH)3,反应的化学方程式是4CO(OH)2+O2+2H2O=4Co(OH)3;故答案为:4CO(OH)2+O2+2H2O=4Co(OH)3;
③根据氧化还原反应规律解释还原性Co(OH)2>Co2+:Co2+-e-═Co3+在碱性条件下,OH-与Co2+、Co3+反应,使c(Co2+)和c(Co3+)均降低,但c(Co3+)降低的程度更大,还原剂的还原性增强;故答案为:c(Co3+);
【小问2详解】
①向Ⅴ中得到的棕褐色沉淀中,加入适量盐酸,棕褐色沉淀溶解,产生黄色有刺激性气味的气体,溶液变为粉红色,证明:实验Ⅲ和Ⅳ推测氧化性:Co3+>Cl2;实验中酸性条件下Co (OH)3将氯离子氧化成氯气,反应的离子方程式是:2Co(OH)3+6H++2Cl-=2Co2++Cl2↑+6H2O;故答案为:加入适量盐酸,棕褐色沉淀溶解,产生黄色有刺激性气味的气体,溶液变为粉红色;2Co (OH)3+6H++2Cl-=2Co2++Cl2↑+6H2O;
②向Ⅴ中得到的棕褐色沉淀中,滴加H2SO4溶液,加入催化剂,产生无色气泡,该气体是O2;故答案为:O2。
同课章节目录
