2 实验活动1 配制一定物质的量浓度的溶液课件(共21张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2 实验活动1 配制一定物质的量浓度的溶液课件(共21张PPT)-2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 844.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-05 00:00:00 | ||
图片预览








文档简介
(共21张PPT)
第2章 海水中的重要元素—
钠和氯
实验活动1 配制一定物质
的量浓度的溶液
导入
实验目的:
1.练习容量瓶的使用方法。
2.练习配制一定物质的量浓度的溶液。
3.加深对物质的量浓度概念的认识。
一、知识梳理,夯实基础
一、基础知识
1.一种或几种物质分散到另一种物质里,形成______的、______的混合物,叫做溶液。能溶解其他物质的物质叫做______,被溶解的物质叫做溶质。
2.物质的量浓度表示单位体积的溶液里所含溶质 B 的_________,符号为______。100 mL 1.0 mol/L NaCl溶液表示在 1 L _______中,含有的溶质是________。
均一
稳定
溶剂
物质的量
cB
溶液
1.0 mol
一、知识梳理,夯实基础
二、容量瓶的使用
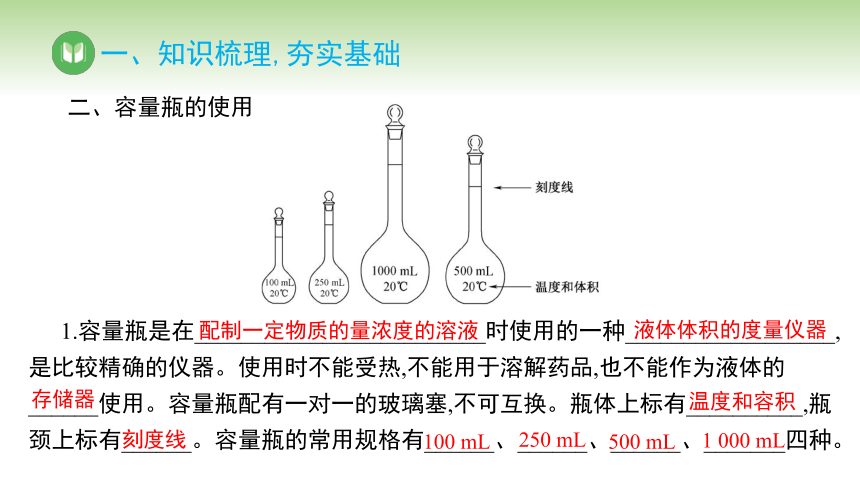
1.容量瓶是在_________________________时使用的一种__________________,是比较精确的仪器。使用时不能受热,不能用于溶解药品,也不能作为液体的 ______使用。容量瓶配有一对一的玻璃塞,不可互换。瓶体上标有__________,瓶颈上标有______。容量瓶的常用规格有______、______、______、_______四种。
配制一定物质的量浓度的溶液
液体体积的度量仪器
存储器
温度和容积
刻度线
100 mL
250 mL
500 mL
1 000 mL
一、知识梳理,夯实基础
2.容量瓶的使用方法
(1)检验容量瓶是否漏液的方法是__________________________________
______________________________________________________________
_____________________________________。
(2)向容量瓶中加液体时要用___________。
(3)容量瓶中溶液的定容方法是____________________________________
___________________________________________________________。
(4)将定容后的容量瓶中的液体混合均匀的方法是___________________
———————————————。
往容量瓶中加入一定量的水,盖好并按住
瓶塞,另一只手托住瓶底,把瓶倒立,观察是否有水漏出;如果不漏水,再将瓶塞旋转180°后盖好,倒立,再检查是否有水漏出
玻璃棒引流
将蒸馏水注入容量瓶,当液面离容量瓶颈刻
度线1~2cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切
用食指按住瓶塞,另一
只手托住瓶底,反复上下颠倒数次
一、知识梳理,夯实基础
三、托盘天平的使用
在配制一定物质的量浓度的溶液时,应使用分析天平或电子天平(用于精确称量的仪器),但在中学阶段可用托盘天平代替。使用托盘天平时的注意事项:①先调零,使天平平衡;②称量时,_____________________;③样品不能直接放在托盘上,应____________________________________________;④砝码要从大到小依次放,称量完毕后要将__________________________。
样品放在左盘,砝码放在右盘
在托盘上各放一张质量相同的称量纸,再将药品放在称量纸上
砝码由大到小放回砝码盒,游码复原
一、知识梳理,夯实基础
容量瓶、托盘天平、量筒、烧杯、玻璃棒使用时的注意事项。
1.容量瓶
(1)不能将固体或浓溶液直接在容量瓶中溶解或稀释。
(2)不能作为反应容器或长期贮存溶液的容器,不能用来加热。
(3)不能配制任意体积的溶液,只能配制容量瓶上规定容积的溶液。
(4)选用容量瓶的原则———“大而近”,如需配制 90 mL 溶液,应选用 100 mL 的容量瓶。
(5)选用容量瓶时应指明其规格。
(6)往容量瓶中转移液体时,要用玻璃棒引流,玻璃棒末端应在容量瓶刻度线以下。
一、知识梳理,夯实基础
2.托盘天平
(1)使用前调零。
(2)药品不能直接放在托盘上。
(3)左物右码,先大后小。
(4)读数至小数点后 1 位。
(5)用托盘天平称量,物体和砝码放反时,不一定有误差。若没有用到游码,则无误差;若用到游码,则按照“药品的质量=砝码的质量-游码的质量”来计算。
一、知识梳理,夯实基础
3.量筒
(1)不能作为反应容器。
(2)不能将浓溶液直接在量筒中稀释。
(3)倒出量取的液体后不必洗涤量筒。
4.烧杯
(1)用于溶解固体或稀释浓溶液。
(2)将溶液注入容量瓶后,必须将烧杯洗涤 2~3 次,洗涤液也注入容量瓶。
5.玻璃棒
(1)在溶液配制中的作用是搅拌、引流。
(2)搅拌时勿触碰烧杯内壁,引流时注意玻璃棒下端应在刻度线以下。
二、分组实验,提升能力
配制 100 mL 1.00 mol/L NaCl溶液。
用固体试剂配制溶液的基本步骤:
计算
称量
溶解
移液
洗涤
定容
摇匀
装瓶
二、分组实验,提升能力
1.在溶解溶质时一般会有放热或吸热的现象,需要等液体恢复到室温才能转移入容量瓶中,为什么
因为容量瓶的刻度线所指示的体积是在指定温度下的数据,只有在该温度下使用才能保证所配制溶液浓度的准确性。
2.将烧杯中的溶液注入容量瓶后,要用蒸馏水洗涤烧杯内壁和玻璃棒2~3次,这样操作的原因是什么
确保溶质完全转移到容量瓶中。
二、分组实验,提升能力
3.如果在读数时,俯视容量瓶上的刻度线,最后配成的溶液中溶质的实际浓度比所要求的大了还是小了 如果在读数时,仰视容量瓶上的刻度线呢
俯视容量瓶的刻度线时,读数偏高,液体的实际体积<读数,配成的溶液中溶质的实际浓度>要求的浓度。仰视容量瓶的刻度线时,读数偏低,液体的实际体积>读数,配成的溶液中溶质的实际浓度<要求的浓度。
三、配制一定物质的量浓度溶液时的误差分析
依据 cB=nBV ,分析实验过程中 nB、V 的变化情况,若nB 减小,则 cB 偏低,若 nB 增大,则 cB偏高;若V 增大,则 cB 偏低,则V 减小,则 cB 偏高。
以配制某浓度的NaOH溶液为例,判断cB 误差的具体情况分析。
可能引起误差的操作 变化的量 实际浓度
①药品、砝码左右位置颠倒(用到游码)
②称量时间过长,因NaOH易潮解,会使称量的NaOH质量偏小
③NaOH放在滤纸上称量,NaOH 易潮解,会有少量NaOH 黏附在滤纸上
④转移溶液时,有少量溶液溅在容量瓶外
nB 减小
cB 偏低
nB 减小
cB 偏低
cB 偏低
cB 偏低
nB 减小
nB 减小
三、配制一定物质的量浓度溶液时的误差分析
可能引起误差的操作 变化的量 实际浓度
⑤转移溶液时,未洗涤烧杯和玻璃棒
⑥溶解后,溶液未冷却至室温就转移到容量瓶中定容
⑦定容时,加水超过刻度线,用胶头滴管吸出部分液体,使液面与刻度线相切
⑧ 定容时仰视刻度线
⑨ 定容时俯视刻度线
⑩定容摇匀后,发现液面低于刻度线,补加水至刻度线
容量瓶洗净后未经干燥就直接使用
nB 减小
cB 偏低
V减小
cB 偏高
nB 减小
cB 偏低
V增大
cB 偏低
V减小
cB 偏高
V增大
cB 偏低
对nB、V不产生影响
对cB 无影响
总结
本节课通过小组实验实操了“用固体试剂配制一定物质的量浓度的溶液”的基本步骤。容量瓶的使用,溶液配制过程中溶解、移液、定容的正确操作,以及实验误差分析是重要的考点。
课堂练习
1.实验室里需配制 480 mL 0.1 mol·L-1的硫酸铜溶液,以下操作正
确的是 ( )
A.称取 7.680 g 硫酸铜,加入 500 mL 水
B.称取 12.000 g 胆矾配成 500 mL 溶液
C.称取 12.500 g 胆矾配成 500 mL 溶液
D.称取 8.000 g 硫酸铜,加入 500 mL 水
C
课堂练习
2.从 200 mL 6.0 mol·L-1Fe2(SO4)3 溶液中取出 10 mL 稀释至200 mL ,
则稀释后溶液中SO42-的物质的量浓度是 ( )
A.0.015 mol· L-1
B.0.045 mol·L-1
C.0.30 mol· L-1
D.0.90 mol· L-1
D
课堂练习
3.取 100 mL 0.3 mol/L 的硝酸和 300 mL 0.25 mol/L 的硫酸注入
500 mL 的容量瓶中,加水稀释至刻度线,该混合溶液中H+ 的物质
的量浓度是 ( )
A.0.18 mol/L B.0.36 mol/L
C.0.2 mol/L D.0.4 mol/L
B
课堂练习
4.下列说法正确的是 ( )
A.将 5.85 g NaCl固体溶于 1 L 水,所得NaCl溶液物质的量浓度为0.1mol/L
B.配制 480 mL 0.2 mol/L NaOH 溶液,需称量NaOH固体的质量为3.84 g
C.质量分数为98%的浓硫酸与等体积水混合后,硫酸的质量分数大于49%
D.定容后摇匀,发现液面低于刻度线,又补加少量水,重新达到刻度线
C
课堂练习
5.配制 400 mL 0.100 mol/L 的KCl溶液,下列说法正确的是 ( )
A.上述实验步骤的正确顺序为④①②③
B.容量瓶需要用自来水、蒸馏水洗涤,干燥后才可用
C.实验中需称量 2.98 g KCl固体
D.定容时,若仰视容量瓶的刻度线,会使配得的KCl溶液浓度偏低
D
谢谢!
第2章 海水中的重要元素—
钠和氯
实验活动1 配制一定物质
的量浓度的溶液
导入
实验目的:
1.练习容量瓶的使用方法。
2.练习配制一定物质的量浓度的溶液。
3.加深对物质的量浓度概念的认识。
一、知识梳理,夯实基础
一、基础知识
1.一种或几种物质分散到另一种物质里,形成______的、______的混合物,叫做溶液。能溶解其他物质的物质叫做______,被溶解的物质叫做溶质。
2.物质的量浓度表示单位体积的溶液里所含溶质 B 的_________,符号为______。100 mL 1.0 mol/L NaCl溶液表示在 1 L _______中,含有的溶质是________。
均一
稳定
溶剂
物质的量
cB
溶液
1.0 mol
一、知识梳理,夯实基础
二、容量瓶的使用
1.容量瓶是在_________________________时使用的一种__________________,是比较精确的仪器。使用时不能受热,不能用于溶解药品,也不能作为液体的 ______使用。容量瓶配有一对一的玻璃塞,不可互换。瓶体上标有__________,瓶颈上标有______。容量瓶的常用规格有______、______、______、_______四种。
配制一定物质的量浓度的溶液
液体体积的度量仪器
存储器
温度和容积
刻度线
100 mL
250 mL
500 mL
1 000 mL
一、知识梳理,夯实基础
2.容量瓶的使用方法
(1)检验容量瓶是否漏液的方法是__________________________________
______________________________________________________________
_____________________________________。
(2)向容量瓶中加液体时要用___________。
(3)容量瓶中溶液的定容方法是____________________________________
___________________________________________________________。
(4)将定容后的容量瓶中的液体混合均匀的方法是___________________
———————————————。
往容量瓶中加入一定量的水,盖好并按住
瓶塞,另一只手托住瓶底,把瓶倒立,观察是否有水漏出;如果不漏水,再将瓶塞旋转180°后盖好,倒立,再检查是否有水漏出
玻璃棒引流
将蒸馏水注入容量瓶,当液面离容量瓶颈刻
度线1~2cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切
用食指按住瓶塞,另一
只手托住瓶底,反复上下颠倒数次
一、知识梳理,夯实基础
三、托盘天平的使用
在配制一定物质的量浓度的溶液时,应使用分析天平或电子天平(用于精确称量的仪器),但在中学阶段可用托盘天平代替。使用托盘天平时的注意事项:①先调零,使天平平衡;②称量时,_____________________;③样品不能直接放在托盘上,应____________________________________________;④砝码要从大到小依次放,称量完毕后要将__________________________。
样品放在左盘,砝码放在右盘
在托盘上各放一张质量相同的称量纸,再将药品放在称量纸上
砝码由大到小放回砝码盒,游码复原
一、知识梳理,夯实基础
容量瓶、托盘天平、量筒、烧杯、玻璃棒使用时的注意事项。
1.容量瓶
(1)不能将固体或浓溶液直接在容量瓶中溶解或稀释。
(2)不能作为反应容器或长期贮存溶液的容器,不能用来加热。
(3)不能配制任意体积的溶液,只能配制容量瓶上规定容积的溶液。
(4)选用容量瓶的原则———“大而近”,如需配制 90 mL 溶液,应选用 100 mL 的容量瓶。
(5)选用容量瓶时应指明其规格。
(6)往容量瓶中转移液体时,要用玻璃棒引流,玻璃棒末端应在容量瓶刻度线以下。
一、知识梳理,夯实基础
2.托盘天平
(1)使用前调零。
(2)药品不能直接放在托盘上。
(3)左物右码,先大后小。
(4)读数至小数点后 1 位。
(5)用托盘天平称量,物体和砝码放反时,不一定有误差。若没有用到游码,则无误差;若用到游码,则按照“药品的质量=砝码的质量-游码的质量”来计算。
一、知识梳理,夯实基础
3.量筒
(1)不能作为反应容器。
(2)不能将浓溶液直接在量筒中稀释。
(3)倒出量取的液体后不必洗涤量筒。
4.烧杯
(1)用于溶解固体或稀释浓溶液。
(2)将溶液注入容量瓶后,必须将烧杯洗涤 2~3 次,洗涤液也注入容量瓶。
5.玻璃棒
(1)在溶液配制中的作用是搅拌、引流。
(2)搅拌时勿触碰烧杯内壁,引流时注意玻璃棒下端应在刻度线以下。
二、分组实验,提升能力
配制 100 mL 1.00 mol/L NaCl溶液。
用固体试剂配制溶液的基本步骤:
计算
称量
溶解
移液
洗涤
定容
摇匀
装瓶
二、分组实验,提升能力
1.在溶解溶质时一般会有放热或吸热的现象,需要等液体恢复到室温才能转移入容量瓶中,为什么
因为容量瓶的刻度线所指示的体积是在指定温度下的数据,只有在该温度下使用才能保证所配制溶液浓度的准确性。
2.将烧杯中的溶液注入容量瓶后,要用蒸馏水洗涤烧杯内壁和玻璃棒2~3次,这样操作的原因是什么
确保溶质完全转移到容量瓶中。
二、分组实验,提升能力
3.如果在读数时,俯视容量瓶上的刻度线,最后配成的溶液中溶质的实际浓度比所要求的大了还是小了 如果在读数时,仰视容量瓶上的刻度线呢
俯视容量瓶的刻度线时,读数偏高,液体的实际体积<读数,配成的溶液中溶质的实际浓度>要求的浓度。仰视容量瓶的刻度线时,读数偏低,液体的实际体积>读数,配成的溶液中溶质的实际浓度<要求的浓度。
三、配制一定物质的量浓度溶液时的误差分析
依据 cB=nBV ,分析实验过程中 nB、V 的变化情况,若nB 减小,则 cB 偏低,若 nB 增大,则 cB偏高;若V 增大,则 cB 偏低,则V 减小,则 cB 偏高。
以配制某浓度的NaOH溶液为例,判断cB 误差的具体情况分析。
可能引起误差的操作 变化的量 实际浓度
①药品、砝码左右位置颠倒(用到游码)
②称量时间过长,因NaOH易潮解,会使称量的NaOH质量偏小
③NaOH放在滤纸上称量,NaOH 易潮解,会有少量NaOH 黏附在滤纸上
④转移溶液时,有少量溶液溅在容量瓶外
nB 减小
cB 偏低
nB 减小
cB 偏低
cB 偏低
cB 偏低
nB 减小
nB 减小
三、配制一定物质的量浓度溶液时的误差分析
可能引起误差的操作 变化的量 实际浓度
⑤转移溶液时,未洗涤烧杯和玻璃棒
⑥溶解后,溶液未冷却至室温就转移到容量瓶中定容
⑦定容时,加水超过刻度线,用胶头滴管吸出部分液体,使液面与刻度线相切
⑧ 定容时仰视刻度线
⑨ 定容时俯视刻度线
⑩定容摇匀后,发现液面低于刻度线,补加水至刻度线
容量瓶洗净后未经干燥就直接使用
nB 减小
cB 偏低
V减小
cB 偏高
nB 减小
cB 偏低
V增大
cB 偏低
V减小
cB 偏高
V增大
cB 偏低
对nB、V不产生影响
对cB 无影响
总结
本节课通过小组实验实操了“用固体试剂配制一定物质的量浓度的溶液”的基本步骤。容量瓶的使用,溶液配制过程中溶解、移液、定容的正确操作,以及实验误差分析是重要的考点。
课堂练习
1.实验室里需配制 480 mL 0.1 mol·L-1的硫酸铜溶液,以下操作正
确的是 ( )
A.称取 7.680 g 硫酸铜,加入 500 mL 水
B.称取 12.000 g 胆矾配成 500 mL 溶液
C.称取 12.500 g 胆矾配成 500 mL 溶液
D.称取 8.000 g 硫酸铜,加入 500 mL 水
C
课堂练习
2.从 200 mL 6.0 mol·L-1Fe2(SO4)3 溶液中取出 10 mL 稀释至200 mL ,
则稀释后溶液中SO42-的物质的量浓度是 ( )
A.0.015 mol· L-1
B.0.045 mol·L-1
C.0.30 mol· L-1
D.0.90 mol· L-1
D
课堂练习
3.取 100 mL 0.3 mol/L 的硝酸和 300 mL 0.25 mol/L 的硫酸注入
500 mL 的容量瓶中,加水稀释至刻度线,该混合溶液中H+ 的物质
的量浓度是 ( )
A.0.18 mol/L B.0.36 mol/L
C.0.2 mol/L D.0.4 mol/L
B
课堂练习
4.下列说法正确的是 ( )
A.将 5.85 g NaCl固体溶于 1 L 水,所得NaCl溶液物质的量浓度为0.1mol/L
B.配制 480 mL 0.2 mol/L NaOH 溶液,需称量NaOH固体的质量为3.84 g
C.质量分数为98%的浓硫酸与等体积水混合后,硫酸的质量分数大于49%
D.定容后摇匀,发现液面低于刻度线,又补加少量水,重新达到刻度线
C
课堂练习
5.配制 400 mL 0.100 mol/L 的KCl溶液,下列说法正确的是 ( )
A.上述实验步骤的正确顺序为④①②③
B.容量瓶需要用自来水、蒸馏水洗涤,干燥后才可用
C.实验中需称量 2.98 g KCl固体
D.定容时,若仰视容量瓶的刻度线,会使配得的KCl溶液浓度偏低
D
谢谢!
