1.3氧化还原反应同步练习(含答案)2023——2024学年高一化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3氧化还原反应同步练习(含答案)2023——2024学年高一化学人教版(2019)必修第一册 |

|
|
| 格式 | doc | ||
| 文件大小 | 868.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-05 00:00:00 | ||
图片预览


文档简介
1.3氧化还原反应同步练习
一、选择题(本题共15道小题,每小题0分,共0分)
1.下列反应的离子方程式正确的是
A.溶液中滴入溶液至中性:
B.大理石与醋酸反应:
C.放入水中:
D.向酸化溶液中通入:
2.科学家发现某些生物酶体系可以促进和的转移(如a、b和c),能将海洋中的转化为N2进入大气层,反应过程如图所示。下列说法正确的是
A.过程I中NO为氧化产物
B.过程III中每生成1molN2转移6mol电子
C.过程II的离子方程式:
D.过程II中发生还原反应
3.关于反应,下列说法正确的是
A.既是氧化产物又是还原产物
B.氧化剂与还原剂的物质的量之比为3∶1
C.该反应中被NO氧化的O3占消耗掉O3的1/4
D.反应时转移电子数为
4.已知反应前后有元素化合价改变的反应称为氧化还原反应,如图为反应类型的关系图,下列有关说法正确的是
A.CO2+H2O=H2CO3属于a处的反应
B.2H2O2H2↑+O2↑属于氧化还原反应
C.c处反应后物质的质量一定减小,不符合质量守恒定律
D.任何两种化合物之间发生的反应都属于d
5.
下列反应中,Br2既作氧化剂,又作还原剂的是
A. 5FeI2 +6Br2=3FeBr2+2FeBr2+5I2
B. KBrO3+5KBr+3H2SO4=3K2SO4+3Br2+3H2O
C. 2KMnO4+16HBr=2KBr+2MnBr2+5Br2+8H2O
D. 3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2↑
6.
已知有如下反应:①2BrO3-+Cl2=Br2+ClO
②ClO-+5Cl-+6H+=3Cl2↑+3H2O
③2FeCl2+Cl2=2FeCl3
根据上述反应,判断下列结论中错误的是( )
A.Cl2是在反应②中既是氧化产物又是还原产物
B.Cl2在①、③反应中均作氧化剂
C.氧化性强弱的顺序为:BrO3->ClO3->Cl2>Fe3+
D.溶液中可发生:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
7.
下列四种基本反应类型与氧化还原反应的关系图中,正确的是( )
A. B.
C. D.
8.
下列反应中,属于氧化还原反应,但水既不是氧化剂,又不是还原剂的是( )
A. B. 2Na2O2+2H2O=4NaOH+O2↑
C. D. Mg+2H2O=Mg(OH)2↓+H2↑
9.
锡是大名鼎鼎的“五金”——金、银、铜、铁、锡之一。早在远古时代,人们便发现并使用锡了。在我国的一些古墓中,便常发掘到一些锡壶、锡烛台之类锡器。
工业上冶炼锡的第一步反应原理为2SnO2+3C=2Sn+aM↑+CO2↑,则下列说法中错误的是( )
A. 反应中SnO2被还原 B. 每生成1个CO2,转移8个电子
C. 反应后元素化合价升高物质有两种 D. a的值为3
10.
根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O═2HI+H2SO4
②2FeCl3+2HI═2FeCl2+2HCl+I2
③3FeCl2+4HNO3═2FeCl3+NO↑+2H2O+Fe(NO3)3
A. H2SO3>I﹣>Fe2+>NO B. I﹣>Fe2+>H2SO3>NO
C. Fe2+>I﹣>H2SO3>NO D. NO>Fe2+>H2SO3>I﹣
11.
下列单、双线桥的表示方法不正确的是( )
A.
B.
C.
D.
12.
单质X和单质Y反应生成X3+和Y2-,现有下列叙述:①X被氧化,②X是氧化剂,③X3+是氧化产物,④X具有氧化性,⑤Y2-是还原产物,⑥X3+具有氧化性。其中正确的是( )
A. ①④⑤⑥ B. ②③④⑤ C. ①③⑤⑥ D. ①②④⑥
13.
飞船以铝粉与高氯酸铵的混合物为固体燃料,其中高氯酸铵的反应为2NH4ClO4=N2↑+Cl2↑+2O2↑+4H2O。下列有关叙述不正确的是( )
A. 该反应属于分解反应、氧化还原反应
B. 上述反应瞬间能产生大量高温气体,推动飞船飞行
C. 铝粉的作用是点燃时氧化放热引发高氯酸铵反应
D. 在反应中NH4ClO4只作氧化剂
14.
根据反应:①2C-+A2=2A-+C2;②2B-+D2=2D-+B2;③2A-+B2=2B-+A2。推断A-、B-、C-、D-的还原能力由强到弱的顺序是
A A->B->C->D- B. D->B->A->C-
C. D->A->B->C- D. C->A->B->D-
15.
发射“神舟七号”载人飞船的是我国自主研制的“长征二号”运载火箭。该火箭的主要燃料是偏二甲肼(用表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为,下列叙述错误的是( )
A. 此反应是氧化还原反应
B. 反应瞬间产生大量的高温气体,推动火箭飞行
C. 在此反应中N2O4作还原剂
D. N2O4中N元素的化合价为+4
二、填空题(本题共2道小题,每小题0分,共0分)
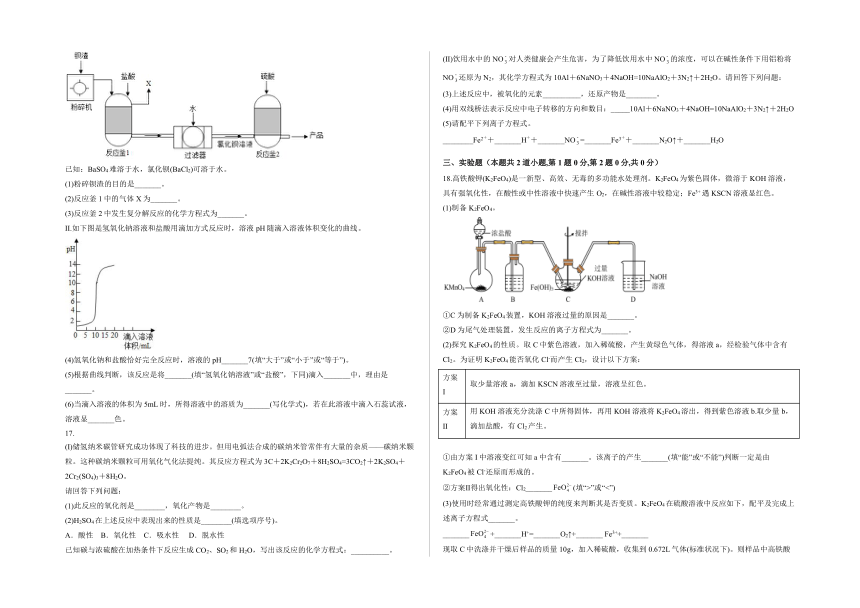
16.I.为保护绿水青山,可将工业残留的钡渣[主要成分为碳酸钡(BaCO3)]进行无害化处理,制取化工原料硫酸钡(BaSO4)。主要流程如下:
已知:BaSO4难溶于水,氯化钡(BaCl2)可溶于水。
(1)粉碎钡渣的目的是_______。
(2)反应釜1中的气体X为_______。
(3)反应釜2中发生复分解反应的化学方程式为_______。
II.如下图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH随滴入溶液体积变化的曲线。
(4)氢氧化钠和盐酸恰好完全反应时,溶液的pH_______7(填“大于”或“小于”或“等于”)。
(5)根据曲线判断,该反应是将_______(填“氢氧化钠溶液”或“盐酸”,下同)滴入_______中,理由是_______。
(6)当滴入溶液的体积为5mL时,所得溶液中的溶质为_______(写化学式),若在此溶液中滴入石蕊试液,溶液显_______色。
17.
(Ⅰ)储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应方程式为3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
请回答下列问题:
(1)此反应的氧化剂是________,氧化产物是________。
(2)H2SO4在上述反应中表现出来的性质是________(填选项序号)。
A.酸性 B.氧化性 C.吸水性 D.脱水性
已知碳与浓硫酸在加热条件下反应生成CO2、SO2和H2O,写出该反应的化学方程式:__________。
(Ⅱ)饮用水中的NO对人类健康会产生危害,为了降低饮用水中NO的浓度,可以在碱性条件下用铝粉将NO还原为N2,其化学方程式为10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(3)上述反应中,被氧化的元素__________,还原产物是________。
(4)用双线桥法表示反应中电子转移的方向和数目:_____10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(5)请配平下列离子方程式。
________Fe2++_______H++_______NO=_______Fe3++_______N2O↑+_______H2O
三、实验题(本题共2道小题,第1题0分,第2题0分,共0分)
18.高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定;Fe3+ 遇KSCN溶液显红色。
(1)制备K2FeO4。
①C为制备K2FeO4装置,KOH溶液过量的原因是_______。
②D为尾气处理装置,发生反应的离子方程式为_______。
(2)探究K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
方案I 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。
方案Ⅱ 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b.取少量b,滴加盐酸,有Cl2产生。
①由方案I中溶液变红可知a中含有_______。该离子的产生_______(填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的。
②方案Ⅱ得出氧化性:Cl2_______(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下,配平及完成上述离子方程式_______。
_______+_______H+=_______O2↑+_______ Fe3++_______
现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为_______。(计算结果保留到0.1%)
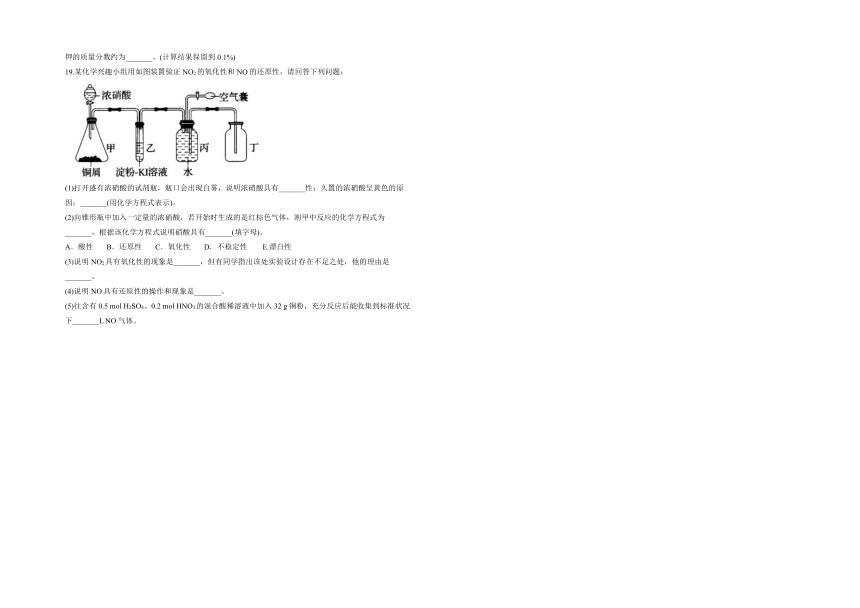
19.某化学兴趣小组用如图装置验证NO2的氧化性和NO的还原性,请回答下列问题:
(1)打开盛有浓硝酸的试剂瓶,瓶口会出现白雾,说明浓硝酸具有_______性;久置的浓硝酸呈黄色的原因:_______(用化学方程式表示)。
(2)向锥形瓶中加入一定量的浓硝酸,若开始时生成的是红棕色气体,则甲中反应的化学方程式为_______,根据该化学方程式说明硝酸具有_______(填字母)。
A.酸性 B.还原性 C.氧化性 D.不稳定性 E.漂白性
(3)说明NO2具有氧化性的现象是_______,但有同学指出该处实验设计存在不足之处,他的理由是_______。
(4)说明NO具有还原性的操作和现象是_______。
(5)往含有0.5 mol H2SO4、0.2 mol HNO3的混合酸稀溶液中加入32 g铜粉,充分反应后能收集到标准状况下_______L NO气体。
试卷答案
1.D
【详解】A.溶液中滴入氢氧化钡溶液至中性,氢氧根离子与钡离子的计量数关系产物,正确的离子方程式为:,故A错误;
B.大理石主要成分即碳酸钙跟醋酸反应生成醋酸钙和水、二氧化碳,离子方程式:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑,故B错误;
C.与水反应生成氢氧化钠和氧气,离子方程式为:,故C错误;
D.向酸化KMnO4溶液中通入SO2生成锰离子和硫酸根离子,离子方程式为:,故D正确;
故选:D。
2.C
【分析】从图中可以看出,一共有三个过程,I:,
II:,III:。
【详解】A.过程I中,N元素化合价降低生成NO,则NO为还原产物,A错误;
B.过程III中生成1mol氮气,转移4mol电子,B错误;
C.过程II中,NO与反应生成水、N2H4和H+,其离子方程式为,C正确;
D.过程II中中N元素的化合价升高为-2价,即发生了氧化反应,D错误;
故选C。
3.D
【详解】A.FeSO4、NO中亚铁离子、N元素化合价升高,被氧化生成氧化产物,是氧化产物,故A错误;
B.反应中FeSO4、NO化合价升高为还原剂,O3化合价降低为氧化剂,氧化剂与还原剂的物质的量之比为1∶3,故B错误;
C.该反应中NO的氮元素化合价由+2升高为+5,NO为还原剂,NO还原O3,故C错误;
D.3molFeSO4反应共消耗O3为2mol,根据O原子由0价降低为-2价以及得失电子守恒,转移的电子数为12NA,故D正确;
答案选D。
4.B
【详解】A.CO2+H2O=H2CO3反应中,各元素化合价没有发生变化,不属于氧化还原反应,故A错误;
B.2H2O2H2↑+O2↑反应中氢、氧元素化合价发生改变,属于氧化还原反应,故B正确;
C.c为分解反应,c处反应后物质的质量一定减小,但符合质量守恒定律,故C错误;
D.d为复分解反应,并不是任何两种化合物之间发生的反应都属于d,故D错误;
故选B。
5.
D
【详解】A.5FeI2 +6Br2=3FeBr2+2FeBr2+5I2,Br2中溴元素化合价由0降低为-1,Br2只作氧化剂,故不选A;
B.KBrO3+5KBr+3H2SO4=3K2SO4+3Br2+3H2O,Br2既是氧化产物又是还原产物,故不选B;
C.2KMnO4+16HBr=2KBr+2MnBr2+5Br2+8H2O ,Br2是氧化产物,故不选C;
D.3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2↑,Br2中溴元素化合价由0降低为-1,Br2中溴元素化合价由0升高为+5,所以Br2既作氧化剂又作还原剂,故选D;
选D。
6.
B
解:A、②ClO﹣+5Cl﹣+6H+═3Cl2+3H2O反应中ClO﹣中Cl元素化合价由+5降低到0价的Cl2,Cl﹣中Cl元素化合价由﹣1价升高到0价的Cl2,所以Cl2是在反应②中既是氧化产物又是还原产物,故A正确;
B、①2BrO3﹣+Cl2═Br2+2ClO3﹣中,Cl2在反应中化合价升高作还原剂,③2FeCl2+Cl2═2FeCl3中,Cl2在反应中化合价降低作氧化剂,故B错误。
C、①2BrO3﹣+Cl2═Br2+2ClO3﹣中,氧化性:BrO3﹣>ClO3﹣,
②ClO3﹣+5Cl﹣+6H+═3Cl2↑+3H2O中,氧化性:ClO3﹣>Cl2;
③2FeCl2+Cl2═2FeCl3中,氧化性:Cl2>Fe3+,所以氧化性强弱的顺序为:BrO3﹣>ClO3﹣>Cl2>Fe3+,故C正确;
D、氧化性:ClO3﹣>Cl2>Fe3+,反应ClO3﹣+6Fe2++6H+=Cl﹣+6Fe3++3H2O能发生,故D正确;
7.
C
解:A.化合反应不一定为氧化还原反应,如CaO和水反应,故A错误;
B.分解反应可能为氧化还原反应,如高锰酸钾的分解,故B错误;
C.置换反应有单质参加和生成,一定为氧化还原反应,故C正确;
D.复分解反应不是氧化还原反应,故D错误。
8.B
【详解】A.该反应中,所有元素的化合价都不变,所以不是氧化还原反应,选项A错误;
B.该反应中过氧化钠中氧元素的化合价由-1价变为0价和-2价,所以该反应属于氧化还原反应,但水中各元素的化合价在反应前后都不变,所以水既不是氧化剂又不是还原剂,选项B正确;
C.该反应中,水中氧元素的化合价由-2价变为0价,所以水是还原剂,选项C错误;
D.该反应中,水中氢元素的化合价由+1价变为0价,所以水是氧化剂,选项D错误;
答案选B。
9.D
【分析】
工业上冶炼锡的第一步反应原理为2SnO2+3C=2Sn+aM↑+CO2↑,则根据原子守恒可知M是CO,a=2,据此解答。
【详解】A. 反应中Sn元素化合价从+4价降低到0价,得到4个电子,SnO2被还原,A正确;
B. 每生成1个CO2,消耗2个 SnO2,转移8个电子,B正确;
C. 碳元素化合价升高,被氧化为CO和CO2,则反应后元素化合价升高的物质有两种,C正确;
D. a的值为2,D错误;答案选D。
10.A
【详解】①H2SO3+I2+H2O=2HI+H2SO4中,I元素的化合价降低,S元素的化合价升高,则H2SO3为还原剂,还原性H2SO3>I-,
②2FeCl3+2HI=2FeCl2+2HCl+I2中,Fe元素的化合价降低,I元素的化合价升高,则HI为还原剂,还原性I->Fe2+,
③3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3中,N元素的化合价降低,Fe元素的化合价升高,则FeCl2为还原剂,还原性Fe2+>NO,
显然还原性由强到弱的顺序为H2SO3>I->Fe2+>NO,
故选:A。
11.B
【详解】A、钠元素的化合价升高,氯元素的化合价降低,则钠失去电子,转移的电子数为2e-,故A正确;
B、该反应中Cl元素的化合价既升高又降低,转移的电子数为e-,正确的表示为,故B错误;
C、该反应中钠元素失去电子,氢元素得到电子,转移的电子数为2e-,故C正确;
D、该反应中碘元素失去电子,溴元素得到电子,转移的电子数为2e-,故D正确;
故选B。
12.C
【分析】
单质X和单质Y反应生成X3+和Y2-,X元素的化合价由0升高为+3价,Y元素的化合价由0降低为-2价,结合氧化还原反应中基本概念及规律来解答。
【详解】单质X和单质Y反应生成X3+和Y2-,X元素的化合价由0升高为+3价,Y元素的化合价由0降低为-2价,则
①X元素的化合价升高,被氧化,故正确;
②X元素的化合价升高,则是还原剂,故错误;
③X为还原剂,被氧化,X3+是氧化产物,故正确;
④X元素的化合价升高,则是还原剂,具有还原性,故错误;
⑤Y元素化合价由0降低为-2价,Y被还原,所以Y2-是还原产物,故正确;
⑥X3+是氧化产物,具有氧化性,故正确;
即正确的是①③⑤⑥,答案选C。
13.D
【详解】A.该反应由一种物质生成多种物质,且元素化合价发生变化,属于分解反应和氧化还原反应,故A正确;
B.反应生成大量高温气体,为推动飞船飞行的原因,故B正确;
C.铝粉在点燃条件下剧烈反应放出大量的热,可作为反应的引发剂,故C正确;
D.反应物只有一种,且NH4ClO4中N和部分O元素化合价升高、Cl元素的化合价降低,则反应中NH4ClO4既是氧化剂又是还原剂,故D错误;
故选D。
14.D
【分析】
氧化还原反应中还原剂的还原性大于还原产物。
【详解】反应①2C-+A2=2A-+C2中,C-做还原剂,A-为还原产物,故还原能力C->A-;反应②2B-+D2=2D-+B2中,B-做还原剂,D-为还原产物,故还原能力B->D-;反应③2A-+B2=2B-+A2中,A-做还原剂,B-为还原产物,故还原能力A->B-;综上分析还原能力由强到弱的顺序为C->A->B->D-;
答案选D。
15.C
16.(1)增大反应物的接触面积,加快反应速率,使其充分反应
(2)二氧化碳
(3)BaCl2+H2SO4=BaSO4↓+2HCl
(4)等于
(5) 氢氧化钠溶液 盐酸 在未滴入溶液之前,溶液的pH小于7,酸性溶液
(6) NaCl、HCl 红
(1)
粉碎钡渣的目的是:增大反应物的接触面积,加快反应速率,使其充分反应。
(2)
碳酸钡和盐酸反应生成氯化钡、水和二氧化碳,所以反应釜1中的气体X为:二氧化碳。
(3)
反应釜2中发生的复分解反应是氯化钡和硫酸反应生成硫酸钡沉淀和盐酸,化学方程式为:BaCl2+H2SO4=BaSO4↓+2HCl。
(4)
氢氧化钠和盐酸反应生成氯化钠和水,恰好完全反应时得到的氯化钠溶液显中性,pH=7,故答案为:等于;
(5)
根据图像,在反应未进行时,溶液的pH<7,为酸性溶液,所以是将氢氧化钠溶液滴入盐酸中。故填:氢氧化钠溶液;盐酸;在未滴入溶液之前,溶液的pH小于;
(6)
盐酸和氢氧化钠的反应原理是:HCl+NaOH=NaCl+H2O,滴入氢氧化钠溶液的体积为5mL时,溶液仍为酸性,所得溶液中的溶质有生成的氯化钠和剩余的盐酸,溶液显酸性,能使紫色石蕊溶液变红色,故答案为:NaCl、HCl;红。
17.
(1)K2Cr2O7 CO2 (2)A C+2H2SO4(浓) CO2↑+2SO2↑+2H2O (3)Al N2 (4) (5)8 10 2 8 1 5
【详解】(Ⅰ)(1)由反应的化学方程式可知,反应中铬元素的化合价降低被还原,重铬酸钾是反应的氧化剂,碳元素的化合价升高被氧化,碳是反应的还原剂,二氧化碳是氧化产物,故答案为:K2Cr2O7;CO2;
(2)由反应的化学方程式可知,反应中硫酸只起酸的作用,表现酸性;在加热条件下,还原剂碳与氧化剂浓硫酸发生氧化还原反应生成二氧化碳、二氧化硫和水,反应的化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,故答案为:A;C+2H2SO4(浓) CO2↑+2SO2↑+2H2O;
(Ⅱ) (3)由反应的化学方程式可知,反应中铝元素素的化合价升高被氧化,氮元素的化合价降低被还原,氮气是还原产物,故答案为:Al;N2;
(4)由反应的化学方程式可知,碱性条件下,铝与硝酸钠发生氧化还原反应生成偏铝酸钠、氮气和水,反应转移电子数为30,则反应中电子转移的方向和数目为,故答案为:;
(5)由没有配平的化学方程式可知,反应中铁元素化合价升高被氧化,亚铁离子是反应的还原剂,氮元素的化合价降低被还原,硝酸根是反应的氧化剂,由得失电子数目守恒可知,亚铁离子和铁离子的化学计量数为8,硝酸根的化学计量数为2,一氧化二氮的化学计量数为1,由电荷守恒可知,氢离子的化学计量数为10,由氢原子个数守恒可知,水的化学计量数为5,反应的化学方程式为8 Fe2++10H++2NO=8Fe3++N2O↑+5H2O,故答案为:8;10;2;8;1;5.
18.(1) K2FeO4在碱性溶液中稳定,有利于生成K2FeO4 Cl2+2OH-=Cl-+ClO-+H2O
(2) Fe3+、不能 排除ClO-的干扰,防止干扰后续实验 <
(3) 4、20、3、4、10H2O 79.2%
【分析】浓盐酸和高锰酸钾反应制取氯气,用饱和食盐水除去挥发的HCl,氯气与KOH反应生成次氯酸钾,次氯酸钾、氢氧化铁和KOH反应生成高铁酸钾(K2FeO4),K2FeO4在过量的碱溶液中较稳定,由于高铁酸钾在酸中条件下分解生成铁离子和氧气,因此溶液中加KSCN溶液,变红不能说明是高铁酸钾被Cl-还原而形成的,再根据氧化还原反应分析氧化性强弱,根据得失电子进行配平,根据方程式计算质量含量。
(1)
①C为制备K2FeO4装置,根据题中信息,高铁酸钾在碱性溶液中较稳定,因此KOH溶液过量的原因是K2FeO4在碱性溶液中稳定,有利于生成K2FeO4;
②D装置为尾气处理装置,尾气主要是氯气,用NaOH溶液与氯气反应,其反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;
(2)
①由方案I中溶液变红可知a中含有Fe3+。该离子可能是K2FeO4与酸反应生成,因此不能判断一定是由K2FeO4被Cl-还原而形成的;
②方案Ⅱ用KOH溶液洗涤的目的是洗涤K2FeO4表面的ClO-,排除ClO-的干扰,防止干扰后续实验,减小高铁酸钾的损失;根据K2FeO4与HCl反应生成Cl2,因此从方案Ⅱ得出氧化性:Cl2<;
(3)
根据得失电子守恒和原子守恒:4+20 H+=3O2↑+4Fe3++10H2O;现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)即物质的量为0.03mol,根据方程式得到n(K2FeO4)=0.04mol,则样品中高铁酸钾的质量分数约为。
19.(1) 挥发
(2) AC
(3) 淀粉-KI溶液变蓝 挥发出的硝酸也能使淀粉KI溶液变蓝
(4)打开活塞,挤压空气囊,丙中气体由无色变为红棕色
(5)4.48
【分析】铜和浓硝酸反应生成NO2,NO2进入乙中与淀粉碘化钾溶液反应,证明NO2的氧化性;NO2进入丙中与水反应生成硝酸和NO,NO难溶于水,将丙中水排入丁中,验证NO的还原性时可打开活塞,将空气囊中的空气挤入丙中,观察现象。
(1)
打开盛有浓硝酸的试剂瓶,瓶口会出现白雾,说明浓硝酸具有挥发性;久置的浓硝酸呈黄色的原因是浓硝酸在光照或加热条件下分解生成NO2,溶解在浓硝酸中显黄色,化学方程式为:;
(2)
甲中为铜与浓硝酸反应,化学方程式为:;浓硝酸表现酸性和氧化性,故选AC;
(3)
说明NO2具有氧化性的现象是:淀粉-KI溶液变蓝;但不足之处是NO2中混有挥发出来的硝酸,故:挥发出的硝酸也能使淀粉KI溶液变蓝;
(4)
NO与氧气的反应体现还原性,故说明NO具有还原性的操作和现象是:打开活塞,挤压空气囊,丙中气体由无色变为红棕色;
(5)
铜和稀硝酸反应的离子方程式为:,Cu的物质的量为0.5mol,硝酸根的物质的量为0.2mol,氢离子的物质的量为1.2mol,硝酸根的量不足,故0.2mol硝酸根完全反应生成0.2molNO,标况下的体积为:4.48L。
一、选择题(本题共15道小题,每小题0分,共0分)
1.下列反应的离子方程式正确的是
A.溶液中滴入溶液至中性:
B.大理石与醋酸反应:
C.放入水中:
D.向酸化溶液中通入:
2.科学家发现某些生物酶体系可以促进和的转移(如a、b和c),能将海洋中的转化为N2进入大气层,反应过程如图所示。下列说法正确的是
A.过程I中NO为氧化产物
B.过程III中每生成1molN2转移6mol电子
C.过程II的离子方程式:
D.过程II中发生还原反应
3.关于反应,下列说法正确的是
A.既是氧化产物又是还原产物
B.氧化剂与还原剂的物质的量之比为3∶1
C.该反应中被NO氧化的O3占消耗掉O3的1/4
D.反应时转移电子数为
4.已知反应前后有元素化合价改变的反应称为氧化还原反应,如图为反应类型的关系图,下列有关说法正确的是
A.CO2+H2O=H2CO3属于a处的反应
B.2H2O2H2↑+O2↑属于氧化还原反应
C.c处反应后物质的质量一定减小,不符合质量守恒定律
D.任何两种化合物之间发生的反应都属于d
5.
下列反应中,Br2既作氧化剂,又作还原剂的是
A. 5FeI2 +6Br2=3FeBr2+2FeBr2+5I2
B. KBrO3+5KBr+3H2SO4=3K2SO4+3Br2+3H2O
C. 2KMnO4+16HBr=2KBr+2MnBr2+5Br2+8H2O
D. 3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2↑
6.
已知有如下反应:①2BrO3-+Cl2=Br2+ClO
②ClO-+5Cl-+6H+=3Cl2↑+3H2O
③2FeCl2+Cl2=2FeCl3
根据上述反应,判断下列结论中错误的是( )
A.Cl2是在反应②中既是氧化产物又是还原产物
B.Cl2在①、③反应中均作氧化剂
C.氧化性强弱的顺序为:BrO3->ClO3->Cl2>Fe3+
D.溶液中可发生:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
7.
下列四种基本反应类型与氧化还原反应的关系图中,正确的是( )
A. B.
C. D.
8.
下列反应中,属于氧化还原反应,但水既不是氧化剂,又不是还原剂的是( )
A. B. 2Na2O2+2H2O=4NaOH+O2↑
C. D. Mg+2H2O=Mg(OH)2↓+H2↑
9.
锡是大名鼎鼎的“五金”——金、银、铜、铁、锡之一。早在远古时代,人们便发现并使用锡了。在我国的一些古墓中,便常发掘到一些锡壶、锡烛台之类锡器。
工业上冶炼锡的第一步反应原理为2SnO2+3C=2Sn+aM↑+CO2↑,则下列说法中错误的是( )
A. 反应中SnO2被还原 B. 每生成1个CO2,转移8个电子
C. 反应后元素化合价升高物质有两种 D. a的值为3
10.
根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O═2HI+H2SO4
②2FeCl3+2HI═2FeCl2+2HCl+I2
③3FeCl2+4HNO3═2FeCl3+NO↑+2H2O+Fe(NO3)3
A. H2SO3>I﹣>Fe2+>NO B. I﹣>Fe2+>H2SO3>NO
C. Fe2+>I﹣>H2SO3>NO D. NO>Fe2+>H2SO3>I﹣
11.
下列单、双线桥的表示方法不正确的是( )
A.
B.
C.
D.
12.
单质X和单质Y反应生成X3+和Y2-,现有下列叙述:①X被氧化,②X是氧化剂,③X3+是氧化产物,④X具有氧化性,⑤Y2-是还原产物,⑥X3+具有氧化性。其中正确的是( )
A. ①④⑤⑥ B. ②③④⑤ C. ①③⑤⑥ D. ①②④⑥
13.
飞船以铝粉与高氯酸铵的混合物为固体燃料,其中高氯酸铵的反应为2NH4ClO4=N2↑+Cl2↑+2O2↑+4H2O。下列有关叙述不正确的是( )
A. 该反应属于分解反应、氧化还原反应
B. 上述反应瞬间能产生大量高温气体,推动飞船飞行
C. 铝粉的作用是点燃时氧化放热引发高氯酸铵反应
D. 在反应中NH4ClO4只作氧化剂
14.
根据反应:①2C-+A2=2A-+C2;②2B-+D2=2D-+B2;③2A-+B2=2B-+A2。推断A-、B-、C-、D-的还原能力由强到弱的顺序是
A A->B->C->D- B. D->B->A->C-
C. D->A->B->C- D. C->A->B->D-
15.
发射“神舟七号”载人飞船的是我国自主研制的“长征二号”运载火箭。该火箭的主要燃料是偏二甲肼(用表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为,下列叙述错误的是( )
A. 此反应是氧化还原反应
B. 反应瞬间产生大量的高温气体,推动火箭飞行
C. 在此反应中N2O4作还原剂
D. N2O4中N元素的化合价为+4
二、填空题(本题共2道小题,每小题0分,共0分)
16.I.为保护绿水青山,可将工业残留的钡渣[主要成分为碳酸钡(BaCO3)]进行无害化处理,制取化工原料硫酸钡(BaSO4)。主要流程如下:
已知:BaSO4难溶于水,氯化钡(BaCl2)可溶于水。
(1)粉碎钡渣的目的是_______。
(2)反应釜1中的气体X为_______。
(3)反应釜2中发生复分解反应的化学方程式为_______。
II.如下图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH随滴入溶液体积变化的曲线。
(4)氢氧化钠和盐酸恰好完全反应时,溶液的pH_______7(填“大于”或“小于”或“等于”)。
(5)根据曲线判断,该反应是将_______(填“氢氧化钠溶液”或“盐酸”,下同)滴入_______中,理由是_______。
(6)当滴入溶液的体积为5mL时,所得溶液中的溶质为_______(写化学式),若在此溶液中滴入石蕊试液,溶液显_______色。
17.
(Ⅰ)储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应方程式为3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
请回答下列问题:
(1)此反应的氧化剂是________,氧化产物是________。
(2)H2SO4在上述反应中表现出来的性质是________(填选项序号)。
A.酸性 B.氧化性 C.吸水性 D.脱水性
已知碳与浓硫酸在加热条件下反应生成CO2、SO2和H2O,写出该反应的化学方程式:__________。
(Ⅱ)饮用水中的NO对人类健康会产生危害,为了降低饮用水中NO的浓度,可以在碱性条件下用铝粉将NO还原为N2,其化学方程式为10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(3)上述反应中,被氧化的元素__________,还原产物是________。
(4)用双线桥法表示反应中电子转移的方向和数目:_____10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(5)请配平下列离子方程式。
________Fe2++_______H++_______NO=_______Fe3++_______N2O↑+_______H2O
三、实验题(本题共2道小题,第1题0分,第2题0分,共0分)
18.高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定;Fe3+ 遇KSCN溶液显红色。
(1)制备K2FeO4。
①C为制备K2FeO4装置,KOH溶液过量的原因是_______。
②D为尾气处理装置,发生反应的离子方程式为_______。
(2)探究K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
方案I 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。
方案Ⅱ 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b.取少量b,滴加盐酸,有Cl2产生。
①由方案I中溶液变红可知a中含有_______。该离子的产生_______(填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的。
②方案Ⅱ得出氧化性:Cl2_______(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下,配平及完成上述离子方程式_______。
_______+_______H+=_______O2↑+_______ Fe3++_______
现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为_______。(计算结果保留到0.1%)
19.某化学兴趣小组用如图装置验证NO2的氧化性和NO的还原性,请回答下列问题:
(1)打开盛有浓硝酸的试剂瓶,瓶口会出现白雾,说明浓硝酸具有_______性;久置的浓硝酸呈黄色的原因:_______(用化学方程式表示)。
(2)向锥形瓶中加入一定量的浓硝酸,若开始时生成的是红棕色气体,则甲中反应的化学方程式为_______,根据该化学方程式说明硝酸具有_______(填字母)。
A.酸性 B.还原性 C.氧化性 D.不稳定性 E.漂白性
(3)说明NO2具有氧化性的现象是_______,但有同学指出该处实验设计存在不足之处,他的理由是_______。
(4)说明NO具有还原性的操作和现象是_______。
(5)往含有0.5 mol H2SO4、0.2 mol HNO3的混合酸稀溶液中加入32 g铜粉,充分反应后能收集到标准状况下_______L NO气体。
试卷答案
1.D
【详解】A.溶液中滴入氢氧化钡溶液至中性,氢氧根离子与钡离子的计量数关系产物,正确的离子方程式为:,故A错误;
B.大理石主要成分即碳酸钙跟醋酸反应生成醋酸钙和水、二氧化碳,离子方程式:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑,故B错误;
C.与水反应生成氢氧化钠和氧气,离子方程式为:,故C错误;
D.向酸化KMnO4溶液中通入SO2生成锰离子和硫酸根离子,离子方程式为:,故D正确;
故选:D。
2.C
【分析】从图中可以看出,一共有三个过程,I:,
II:,III:。
【详解】A.过程I中,N元素化合价降低生成NO,则NO为还原产物,A错误;
B.过程III中生成1mol氮气,转移4mol电子,B错误;
C.过程II中,NO与反应生成水、N2H4和H+,其离子方程式为,C正确;
D.过程II中中N元素的化合价升高为-2价,即发生了氧化反应,D错误;
故选C。
3.D
【详解】A.FeSO4、NO中亚铁离子、N元素化合价升高,被氧化生成氧化产物,是氧化产物,故A错误;
B.反应中FeSO4、NO化合价升高为还原剂,O3化合价降低为氧化剂,氧化剂与还原剂的物质的量之比为1∶3,故B错误;
C.该反应中NO的氮元素化合价由+2升高为+5,NO为还原剂,NO还原O3,故C错误;
D.3molFeSO4反应共消耗O3为2mol,根据O原子由0价降低为-2价以及得失电子守恒,转移的电子数为12NA,故D正确;
答案选D。
4.B
【详解】A.CO2+H2O=H2CO3反应中,各元素化合价没有发生变化,不属于氧化还原反应,故A错误;
B.2H2O2H2↑+O2↑反应中氢、氧元素化合价发生改变,属于氧化还原反应,故B正确;
C.c为分解反应,c处反应后物质的质量一定减小,但符合质量守恒定律,故C错误;
D.d为复分解反应,并不是任何两种化合物之间发生的反应都属于d,故D错误;
故选B。
5.
D
【详解】A.5FeI2 +6Br2=3FeBr2+2FeBr2+5I2,Br2中溴元素化合价由0降低为-1,Br2只作氧化剂,故不选A;
B.KBrO3+5KBr+3H2SO4=3K2SO4+3Br2+3H2O,Br2既是氧化产物又是还原产物,故不选B;
C.2KMnO4+16HBr=2KBr+2MnBr2+5Br2+8H2O ,Br2是氧化产物,故不选C;
D.3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2↑,Br2中溴元素化合价由0降低为-1,Br2中溴元素化合价由0升高为+5,所以Br2既作氧化剂又作还原剂,故选D;
选D。
6.
B
解:A、②ClO﹣+5Cl﹣+6H+═3Cl2+3H2O反应中ClO﹣中Cl元素化合价由+5降低到0价的Cl2,Cl﹣中Cl元素化合价由﹣1价升高到0价的Cl2,所以Cl2是在反应②中既是氧化产物又是还原产物,故A正确;
B、①2BrO3﹣+Cl2═Br2+2ClO3﹣中,Cl2在反应中化合价升高作还原剂,③2FeCl2+Cl2═2FeCl3中,Cl2在反应中化合价降低作氧化剂,故B错误。
C、①2BrO3﹣+Cl2═Br2+2ClO3﹣中,氧化性:BrO3﹣>ClO3﹣,
②ClO3﹣+5Cl﹣+6H+═3Cl2↑+3H2O中,氧化性:ClO3﹣>Cl2;
③2FeCl2+Cl2═2FeCl3中,氧化性:Cl2>Fe3+,所以氧化性强弱的顺序为:BrO3﹣>ClO3﹣>Cl2>Fe3+,故C正确;
D、氧化性:ClO3﹣>Cl2>Fe3+,反应ClO3﹣+6Fe2++6H+=Cl﹣+6Fe3++3H2O能发生,故D正确;
7.
C
解:A.化合反应不一定为氧化还原反应,如CaO和水反应,故A错误;
B.分解反应可能为氧化还原反应,如高锰酸钾的分解,故B错误;
C.置换反应有单质参加和生成,一定为氧化还原反应,故C正确;
D.复分解反应不是氧化还原反应,故D错误。
8.B
【详解】A.该反应中,所有元素的化合价都不变,所以不是氧化还原反应,选项A错误;
B.该反应中过氧化钠中氧元素的化合价由-1价变为0价和-2价,所以该反应属于氧化还原反应,但水中各元素的化合价在反应前后都不变,所以水既不是氧化剂又不是还原剂,选项B正确;
C.该反应中,水中氧元素的化合价由-2价变为0价,所以水是还原剂,选项C错误;
D.该反应中,水中氢元素的化合价由+1价变为0价,所以水是氧化剂,选项D错误;
答案选B。
9.D
【分析】
工业上冶炼锡的第一步反应原理为2SnO2+3C=2Sn+aM↑+CO2↑,则根据原子守恒可知M是CO,a=2,据此解答。
【详解】A. 反应中Sn元素化合价从+4价降低到0价,得到4个电子,SnO2被还原,A正确;
B. 每生成1个CO2,消耗2个 SnO2,转移8个电子,B正确;
C. 碳元素化合价升高,被氧化为CO和CO2,则反应后元素化合价升高的物质有两种,C正确;
D. a的值为2,D错误;答案选D。
10.A
【详解】①H2SO3+I2+H2O=2HI+H2SO4中,I元素的化合价降低,S元素的化合价升高,则H2SO3为还原剂,还原性H2SO3>I-,
②2FeCl3+2HI=2FeCl2+2HCl+I2中,Fe元素的化合价降低,I元素的化合价升高,则HI为还原剂,还原性I->Fe2+,
③3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3中,N元素的化合价降低,Fe元素的化合价升高,则FeCl2为还原剂,还原性Fe2+>NO,
显然还原性由强到弱的顺序为H2SO3>I->Fe2+>NO,
故选:A。
11.B
【详解】A、钠元素的化合价升高,氯元素的化合价降低,则钠失去电子,转移的电子数为2e-,故A正确;
B、该反应中Cl元素的化合价既升高又降低,转移的电子数为e-,正确的表示为,故B错误;
C、该反应中钠元素失去电子,氢元素得到电子,转移的电子数为2e-,故C正确;
D、该反应中碘元素失去电子,溴元素得到电子,转移的电子数为2e-,故D正确;
故选B。
12.C
【分析】
单质X和单质Y反应生成X3+和Y2-,X元素的化合价由0升高为+3价,Y元素的化合价由0降低为-2价,结合氧化还原反应中基本概念及规律来解答。
【详解】单质X和单质Y反应生成X3+和Y2-,X元素的化合价由0升高为+3价,Y元素的化合价由0降低为-2价,则
①X元素的化合价升高,被氧化,故正确;
②X元素的化合价升高,则是还原剂,故错误;
③X为还原剂,被氧化,X3+是氧化产物,故正确;
④X元素的化合价升高,则是还原剂,具有还原性,故错误;
⑤Y元素化合价由0降低为-2价,Y被还原,所以Y2-是还原产物,故正确;
⑥X3+是氧化产物,具有氧化性,故正确;
即正确的是①③⑤⑥,答案选C。
13.D
【详解】A.该反应由一种物质生成多种物质,且元素化合价发生变化,属于分解反应和氧化还原反应,故A正确;
B.反应生成大量高温气体,为推动飞船飞行的原因,故B正确;
C.铝粉在点燃条件下剧烈反应放出大量的热,可作为反应的引发剂,故C正确;
D.反应物只有一种,且NH4ClO4中N和部分O元素化合价升高、Cl元素的化合价降低,则反应中NH4ClO4既是氧化剂又是还原剂,故D错误;
故选D。
14.D
【分析】
氧化还原反应中还原剂的还原性大于还原产物。
【详解】反应①2C-+A2=2A-+C2中,C-做还原剂,A-为还原产物,故还原能力C->A-;反应②2B-+D2=2D-+B2中,B-做还原剂,D-为还原产物,故还原能力B->D-;反应③2A-+B2=2B-+A2中,A-做还原剂,B-为还原产物,故还原能力A->B-;综上分析还原能力由强到弱的顺序为C->A->B->D-;
答案选D。
15.C
16.(1)增大反应物的接触面积,加快反应速率,使其充分反应
(2)二氧化碳
(3)BaCl2+H2SO4=BaSO4↓+2HCl
(4)等于
(5) 氢氧化钠溶液 盐酸 在未滴入溶液之前,溶液的pH小于7,酸性溶液
(6) NaCl、HCl 红
(1)
粉碎钡渣的目的是:增大反应物的接触面积,加快反应速率,使其充分反应。
(2)
碳酸钡和盐酸反应生成氯化钡、水和二氧化碳,所以反应釜1中的气体X为:二氧化碳。
(3)
反应釜2中发生的复分解反应是氯化钡和硫酸反应生成硫酸钡沉淀和盐酸,化学方程式为:BaCl2+H2SO4=BaSO4↓+2HCl。
(4)
氢氧化钠和盐酸反应生成氯化钠和水,恰好完全反应时得到的氯化钠溶液显中性,pH=7,故答案为:等于;
(5)
根据图像,在反应未进行时,溶液的pH<7,为酸性溶液,所以是将氢氧化钠溶液滴入盐酸中。故填:氢氧化钠溶液;盐酸;在未滴入溶液之前,溶液的pH小于;
(6)
盐酸和氢氧化钠的反应原理是:HCl+NaOH=NaCl+H2O,滴入氢氧化钠溶液的体积为5mL时,溶液仍为酸性,所得溶液中的溶质有生成的氯化钠和剩余的盐酸,溶液显酸性,能使紫色石蕊溶液变红色,故答案为:NaCl、HCl;红。
17.
(1)K2Cr2O7 CO2 (2)A C+2H2SO4(浓) CO2↑+2SO2↑+2H2O (3)Al N2 (4) (5)8 10 2 8 1 5
【详解】(Ⅰ)(1)由反应的化学方程式可知,反应中铬元素的化合价降低被还原,重铬酸钾是反应的氧化剂,碳元素的化合价升高被氧化,碳是反应的还原剂,二氧化碳是氧化产物,故答案为:K2Cr2O7;CO2;
(2)由反应的化学方程式可知,反应中硫酸只起酸的作用,表现酸性;在加热条件下,还原剂碳与氧化剂浓硫酸发生氧化还原反应生成二氧化碳、二氧化硫和水,反应的化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,故答案为:A;C+2H2SO4(浓) CO2↑+2SO2↑+2H2O;
(Ⅱ) (3)由反应的化学方程式可知,反应中铝元素素的化合价升高被氧化,氮元素的化合价降低被还原,氮气是还原产物,故答案为:Al;N2;
(4)由反应的化学方程式可知,碱性条件下,铝与硝酸钠发生氧化还原反应生成偏铝酸钠、氮气和水,反应转移电子数为30,则反应中电子转移的方向和数目为,故答案为:;
(5)由没有配平的化学方程式可知,反应中铁元素化合价升高被氧化,亚铁离子是反应的还原剂,氮元素的化合价降低被还原,硝酸根是反应的氧化剂,由得失电子数目守恒可知,亚铁离子和铁离子的化学计量数为8,硝酸根的化学计量数为2,一氧化二氮的化学计量数为1,由电荷守恒可知,氢离子的化学计量数为10,由氢原子个数守恒可知,水的化学计量数为5,反应的化学方程式为8 Fe2++10H++2NO=8Fe3++N2O↑+5H2O,故答案为:8;10;2;8;1;5.
18.(1) K2FeO4在碱性溶液中稳定,有利于生成K2FeO4 Cl2+2OH-=Cl-+ClO-+H2O
(2) Fe3+、不能 排除ClO-的干扰,防止干扰后续实验 <
(3) 4、20、3、4、10H2O 79.2%
【分析】浓盐酸和高锰酸钾反应制取氯气,用饱和食盐水除去挥发的HCl,氯气与KOH反应生成次氯酸钾,次氯酸钾、氢氧化铁和KOH反应生成高铁酸钾(K2FeO4),K2FeO4在过量的碱溶液中较稳定,由于高铁酸钾在酸中条件下分解生成铁离子和氧气,因此溶液中加KSCN溶液,变红不能说明是高铁酸钾被Cl-还原而形成的,再根据氧化还原反应分析氧化性强弱,根据得失电子进行配平,根据方程式计算质量含量。
(1)
①C为制备K2FeO4装置,根据题中信息,高铁酸钾在碱性溶液中较稳定,因此KOH溶液过量的原因是K2FeO4在碱性溶液中稳定,有利于生成K2FeO4;
②D装置为尾气处理装置,尾气主要是氯气,用NaOH溶液与氯气反应,其反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;
(2)
①由方案I中溶液变红可知a中含有Fe3+。该离子可能是K2FeO4与酸反应生成,因此不能判断一定是由K2FeO4被Cl-还原而形成的;
②方案Ⅱ用KOH溶液洗涤的目的是洗涤K2FeO4表面的ClO-,排除ClO-的干扰,防止干扰后续实验,减小高铁酸钾的损失;根据K2FeO4与HCl反应生成Cl2,因此从方案Ⅱ得出氧化性:Cl2<;
(3)
根据得失电子守恒和原子守恒:4+20 H+=3O2↑+4Fe3++10H2O;现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)即物质的量为0.03mol,根据方程式得到n(K2FeO4)=0.04mol,则样品中高铁酸钾的质量分数约为。
19.(1) 挥发
(2) AC
(3) 淀粉-KI溶液变蓝 挥发出的硝酸也能使淀粉KI溶液变蓝
(4)打开活塞,挤压空气囊,丙中气体由无色变为红棕色
(5)4.48
【分析】铜和浓硝酸反应生成NO2,NO2进入乙中与淀粉碘化钾溶液反应,证明NO2的氧化性;NO2进入丙中与水反应生成硝酸和NO,NO难溶于水,将丙中水排入丁中,验证NO的还原性时可打开活塞,将空气囊中的空气挤入丙中,观察现象。
(1)
打开盛有浓硝酸的试剂瓶,瓶口会出现白雾,说明浓硝酸具有挥发性;久置的浓硝酸呈黄色的原因是浓硝酸在光照或加热条件下分解生成NO2,溶解在浓硝酸中显黄色,化学方程式为:;
(2)
甲中为铜与浓硝酸反应,化学方程式为:;浓硝酸表现酸性和氧化性,故选AC;
(3)
说明NO2具有氧化性的现象是:淀粉-KI溶液变蓝;但不足之处是NO2中混有挥发出来的硝酸,故:挥发出的硝酸也能使淀粉KI溶液变蓝;
(4)
NO与氧气的反应体现还原性,故说明NO具有还原性的操作和现象是:打开活塞,挤压空气囊,丙中气体由无色变为红棕色;
(5)
铜和稀硝酸反应的离子方程式为:,Cu的物质的量为0.5mol,硝酸根的物质的量为0.2mol,氢离子的物质的量为1.2mol,硝酸根的量不足,故0.2mol硝酸根完全反应生成0.2molNO,标况下的体积为:4.48L。
