4.2元素周期律同步练习(含解析)2023——2024学年高一化学人教版(2019)必修第一册
文档属性
| 名称 | 4.2元素周期律同步练习(含解析)2023——2024学年高一化学人教版(2019)必修第一册 |  | |
| 格式 | doc | ||
| 文件大小 | 528.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-05 20:38:31 | ||
图片预览


文档简介
4.2元素周期律同步练习
一、选择题
1.A、B均是短周期元素,它们的离子A-和B2+具有相同的核外电子层结构,下列说法正确的是
A.原子序数A>B B.离子半径A->B2+
C.原子半径A>B D.电子数A>B
2.X、Y、Z是三种主族元素,X的阳离子与Y的阴离子具有相同的电子层结构,Z的阴离子半径大于等电荷数的Y的阴离子的半径,则三种元素的原子序数大小顺序是
A.X>Y>Z B.Z>Y>X C.X>Z>Y D.Z>X>Y
3.根据元素周期律,由下列事实进行归纳推测,推测不合理的是
事实 推测
A. 12Mg与水反应缓慢,20Ca与水反应较快 56Ba(ⅡA)与水反应会更快
B. Si是半导体材料,同族的Ge也是半导体材料 ⅣA族的元素都是半导体材料
C. HCl在1500℃时分解,HI在230℃时分解 HBr的分解温度介于二者之间
D. Si与H2高温时反应,S与H2加热能反应 P与H2在高温时能反应
A.A B.B C.C D.D
4.下列事实能证明碳的非金属性比硅强的是
①Na2SiO3+CO2+2H2O=H4SiO4↓+Na2CO3
②SiO2+2CSi+2CO↑
③Na2CO3+SiO2Na2SiO3+CO2↑
④CH4比SiH4稳定
A.①②③④ B.①② C.②④ D.①④
5.
下列事实不能用元素周期律解释的是
A. NaOH的碱性强于Al(OH)3
B. Mg与热水能反应,Al与热水很难反应
C. H2O稳定性强于H2S
D. HClO4 的酸性强于HBrO
6.
短周期主族元素X、Y、Z、W的原子序数依次增大。Y是地壳中含量最高的元素,X、Y原子的最外层电子数之比为2:3,Z是短周期中金属性最强的元素,W原子与X原子的最外层电子数相同。下列说法正确的是
A. 原子半径:r(Y)<r(X)<r(W)<r(Z) B. X的非金属性比Y的强
C. W的简单气态氢化物的热稳定性比X的强 D. Z位于元素周期表中第2周期ⅠA族
7.
下列物质性质递变规律正确且能用元素周期律解释的是
A. 酸性:HClO4>H2SO4>H2SiO3
B. 碱性:NaOH>Mg(OH)2>Ca(OH)2
C. 还原性:S2->Cl->Br-
D. 稳定性:Na2CO3>NaHCO3>H2CO3
8.
下列递变规律不正确的是:
A. Na、Mg、Al还原性依次减弱 B. I2、Br2、Cl2氧化性依次增强
C. C、N、O原子半径依次增大 D. P、S、Cl最高正价依次升高
9.
下列关于物质性质变化的比较,不正确的是( )
A. 酸性强弱:HIO4>HBrO4>HClO4 B. 原子半径大小:Na>S>O
C. 碱性强弱:KOH>NaOH>LiOH D. 金属性强弱:Na>Mg>Al
10.下列物质中,阳离子与阴离子的半径之比最小的是
A.KF B.NaCl C.Li2S D.LiCl
二、填空题
11.某研究性学习小组设计了一组实验,验证元素周期律。
甲同学在a、b、c、d四只烧杯里分别加入50mL冷水,再分别滴加几滴酚酞溶液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)甲同学设计实验的目的是验证:同一主族,从上到下元素的元素金属性逐渐增强;同一周期,从左到右,元素金属性_______;
(2)反应最剧烈的烧杯里金属是_____ (填字母)
A.钠 B.镁 C.铝 D.钾;
(3)写出a烧杯里发生反应的离子方程式_______。
(4)实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验的目的,请你帮助选择下列合适的方法 。
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸
D.把烧杯中的冷水换成氢氧化钠溶液
(5)写出铝和盐酸反应的化学方程式_______。
12.请回答下列问题。
(1)第三周期元素中,化学性质最不活泼的是______,可用于制半导体材料的元素是______,最高价氧化物的水化物碱性最强的是______,酸性最强的是______,两性的是______(用元素符号填空)。
(2)在C、N、O、F中,原子半径最大的是______。
(3)第32号元素在元素周期表中的位置为______。
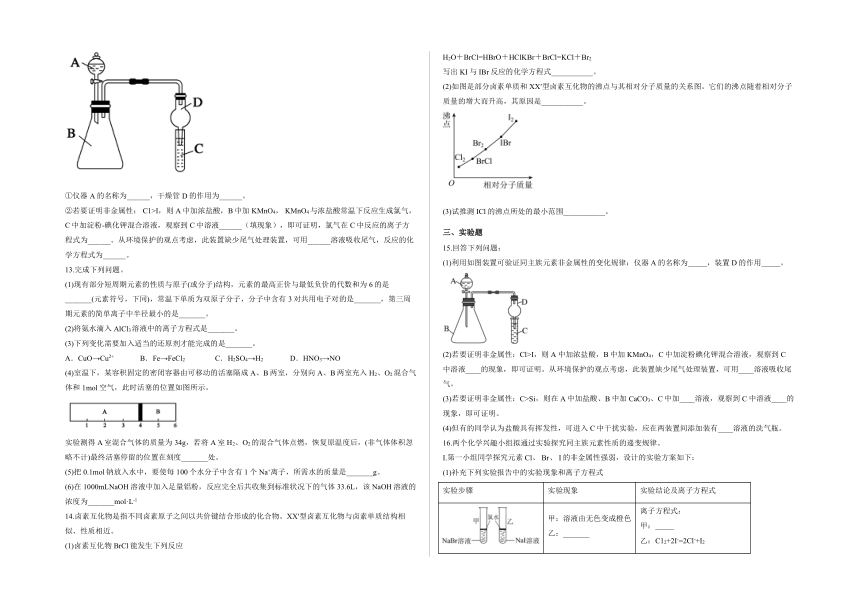
(4)利用如图装置可验证同主族元素非金属性的变化规律。
①仪器A的名称为______,干燥管D的作用为______。
②若要证明非金属性: C1>I,则A中加浓盐酸,B中加KMnO4, KMnO4与浓盐酸常温下反应生成氯气,C中加淀粉-碘化钾混合溶液,观察到C中溶液______(填现象),即可证明,氯气在C中反应的离子方程式为______。从环境保护的观点考虑,此装置缺少尾气处理装置,可用______溶液吸收尾气,反应的化学方程式为______。
13.完成下列问题。
(1)现有部分短周期元素的性质与原子(或分子)结构,元素的最高正价与最低负价的代数和为6的是_______(元素符号,下同),常温下单质为双原子分子,分子中含有3对共用电子对的是_______,第三周期元素的简单离子中半径最小的是_______。
(2)将氨水滴入AlCl3溶液中的离子方程式是_______。
(3)下列变化需要加入适当的还原剂才能完成的是_______。
A.CuO→Cu2+ B.Fe→FeCl2 C.H2SO4→H2 D.HNO3→NO
(4)室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2混合气体和1mol空气,此时活塞的位置如图所示。
实验测得A室混合气体的质量为34g,若将A室H2、O2的混合气体点燃,恢复原温度后,(非气体体积忽略不计)最终活塞停留的位置在刻度_______处。
(5)把0.1mol钠放入水中,要使每100个水分子中含有1个Na+离子,所需水的质量是_______g。
(6)在1000mLNaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6L,该NaOH溶液的浓度为_______mol·L-1
14.卤素互化物是指不同卤素原子之间以共价键结合形成的化合物。XX'型卤素互化物与卤素单质结构相似、性质相近。
(1)卤素互化物BrCl能发生下列反应
H2O+BrCl=HBrO+HClKBr+BrCl=KCl+Br2
写出KI与IBr反应的化学方程式___________。
(2)如图是部分卤素单质和XX′型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是___________。
(3)试推测ICl的沸点所处的最小范围___________。
三、实验题
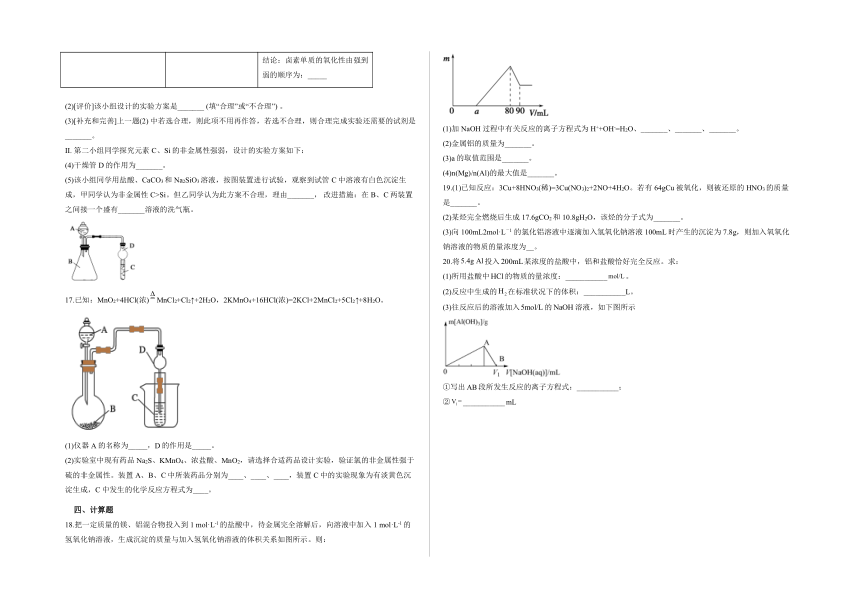
15.回答下列问题:
(1)利用如图装置可验证同主族元素非金属性的变化规律:仪器A的名称为_____,装置D的作用_____。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,C中加淀粉碘化钾混合溶液,观察到C中溶液____的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____溶液吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加____溶液,观察到C中溶液____的现象,即可证明。
(4)但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有____溶液的洗气瓶。
16.两个化学兴趣小组拟通过实验探究同主族元素性质的递变规律。
I.第一小组同学探究元素Cl、 Br、 I的非金属性强弱,设计的实验方案如下:
(1)补充下列实验报告中的实验现象和离子方程式
实验步骤 实验现象 实验结论及离子方程式
甲:溶液由无色变成橙色乙:_______ 离子方程式:甲:_____乙:C12+2I-=2Cl-+I2结论:卤素单质的氧化性由强到 弱的顺序为:_____
(2)[评价]该小组设计的实验方案是_______ (填“合理”或“不合理”) 。
(3)[补充和完善]上一题(2) 中若选合理,则此项不用再作答,若选不合理,则合理完成实验还需要的试剂是_______。
II. 第二小组同学探究元素C、Si的非金属性强弱,设计的实验方案如下:
(4)干燥管D的作用为_______。
(5)该小组同学用盐酸、CaCO3和Na2SiO3溶液,按图装置进行试验,观察到试管C中溶液有白色沉淀生成,甲同学认为非金属性C>Si。但乙同学认为此方案不合理,理由_______, 改进措施:在B、C两装置之间接一个盛有_______溶液的洗气瓶。
17.已知:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
(1)仪器A的名称为_____,D的作用是_____。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验,验证氯的非金属性强于硫的非金属性。装置A、B、C中所装药品分别为____、____、____,装置C中的实验现象为有淡黄色沉淀生成,C中发生的化学反应方程式为____。
四、计算题
18.把一定质量的镁、铝混合物投入到1 mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入1 mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。则:
(1)加NaOH过程中有关反应的离子方程式为H++OH-=H2O、_______、_______、_______。
(2)金属铝的质量为_______。
(3)a的取值范围是_______。
(4)n(Mg)/n(Al)的最大值是_______。
19.(1)已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO+4H2O。若有64gCu被氧化,则被还原的HNO3的质量是_______。
(2)某烃完全燃烧后生成17.6gCO2和10.8gH2O,该烃的分子式为_______。
(3)向100mL2mol·L-1 的氯化铝溶液中逐滴加入氢氧化钠溶液100mL时产生的沉淀为7.8g,则加入氧氧化钠溶液的物质的量浓度为__。
20.将投入某浓度的盐酸中,铝和盐酸恰好完全反应。求:
(1)所用盐酸中的物质的量浓度:___________。
(2)反应中生成的在标准状况下的体积:___________L。
(3)往反应后的溶液加入的溶液,如下图所示
①写出段所发生反应的离子方程式:___________;
②___________
试卷答案
1.B
【分析】A和B是短周期的元素,它们的离子A-和B2+有相同的电子层结构,则其核外电子数相同,所以原子序数是A<B,且B位于A的下一周期;
【详解】A.B的原子序数=离子核外电子数+2、A的原子序数=离子核外电子数-1,两种离子核外电子数相等,所以原子序数AB.电子层结构相同的离子,离子半径随着原子序数增大而减小,则两种离子半径:A->B2+,故B正确;
C.B位于A下一周期,B原子核外电子层数大于A,原子半径:AD.A原子电子数=离子核外电子数-1、B原子核外电子数=离子核外电子数+2,两种离子核外电子数相等,所以原子核外电子数:A故选B。
2.D
【详解】元素原子核外电子数等于原子核内质子数,等于其核电荷数。金属元素的原子失去电子形成阳离子;非金属元素的原子获得电子形成阴离子。X、Y、Z三种主族元素,X的阳离子与Y的阴离子具有相同的电子层结构,则X处于Y的下一周期,原子序数:X>Y;Z阴离子半径大于等电荷数的Y的阴离子半径,则Y与Z处于同一主族,原子序数:Z>Y;Z与X可能处于同一周期也可能其周期数比X的周期数大。X形成阳离子,说明X为金属元素;Y、Z形成阴离子,则Y、Z为非金属,原子序数Z>X,故X、Y、Z三种主族元素的原子序数大小关系为:Z>X>Y,合理选项是D。
3.B
【详解】A.同主族金属元素从上到下元素的金属性逐渐增强,与水反应剧烈程度增强。元素的金属性:Ba>Ca>Mg,故可根据Ca与水反应较快推知Ba与水反应会更快,A正确;
B.半导体材料通常位于元素周期表中金属元素和非金属元素的分界处,Si和Ge处于金属和非金属分界线处,能作半导体,而C和Pb不能作半导体,所以第IVA族元素并不都是半导体材料,B错误;
C.同主族元素从上到下元素的非金属元素逐渐减弱,元素的非金属性越强,其简单氢化物的稳定性就越强。元素的非金属性:Cl>Br>I,所以HBr的稳定性介于HCl、HI之间,其分解温度介于二者之间,C正确;
D.同周期元素的非金属元素从左到右逐渐增强,元素的非金属性越强,其单质与H2化合就越容易,元素的非金属性:S>P>Si,所以可根据Si与H2高温时反应,S与H2加热能反应推知P与H2在高温时能反应,D正确;
故合理选项是B。
4.D
【详解】①非金属性越强,最高价氧化物对应的水化物的酸性越强,该反应为强酸制取弱酸的反应,可以判断非金属性强弱,故①正确;
②该反应中C的还原性大于Si的还原性,无法比较C、Si的非金属性,故②错误;
③该反应为高温固体之间的反应,不能判断非金属性强弱,故③错误;
④CH4比SiH4稳定,可知C的非金属性强,故④正确;
所以①④正确;
故选D。
5.D
【详解】A.NaOH、Al(OH)3均是该元素最高价氧化物对应水化物,NaOH的碱性强于Al(OH)3可说明钠元素金属性强于铝元素,故A项不选;
B.Mg、Al与热水反应中,金属单质都是还原剂,Mg较易反应,说明还原性:Mg>Al,二者是同一周期元素,原子序数MgC.非金属性O>S,同时H2O的稳定性强于H2S,能够用元素周期律解释,故C项不选;
D.HClO4是氯元素最高价氧化物的水化物,HBrO不是溴元素最高价氧化物的水化物,虽然酸性HClO4>HBrO,但不能用元素周期律解释,故D项选;
综上所述,不能用元素周期律解释的是D项,故答案为D。
6.
A
【分析】
短周期元素X、Y、Z、W原子序数依次增大,Y是地壳中含量最高的元素,则Y是氧元素,X、Y原子的最外层电子数之比为2∶3,所以X是6号碳元素;Z是短周期中金属性最强的元素,则Z为钠元素;W原子与X原子的最外层电子数相同,则W是硅元素,据此分析解答。
【详解】A.电子层数越多半径越大,电子层相同核电荷数越多半径越小,所以原子半径:r(Y)<r(X)<r(W)<r(Z),故A正确;
B.X是碳,Y是氧,氧的非金属性强于碳,即X的非金属性比Y的弱,故B错误;
C.碳的非金属性强于硅,所以W的简单气态氢化物的热稳定性比X的弱,故C错误;
D.Z为钠元素,位于元素周期表中第三周期ⅠA族,故D错误;
故选A。
7.
A
【详解】A. 非金属性:Cl>S>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性:HClO4>H2SO4>H2SiO3,能用元素周期律解释,A正确;
B. 金属性:Ca>Na>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性:Ca(OH)2>NaOH>Mg(OH)2,能用元素周期律解释,B错误;
C. 非金属性:Cl>Br>S,元素的非金属性越强,对应离子的还原性越弱,则还原性:S2->Br->Cl-,能用元素周期律解释,C错误;
D. H2CO3不能稳定存在,常温下能分解生成CO2和H2O,碳酸盐难分解,碳酸氢盐受热易分解,则稳定性:Na2CO3>NaHCO3>H2CO3,但是不能用元素周期律解释,D错误;
故选A。
8.C
【详解】A. Na、Mg、Al金属性减弱,还原性依次减弱,故A正确;
B. I、Br、Cl非金属增强,其单质的氧化性依次增强,故B正确;
C. C、N、O同属于周期元素,核电荷数增大,原子半径依次减小,故C错误;
D. P、S、Cl最高正价依次为+5、+6、+7,依次升高,故D正确;
故选C。
9.A
【详解】A.非金属性:Cl>Br>I,元素非金属性越强,对应的最高价氧化物的水化物酸性越强,则有酸性强弱:HIO4>HBrO4>HClO4,故A错误;
B.同周期元素从左到右原子半径逐渐减小,则Na>S,原子核外电子层数越多,半径越大,O的原子核外有2个电子层,半径最小,则原子半径:Na>S>O,故B不选;
C.金属性:K>Na>Li,元素的金属性越强,对应最高价氧化物的水化物的碱性越强,则有碱性强弱:KOH>NaOH>LiOH,故C不选;
D.同周期元素从左到右金属性逐渐减弱,则有金属性强弱:Na>Mg>Al,故D不选。
故答案选A。
10.C
【详解】电子层数越多半径越大,电子层数相同时,质子数越多半径越小;阳离子半径,阴离子半径,所以阳离子与阴离子的半径之比最小的是Li2S,故选C。
11.(1)逐渐减弱
(2)D
(3)2Na+2H2O=2Na++2OH-+H2↑
(4)BC
(5)2Al+6H+=2Al3++3H2↑
同一周期,从左到右,原子失电子能力减弱,则元素金属性逐渐减弱;故答案为:逐渐减弱;
(2)
金属性K>Na>Mg>Al,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是D,故答案为:D;
(3)
钠与水反应生成氢氧化钠和氢气,则钠与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(4)
反应现象不明显,说明反应速率小,升高温度可以加快速率,所以把冷水换为热水,把水换为盐酸增大了溶液中氢离子的浓度,可以加快速率;故答案为:BC;
(5)
铝与盐酸反应生成氯化铝和氢气,其反应的离子方程式为:2Al+6H+=2Al3++3H2↑;故答案为:2Al+6H+=2Al3++3H2↑。
12.(1) Ar Si NaOH HClO4 Al (OH) 3
(2)C
(3)第四周期IVA族
(4) 分液漏斗 防止倒吸 变蓝 Cl2+2I-=2C1-+I2 氢氧化钠 Cl2+2NaOH=NaCl+NaC1O+2H2O
第三周期元素中,Ar原子最外层有8个电子,结构稳定,化学性质最不活泼的是Ar;单质Si的导电性介于导体和绝缘体之间,可用于制半导体材料的元素是Si;金属性越强,最高价氧化物的水化物碱性越强,最高价氧化物的水化物碱性最强的是NaOH;非金属性越强,最高价氧化物的水化物酸性越强,最高价氧化物的水化物酸性最强的是HClO4,氢氧化铝既能和酸反应又能与碱反应,具有两性的是Al (OH) 3。
(2)
同周期元素从左到右,半径依次减小,在C、N、O、F中,原子半径最大的是C;
(3)
第32号元素是Ge,在元素周期表中的位置为第四周期IVA族;
(4)
①根据装置图,仪器A的名称为分液漏斗;干燥管D具有防止倒吸的作用。
②氯气和KI反应生成KCl、I2,碘遇与淀粉变蓝色,观察到C中溶液变蓝,氯气在C中反应的离子方程式为Cl2+2I-=2C1-+I2。氯气能与氢氧化钠反应生成氯化钠和次氯酸钠,可用氢氧化钠溶液吸收尾气,反应的化学方程式为Cl2+2NaOH=NaCl+NaC1O+2H2O。
13.(1) Cl N Al
(2)
(3)CD
(4)2
(5)181.8
(6)1
Cl的最高正价为+7,最低负价为-1,代数和为6,故该元素为Cl;常温下单质为双原子分子,氮气分子中含有3对共用电子对,故该元素为N;第三周期元素金属离子的电子层数为2,非金属离子的电子层数为3,电子层数越少,半径越小,核电荷数越大,半径越小,简单离子中半径最小的元素是:Al;
(2)
将氨水滴入AlCl3溶液中生成氢氧化铝沉淀,离子方程式是:;
(3)
A. 铜元素化合价不变,A错误;
B. 铁元素化合价升高,需要氧化剂才能实现,B错误;
C. 氢元素化合价降低,需要还原剂才能实现,C正确;
D. 氮元素化合价降低,需要还原剂才能实现,D正确;
故选CD;
(4)
容器中活塞两侧的压强相同,物质的量之比等于体积比,故H2和O2的物质的量之和为2mol,设H2和O2的物质的量分别为xmol和ymol,则x+y=2,2x+32y=34g,解得x=y=1,H2和O2充分反应后:,剩余氧气的物质的量为0.5mol,而右侧空气的物质的量为1mol,故VB=2VA,活塞应在2处;
(5)
每100个水分子中含有1个Na+离子,设需要水的物质的量为xmol,则,x=10mol,又金属钠与水反应还需要消耗水,根据方程式:,0.1molNa消耗0.1mol水,故共需要水的物质的量为10.1mol,质量为:;
(6)
根据离子方程式:,产生氢气的物质的量为,消耗氢氧根的物质的量为1.0mol,NaOH溶液的浓度为:。
14.(1)KI+IBr=I2+KBr
(2)由于卤素互化物分子的极性并不强,故X2、XX′形成的分子晶体沸点高低主要取决于相对分子质量大小。随着相对分子质量增大,分子间作用力增强,故沸点升高
(3)根据其相对分子质量,其沸点范围应该在Br2与IBr之间
KI与IBr反应生成溴化钾和碘,反应方程式为KI+IBr=KBr+I2,故答案为:KI+IBr=KBr+I2;
(2)
卤素单质的沸点随着相对分子质量的增大而升高,其原因是:由于卤素互化物分子的极性并不强,故X2、XX′形成的分子晶体沸点高低主要取决于相对分子质量大小。随着相对分子质量增大,分子间作用力增强,故沸点升高;
(3)
分子晶体的熔沸点随分子量的增大而升高,这三种物质都是分子晶体,其相对分子质量越大,该物质的熔沸点越高,所以ICl的沸点所处的最小范围:Br2<ICl<IBr,故答案为:根据其相对分子质量,其沸点范围应该在Br2与IBr之间。
15.(1) 分液漏斗 防止倒吸
(2) 变蓝 NaOH
(3) Na2SiO3 有白色沉淀生成
(4)饱和NaHCO3
【分析】(2)浓盐酸和高锰酸钾反应生成氯气,氯气能氧化碘离子生成碘,氯气有毒,不能直接排空,可以用碱液吸收氯气;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;盐酸具有挥发性导致生成的二氧化碳中含有HCl,HCl能和硅酸钠反应生成硅酸,要除去HCl,可以用饱和的碳酸氢钠溶液。
(1)
仪器A为分液漏斗,装置D有缓冲作用,能防止倒吸;
(2)
浓盐酸和高锰酸钾反应生成氯气,氯气具有强氧化性、碘离子具有还原性,则氯气能氧化碘离子生成碘,离子方程式为Cl2+2I-=2Cl-+I2,碘单质遇淀粉变蓝;氯气有毒,不能直接排空,但是氯气能和NaOH反应生成无毒的钠盐,所以可以用NaOH溶液吸收多余的氯气;
(3)
元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,要证明非金属性C>Si,稀盐酸和碳酸钙反应生成二氧化碳,二氧化碳和硅酸钠溶液反应生成难溶性的硅酸,由此知碳酸酸性大于硅酸,所以非金属性C>Si,所以C中应该盛放Na2SiO3溶液;现象为C中生成硅酸白色沉淀;
(4)
盐酸具有挥发性导致生成的二氧化碳中含有HCl,HCl能和硅酸钠反应生成硅酸,所以在将气体通入硅酸钠溶液之前除去HCl,可以用饱和的NaHCO3溶液,则可进入C中干扰实验,应在两装置间添加装有NaHCO3溶液的洗气瓶。
16.
阅读材料,完成下列要求。
(1)这个公司今年做了将近一百万元以上的生意。
(2)张三考试作弊,一种意见是要处分,一种意见是不要处分,这两种意见我都不赞成,关键是做好张三的思想工作。
(3)万里长城是我国劳动人民智慧的结晶,也是我国的天然屏障。
(4)“鲁迅是一个乡土作家”是一种意见,“鲁迅不是一个乡土作家”也是一种意见,对这两种意见我很难表态。如果一定要我表态的话。我认为:“如果鲁迅是一个乡土作家,那么,他就是一个乡土作家,如果鲁迅不是一个乡土作家,那么,他就不是一个乡土作家。”
以上各段文字是否符合矛盾律和排中律的要求?如不符合,指出其违反了哪条基本规律,犯了什么逻辑错误。
17.(1) 分液漏斗 防止倒吸
(2) 浓盐酸 KMnO4 Na2S溶液 Cl2+Na2S=2NaCl+S↓
【分析】先用浓盐酸和高锰酸钾常温下反应制取氯气,生成的氯气通入硫化钠溶液中,置换出硫单质,证明氯气的氧化性比硫强。
(1)
依据仪器构造可知,A为分液漏斗,氯气与硫化钠溶液反应,气体体积减少,D起到防倒吸的作用。
(2)
要验证氯的非金属性比硫强,可验证氯气的氧化性比硫单质强,题给发生装置为固-液不加热装置,因此应选择浓盐酸和高锰酸钾常温下反应制取氯气,A中盛放浓盐酸、B中盛放高锰酸钾,将生成的氯气通入硫化钠溶液中,氯气与硫化钠反应生成氯化钠和硫单质,从而证明氯气的氧化性比硫单质强,则C中盛放硫化钠溶液,反应的化学方程式为:Cl2+Na2S=2NaCl+S↓。
18. Mg2++2OH-=Mg(OH)2↓ Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO+2H2O 0.27g 0≤a<50mL 2.5
【分析】0~a段没有生成沉淀,说明盐酸过量,加入的氢氧化钠与氯化氢反应;a~80段开始生成沉淀,加入80mL氢氧化钠溶液后沉淀达到最大量,沉淀为Mg(OH)2和Al(OH)3,此时溶液中的溶质为NaCl;80~90段氢氧化铝开始溶解,得到偏铝酸钠,溶解氢氧化铝消耗了10mLNaOH,当加入90mLNaOH溶液后氢氧化铝完全溶解,此时沉淀只有氢氧化镁。
【详解】(1)0~a段氢氧化钠与氯化氢反应,离子方程式为H++OH-=H2O,a~80段生成Mg(OH)2和Al(OH)3沉淀,离子方程式分别为Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓;
(2)80~90段氢氧化铝开始溶解,发生反应Al(OH)3+OH-=AlO+2H2O,溶解氢氧化铝消耗了10mLNaOH,所以n(Al)=1mol·L-1×0.01L=0.01mol,质量为0.01mol×27g/mol=0.27g;
(3)假设盐酸溶解金属后不剩,这种情况下,酸恰好与合金反应完全,此时a=0;当合金中0.01mol铝时,a值最大,沉淀Al3+需要NaOH溶液的体积为30mL,所以a最大为80mL-30mL=50mL,但合金中不可能只有铝,所以的取值范围为0≤a<50mL;
(4)当a=0时,n(Mg)最大,此时沉淀Mg2+消耗50mLNaOH溶液,所以n(Mg)= 1mol·L-1×0.05L÷2=0.025mol,所以的最大值为=2.5。
19. 42g C2H6 3mol·L-1或7mol·L-1
【分析】3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,3molCu作还原剂,与2molHNO3作氧化剂,遵循电子守恒,以此来解答;AlCl3溶液中加入NaOH溶液,若碱不足,只发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl;先求出实验式,再求分子式;若碱与铝离子的物质的量之比大于3:1时,先发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl,后发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,据此讨论计算。
【详解】(1)n(Cu)= =1mol,设被还原的硝酸为xmol,则
, ,解得x= mol,则被还原的硝酸的质量为mol×63g/mol=42g,故答案为42g;
(2)n(CO2)==0.4mol,n(H2O)= =0.6mol,完全燃烧生成0.4molCO2和0.6H2O,n(C):n(H)=0.4:0.6 2=2:6,可知烃的实验式为C2H6,碳已经饱和,分子式为C2H6,故答案为:C2H6;
(3)100ml2mol·L-1的AlCl3溶液中,n(Al3+)=0.1L×2mol·L-1 =0.2mol,生成沉淀的质量是7.8g,其物质的量为: =0.1mol,可能是0.2molAl3+生成0.1mol沉淀,或者0.2molAl3+生成0.2molAl(OH)3沉淀后又溶解了0.1mol;
①若碱不足,即0.2molAl3+生成0.1mol沉淀,AlCl3+3NaOH=Al(OH)3↓+3NaCl,NaOH的物质的量为0.1mol×3=0.3mol,c(NaOH)= =3mol·L-1;
②碱与铝离子的物质的量之比大于3:1,小于4:1,即0.2molAl3+生成0.1mol沉淀,或者0.2molAl3+生成0.2molAl(OH)3沉淀后又溶解了0.1mol;
则消耗的碱的物质的量为0.6mol+0.1mol=0.7mol,c(NaOH)==7mol·L-1;
故答案为:3mol·L-1或7mol·L-1。
20.(1)3
(2)6.72
(3) 160
【分析】铝的原子量为27g/mol,的物质的量为0.2mol,与盐酸恰好完全反应生成氯化铝和氢气,方程式为:2Al+6HCl=2AlCl3+3H2↑,根据2Al~6HCl~3H2~2 AlCl3关系进行计算。
(1)
结合以上分析可知,2Al~6HCl,所以0.2mol铝完全反应消耗HCl为0.6mol,根据c=计算,所用盐酸中的物质的量浓度为=3mol/L;
(2)
根据2Al~6HCl~3H2关系可知,0.2mol铝完全反应生成氢气0.3mol,根据V=nVm计算,反应中生成的在标准状况下的体积为0.3mol×22.4L/mol=6.72L;
(3)
结合以上分析可知,反应后的溶液为氯化铝,向氯化铝溶液中滴加氢氧化钠溶液,先发生的反应为:Al3++3OH-=Al(OH)3↓,生成沉淀;后发生反应:Al(OH)3+OH-=+2H2O,沉淀溶解;
①段为生成的沉淀溶解的过程,反应的离子方程式:;
②氯化铝溶液加入氢氧化钠溶液后,先沉淀后溶解,到V1时,恰好完全反应生成偏铝酸钠和氯化钠,结合以上分析可知,0.2mol铝完全反应生成氯化铝0.2mol,所以n(Cl)=3n(AlCl3)=0.2mol×3=0.6mol;n(Al)= n(AlCl3)=0.2mol,根据元素守恒规律可知n(Cl)+n(Al)=n(Na)可知,n(Na)=0.8mol,设氢氧化钠的体积为VL,所以5mol/L×V=0.8mol,V=0.16L=160mL。
一、选择题
1.A、B均是短周期元素,它们的离子A-和B2+具有相同的核外电子层结构,下列说法正确的是
A.原子序数A>B B.离子半径A->B2+
C.原子半径A>B D.电子数A>B
2.X、Y、Z是三种主族元素,X的阳离子与Y的阴离子具有相同的电子层结构,Z的阴离子半径大于等电荷数的Y的阴离子的半径,则三种元素的原子序数大小顺序是
A.X>Y>Z B.Z>Y>X C.X>Z>Y D.Z>X>Y
3.根据元素周期律,由下列事实进行归纳推测,推测不合理的是
事实 推测
A. 12Mg与水反应缓慢,20Ca与水反应较快 56Ba(ⅡA)与水反应会更快
B. Si是半导体材料,同族的Ge也是半导体材料 ⅣA族的元素都是半导体材料
C. HCl在1500℃时分解,HI在230℃时分解 HBr的分解温度介于二者之间
D. Si与H2高温时反应,S与H2加热能反应 P与H2在高温时能反应
A.A B.B C.C D.D
4.下列事实能证明碳的非金属性比硅强的是
①Na2SiO3+CO2+2H2O=H4SiO4↓+Na2CO3
②SiO2+2CSi+2CO↑
③Na2CO3+SiO2Na2SiO3+CO2↑
④CH4比SiH4稳定
A.①②③④ B.①② C.②④ D.①④
5.
下列事实不能用元素周期律解释的是
A. NaOH的碱性强于Al(OH)3
B. Mg与热水能反应,Al与热水很难反应
C. H2O稳定性强于H2S
D. HClO4 的酸性强于HBrO
6.
短周期主族元素X、Y、Z、W的原子序数依次增大。Y是地壳中含量最高的元素,X、Y原子的最外层电子数之比为2:3,Z是短周期中金属性最强的元素,W原子与X原子的最外层电子数相同。下列说法正确的是
A. 原子半径:r(Y)<r(X)<r(W)<r(Z) B. X的非金属性比Y的强
C. W的简单气态氢化物的热稳定性比X的强 D. Z位于元素周期表中第2周期ⅠA族
7.
下列物质性质递变规律正确且能用元素周期律解释的是
A. 酸性:HClO4>H2SO4>H2SiO3
B. 碱性:NaOH>Mg(OH)2>Ca(OH)2
C. 还原性:S2->Cl->Br-
D. 稳定性:Na2CO3>NaHCO3>H2CO3
8.
下列递变规律不正确的是:
A. Na、Mg、Al还原性依次减弱 B. I2、Br2、Cl2氧化性依次增强
C. C、N、O原子半径依次增大 D. P、S、Cl最高正价依次升高
9.
下列关于物质性质变化的比较,不正确的是( )
A. 酸性强弱:HIO4>HBrO4>HClO4 B. 原子半径大小:Na>S>O
C. 碱性强弱:KOH>NaOH>LiOH D. 金属性强弱:Na>Mg>Al
10.下列物质中,阳离子与阴离子的半径之比最小的是
A.KF B.NaCl C.Li2S D.LiCl
二、填空题
11.某研究性学习小组设计了一组实验,验证元素周期律。
甲同学在a、b、c、d四只烧杯里分别加入50mL冷水,再分别滴加几滴酚酞溶液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)甲同学设计实验的目的是验证:同一主族,从上到下元素的元素金属性逐渐增强;同一周期,从左到右,元素金属性_______;
(2)反应最剧烈的烧杯里金属是_____ (填字母)
A.钠 B.镁 C.铝 D.钾;
(3)写出a烧杯里发生反应的离子方程式_______。
(4)实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验的目的,请你帮助选择下列合适的方法 。
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸
D.把烧杯中的冷水换成氢氧化钠溶液
(5)写出铝和盐酸反应的化学方程式_______。
12.请回答下列问题。
(1)第三周期元素中,化学性质最不活泼的是______,可用于制半导体材料的元素是______,最高价氧化物的水化物碱性最强的是______,酸性最强的是______,两性的是______(用元素符号填空)。
(2)在C、N、O、F中,原子半径最大的是______。
(3)第32号元素在元素周期表中的位置为______。
(4)利用如图装置可验证同主族元素非金属性的变化规律。
①仪器A的名称为______,干燥管D的作用为______。
②若要证明非金属性: C1>I,则A中加浓盐酸,B中加KMnO4, KMnO4与浓盐酸常温下反应生成氯气,C中加淀粉-碘化钾混合溶液,观察到C中溶液______(填现象),即可证明,氯气在C中反应的离子方程式为______。从环境保护的观点考虑,此装置缺少尾气处理装置,可用______溶液吸收尾气,反应的化学方程式为______。
13.完成下列问题。
(1)现有部分短周期元素的性质与原子(或分子)结构,元素的最高正价与最低负价的代数和为6的是_______(元素符号,下同),常温下单质为双原子分子,分子中含有3对共用电子对的是_______,第三周期元素的简单离子中半径最小的是_______。
(2)将氨水滴入AlCl3溶液中的离子方程式是_______。
(3)下列变化需要加入适当的还原剂才能完成的是_______。
A.CuO→Cu2+ B.Fe→FeCl2 C.H2SO4→H2 D.HNO3→NO
(4)室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2混合气体和1mol空气,此时活塞的位置如图所示。
实验测得A室混合气体的质量为34g,若将A室H2、O2的混合气体点燃,恢复原温度后,(非气体体积忽略不计)最终活塞停留的位置在刻度_______处。
(5)把0.1mol钠放入水中,要使每100个水分子中含有1个Na+离子,所需水的质量是_______g。
(6)在1000mLNaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6L,该NaOH溶液的浓度为_______mol·L-1
14.卤素互化物是指不同卤素原子之间以共价键结合形成的化合物。XX'型卤素互化物与卤素单质结构相似、性质相近。
(1)卤素互化物BrCl能发生下列反应
H2O+BrCl=HBrO+HClKBr+BrCl=KCl+Br2
写出KI与IBr反应的化学方程式___________。
(2)如图是部分卤素单质和XX′型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是___________。
(3)试推测ICl的沸点所处的最小范围___________。
三、实验题
15.回答下列问题:
(1)利用如图装置可验证同主族元素非金属性的变化规律:仪器A的名称为_____,装置D的作用_____。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,C中加淀粉碘化钾混合溶液,观察到C中溶液____的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____溶液吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加____溶液,观察到C中溶液____的现象,即可证明。
(4)但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有____溶液的洗气瓶。
16.两个化学兴趣小组拟通过实验探究同主族元素性质的递变规律。
I.第一小组同学探究元素Cl、 Br、 I的非金属性强弱,设计的实验方案如下:
(1)补充下列实验报告中的实验现象和离子方程式
实验步骤 实验现象 实验结论及离子方程式
甲:溶液由无色变成橙色乙:_______ 离子方程式:甲:_____乙:C12+2I-=2Cl-+I2结论:卤素单质的氧化性由强到 弱的顺序为:_____
(2)[评价]该小组设计的实验方案是_______ (填“合理”或“不合理”) 。
(3)[补充和完善]上一题(2) 中若选合理,则此项不用再作答,若选不合理,则合理完成实验还需要的试剂是_______。
II. 第二小组同学探究元素C、Si的非金属性强弱,设计的实验方案如下:
(4)干燥管D的作用为_______。
(5)该小组同学用盐酸、CaCO3和Na2SiO3溶液,按图装置进行试验,观察到试管C中溶液有白色沉淀生成,甲同学认为非金属性C>Si。但乙同学认为此方案不合理,理由_______, 改进措施:在B、C两装置之间接一个盛有_______溶液的洗气瓶。
17.已知:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
(1)仪器A的名称为_____,D的作用是_____。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验,验证氯的非金属性强于硫的非金属性。装置A、B、C中所装药品分别为____、____、____,装置C中的实验现象为有淡黄色沉淀生成,C中发生的化学反应方程式为____。
四、计算题
18.把一定质量的镁、铝混合物投入到1 mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入1 mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。则:
(1)加NaOH过程中有关反应的离子方程式为H++OH-=H2O、_______、_______、_______。
(2)金属铝的质量为_______。
(3)a的取值范围是_______。
(4)n(Mg)/n(Al)的最大值是_______。
19.(1)已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO+4H2O。若有64gCu被氧化,则被还原的HNO3的质量是_______。
(2)某烃完全燃烧后生成17.6gCO2和10.8gH2O,该烃的分子式为_______。
(3)向100mL2mol·L-1 的氯化铝溶液中逐滴加入氢氧化钠溶液100mL时产生的沉淀为7.8g,则加入氧氧化钠溶液的物质的量浓度为__。
20.将投入某浓度的盐酸中,铝和盐酸恰好完全反应。求:
(1)所用盐酸中的物质的量浓度:___________。
(2)反应中生成的在标准状况下的体积:___________L。
(3)往反应后的溶液加入的溶液,如下图所示
①写出段所发生反应的离子方程式:___________;
②___________
试卷答案
1.B
【分析】A和B是短周期的元素,它们的离子A-和B2+有相同的电子层结构,则其核外电子数相同,所以原子序数是A<B,且B位于A的下一周期;
【详解】A.B的原子序数=离子核外电子数+2、A的原子序数=离子核外电子数-1,两种离子核外电子数相等,所以原子序数A
C.B位于A下一周期,B原子核外电子层数大于A,原子半径:A
2.D
【详解】元素原子核外电子数等于原子核内质子数,等于其核电荷数。金属元素的原子失去电子形成阳离子;非金属元素的原子获得电子形成阴离子。X、Y、Z三种主族元素,X的阳离子与Y的阴离子具有相同的电子层结构,则X处于Y的下一周期,原子序数:X>Y;Z阴离子半径大于等电荷数的Y的阴离子半径,则Y与Z处于同一主族,原子序数:Z>Y;Z与X可能处于同一周期也可能其周期数比X的周期数大。X形成阳离子,说明X为金属元素;Y、Z形成阴离子,则Y、Z为非金属,原子序数Z>X,故X、Y、Z三种主族元素的原子序数大小关系为:Z>X>Y,合理选项是D。
3.B
【详解】A.同主族金属元素从上到下元素的金属性逐渐增强,与水反应剧烈程度增强。元素的金属性:Ba>Ca>Mg,故可根据Ca与水反应较快推知Ba与水反应会更快,A正确;
B.半导体材料通常位于元素周期表中金属元素和非金属元素的分界处,Si和Ge处于金属和非金属分界线处,能作半导体,而C和Pb不能作半导体,所以第IVA族元素并不都是半导体材料,B错误;
C.同主族元素从上到下元素的非金属元素逐渐减弱,元素的非金属性越强,其简单氢化物的稳定性就越强。元素的非金属性:Cl>Br>I,所以HBr的稳定性介于HCl、HI之间,其分解温度介于二者之间,C正确;
D.同周期元素的非金属元素从左到右逐渐增强,元素的非金属性越强,其单质与H2化合就越容易,元素的非金属性:S>P>Si,所以可根据Si与H2高温时反应,S与H2加热能反应推知P与H2在高温时能反应,D正确;
故合理选项是B。
4.D
【详解】①非金属性越强,最高价氧化物对应的水化物的酸性越强,该反应为强酸制取弱酸的反应,可以判断非金属性强弱,故①正确;
②该反应中C的还原性大于Si的还原性,无法比较C、Si的非金属性,故②错误;
③该反应为高温固体之间的反应,不能判断非金属性强弱,故③错误;
④CH4比SiH4稳定,可知C的非金属性强,故④正确;
所以①④正确;
故选D。
5.D
【详解】A.NaOH、Al(OH)3均是该元素最高价氧化物对应水化物,NaOH的碱性强于Al(OH)3可说明钠元素金属性强于铝元素,故A项不选;
B.Mg、Al与热水反应中,金属单质都是还原剂,Mg较易反应,说明还原性:Mg>Al,二者是同一周期元素,原子序数Mg
D.HClO4是氯元素最高价氧化物的水化物,HBrO不是溴元素最高价氧化物的水化物,虽然酸性HClO4>HBrO,但不能用元素周期律解释,故D项选;
综上所述,不能用元素周期律解释的是D项,故答案为D。
6.
A
【分析】
短周期元素X、Y、Z、W原子序数依次增大,Y是地壳中含量最高的元素,则Y是氧元素,X、Y原子的最外层电子数之比为2∶3,所以X是6号碳元素;Z是短周期中金属性最强的元素,则Z为钠元素;W原子与X原子的最外层电子数相同,则W是硅元素,据此分析解答。
【详解】A.电子层数越多半径越大,电子层相同核电荷数越多半径越小,所以原子半径:r(Y)<r(X)<r(W)<r(Z),故A正确;
B.X是碳,Y是氧,氧的非金属性强于碳,即X的非金属性比Y的弱,故B错误;
C.碳的非金属性强于硅,所以W的简单气态氢化物的热稳定性比X的弱,故C错误;
D.Z为钠元素,位于元素周期表中第三周期ⅠA族,故D错误;
故选A。
7.
A
【详解】A. 非金属性:Cl>S>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性:HClO4>H2SO4>H2SiO3,能用元素周期律解释,A正确;
B. 金属性:Ca>Na>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性:Ca(OH)2>NaOH>Mg(OH)2,能用元素周期律解释,B错误;
C. 非金属性:Cl>Br>S,元素的非金属性越强,对应离子的还原性越弱,则还原性:S2->Br->Cl-,能用元素周期律解释,C错误;
D. H2CO3不能稳定存在,常温下能分解生成CO2和H2O,碳酸盐难分解,碳酸氢盐受热易分解,则稳定性:Na2CO3>NaHCO3>H2CO3,但是不能用元素周期律解释,D错误;
故选A。
8.C
【详解】A. Na、Mg、Al金属性减弱,还原性依次减弱,故A正确;
B. I、Br、Cl非金属增强,其单质的氧化性依次增强,故B正确;
C. C、N、O同属于周期元素,核电荷数增大,原子半径依次减小,故C错误;
D. P、S、Cl最高正价依次为+5、+6、+7,依次升高,故D正确;
故选C。
9.A
【详解】A.非金属性:Cl>Br>I,元素非金属性越强,对应的最高价氧化物的水化物酸性越强,则有酸性强弱:HIO4>HBrO4>HClO4,故A错误;
B.同周期元素从左到右原子半径逐渐减小,则Na>S,原子核外电子层数越多,半径越大,O的原子核外有2个电子层,半径最小,则原子半径:Na>S>O,故B不选;
C.金属性:K>Na>Li,元素的金属性越强,对应最高价氧化物的水化物的碱性越强,则有碱性强弱:KOH>NaOH>LiOH,故C不选;
D.同周期元素从左到右金属性逐渐减弱,则有金属性强弱:Na>Mg>Al,故D不选。
故答案选A。
10.C
【详解】电子层数越多半径越大,电子层数相同时,质子数越多半径越小;阳离子半径,阴离子半径,所以阳离子与阴离子的半径之比最小的是Li2S,故选C。
11.(1)逐渐减弱
(2)D
(3)2Na+2H2O=2Na++2OH-+H2↑
(4)BC
(5)2Al+6H+=2Al3++3H2↑
同一周期,从左到右,原子失电子能力减弱,则元素金属性逐渐减弱;故答案为:逐渐减弱;
(2)
金属性K>Na>Mg>Al,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是D,故答案为:D;
(3)
钠与水反应生成氢氧化钠和氢气,则钠与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(4)
反应现象不明显,说明反应速率小,升高温度可以加快速率,所以把冷水换为热水,把水换为盐酸增大了溶液中氢离子的浓度,可以加快速率;故答案为:BC;
(5)
铝与盐酸反应生成氯化铝和氢气,其反应的离子方程式为:2Al+6H+=2Al3++3H2↑;故答案为:2Al+6H+=2Al3++3H2↑。
12.(1) Ar Si NaOH HClO4 Al (OH) 3
(2)C
(3)第四周期IVA族
(4) 分液漏斗 防止倒吸 变蓝 Cl2+2I-=2C1-+I2 氢氧化钠 Cl2+2NaOH=NaCl+NaC1O+2H2O
第三周期元素中,Ar原子最外层有8个电子,结构稳定,化学性质最不活泼的是Ar;单质Si的导电性介于导体和绝缘体之间,可用于制半导体材料的元素是Si;金属性越强,最高价氧化物的水化物碱性越强,最高价氧化物的水化物碱性最强的是NaOH;非金属性越强,最高价氧化物的水化物酸性越强,最高价氧化物的水化物酸性最强的是HClO4,氢氧化铝既能和酸反应又能与碱反应,具有两性的是Al (OH) 3。
(2)
同周期元素从左到右,半径依次减小,在C、N、O、F中,原子半径最大的是C;
(3)
第32号元素是Ge,在元素周期表中的位置为第四周期IVA族;
(4)
①根据装置图,仪器A的名称为分液漏斗;干燥管D具有防止倒吸的作用。
②氯气和KI反应生成KCl、I2,碘遇与淀粉变蓝色,观察到C中溶液变蓝,氯气在C中反应的离子方程式为Cl2+2I-=2C1-+I2。氯气能与氢氧化钠反应生成氯化钠和次氯酸钠,可用氢氧化钠溶液吸收尾气,反应的化学方程式为Cl2+2NaOH=NaCl+NaC1O+2H2O。
13.(1) Cl N Al
(2)
(3)CD
(4)2
(5)181.8
(6)1
Cl的最高正价为+7,最低负价为-1,代数和为6,故该元素为Cl;常温下单质为双原子分子,氮气分子中含有3对共用电子对,故该元素为N;第三周期元素金属离子的电子层数为2,非金属离子的电子层数为3,电子层数越少,半径越小,核电荷数越大,半径越小,简单离子中半径最小的元素是:Al;
(2)
将氨水滴入AlCl3溶液中生成氢氧化铝沉淀,离子方程式是:;
(3)
A. 铜元素化合价不变,A错误;
B. 铁元素化合价升高,需要氧化剂才能实现,B错误;
C. 氢元素化合价降低,需要还原剂才能实现,C正确;
D. 氮元素化合价降低,需要还原剂才能实现,D正确;
故选CD;
(4)
容器中活塞两侧的压强相同,物质的量之比等于体积比,故H2和O2的物质的量之和为2mol,设H2和O2的物质的量分别为xmol和ymol,则x+y=2,2x+32y=34g,解得x=y=1,H2和O2充分反应后:,剩余氧气的物质的量为0.5mol,而右侧空气的物质的量为1mol,故VB=2VA,活塞应在2处;
(5)
每100个水分子中含有1个Na+离子,设需要水的物质的量为xmol,则,x=10mol,又金属钠与水反应还需要消耗水,根据方程式:,0.1molNa消耗0.1mol水,故共需要水的物质的量为10.1mol,质量为:;
(6)
根据离子方程式:,产生氢气的物质的量为,消耗氢氧根的物质的量为1.0mol,NaOH溶液的浓度为:。
14.(1)KI+IBr=I2+KBr
(2)由于卤素互化物分子的极性并不强,故X2、XX′形成的分子晶体沸点高低主要取决于相对分子质量大小。随着相对分子质量增大,分子间作用力增强,故沸点升高
(3)根据其相对分子质量,其沸点范围应该在Br2与IBr之间
KI与IBr反应生成溴化钾和碘,反应方程式为KI+IBr=KBr+I2,故答案为:KI+IBr=KBr+I2;
(2)
卤素单质的沸点随着相对分子质量的增大而升高,其原因是:由于卤素互化物分子的极性并不强,故X2、XX′形成的分子晶体沸点高低主要取决于相对分子质量大小。随着相对分子质量增大,分子间作用力增强,故沸点升高;
(3)
分子晶体的熔沸点随分子量的增大而升高,这三种物质都是分子晶体,其相对分子质量越大,该物质的熔沸点越高,所以ICl的沸点所处的最小范围:Br2<ICl<IBr,故答案为:根据其相对分子质量,其沸点范围应该在Br2与IBr之间。
15.(1) 分液漏斗 防止倒吸
(2) 变蓝 NaOH
(3) Na2SiO3 有白色沉淀生成
(4)饱和NaHCO3
【分析】(2)浓盐酸和高锰酸钾反应生成氯气,氯气能氧化碘离子生成碘,氯气有毒,不能直接排空,可以用碱液吸收氯气;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;盐酸具有挥发性导致生成的二氧化碳中含有HCl,HCl能和硅酸钠反应生成硅酸,要除去HCl,可以用饱和的碳酸氢钠溶液。
(1)
仪器A为分液漏斗,装置D有缓冲作用,能防止倒吸;
(2)
浓盐酸和高锰酸钾反应生成氯气,氯气具有强氧化性、碘离子具有还原性,则氯气能氧化碘离子生成碘,离子方程式为Cl2+2I-=2Cl-+I2,碘单质遇淀粉变蓝;氯气有毒,不能直接排空,但是氯气能和NaOH反应生成无毒的钠盐,所以可以用NaOH溶液吸收多余的氯气;
(3)
元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,要证明非金属性C>Si,稀盐酸和碳酸钙反应生成二氧化碳,二氧化碳和硅酸钠溶液反应生成难溶性的硅酸,由此知碳酸酸性大于硅酸,所以非金属性C>Si,所以C中应该盛放Na2SiO3溶液;现象为C中生成硅酸白色沉淀;
(4)
盐酸具有挥发性导致生成的二氧化碳中含有HCl,HCl能和硅酸钠反应生成硅酸,所以在将气体通入硅酸钠溶液之前除去HCl,可以用饱和的NaHCO3溶液,则可进入C中干扰实验,应在两装置间添加装有NaHCO3溶液的洗气瓶。
16.
阅读材料,完成下列要求。
(1)这个公司今年做了将近一百万元以上的生意。
(2)张三考试作弊,一种意见是要处分,一种意见是不要处分,这两种意见我都不赞成,关键是做好张三的思想工作。
(3)万里长城是我国劳动人民智慧的结晶,也是我国的天然屏障。
(4)“鲁迅是一个乡土作家”是一种意见,“鲁迅不是一个乡土作家”也是一种意见,对这两种意见我很难表态。如果一定要我表态的话。我认为:“如果鲁迅是一个乡土作家,那么,他就是一个乡土作家,如果鲁迅不是一个乡土作家,那么,他就不是一个乡土作家。”
以上各段文字是否符合矛盾律和排中律的要求?如不符合,指出其违反了哪条基本规律,犯了什么逻辑错误。
17.(1) 分液漏斗 防止倒吸
(2) 浓盐酸 KMnO4 Na2S溶液 Cl2+Na2S=2NaCl+S↓
【分析】先用浓盐酸和高锰酸钾常温下反应制取氯气,生成的氯气通入硫化钠溶液中,置换出硫单质,证明氯气的氧化性比硫强。
(1)
依据仪器构造可知,A为分液漏斗,氯气与硫化钠溶液反应,气体体积减少,D起到防倒吸的作用。
(2)
要验证氯的非金属性比硫强,可验证氯气的氧化性比硫单质强,题给发生装置为固-液不加热装置,因此应选择浓盐酸和高锰酸钾常温下反应制取氯气,A中盛放浓盐酸、B中盛放高锰酸钾,将生成的氯气通入硫化钠溶液中,氯气与硫化钠反应生成氯化钠和硫单质,从而证明氯气的氧化性比硫单质强,则C中盛放硫化钠溶液,反应的化学方程式为:Cl2+Na2S=2NaCl+S↓。
18. Mg2++2OH-=Mg(OH)2↓ Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO+2H2O 0.27g 0≤a<50mL 2.5
【分析】0~a段没有生成沉淀,说明盐酸过量,加入的氢氧化钠与氯化氢反应;a~80段开始生成沉淀,加入80mL氢氧化钠溶液后沉淀达到最大量,沉淀为Mg(OH)2和Al(OH)3,此时溶液中的溶质为NaCl;80~90段氢氧化铝开始溶解,得到偏铝酸钠,溶解氢氧化铝消耗了10mLNaOH,当加入90mLNaOH溶液后氢氧化铝完全溶解,此时沉淀只有氢氧化镁。
【详解】(1)0~a段氢氧化钠与氯化氢反应,离子方程式为H++OH-=H2O,a~80段生成Mg(OH)2和Al(OH)3沉淀,离子方程式分别为Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓;
(2)80~90段氢氧化铝开始溶解,发生反应Al(OH)3+OH-=AlO+2H2O,溶解氢氧化铝消耗了10mLNaOH,所以n(Al)=1mol·L-1×0.01L=0.01mol,质量为0.01mol×27g/mol=0.27g;
(3)假设盐酸溶解金属后不剩,这种情况下,酸恰好与合金反应完全,此时a=0;当合金中0.01mol铝时,a值最大,沉淀Al3+需要NaOH溶液的体积为30mL,所以a最大为80mL-30mL=50mL,但合金中不可能只有铝,所以的取值范围为0≤a<50mL;
(4)当a=0时,n(Mg)最大,此时沉淀Mg2+消耗50mLNaOH溶液,所以n(Mg)= 1mol·L-1×0.05L÷2=0.025mol,所以的最大值为=2.5。
19. 42g C2H6 3mol·L-1或7mol·L-1
【分析】3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,3molCu作还原剂,与2molHNO3作氧化剂,遵循电子守恒,以此来解答;AlCl3溶液中加入NaOH溶液,若碱不足,只发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl;先求出实验式,再求分子式;若碱与铝离子的物质的量之比大于3:1时,先发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl,后发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,据此讨论计算。
【详解】(1)n(Cu)= =1mol,设被还原的硝酸为xmol,则
, ,解得x= mol,则被还原的硝酸的质量为mol×63g/mol=42g,故答案为42g;
(2)n(CO2)==0.4mol,n(H2O)= =0.6mol,完全燃烧生成0.4molCO2和0.6H2O,n(C):n(H)=0.4:0.6 2=2:6,可知烃的实验式为C2H6,碳已经饱和,分子式为C2H6,故答案为:C2H6;
(3)100ml2mol·L-1的AlCl3溶液中,n(Al3+)=0.1L×2mol·L-1 =0.2mol,生成沉淀的质量是7.8g,其物质的量为: =0.1mol,可能是0.2molAl3+生成0.1mol沉淀,或者0.2molAl3+生成0.2molAl(OH)3沉淀后又溶解了0.1mol;
①若碱不足,即0.2molAl3+生成0.1mol沉淀,AlCl3+3NaOH=Al(OH)3↓+3NaCl,NaOH的物质的量为0.1mol×3=0.3mol,c(NaOH)= =3mol·L-1;
②碱与铝离子的物质的量之比大于3:1,小于4:1,即0.2molAl3+生成0.1mol沉淀,或者0.2molAl3+生成0.2molAl(OH)3沉淀后又溶解了0.1mol;
则消耗的碱的物质的量为0.6mol+0.1mol=0.7mol,c(NaOH)==7mol·L-1;
故答案为:3mol·L-1或7mol·L-1。
20.(1)3
(2)6.72
(3) 160
【分析】铝的原子量为27g/mol,的物质的量为0.2mol,与盐酸恰好完全反应生成氯化铝和氢气,方程式为:2Al+6HCl=2AlCl3+3H2↑,根据2Al~6HCl~3H2~2 AlCl3关系进行计算。
(1)
结合以上分析可知,2Al~6HCl,所以0.2mol铝完全反应消耗HCl为0.6mol,根据c=计算,所用盐酸中的物质的量浓度为=3mol/L;
(2)
根据2Al~6HCl~3H2关系可知,0.2mol铝完全反应生成氢气0.3mol,根据V=nVm计算,反应中生成的在标准状况下的体积为0.3mol×22.4L/mol=6.72L;
(3)
结合以上分析可知,反应后的溶液为氯化铝,向氯化铝溶液中滴加氢氧化钠溶液,先发生的反应为:Al3++3OH-=Al(OH)3↓,生成沉淀;后发生反应:Al(OH)3+OH-=+2H2O,沉淀溶解;
①段为生成的沉淀溶解的过程,反应的离子方程式:;
②氯化铝溶液加入氢氧化钠溶液后,先沉淀后溶解,到V1时,恰好完全反应生成偏铝酸钠和氯化钠,结合以上分析可知,0.2mol铝完全反应生成氯化铝0.2mol,所以n(Cl)=3n(AlCl3)=0.2mol×3=0.6mol;n(Al)= n(AlCl3)=0.2mol,根据元素守恒规律可知n(Cl)+n(Al)=n(Na)可知,n(Na)=0.8mol,设氢氧化钠的体积为VL,所以5mol/L×V=0.8mol,V=0.16L=160mL。
