“精品作业”2.5.2 物质的转化(提高版,含答案)
文档属性
| 名称 | “精品作业”2.5.2 物质的转化(提高版,含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 234.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-10-06 12:57:53 | ||
图片预览




文档简介
“精品作业”2.5.2 物质的转化
(提高版)
一.选择题(共15小题)
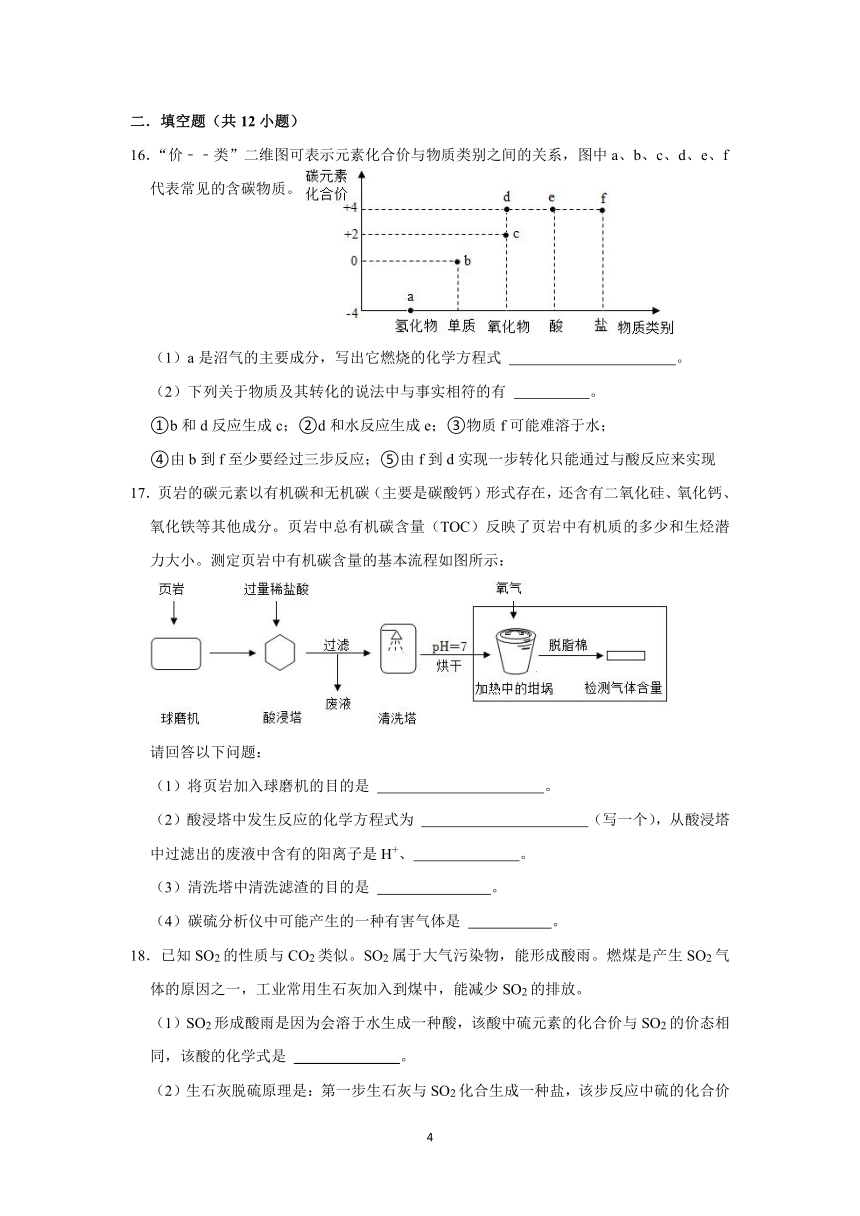
1.NSR技术通过BaO和Ba(NO3)2的相互转化实现NOx(氮氧化物)的储存和还原,能有效降低柴油发动机在空气过量条件下的NOx排放。其工作原理如图所示,下列说法正确的是( )
A.BaO、Ba(NO3)2都属于金属氧化物
B.储存时,吸收NOx(如NO,NO2)的物质是Pt C.储存和还原中分子的种类不变
D.还原反应:5CO+Ba(NO3)2N2+BaO+5X,则X的化学式为CO2
2.用Mg、MgO、稀盐酸、Mg(OH)2、CuCl2溶液五种物质两两混合,能得到MgCl2的方法有( )
A.两种 B.三种 C.四种 D.五种
3.甲、乙、丙三种物质转化关系如图所示(“→”表示反应能一步实现,“﹣”表示相连物质能发生反应,部分反应物、生成物和反应条件均已略去),则不满足的是( )
A.甲是O2,丙是CO2 B.甲是H2,乙是O2
C.乙是NaOH,丙是Na2CO3 D.甲是HNO3,丙是NaNO3
4.要完成下列变化,能通过盐酸一步反应实现的是( )
①CaCO3→CaCl2②Fe2O3→FeCl2③Cu(OH)2→CuCl2④Fe→FeCl3⑤CaO→CaCl2.
A.①②⑤ B.②③⑤ C.③④ D.①③⑤
5.工业上综合利用铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)的部分工艺流程如图。实验室模拟上述流程中,不需要使用的装置是( )
铝土矿滤渣硅酸钠
B. C. D.
6.A、B是初中化学常见的物质,它们之间的转化关系如图所示(反应条件、部分反应物和生成物已略去,“—”表示物质间可以直接转化)。其中A、B对应的物质不合理的是( )
A.Cu、CuO B.H2O、O2 C.Ca(OH)2、CaCO3 D.CO2、Na2CO3
7.如图是铜及其化合物之间的转化,下列说法正确的是( )
A.转化①中能观察到紫红色固体变成蓝色
B.通过与C或CO发生置换反应可实现转化②
C.向CuO中加入稀硫酸能实现转化③
D.要实现转化④只能向CuSO4溶液中加入铁
8.小科同学在学习了物质的转化规律后,绘制了可以通过一步
反应制取ZnSO4的思维导图。下列选项中各字母所对应的物质不能达到目的的是( )
A.Zn(OH)2 B.CuSO4 C.ZnO D.H2SO4
9.在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径:若用这两种方法制得的铜质量相等,则下列有关说法符合实际情况的是( )
(1)FeH2Cu (2)CuOCuSO4Cu
A.消耗氧化铜的质量不同 B.消耗铁的质量相同
C.消耗硫酸的质量相同 D.生成硫酸亚铁的质量不同
10.下列物质的转化在给定条件下均能实现的是( )
A.H2H2OH2SO4
B.AgAg2SO4AgNO3溶液
C.Ca(OH)2溶液Ca(NO3)2溶液CaCO3
D.NaClNaHCO3Na2SO4溶液
11.南海深处有“鲸落”,在硫细菌作用下,有如图所示物质转化。在H2S充足时,发生①反应,为反应③提供能量、同时积累S;当H2S不充足时,利用积累的S进行反应②,也为反应③提供能量。下列关于反应的说法不正确的是( )
A.反应①中硫化氢与氧气两物质质量之比为17:8
B.反应②中一定有水参加
C.反应③为光合作用
D.①③总的反应方程式为:6H2S+6CO2═C6H12O6+3O2+6S↓
12.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取绿矾(FeSO4 7H2O),设计了如图流程:
已知:①Al(OH)3与Fe(OH)2沉淀时的pH不同,Al(OH)3恰好完全沉淀时,Fe2+尚未沉淀。②Fe2(SO4)3+Fe═3FeSO4。下列说法正确的是( )
A.溶解烧渣可选用足量稀盐酸,试剂X选用铁粉
B.过滤得到绿矾后,剩余母液可返回到溶液3中循环利用
C.固体1是SiO2,固体3是Al(OH)3和Fe(OH)3
D.为加快过滤速度,可用玻璃棒搅拌
13.利用化学反应合成新物质是化学对人类的巨大贡献。如图是Mg(OH)2、MgCl2、
Mg(NO3)2三种物质间的转化关系,根据所学知识判断,下列说法正确的是( )
A.通过一步反应无法实现②的转化 B.欲实现①的转化,加入稀盐酸即可
C.只有加入氢氧化钠溶液才能实现③的转化
D.通过一步反应可实现Mg(NO3)2向MgCl2的转化
14.在C→CO2→CaCO3→CaO→Ca(OH)2的转化过程中,下列说法正确的是( )
A.C→CO2转化过程中只能体现C的可燃性 B.CaO→Ca(OH)2的过程吸收热量
C.在此转化过程中钙元素的质量没有发生改变
D.如要实现由CaCO3→CO2只能通过碳酸钙与稀盐酸反应
15.如图,给出了三种物质可能存在的转化关系,根据所学的物质性质及化学变化规律,判断下列选项正确的是( )
A.实现①转化,可加入氧化铜
B.实现②转化,可通入CO2
C.实现③转化,可加入稀盐酸 D.能一步实现转化的是④
二.填空题(共12小题)
16.“价﹣﹣类”二维图可表示元素化合价与物质类别之间的关系,图中a、b、c、d、e、f代表常见的含碳物质。
(1)a是沼气的主要成分,写出它燃烧的化学方程式 。
(2)下列关于物质及其转化的说法中与事实相符的有 。
①b和d反应生成c;②d和水反应生成e;③物质f可能难溶于水;
④由b到f至少要经过三步反应;⑤由f到d实现一步转化只能通过与酸反应来实现
17.页岩的碳元素以有机碳和无机碳(主要是碳酸钙)形式存在,还含有二氧化硅、氧化钙、氧化铁等其他成分。页岩中总有机碳含量(TOC)反映了页岩中有机质的多少和生烃潜力大小。测定页岩中有机碳含量的基本流程如图所示:
请回答以下问题:
(1)将页岩加入球磨机的目的是 。
(2)酸浸塔中发生反应的化学方程式为 (写一个),从酸浸塔中过滤出的废液中含有的阳离子是H+、 。
(3)清洗塔中清洗滤渣的目的是 。
(4)碳硫分析仪中可能产生的一种有害气体是 。
18.已知SO2的性质与CO2类似。SO2属于大气污染物,能形成酸雨。燃煤是产生SO2气体的原因之一,工业常用生石灰加入到煤中,能减少SO2的排放。
(1)SO2形成酸雨是因为会溶于水生成一种酸,该酸中硫元素的化合价与SO2的价态相同,该酸的化学式是 。
(2)生石灰脱硫原理是:第一步生石灰与SO2化合生成一种盐,该步反应中硫的化合价不变:第二步是生成的盐与氧气化合为一种常见的建筑原料,该步反应中硫元素的化合价升高到+6价。写出两步反应的化学方程式:第一步: 。第二步: 。
(3)某工厂将矿物燃料燃烧产生的废气中的SO2收集起来,既可以生产稀硫酸,又能制备氢气,其反应过程如图所示:
写出反应器中发生化学反应的方程式 ,某含硫5%的矿物燃料1000kg完全燃烧后,按上述过程进行废气处理,最终可获得硫酸 kg(保留一位小数);此制备过程中可循环利用的物质是 (填名称)。
19.进一步了解金属的性质,才能使金属材料更好的为人类服务。
(1)金属的物理性质建造高铁使用了大量的铝合金,该合金的物理性质有
(填一条)。
(2)金属的化学性质:
①铝制品在空气中不易锈蚀的原因是 (用化学方程式表示)。
②如图是铝原子的结构示意图,最外层电子数是 ,在化学反应中容易 电子变成阳离子,化学性质比较活泼。
新型金属材料的研发,如图新型材料纳米级Fe粉具有广泛的用途,
它比普通Fe粉更易与氧气反应,其制备工艺流程如图所示,请回答下列问题:
①纳米级Fe粉在氧气中能容易燃烧生成黑色固体,此黑色固体的化学式为 。
②在制备纳米级Fe粉的工艺流程中,N2不参与反应,则N2作用是 。
③研究人员发现最后制得的纳米级Fe粉样品中混有少量的FeCl2杂质,请设计实验方案除去杂质,方案是 。
20.我国科研团队发现“嫦娥五号”取回的月壤中含催化活性物质,它们船实现水、二氧化碳的高效转化,该团队提出利用月填实现月球生存的设想:
21.(1)环节①分离水后的气体含有CO2、N2和 等(填一种)。
(2)环节②电解水的化学方程式为 。
(3)环节③利用月球夜间低温(约﹣173℃),将二氧化碳凝结分离。为检验分离后的气体中是否还含有,可将气体样品通入 (填试剂名称)。
(4)环节④将二氧化碳和氢气转化为甲烷和水。微观示意图如图:
参加反应的甲和乙的分子个数比为 。
(5)该设想有利于实现月球基地中 等元素的循环利用。
22.半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O。半水煤气经过下列步骤转化为合成氨所需要的H2和N2。
(1)半水煤气在铜催化和加热条件下实现CO变换为CO2,观察流程图,分析可知反应的化学方程式为 。
(2)碱液吸收法是脱除二氧化碳的方法之一。用氢氧化钠溶液脱除二氧化碳,若取某脱除二氧化碳后的碱液样品于试管中,加入 ,溶液变红,证明该碱液中还含有氢氧化钠。
23.化学材料在生产生活中具有重要作用。(1)请用化学用语填空:
①氖元素 ;②3个镁离子 ;③天然气的主要成分是 ;
④高铁酸钠由Na+和构成,则其化学式为: 。
(2)钼是一种重要的金属元素,用它制成的合金具有良好的机械性能,在工农业生产和国防上有着广泛的应用。利用钼矿石(主要成分为MoS2)制备金属钼的流程如图所示:
①通常在灼烧时会将钼矿石粉碎,目的是 。
②尾气SO2容易引起的环境问题是 。
③由精产品到金属钼的化学方程式为 。
24.“CO2”的再认识。Ⅰ、“CO2”的现实矛盾
(1)CO2的大量排放导致了世界十大环境问题之一的 ,但CO2又是绿色植物进行 的原料,为生物提供食物和氧气。Ⅱ、“CO2”的研究历史
(2)西晋《博物志》记载:在烧白石(CaCO3)制白灰过程中产生一种气体,即CO2。
(3)一千多年后,英国化学家布莱克将此法产生的CO2称作为“固定空气”,提出了以下论断:①石灰石﹣固定空气=苛性石灰②苛性石灰+苏打(碳酸钠)=石灰石+苛性钠;③苏打一固定空气=苛性钠,此论断已被否定,否定的理由是 。
Ⅲ、“CO2”的米米发展
2022年4月,中国科学家发表了将CO2先高效还原合成高浓度乙酸(C2H4O2)再进一步利用微生物合成葡萄糖的成果,下图为该成果的关键步骤。
(4)虚线框内制CO的总反应化学方程式为 。
(5)合成乙酸时,参加反应的CO和H2O的质量比为 。将获得的葡萄糖配制成一定浓度的溶液,加入适量新制Cu(OH)2,加热煮沸,出现红色固体 (填化学式)。
25.甲醇有“液态阳光”之称,可用二氧化碳和氢气制得。
(1)图1中物质A的化学式 。
(2)该合成过程采用了“光伏发电”电解水制取氢气,其中“光伏发电”是将光能转化为 能。
(3)图2是二氧化碳合成甲醇的微观过程(未配平)。
①该反应的化学方程式为 。
②反应前后不变的微粒是 。(用符号表示)
26.盐卤是海水晒盐后的富含镁盐的溶液,盐卤中主要盐类物质及其含量如图甲,利用盐卤生产金属镁的主要流程如图乙,据图回答以下问题。
(1)①操作a是过滤,如在实验室进行此操作用到的玻璃仪器有 、烧杯、玻璃棒。写出盐卤与熟石灰反应的化学方程式 (写一个)。
②试剂B是 (填物质名称)。
(2)若生产中镁元素没有损失,且其他盐类中镁元素质量可忽略不计,则1000克盐卤可制备金属镁 克。
27.利用废旧电池铜帽(含Cu、Zn)制取海绵铜的主要流程如图。
已知:①2Cu+2H2SO4+O2═2CuSO4+2H2O;②流程中各步反应所加试剂均过量。
(1)反应池Ⅰ中,Zn能与稀H2SO4发生置换反应而Cu不能的原因是 。
(2)反应池Ⅱ中发生反应的化学方程式为: 。
(3)反应池Ⅲ中加入稀H2SO4的目的是 。
28.碳是重要的生命元素,碳元素使世界变得更加绚丽多彩,回答下列与碳元素相关的问题。
(1)如图是含碳元素的一些物质转化关系。
①途径Ⅰ:可由化合物与单质参与反应实现,该化合物是 。
②途径Ⅱ:古人将炉甘石(ZnCO3)煅烧分解可制得 (填化学式)和CO2。
③途径Ⅲ:写出符合要求的一个化学反应方程式 。
④途径Ⅳ:面包中有许多小孔,是发酵粉中的 (填化学式)与有机酸作用形成的。
(2)乙醇汽油的开发与利用可适当地节省石油资源,
请写出乙醇燃烧的化学方程式 。
“精品作业”2.5.2 物质的转化
(提高版)参考答案与试题解析
一.选择题(共15小题)
1.D。2.C。3.D。4.D。5.B。6.C。7.C。8.A。9.D。10.C。11.C。
12.B。13.B。14.C。15.C。
二.填空题(共12小题)
16.(1)CH4+2O2CO2+2H2O;(2)①②③。
17.(1)粉碎,增大反应物的接触面积,提高反应速率;
(2)CaO+2HCl=CaCl2+H2O;钙离子、铁离子;(3)除去二氧化硅和碳;(4)CO。
18.(1)H2SO3;(2)CaO+SO2=CaSO3;2CaSO3+O2=2CaSO4;
(3)SO2+I2+2H2OH2SO4+2HI;153.1;碘。
19.(1)硬度大(合理即可);(2)4Al+3O2=2Al2O3;3;失去;(3)①Fe3O4;
②做保护气;③在无氧环境下,先加水溶解,然后再过滤、洗涤、烘干。
20.(1)O2;(2)2H2O2H2↑+O2↑;(3)澄清石灰水;
(4)4:1;(5)碳、氢、氧。
21.(1)CO+H2OCO2+H2。(2)足量氯化钙溶液,再滴加酚酞试液。
22.(1)①Ne;②3Mg2+;③CH4;④Na2FeO4;
(2)①增大接触面积,使反应更加充分;②酸雨;③。
23.(1)温室效应;光合作用;(3)②、③反应前后元素不守恒
(4)H2O+CO2H2+O2+CO;(5)14:9;Cu2O。
24.(1)CO2。(2)电。(3)①CO2+3H2CH3OH+H2O。②C、O、H。
25.(1)①漏斗;MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2;②盐酸;(2)48g。
26.(1)锌的位置排在氢的前面,铜的位置排在氢的后面;
(2)Zn+H2SO4═ZnSO4+H2↑、Zn+CuSO4═ZnSO4+Cu;
(3)除去固体C中的锌。
27.(1)①一氧化碳;②ZnO;③C+2CuO2Cu+CO2↑;④NaHCO3;
(2)C2H5OH+3O22CO2+3H2O。
(提高版)
一.选择题(共15小题)
1.NSR技术通过BaO和Ba(NO3)2的相互转化实现NOx(氮氧化物)的储存和还原,能有效降低柴油发动机在空气过量条件下的NOx排放。其工作原理如图所示,下列说法正确的是( )
A.BaO、Ba(NO3)2都属于金属氧化物
B.储存时,吸收NOx(如NO,NO2)的物质是Pt C.储存和还原中分子的种类不变
D.还原反应:5CO+Ba(NO3)2N2+BaO+5X,则X的化学式为CO2
2.用Mg、MgO、稀盐酸、Mg(OH)2、CuCl2溶液五种物质两两混合,能得到MgCl2的方法有( )
A.两种 B.三种 C.四种 D.五种
3.甲、乙、丙三种物质转化关系如图所示(“→”表示反应能一步实现,“﹣”表示相连物质能发生反应,部分反应物、生成物和反应条件均已略去),则不满足的是( )
A.甲是O2,丙是CO2 B.甲是H2,乙是O2
C.乙是NaOH,丙是Na2CO3 D.甲是HNO3,丙是NaNO3
4.要完成下列变化,能通过盐酸一步反应实现的是( )
①CaCO3→CaCl2②Fe2O3→FeCl2③Cu(OH)2→CuCl2④Fe→FeCl3⑤CaO→CaCl2.
A.①②⑤ B.②③⑤ C.③④ D.①③⑤
5.工业上综合利用铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)的部分工艺流程如图。实验室模拟上述流程中,不需要使用的装置是( )
铝土矿滤渣硅酸钠
B. C. D.
6.A、B是初中化学常见的物质,它们之间的转化关系如图所示(反应条件、部分反应物和生成物已略去,“—”表示物质间可以直接转化)。其中A、B对应的物质不合理的是( )
A.Cu、CuO B.H2O、O2 C.Ca(OH)2、CaCO3 D.CO2、Na2CO3
7.如图是铜及其化合物之间的转化,下列说法正确的是( )
A.转化①中能观察到紫红色固体变成蓝色
B.通过与C或CO发生置换反应可实现转化②
C.向CuO中加入稀硫酸能实现转化③
D.要实现转化④只能向CuSO4溶液中加入铁
8.小科同学在学习了物质的转化规律后,绘制了可以通过一步
反应制取ZnSO4的思维导图。下列选项中各字母所对应的物质不能达到目的的是( )
A.Zn(OH)2 B.CuSO4 C.ZnO D.H2SO4
9.在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径:若用这两种方法制得的铜质量相等,则下列有关说法符合实际情况的是( )
(1)FeH2Cu (2)CuOCuSO4Cu
A.消耗氧化铜的质量不同 B.消耗铁的质量相同
C.消耗硫酸的质量相同 D.生成硫酸亚铁的质量不同
10.下列物质的转化在给定条件下均能实现的是( )
A.H2H2OH2SO4
B.AgAg2SO4AgNO3溶液
C.Ca(OH)2溶液Ca(NO3)2溶液CaCO3
D.NaClNaHCO3Na2SO4溶液
11.南海深处有“鲸落”,在硫细菌作用下,有如图所示物质转化。在H2S充足时,发生①反应,为反应③提供能量、同时积累S;当H2S不充足时,利用积累的S进行反应②,也为反应③提供能量。下列关于反应的说法不正确的是( )
A.反应①中硫化氢与氧气两物质质量之比为17:8
B.反应②中一定有水参加
C.反应③为光合作用
D.①③总的反应方程式为:6H2S+6CO2═C6H12O6+3O2+6S↓
12.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取绿矾(FeSO4 7H2O),设计了如图流程:
已知:①Al(OH)3与Fe(OH)2沉淀时的pH不同,Al(OH)3恰好完全沉淀时,Fe2+尚未沉淀。②Fe2(SO4)3+Fe═3FeSO4。下列说法正确的是( )
A.溶解烧渣可选用足量稀盐酸,试剂X选用铁粉
B.过滤得到绿矾后,剩余母液可返回到溶液3中循环利用
C.固体1是SiO2,固体3是Al(OH)3和Fe(OH)3
D.为加快过滤速度,可用玻璃棒搅拌
13.利用化学反应合成新物质是化学对人类的巨大贡献。如图是Mg(OH)2、MgCl2、
Mg(NO3)2三种物质间的转化关系,根据所学知识判断,下列说法正确的是( )
A.通过一步反应无法实现②的转化 B.欲实现①的转化,加入稀盐酸即可
C.只有加入氢氧化钠溶液才能实现③的转化
D.通过一步反应可实现Mg(NO3)2向MgCl2的转化
14.在C→CO2→CaCO3→CaO→Ca(OH)2的转化过程中,下列说法正确的是( )
A.C→CO2转化过程中只能体现C的可燃性 B.CaO→Ca(OH)2的过程吸收热量
C.在此转化过程中钙元素的质量没有发生改变
D.如要实现由CaCO3→CO2只能通过碳酸钙与稀盐酸反应
15.如图,给出了三种物质可能存在的转化关系,根据所学的物质性质及化学变化规律,判断下列选项正确的是( )
A.实现①转化,可加入氧化铜
B.实现②转化,可通入CO2
C.实现③转化,可加入稀盐酸 D.能一步实现转化的是④
二.填空题(共12小题)
16.“价﹣﹣类”二维图可表示元素化合价与物质类别之间的关系,图中a、b、c、d、e、f代表常见的含碳物质。
(1)a是沼气的主要成分,写出它燃烧的化学方程式 。
(2)下列关于物质及其转化的说法中与事实相符的有 。
①b和d反应生成c;②d和水反应生成e;③物质f可能难溶于水;
④由b到f至少要经过三步反应;⑤由f到d实现一步转化只能通过与酸反应来实现
17.页岩的碳元素以有机碳和无机碳(主要是碳酸钙)形式存在,还含有二氧化硅、氧化钙、氧化铁等其他成分。页岩中总有机碳含量(TOC)反映了页岩中有机质的多少和生烃潜力大小。测定页岩中有机碳含量的基本流程如图所示:
请回答以下问题:
(1)将页岩加入球磨机的目的是 。
(2)酸浸塔中发生反应的化学方程式为 (写一个),从酸浸塔中过滤出的废液中含有的阳离子是H+、 。
(3)清洗塔中清洗滤渣的目的是 。
(4)碳硫分析仪中可能产生的一种有害气体是 。
18.已知SO2的性质与CO2类似。SO2属于大气污染物,能形成酸雨。燃煤是产生SO2气体的原因之一,工业常用生石灰加入到煤中,能减少SO2的排放。
(1)SO2形成酸雨是因为会溶于水生成一种酸,该酸中硫元素的化合价与SO2的价态相同,该酸的化学式是 。
(2)生石灰脱硫原理是:第一步生石灰与SO2化合生成一种盐,该步反应中硫的化合价不变:第二步是生成的盐与氧气化合为一种常见的建筑原料,该步反应中硫元素的化合价升高到+6价。写出两步反应的化学方程式:第一步: 。第二步: 。
(3)某工厂将矿物燃料燃烧产生的废气中的SO2收集起来,既可以生产稀硫酸,又能制备氢气,其反应过程如图所示:
写出反应器中发生化学反应的方程式 ,某含硫5%的矿物燃料1000kg完全燃烧后,按上述过程进行废气处理,最终可获得硫酸 kg(保留一位小数);此制备过程中可循环利用的物质是 (填名称)。
19.进一步了解金属的性质,才能使金属材料更好的为人类服务。
(1)金属的物理性质建造高铁使用了大量的铝合金,该合金的物理性质有
(填一条)。
(2)金属的化学性质:
①铝制品在空气中不易锈蚀的原因是 (用化学方程式表示)。
②如图是铝原子的结构示意图,最外层电子数是 ,在化学反应中容易 电子变成阳离子,化学性质比较活泼。
新型金属材料的研发,如图新型材料纳米级Fe粉具有广泛的用途,
它比普通Fe粉更易与氧气反应,其制备工艺流程如图所示,请回答下列问题:
①纳米级Fe粉在氧气中能容易燃烧生成黑色固体,此黑色固体的化学式为 。
②在制备纳米级Fe粉的工艺流程中,N2不参与反应,则N2作用是 。
③研究人员发现最后制得的纳米级Fe粉样品中混有少量的FeCl2杂质,请设计实验方案除去杂质,方案是 。
20.我国科研团队发现“嫦娥五号”取回的月壤中含催化活性物质,它们船实现水、二氧化碳的高效转化,该团队提出利用月填实现月球生存的设想:
21.(1)环节①分离水后的气体含有CO2、N2和 等(填一种)。
(2)环节②电解水的化学方程式为 。
(3)环节③利用月球夜间低温(约﹣173℃),将二氧化碳凝结分离。为检验分离后的气体中是否还含有,可将气体样品通入 (填试剂名称)。
(4)环节④将二氧化碳和氢气转化为甲烷和水。微观示意图如图:
参加反应的甲和乙的分子个数比为 。
(5)该设想有利于实现月球基地中 等元素的循环利用。
22.半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O。半水煤气经过下列步骤转化为合成氨所需要的H2和N2。
(1)半水煤气在铜催化和加热条件下实现CO变换为CO2,观察流程图,分析可知反应的化学方程式为 。
(2)碱液吸收法是脱除二氧化碳的方法之一。用氢氧化钠溶液脱除二氧化碳,若取某脱除二氧化碳后的碱液样品于试管中,加入 ,溶液变红,证明该碱液中还含有氢氧化钠。
23.化学材料在生产生活中具有重要作用。(1)请用化学用语填空:
①氖元素 ;②3个镁离子 ;③天然气的主要成分是 ;
④高铁酸钠由Na+和构成,则其化学式为: 。
(2)钼是一种重要的金属元素,用它制成的合金具有良好的机械性能,在工农业生产和国防上有着广泛的应用。利用钼矿石(主要成分为MoS2)制备金属钼的流程如图所示:
①通常在灼烧时会将钼矿石粉碎,目的是 。
②尾气SO2容易引起的环境问题是 。
③由精产品到金属钼的化学方程式为 。
24.“CO2”的再认识。Ⅰ、“CO2”的现实矛盾
(1)CO2的大量排放导致了世界十大环境问题之一的 ,但CO2又是绿色植物进行 的原料,为生物提供食物和氧气。Ⅱ、“CO2”的研究历史
(2)西晋《博物志》记载:在烧白石(CaCO3)制白灰过程中产生一种气体,即CO2。
(3)一千多年后,英国化学家布莱克将此法产生的CO2称作为“固定空气”,提出了以下论断:①石灰石﹣固定空气=苛性石灰②苛性石灰+苏打(碳酸钠)=石灰石+苛性钠;③苏打一固定空气=苛性钠,此论断已被否定,否定的理由是 。
Ⅲ、“CO2”的米米发展
2022年4月,中国科学家发表了将CO2先高效还原合成高浓度乙酸(C2H4O2)再进一步利用微生物合成葡萄糖的成果,下图为该成果的关键步骤。
(4)虚线框内制CO的总反应化学方程式为 。
(5)合成乙酸时,参加反应的CO和H2O的质量比为 。将获得的葡萄糖配制成一定浓度的溶液,加入适量新制Cu(OH)2,加热煮沸,出现红色固体 (填化学式)。
25.甲醇有“液态阳光”之称,可用二氧化碳和氢气制得。
(1)图1中物质A的化学式 。
(2)该合成过程采用了“光伏发电”电解水制取氢气,其中“光伏发电”是将光能转化为 能。
(3)图2是二氧化碳合成甲醇的微观过程(未配平)。
①该反应的化学方程式为 。
②反应前后不变的微粒是 。(用符号表示)
26.盐卤是海水晒盐后的富含镁盐的溶液,盐卤中主要盐类物质及其含量如图甲,利用盐卤生产金属镁的主要流程如图乙,据图回答以下问题。
(1)①操作a是过滤,如在实验室进行此操作用到的玻璃仪器有 、烧杯、玻璃棒。写出盐卤与熟石灰反应的化学方程式 (写一个)。
②试剂B是 (填物质名称)。
(2)若生产中镁元素没有损失,且其他盐类中镁元素质量可忽略不计,则1000克盐卤可制备金属镁 克。
27.利用废旧电池铜帽(含Cu、Zn)制取海绵铜的主要流程如图。
已知:①2Cu+2H2SO4+O2═2CuSO4+2H2O;②流程中各步反应所加试剂均过量。
(1)反应池Ⅰ中,Zn能与稀H2SO4发生置换反应而Cu不能的原因是 。
(2)反应池Ⅱ中发生反应的化学方程式为: 。
(3)反应池Ⅲ中加入稀H2SO4的目的是 。
28.碳是重要的生命元素,碳元素使世界变得更加绚丽多彩,回答下列与碳元素相关的问题。
(1)如图是含碳元素的一些物质转化关系。
①途径Ⅰ:可由化合物与单质参与反应实现,该化合物是 。
②途径Ⅱ:古人将炉甘石(ZnCO3)煅烧分解可制得 (填化学式)和CO2。
③途径Ⅲ:写出符合要求的一个化学反应方程式 。
④途径Ⅳ:面包中有许多小孔,是发酵粉中的 (填化学式)与有机酸作用形成的。
(2)乙醇汽油的开发与利用可适当地节省石油资源,
请写出乙醇燃烧的化学方程式 。
“精品作业”2.5.2 物质的转化
(提高版)参考答案与试题解析
一.选择题(共15小题)
1.D。2.C。3.D。4.D。5.B。6.C。7.C。8.A。9.D。10.C。11.C。
12.B。13.B。14.C。15.C。
二.填空题(共12小题)
16.(1)CH4+2O2CO2+2H2O;(2)①②③。
17.(1)粉碎,增大反应物的接触面积,提高反应速率;
(2)CaO+2HCl=CaCl2+H2O;钙离子、铁离子;(3)除去二氧化硅和碳;(4)CO。
18.(1)H2SO3;(2)CaO+SO2=CaSO3;2CaSO3+O2=2CaSO4;
(3)SO2+I2+2H2OH2SO4+2HI;153.1;碘。
19.(1)硬度大(合理即可);(2)4Al+3O2=2Al2O3;3;失去;(3)①Fe3O4;
②做保护气;③在无氧环境下,先加水溶解,然后再过滤、洗涤、烘干。
20.(1)O2;(2)2H2O2H2↑+O2↑;(3)澄清石灰水;
(4)4:1;(5)碳、氢、氧。
21.(1)CO+H2OCO2+H2。(2)足量氯化钙溶液,再滴加酚酞试液。
22.(1)①Ne;②3Mg2+;③CH4;④Na2FeO4;
(2)①增大接触面积,使反应更加充分;②酸雨;③。
23.(1)温室效应;光合作用;(3)②、③反应前后元素不守恒
(4)H2O+CO2H2+O2+CO;(5)14:9;Cu2O。
24.(1)CO2。(2)电。(3)①CO2+3H2CH3OH+H2O。②C、O、H。
25.(1)①漏斗;MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2;②盐酸;(2)48g。
26.(1)锌的位置排在氢的前面,铜的位置排在氢的后面;
(2)Zn+H2SO4═ZnSO4+H2↑、Zn+CuSO4═ZnSO4+Cu;
(3)除去固体C中的锌。
27.(1)①一氧化碳;②ZnO;③C+2CuO2Cu+CO2↑;④NaHCO3;
(2)C2H5OH+3O22CO2+3H2O。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
