化学人教版(2019)选择性必修1 3.2.2溶液的酸碱性与pH(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.2.2溶液的酸碱性与pH(共24张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 29.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-06 21:09:06 | ||
图片预览






文档简介
(共24张PPT)
第二节 水的电离和溶液的pH
第二课时 溶液的酸碱性与pH
本节重点
新课导入
pH = 2.7
pH = 1.0
pH = 7.6
2、比较下列情况中,c(H+)和c(OH-)的值或变化趋势(增大或者减小)
1、酸性溶液中是否存在OH- 碱性溶液中是否存在H+ 试解释原因。
一、溶液的酸碱性
思考讨论
体系 纯水(25℃) 向纯水中加入 少量盐酸 向纯水中加入少量 NaOH溶液
c(H+)
c(OH-)
c(H+)和c(OH-)的大小比较
溶液的酸碱性
10-7 mol/L
中性
10-7 mol/L
c(H+) = c(OH-)
减小
增大
增大
减小
碱性
酸性
c(H+) > c(OH-)
c(H+) < c(OH-)
一、溶液的酸碱性
二、溶液的酸碱性与pH
如何通过溶液中的c(H+)或者c(OH-)计算溶液的pH呢?
二、溶液的酸碱性与pH
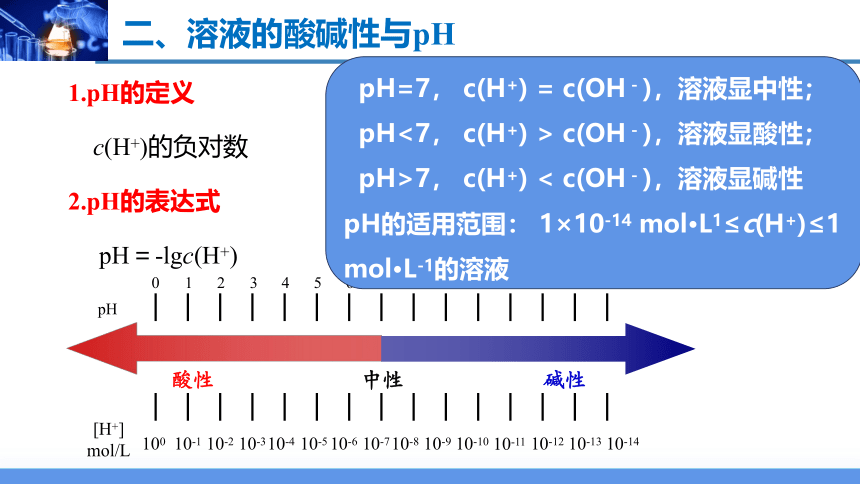
1.pH的定义
c(H+)的负对数
2.pH的表达式
pH=-lgc(H+)
中性
酸性
碱性
[H+]
mol/L
pH
100
10-1
10-2
10-3
10-14
10-4
10-13
10-11
10-12
10-10
10-9
10-8
10-5
10-6
10-7
0
1
2
3
4
5
7
8
9
10
11
12
13
14
6
pH=7, c(H+) = c(OH-),溶液显中性;
pH<7, c(H+) > c(OH-),溶液显酸性;
pH>7, c(H+) < c(OH-),溶液显碱性
pH的适用范围: 1×10-14 mol·L1≤c(H+)≤1 mol·L-1的溶液
(1)一定条件下 pH值越大,溶液的酸性越强。( )
(2)强酸溶液的pH值一定小。( )
(3)pH值等于6的溶液,一定是一个弱酸体系。( )
(4)pH值相同的强酸和弱酸中c(H+)相同。( )
(5)在常温下,pH=0的溶液酸性最强,pH=14的溶液碱性最强。( )
(6)pH值有可能等于负值。( )
(7)常温下,由水电离出的c(H+)= 10-12mol/L,则溶液pH定为12。( )
(8)相同体积和pH值的盐酸,醋酸、硫酸中H+的物质的量相等。( )
×
×
×
√
×
√
×
√
1、判断正误(正确的打“√”,错误的打“×”)
课堂小练
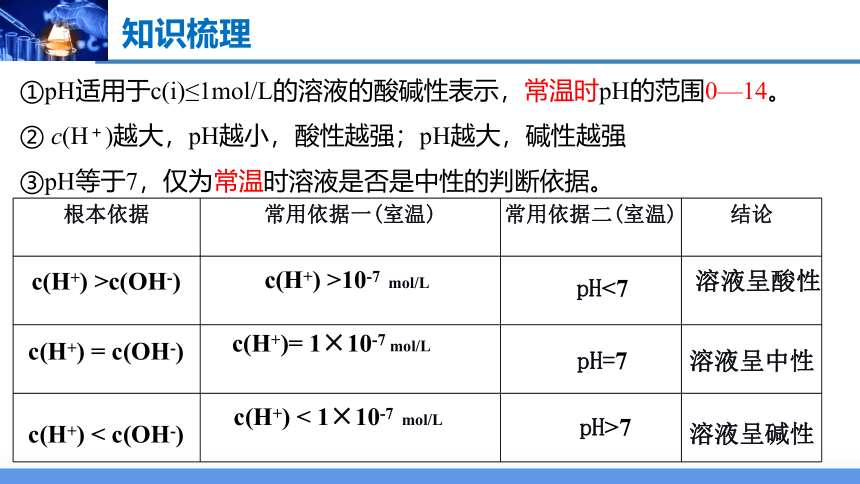
根本依据 常用依据一(室温) 常用依据二(室温) 结论
c(H+) >c(OH-)
c(H+) >10-7 mol/L
c(H+) = c(OH-)
c(H+) < c(OH-)
c(H+)= 1×10-7 mol/L
c(H+) < 1×10-7 mol/L
pH<7
溶液呈酸性
溶液呈碱性
溶液呈中性
pH=7
pH>7
①pH适用于c(i)≤1mol/L的溶液的酸碱性表示,常温时pH的范围0—14。
② c(H+)越大,pH越小,酸性越强;pH越大,碱性越强
③pH等于7,仅为常温时溶液是否是中性的判断依据。
知识梳理
meiyangyang8602
三、pH的测定
1、酸碱指示剂(定性测量)
我们把指示剂发生颜色变化的pH值范围叫做指示剂的变色范围。
pH 1 2 3.1 4.4 5 6 7 8 9 10 11 12 13 14 甲基橙 红色 橙色 黄色 石蕊 红色 紫色 蓝色 酚酞 无色 浅红色 红色
meiyangyang8602
三、pH的测定
2、pH试纸法(定量测量)
将试纸用多种酸碱指示剂的混合溶液浸透,晾干制成pH试纸
广泛pH试纸:其pH范围是 (最常用),可以识别的pH差约为 。
精密pH试纸:可判别0.2或0.3的pH差值。
专用pH试纸:用于酸性、中性或碱性溶液。
1
1-14
操作方法
取一小块试纸放在干燥、洁净的表面皿或玻璃片上,用干净的玻璃棒蘸取溶液点在试纸的中央,待显色后,与标准的比色卡对比,得出溶液的pH
meiyangyang8602
3、pH计法(定量测量)
三、pH的测定
meiyangyang8602
下列有关pH试纸的使用说法正确的是( )
A、把pH试纸浸入待测液
B、用湿润的玻璃棒蘸取待测液
C、测出石灰水的pH为12.4
D、把显色的pH试纸与标准比色卡对照读数
D
课堂小练
1
2
3
4
5
6
人体各种体液都有一定的pH,血液的pH是诊断疾病的一个重要参数。
洗发的护发素可以调节头发pH使之达到适宜酸碱度。
环保领域,酸性或碱性的废水处理常常利用酸碱中和反应,中和过程中可用pH自动测定仪进行检测和控制。
农业生产中,土壤的pH会影响植物对不同形态养分的吸收及养分的有效性
科学实验和工业生产中,溶液pH的控制会影响实验结果或产品质量、产量等
酸碱中和滴定中,溶液pH的变化可作为判断滴定终点的依据
四、pH的应用
c(H+)=1×10-3 mol/L, pH=-lg10-3=3
pH=-lg10-10=10
c(OH-)=1×10-4 mol/L
【例1】1×10-3 mol/L盐酸,求溶液的pH。
【例2】常温下,1×10-4 mol/L NaOH溶液,求溶液的pH。
c(H+)=KW /c(OH-)=1×10-10 mol/L
强酸溶液中
c(H+)=n·c(HnA)
强碱溶液
c(H+)=
KW
c(OH-)
KW
nc[B(OH)n]
c(H+)=
五、pH的计算
1、单一溶液pH的计算
五、pH的计算
2、混合溶液的计算
强酸溶液的混合
例:pH=2的盐酸和pH=5的硫酸溶液等体积混合后,所得溶液的pH=
解题思路
c(H+) = mol/L =5×10-3 mol/L
V10-2+V10-5
2V
pH=-lgc(H+)=-lg(5×10-3)=2.3
五、pH的计算
2、混合溶液的计算
强碱溶液的混合
解题思路
例:pH=11的Ba(OH)2 与pH=9的NaOH按体积比1∶1混合后的pH是
c(OH-) = mol/L =5×10-4 mol/L
10-3 V+10-5V
2V
pH=-lgc(H+) =- lg(2×10-11)=10.7
五、pH的计算
2、混合溶液的计算
强酸和强碱溶液的混合
例:在25℃时,100ml 0.6mol/L的盐酸与等体积0.4mol/L的NaOH溶液混合后,溶液的pH值等于多少?
例:在25℃时,100ml 0.4mol/L的盐酸与等体积0.6mol/L的NaOH溶液混合后,溶液的pH值等于多少?
五、pH的计算
3、酸和碱溶液稀释pH的计算
强酸和弱酸溶液的稀释
①取1mL pH=2的硫酸溶液加水稀释到10mL,pH?
加水稀释到105mL,pH?
接近7
3
②取1mL pH=2的醋酸溶液加水稀释到10mL,pH?
<3
原因:弱酸稀释,电离程度增大,n(H+)增大,稀释10倍pH变化(增大)<1
五、pH的计算
3、酸和碱溶液稀释pH的计算
强碱和弱碱溶液的稀释
11
>11
原因:弱碱稀释,电离程度增大,n(OH+)增大,稀释10倍pH变化(增大)<1
①pH=12的NaOH溶液稀释10倍后pH=
加水稀释到105倍,pH?
接近7
②pH=12的氨水稀释10倍后pH
知识梳理
酸或碱的稀释与pH的关系
强酸pH=a,加水稀释10n倍,则pH=a+n;
弱酸pH=a,加水稀释10n倍,则pH强碱pH=b,加水稀释10n倍,则pH=b-n;
弱碱pH=b,加水稀释10n倍,则pH>b-n;
酸、碱溶液无限稀释时,pH只能接近7,但酸不能大于7,碱不能小于7;
对于浓度(或pH)相同的强酸和弱酸,稀释相同倍数,强酸的pH变化幅度大。 (强碱、弱碱相似)
将体积均为10 mL、pH均为3的盐酸和醋酸,加水稀释至a mL和b mL,测得稀释后溶液的pH均为5,则稀释后溶液的体积( )
A.a=b=100 B.a=b=1 000
C.ab
C
课堂小练
(1)常温下,某H2SO4溶液的浓度是0.005 mol·L-1,此溶液的pH为 。用水稀释到原来体积的100倍,pH为 。再继续稀释到溶液体积的104倍,pH 。
(2)常温下,pH=3的盐酸与pH=5的硫酸溶液等体积混合后溶液的pH为
(3)常温下,pH=10和pH=12的两种NaOH溶液等体积混合后溶液的pH为
(4)常温下,pH=12的NaOH溶液和pH=4的HCl溶液等体积混合后,溶液的pH为 。
2
4
接近7
3.3
11.7
11.7
已知:lg2=0.3 lg5=0.7
课堂小练
谢谢欣赏
第二节 水的电离和溶液的pH
第二课时 溶液的酸碱性与pH
本节重点
新课导入
pH = 2.7
pH = 1.0
pH = 7.6
2、比较下列情况中,c(H+)和c(OH-)的值或变化趋势(增大或者减小)
1、酸性溶液中是否存在OH- 碱性溶液中是否存在H+ 试解释原因。
一、溶液的酸碱性
思考讨论
体系 纯水(25℃) 向纯水中加入 少量盐酸 向纯水中加入少量 NaOH溶液
c(H+)
c(OH-)
c(H+)和c(OH-)的大小比较
溶液的酸碱性
10-7 mol/L
中性
10-7 mol/L
c(H+) = c(OH-)
减小
增大
增大
减小
碱性
酸性
c(H+) > c(OH-)
c(H+) < c(OH-)
一、溶液的酸碱性
二、溶液的酸碱性与pH
如何通过溶液中的c(H+)或者c(OH-)计算溶液的pH呢?
二、溶液的酸碱性与pH
1.pH的定义
c(H+)的负对数
2.pH的表达式
pH=-lgc(H+)
中性
酸性
碱性
[H+]
mol/L
pH
100
10-1
10-2
10-3
10-14
10-4
10-13
10-11
10-12
10-10
10-9
10-8
10-5
10-6
10-7
0
1
2
3
4
5
7
8
9
10
11
12
13
14
6
pH=7, c(H+) = c(OH-),溶液显中性;
pH<7, c(H+) > c(OH-),溶液显酸性;
pH>7, c(H+) < c(OH-),溶液显碱性
pH的适用范围: 1×10-14 mol·L1≤c(H+)≤1 mol·L-1的溶液
(1)一定条件下 pH值越大,溶液的酸性越强。( )
(2)强酸溶液的pH值一定小。( )
(3)pH值等于6的溶液,一定是一个弱酸体系。( )
(4)pH值相同的强酸和弱酸中c(H+)相同。( )
(5)在常温下,pH=0的溶液酸性最强,pH=14的溶液碱性最强。( )
(6)pH值有可能等于负值。( )
(7)常温下,由水电离出的c(H+)= 10-12mol/L,则溶液pH定为12。( )
(8)相同体积和pH值的盐酸,醋酸、硫酸中H+的物质的量相等。( )
×
×
×
√
×
√
×
√
1、判断正误(正确的打“√”,错误的打“×”)
课堂小练
根本依据 常用依据一(室温) 常用依据二(室温) 结论
c(H+) >c(OH-)
c(H+) >10-7 mol/L
c(H+) = c(OH-)
c(H+) < c(OH-)
c(H+)= 1×10-7 mol/L
c(H+) < 1×10-7 mol/L
pH<7
溶液呈酸性
溶液呈碱性
溶液呈中性
pH=7
pH>7
①pH适用于c(i)≤1mol/L的溶液的酸碱性表示,常温时pH的范围0—14。
② c(H+)越大,pH越小,酸性越强;pH越大,碱性越强
③pH等于7,仅为常温时溶液是否是中性的判断依据。
知识梳理
meiyangyang8602
三、pH的测定
1、酸碱指示剂(定性测量)
我们把指示剂发生颜色变化的pH值范围叫做指示剂的变色范围。
pH 1 2 3.1 4.4 5 6 7 8 9 10 11 12 13 14 甲基橙 红色 橙色 黄色 石蕊 红色 紫色 蓝色 酚酞 无色 浅红色 红色
meiyangyang8602
三、pH的测定
2、pH试纸法(定量测量)
将试纸用多种酸碱指示剂的混合溶液浸透,晾干制成pH试纸
广泛pH试纸:其pH范围是 (最常用),可以识别的pH差约为 。
精密pH试纸:可判别0.2或0.3的pH差值。
专用pH试纸:用于酸性、中性或碱性溶液。
1
1-14
操作方法
取一小块试纸放在干燥、洁净的表面皿或玻璃片上,用干净的玻璃棒蘸取溶液点在试纸的中央,待显色后,与标准的比色卡对比,得出溶液的pH
meiyangyang8602
3、pH计法(定量测量)
三、pH的测定
meiyangyang8602
下列有关pH试纸的使用说法正确的是( )
A、把pH试纸浸入待测液
B、用湿润的玻璃棒蘸取待测液
C、测出石灰水的pH为12.4
D、把显色的pH试纸与标准比色卡对照读数
D
课堂小练
1
2
3
4
5
6
人体各种体液都有一定的pH,血液的pH是诊断疾病的一个重要参数。
洗发的护发素可以调节头发pH使之达到适宜酸碱度。
环保领域,酸性或碱性的废水处理常常利用酸碱中和反应,中和过程中可用pH自动测定仪进行检测和控制。
农业生产中,土壤的pH会影响植物对不同形态养分的吸收及养分的有效性
科学实验和工业生产中,溶液pH的控制会影响实验结果或产品质量、产量等
酸碱中和滴定中,溶液pH的变化可作为判断滴定终点的依据
四、pH的应用
c(H+)=1×10-3 mol/L, pH=-lg10-3=3
pH=-lg10-10=10
c(OH-)=1×10-4 mol/L
【例1】1×10-3 mol/L盐酸,求溶液的pH。
【例2】常温下,1×10-4 mol/L NaOH溶液,求溶液的pH。
c(H+)=KW /c(OH-)=1×10-10 mol/L
强酸溶液中
c(H+)=n·c(HnA)
强碱溶液
c(H+)=
KW
c(OH-)
KW
nc[B(OH)n]
c(H+)=
五、pH的计算
1、单一溶液pH的计算
五、pH的计算
2、混合溶液的计算
强酸溶液的混合
例:pH=2的盐酸和pH=5的硫酸溶液等体积混合后,所得溶液的pH=
解题思路
c(H+) = mol/L =5×10-3 mol/L
V10-2+V10-5
2V
pH=-lgc(H+)=-lg(5×10-3)=2.3
五、pH的计算
2、混合溶液的计算
强碱溶液的混合
解题思路
例:pH=11的Ba(OH)2 与pH=9的NaOH按体积比1∶1混合后的pH是
c(OH-) = mol/L =5×10-4 mol/L
10-3 V+10-5V
2V
pH=-lgc(H+) =- lg(2×10-11)=10.7
五、pH的计算
2、混合溶液的计算
强酸和强碱溶液的混合
例:在25℃时,100ml 0.6mol/L的盐酸与等体积0.4mol/L的NaOH溶液混合后,溶液的pH值等于多少?
例:在25℃时,100ml 0.4mol/L的盐酸与等体积0.6mol/L的NaOH溶液混合后,溶液的pH值等于多少?
五、pH的计算
3、酸和碱溶液稀释pH的计算
强酸和弱酸溶液的稀释
①取1mL pH=2的硫酸溶液加水稀释到10mL,pH?
加水稀释到105mL,pH?
接近7
3
②取1mL pH=2的醋酸溶液加水稀释到10mL,pH?
<3
原因:弱酸稀释,电离程度增大,n(H+)增大,稀释10倍pH变化(增大)<1
五、pH的计算
3、酸和碱溶液稀释pH的计算
强碱和弱碱溶液的稀释
11
>11
原因:弱碱稀释,电离程度增大,n(OH+)增大,稀释10倍pH变化(增大)<1
①pH=12的NaOH溶液稀释10倍后pH=
加水稀释到105倍,pH?
接近7
②pH=12的氨水稀释10倍后pH
知识梳理
酸或碱的稀释与pH的关系
强酸pH=a,加水稀释10n倍,则pH=a+n;
弱酸pH=a,加水稀释10n倍,则pH
弱碱pH=b,加水稀释10n倍,则pH>b-n;
酸、碱溶液无限稀释时,pH只能接近7,但酸不能大于7,碱不能小于7;
对于浓度(或pH)相同的强酸和弱酸,稀释相同倍数,强酸的pH变化幅度大。 (强碱、弱碱相似)
将体积均为10 mL、pH均为3的盐酸和醋酸,加水稀释至a mL和b mL,测得稀释后溶液的pH均为5,则稀释后溶液的体积( )
A.a=b=100 B.a=b=1 000
C.ab
C
课堂小练
(1)常温下,某H2SO4溶液的浓度是0.005 mol·L-1,此溶液的pH为 。用水稀释到原来体积的100倍,pH为 。再继续稀释到溶液体积的104倍,pH 。
(2)常温下,pH=3的盐酸与pH=5的硫酸溶液等体积混合后溶液的pH为
(3)常温下,pH=10和pH=12的两种NaOH溶液等体积混合后溶液的pH为
(4)常温下,pH=12的NaOH溶液和pH=4的HCl溶液等体积混合后,溶液的pH为 。
2
4
接近7
3.3
11.7
11.7
已知:lg2=0.3 lg5=0.7
课堂小练
谢谢欣赏
