化学人教版(2019)必修第一册3.1.2铁的氧化物 氢氧化铁及氢氧化亚铁 课件(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1.2铁的氧化物 氢氧化铁及氢氧化亚铁 课件(共19张ppt) |
|
|
| 格式 | pptx | ||
| 文件大小 | 19.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-06 00:00:00 | ||
图片预览






文档简介
(共19张PPT)
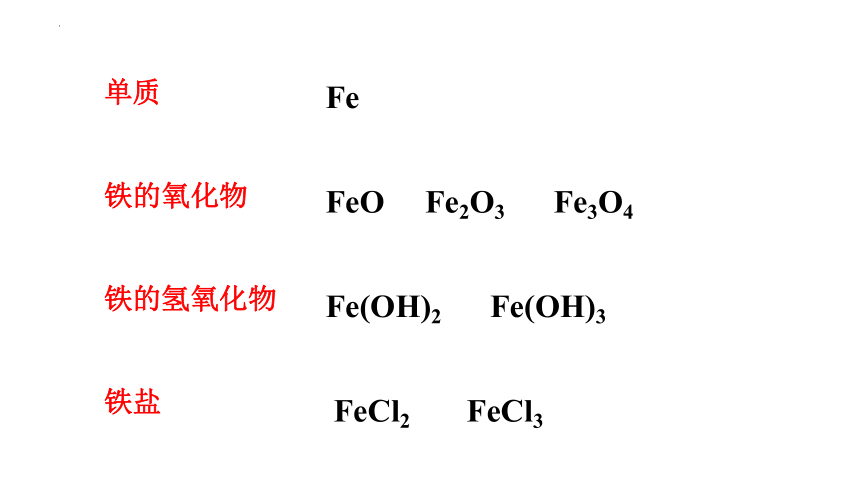
单质
铁的氧化物
铁的氢氧化物
铁盐
Fe
FeO Fe2O3 Fe3O4
Fe(OH)2 Fe(OH)3
FeCl2 FeCl3
Fe(OH)3 沉淀
Fe(OH)2 沉淀
铁粉
Fe2O3
第三章第一节 铁及其化合物
第2课时 铁的氧化物 铁的氢氧化物
氧化亚铁是一种黑色粉末,不稳定,受热会转化为四氧化三铁。
6FeO + O2 2Fe3O4
氧化铁是一种红棕色粉末,俗称铁红,常用作油漆、涂料等的红色颜料
四氧化三铁是具有磁性的黑色晶体,俗称磁性氧化铁.
氧化铁
四氧化三铁
氧化亚铁
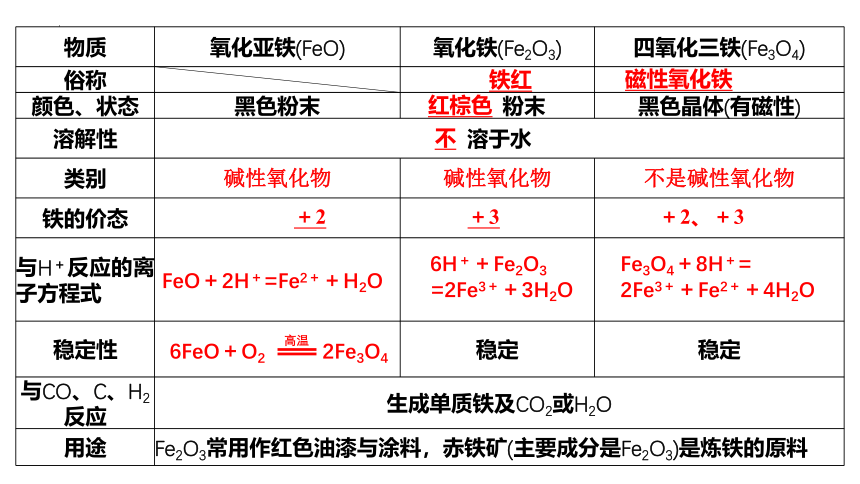
物质 氧化亚铁(FeO) 氧化铁(Fe2O3) 四氧化三铁(Fe3O4)
俗称
颜色、状态 黑色粉末 粉末 黑色晶体(有磁性)
溶解性 溶于水 类别 碱性氧化物 碱性氧化物 不是碱性氧化物
铁的价态
与H+反应的离子方程式
稳定性 稳定 稳定
与CO、C、H2反应 生成单质铁及CO2或H2O 用途 Fe2O3常用作红色油漆与涂料,赤铁矿(主要成分是Fe2O3)是炼铁的原料 6FeO+O2 2Fe3O4
高温
FeO+2H+=Fe2++H2O
6H++Fe2O3
=2Fe3++3H2O
Fe3O4+8H+=
2Fe3++Fe2++4H2O
+2
+3
+2、+3
不
铁红
磁性氧化铁
红棕色
红砖和青砖都是生活中用到的建筑材料
两者颜色不同的原因是两者所含的铁的氧化物是不一样的,你认为红砖和青砖中分别含有什么氧化物呢?
红砖中含的是氧化铁,青砖中含的是四氧化三铁
为什么不是氧化亚铁?
氧化亚铁不稳定
烧制砖瓦时,向窑内添加大量的煤炭后封窑1天,从窑顶向下慢慢浇水7天,水蒸气和窑内高温的炭发生化学反应产生大量的还原气体(氢气和一氧化碳),它们把氧化铁又逐渐还原成为四氧化三铁,而制得青砖。
3.铁的氧化物的用途
Fe2O3可作为冶炼金属的原料
Fe2O3常用于制造红色油漆和涂料
Fe2O3+3CO===2Fe+3CO2
高温
铁元素的氢氧化物有两种,氢氧化亚铁[Fe(OH)2 ]、
和氢氧化铁[Fe(OH)3 ]
一:铁的氢氧化物
Fe(OH)2
Fe(OH)3
思考:铁有哪些氢氧化物?
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
【学习任务一】制备铁的氢氧化物
实验探究
1.铁的氢氧化物的制备
Fe(OH)2 Fe(OH)3
操作
现象
离子反应
实验结论 _________很不稳定,极易转化为_____________ (1)铁的氢氧化物的制备
反应原理:Fe(OH)3与Fe(OH)2 分别可用相应的____与____反应制得
盐
碱
有白色沉淀絮状生成,在空气中迅速变成灰绿色,最后变成红褐色
生成红褐色沉淀
Fe2++2OH-=Fe(OH)2↓(白色);
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe3++3OH-=Fe(OH)3↓
Fe(OH)2
Fe(OH)3
(2)Fe(OH)2和Fe(OH)3性质的比较
化学式 Fe(OH)2 Fe(OH)3
物质类别 二元弱碱 三元弱碱
颜色状态 白色固体 红褐色固体
溶解性 不溶于水 不溶于水
与非氧化性强酸反应 Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O
热稳定性 Fe(OH)2 FeO+H2O (隔绝空气) 2Fe(OH)3 Fe2O3+3H2O
高温
高温
【分析】 Fe(OH)2会被O2氧化,因此制取Fe(OH)2的关键是防止O2的干扰,做到:1.溶液中不含O2 2.生成的Fe(OH)2隔绝O2
【具体措施】
3.使用新配制的FeSO4溶液和NaOH溶液。
1.配制溶液用的蒸馏水加热煮沸除去溶解氧
2.滴入溶液时将胶头滴管伸入液面以下
4.密封产物。
如何得到纯净的氢氧化亚铁?
加热
煮沸
现配现用
胶头滴管伸入液面以下
氢氧化亚铁的制备改进方法
2.常用方法
由于苯的液封作用,可防止生成的Fe(OH)2被氧化,
因而可较长时间观察到白色的Fe(OH)2沉淀
有机层隔离法
①反应在试管底部进行
②加隔氧剂
(这是唯一一种把胶头滴管插入反应溶液的实验)
如加入汽油、苯等比水轻的有机溶剂
方法二:在图2装置中用 NaOH溶液、铁屑、稀H2SO4等试剂制备。
为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是?
这样生成的Fe(OH)2沉淀能较长时间保持白色,
其理由 。
1、先打开止水夹一会儿,Ⅰ中产生的H2把试管I和试管Ⅱ中的空气排除掉
2、关闭止水夹,Ⅰ中产生的H2把试管Ⅰ中液体压入试管Ⅱ中
试管Ⅰ中产生的H2充满了试管Ⅰ和试管Ⅱ,且外界的空气不能进入。
Ⅰ Ⅱ
氢氧化亚铁的制备改进方法
该方法是先在装置Ⅰ中产生FeSO4溶液,并利用产生的H2排尽整个装置中的空气,待检验H2的纯度后,再关闭止水夹K,利用产生的H2把FeSO4溶液压入装置Ⅱ中与NaOH溶液进行反应。
还原性气体保护法
2.常用方法
③
2.实验装置的改进
课堂小结
铁及其化合物
铁的单质
①铁具有延展性和导热性。
②铁能导电,但其导电性不如铜和铝。
③铁能被磁体吸引。
④铁的熔点是:1535℃;沸点是2750℃;密度是7.86g/cm3。
铁的氧化物
氧化亚铁:是一种黑色粉末,不稳定,在空气里受热迅速被氧化成四氧化三铁
氧化铁:是一种红棕色粉末,俗称铁红,常用做红色油漆和涂料,赤铁矿的主要成分
四氧化三铁:是一种具有磁性的黑色晶体,俗称磁性氧化铁
铁的氢氧化物
氢氧化亚铁:白色固体Fe2++2OH-——Fe(OH)2↓
氢氧化铁:红棕色粉末或胶体Fe3++3OH-——Fe(OH)3↓
课堂练习1:下列各组实验装置中能较长时间看到氢氧化亚铁白色沉淀的是( )
A.①②③④⑤ B. ①②⑤ C.①②③④ D. ②④⑤
B
【学习评价一】有关铁的化合物的说法中,错误的是( )
A. 由图示操作可制取Fe(OH)2
B. Fe3O4、Fe(OH)3都可以由化合反应制得
C. Fe(OH)3胶体呈红褐色、透明,能发生丁达尔效应
D. Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化为红褐色
D
还原性气体保护法
有机覆盖层法
单质
铁的氧化物
铁的氢氧化物
铁盐
Fe
FeO Fe2O3 Fe3O4
Fe(OH)2 Fe(OH)3
FeCl2 FeCl3
Fe(OH)3 沉淀
Fe(OH)2 沉淀
铁粉
Fe2O3
第三章第一节 铁及其化合物
第2课时 铁的氧化物 铁的氢氧化物
氧化亚铁是一种黑色粉末,不稳定,受热会转化为四氧化三铁。
6FeO + O2 2Fe3O4
氧化铁是一种红棕色粉末,俗称铁红,常用作油漆、涂料等的红色颜料
四氧化三铁是具有磁性的黑色晶体,俗称磁性氧化铁.
氧化铁
四氧化三铁
氧化亚铁
物质 氧化亚铁(FeO) 氧化铁(Fe2O3) 四氧化三铁(Fe3O4)
俗称
颜色、状态 黑色粉末 粉末 黑色晶体(有磁性)
溶解性 溶于水 类别 碱性氧化物 碱性氧化物 不是碱性氧化物
铁的价态
与H+反应的离子方程式
稳定性 稳定 稳定
与CO、C、H2反应 生成单质铁及CO2或H2O 用途 Fe2O3常用作红色油漆与涂料,赤铁矿(主要成分是Fe2O3)是炼铁的原料 6FeO+O2 2Fe3O4
高温
FeO+2H+=Fe2++H2O
6H++Fe2O3
=2Fe3++3H2O
Fe3O4+8H+=
2Fe3++Fe2++4H2O
+2
+3
+2、+3
不
铁红
磁性氧化铁
红棕色
红砖和青砖都是生活中用到的建筑材料
两者颜色不同的原因是两者所含的铁的氧化物是不一样的,你认为红砖和青砖中分别含有什么氧化物呢?
红砖中含的是氧化铁,青砖中含的是四氧化三铁
为什么不是氧化亚铁?
氧化亚铁不稳定
烧制砖瓦时,向窑内添加大量的煤炭后封窑1天,从窑顶向下慢慢浇水7天,水蒸气和窑内高温的炭发生化学反应产生大量的还原气体(氢气和一氧化碳),它们把氧化铁又逐渐还原成为四氧化三铁,而制得青砖。
3.铁的氧化物的用途
Fe2O3可作为冶炼金属的原料
Fe2O3常用于制造红色油漆和涂料
Fe2O3+3CO===2Fe+3CO2
高温
铁元素的氢氧化物有两种,氢氧化亚铁[Fe(OH)2 ]、
和氢氧化铁[Fe(OH)3 ]
一:铁的氢氧化物
Fe(OH)2
Fe(OH)3
思考:铁有哪些氢氧化物?
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
【学习任务一】制备铁的氢氧化物
实验探究
1.铁的氢氧化物的制备
Fe(OH)2 Fe(OH)3
操作
现象
离子反应
实验结论 _________很不稳定,极易转化为_____________ (1)铁的氢氧化物的制备
反应原理:Fe(OH)3与Fe(OH)2 分别可用相应的____与____反应制得
盐
碱
有白色沉淀絮状生成,在空气中迅速变成灰绿色,最后变成红褐色
生成红褐色沉淀
Fe2++2OH-=Fe(OH)2↓(白色);
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe3++3OH-=Fe(OH)3↓
Fe(OH)2
Fe(OH)3
(2)Fe(OH)2和Fe(OH)3性质的比较
化学式 Fe(OH)2 Fe(OH)3
物质类别 二元弱碱 三元弱碱
颜色状态 白色固体 红褐色固体
溶解性 不溶于水 不溶于水
与非氧化性强酸反应 Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O
热稳定性 Fe(OH)2 FeO+H2O (隔绝空气) 2Fe(OH)3 Fe2O3+3H2O
高温
高温
【分析】 Fe(OH)2会被O2氧化,因此制取Fe(OH)2的关键是防止O2的干扰,做到:1.溶液中不含O2 2.生成的Fe(OH)2隔绝O2
【具体措施】
3.使用新配制的FeSO4溶液和NaOH溶液。
1.配制溶液用的蒸馏水加热煮沸除去溶解氧
2.滴入溶液时将胶头滴管伸入液面以下
4.密封产物。
如何得到纯净的氢氧化亚铁?
加热
煮沸
现配现用
胶头滴管伸入液面以下
氢氧化亚铁的制备改进方法
2.常用方法
由于苯的液封作用,可防止生成的Fe(OH)2被氧化,
因而可较长时间观察到白色的Fe(OH)2沉淀
有机层隔离法
①反应在试管底部进行
②加隔氧剂
(这是唯一一种把胶头滴管插入反应溶液的实验)
如加入汽油、苯等比水轻的有机溶剂
方法二:在图2装置中用 NaOH溶液、铁屑、稀H2SO4等试剂制备。
为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是?
这样生成的Fe(OH)2沉淀能较长时间保持白色,
其理由 。
1、先打开止水夹一会儿,Ⅰ中产生的H2把试管I和试管Ⅱ中的空气排除掉
2、关闭止水夹,Ⅰ中产生的H2把试管Ⅰ中液体压入试管Ⅱ中
试管Ⅰ中产生的H2充满了试管Ⅰ和试管Ⅱ,且外界的空气不能进入。
Ⅰ Ⅱ
氢氧化亚铁的制备改进方法
该方法是先在装置Ⅰ中产生FeSO4溶液,并利用产生的H2排尽整个装置中的空气,待检验H2的纯度后,再关闭止水夹K,利用产生的H2把FeSO4溶液压入装置Ⅱ中与NaOH溶液进行反应。
还原性气体保护法
2.常用方法
③
2.实验装置的改进
课堂小结
铁及其化合物
铁的单质
①铁具有延展性和导热性。
②铁能导电,但其导电性不如铜和铝。
③铁能被磁体吸引。
④铁的熔点是:1535℃;沸点是2750℃;密度是7.86g/cm3。
铁的氧化物
氧化亚铁:是一种黑色粉末,不稳定,在空气里受热迅速被氧化成四氧化三铁
氧化铁:是一种红棕色粉末,俗称铁红,常用做红色油漆和涂料,赤铁矿的主要成分
四氧化三铁:是一种具有磁性的黑色晶体,俗称磁性氧化铁
铁的氢氧化物
氢氧化亚铁:白色固体Fe2++2OH-——Fe(OH)2↓
氢氧化铁:红棕色粉末或胶体Fe3++3OH-——Fe(OH)3↓
课堂练习1:下列各组实验装置中能较长时间看到氢氧化亚铁白色沉淀的是( )
A.①②③④⑤ B. ①②⑤ C.①②③④ D. ②④⑤
B
【学习评价一】有关铁的化合物的说法中,错误的是( )
A. 由图示操作可制取Fe(OH)2
B. Fe3O4、Fe(OH)3都可以由化合反应制得
C. Fe(OH)3胶体呈红褐色、透明,能发生丁达尔效应
D. Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化为红褐色
D
还原性气体保护法
有机覆盖层法
