2024届高三化学二轮复习镁及其化合物专题练习(含解析)
文档属性
| 名称 | 2024届高三化学二轮复习镁及其化合物专题练习(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 416.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-07 08:42:58 | ||
图片预览




文档简介
2024届高三化学二轮复习镁及其化合物专题练习
一、选择题(共17题)
1.有200mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol/L,c(Cl-)为1.3mol/L。要使Mg2+、Al3+全部转化为沉淀,至少需加4mol/LNaOH溶液的体积为( )
A.40mL B.72mL C.65mL D.128mL
2.下列金属可与NaOH碱溶液发生反应的是( )
A.Fe B.Mg C.Cu D.Al
3.物质的性质决定其用途。下列物质的用途中,利用其物理性质的是( )
A.镁粉用于制作照明弹 B.稀有气体用于制作霓虹灯
C.氧气用于医疗急救 D.氮气用作充氮包装,保存食品
4.下列有关物质性质与用途具有对应关系的是
A.Fe比Cu活泼,FeCl3溶液可用作铜制线路板的蚀刻剂
B.SiO2熔点高,可用作半导体材料
C.NaC1O具有氧化性,可用于消菌杀毒
D.CO2密度比空气大且不支持燃烧,可用作镁着火时的灭火剂
5.用NA表示阿伏伽德罗常数的值,下列叙述不正确的是
A.72gCaO2与KHS的混合物中含有的阴离子的数目为NA
B.足量的Mg与0.1molCO2充分反应,转移的电子数目为0.4 NA
C.25℃时,pH=2的H2SO4,溶液中含有的H+数目为0.01 NA
D.标准状况下22.4 L氩气含有的质子数为18NA
6.化学与生产、生活息息相关。下列说法正确的是( )
A.可用钢瓶储存液氯或浓硫酸
B.二氧化碳气体可用作镁燃烧的灭火剂
C.鸡蛋清溶液中加入CuSO4溶液,有沉淀析出,该性质可用于蛋白质的分离与提纯
D.炒菜时加碘食盐要在菜准备出锅时添加,是为了防止食盐中的碘受热升华
7.在给定条件下,下列选项所示的物质间转化均能实现的是
A.
B.
C.
D.
8.下列有关物质性质或用途的说法不正确的是
A.常温下浓硫酸可贮存在铁罐中
B.ClO2具有氧化性,可用于自来水的杀菌消毒
C.燃着的镁条放入盛满二氧化碳的集气瓶中可继续燃烧
D.铁比铜金属性强,所以可用FeCl3腐蚀Cu刻制印刷电路板
9.下列说法不正确的是
A.火山附近的温泉因常常含有游离态硫而具有杀菌作用
B.氧化镁、氧化铝熔点高,都可用作耐火材料
C.某些硅酸盐具有多孔结构,可用于分离、提纯气体或液体混合物,还可作干燥剂、催化剂
D.溴化银是一种重要的感光材料,常用于人工降雨
10.在相同条件下,将质量均为m的Na、Mg、Al分别加入盛有100mL 1mol·L—1稀盐酸的甲、乙、丙三支试管中充分反应,生成气体的体积关系为:甲(Na)>乙(Mg)=丙(Al),则m可能是( )
A.4.0g B.2.3g C.1.2g D.1.8g
11.在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
A.粗硅SiCl4Si
B.Mg(OH)2MgCl2(aq) Mg
C.Fe2O3FeCl3(aq) 无水FeCl3
D.SSO3H2SO4
12.有镁、铝、铁、铜四种金属,若两两混合,取混合物26克与足量稀硫酸反应,若产生标况下氢气11.2L,此混合物的可能组合方式最多有
A.5种 B.4种 C.3种 D.2种
13.下列各实验的原理、操作、现象和结论均完全正确的是
A.证明某红棕色气体是溴蒸气还是NO2,可用AgNO3溶液检验,观察是否有沉淀生成
B.将点燃的镁条迅速投入到集满CO2的集气瓶中,观察到镁条在集气瓶底部继续燃烧
C.实验室用氢氧化钠标准溶液滴定未知浓度的醋酸溶液时,选用甲基橙做指示剂
D.向盛有5mL苯酚溶液的试管中滴入2~3滴稀溴水,边加边振荡,立即观察到有白色沉淀生成
14.下列说法不正确的是
A.铝合金常用于制造飞机部件,常用金属钠高温还原氯化铝制备金属铝
B.纯碱常用于清洗铁制品表面的油污
C.将氯化铁饱和溶液滴入沸水中,并煮沸至红褐色可制备Fe(OH)3胶体
D.镁制品着火后不宜用干粉灭火器灭火
15.下列物质间的转化关系中不能全部通过一步反应完成的是
A.Na→NaOH→Na2CO3→NaCl B.Mg→MgCl2→MgCO3→Mg(OH)2
C.Al→Al2O3→Al(OH)3→AlCl3 D.Fe→FeCl3→Fe(OH)3→Fe2O3
16.在给定条件下,下列选项所示的物质间转化均能实现的是
A.MgCO3MgCl2(aq)Mg
B.NaCl(aq)NaHCO3Na2CO3
C.Cu2(OH)2CO3CuOCu(OH)2
D.SO2NH4HSO3(NH4)2SO4
17.ag镁铝合金投入x mL2mol/L的盐酸中,金属完全溶解。再加入ymL1mol/L的NaOH溶液,沉淀达到最大值,质量为(a+1.7)g,则下列说法不正确的是
A.镁铝合金与盐酸反应转移电子数为0.1NA
B.产生的H2在标况下体积为1.12L
C.x一定等于50
D.a的取值范围为0.9二、综合题(共5题)
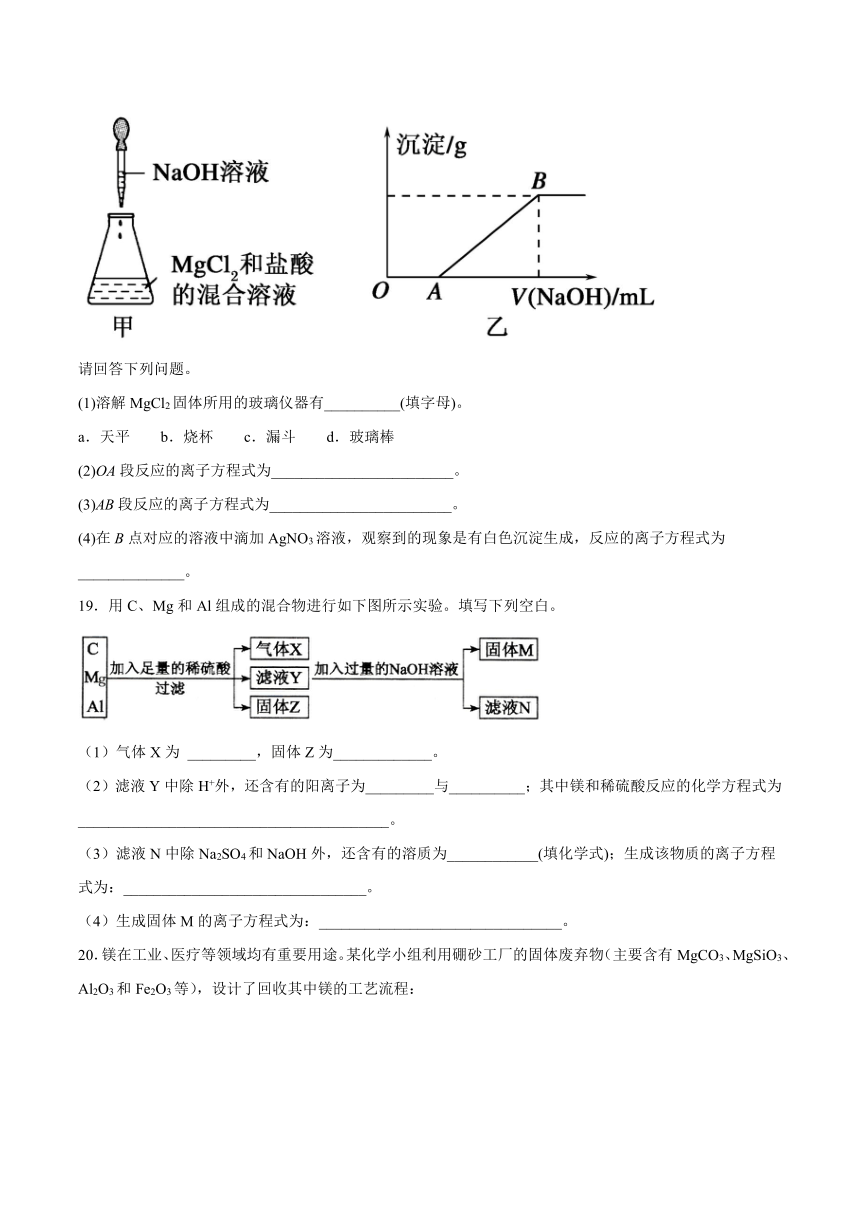
18.某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
请回答下列问题。
(1)溶解MgCl2固体所用的玻璃仪器有__________(填字母)。
a.天平 b.烧杯 c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为________________________。
(3)AB段反应的离子方程式为________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是有白色沉淀生成,反应的离子方程式为______________。
19.用C、Mg和Al组成的混合物进行如下图所示实验。填写下列空白。
(1)气体X为 _________,固体Z为_____________。
(2)滤液Y中除H+外,还含有的阳离子为_________与__________;其中镁和稀硫酸反应的化学方程式为_________________________________________。
(3)滤液N中除Na2SO4和NaOH外,还含有的溶质为____________(填化学式);生成该物质的离子方程式为:________________________________。
(4)生成固体M的离子方程式为:________________________________。
20.镁在工业、医疗等领域均有重要用途。某化学小组利用硼砂工厂的固体废弃物(主要含有MgCO3、MgSiO3、Al2O3和Fe2O3等),设计了回收其中镁的工艺流程:
(1)酸浸前,将固体废弃物研磨的目的是_______,为达到此目的,还可以采取的措施是_____(任写一条)。
(2)酸浸时,生成滤渣I的离子方程式为_________。
(3)第一次调节pH的目的是_____。当加入氨水使Al3+开始沉淀时,溶液中c(Fe3+)/c(Al3+)为 _________ 。已知Ksp[Fe(OH)3 ]=4×10-38,Ksp[Al(OH)3 ]=1×10-33.
(4)设计简单方案分离滤渣2,简述实验过程:______。
(5)滤液3中可回收利用的物质主要是_____(填化学式),其阳离子的电子式为 _______。
(6)写出工业上从滤渣3中获得镁锭的所有反应的化学方程式:_______。
21.金属镁及其化合物在科学研究及生产中具有广泛的用途。
(1)镁能在氧气、空气、氮气或二氧化碳中燃烧。
①点燃条件下,单质镁能与CO2发生置换反应并产生大量的热,反应的化学方程式为_____________________________________________。
②在空气中燃烧会发出眼的自光,将燃烧产物X置于60℃的热水中并充分搅拌,最终得到白色固体,同时有能使湿润的红色石蕊试纸变蓝色的气体生成。则产物X中除MgO外,还肯定含有的物质是_________(填化学式)。
(2)镁一过氧化氢电池具有能量高、安全方便等优点,可用于驱动无人驾驶的潜航器。某种镁一过氧化氢电池以海水为电解质溶液,其工作原理如右图所示(已知:氢氧化镁难溶于水)。
正极的电极反应式为___________________________,隔膜应选择_________ (填“阳”或“阴”)离子膜。
(3)轻质碳酸镁[MgCO3·Mg(OH)2·3H2O]在化工生产上有广泛的用途。以卤块(主要成分为MgCl2,含Fe2+、Fe3+等杂质离子)为原料制备它的工艺流程如下:
常温下,Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH:
Fe3+ Fe2+ Mg2+
开始沉淀时的pH 2.7 7.6 9.9
完全沉淀时的pH 3.7 9.6 11
[注:Fe(OH)2沉淀呈絮状,不易从溶液中除去]。
①写出一条能提高酸浸速率的措施:_______________________________________。
②“氧化”过程中,参加反应的氧化剂与还原剂的物质的量之比为__________________。
③加入NaOH溶液调节pH,通常控制pH在9.0左右,其目的是__________________。
④热解时,反应的离子方程式为____________________________________。
⑤操作I、Ⅱ均是将固体与液体分离,但在对分离后所得固体的操作上有明显差异,差异是_____________________________________________。
22.(1)分别取W g钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是_______。
(2)分别取0.1 mol钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是___________。
(3)若产生相同体积(同温同压下)的氢气,所需钠、镁、铝(与足量的盐酸反应)的物质的量之比为____________。
(4)若将0.2 mol钠、镁、铝分别投入10 mL 1 mol·L-1的盐酸中,在标准状况下,产生氢气的体积大小顺序是________。
参考答案
1.C
【详解】
根据题意可知,混合溶液中n(Cl-)=,n(Mg2+)= ,则有:n(Al3+)=。要使Mg2+、Al3+全部转化为沉淀,则所需的n(OH )=,则需加4mol/LNaOH溶液的体积为。
答案选C。
2.D
【详解】
A.Fe不与NaOH碱溶液发生反应,故A不符合题意;
B.Mg不与NaOH碱溶液发生反应,故B不符合题意;
C.Cu不与NaOH碱溶液发生反应,故C不符合题意;
D.Al既可与强酸反应又可与强碱反应,故D符合题意;
答案选D。
3.B
【详解】
A.镁粉燃烧发出耀眼的强光,用于制作照明弹,利用了化学性质,故不选A;
B.稀有气体用于制作霓虹灯,利用电子跃迁辐射能量,电子跃迁属于物理变化,利用了物理性质,故选B;
C.氧气用于医疗急救,是因为氧气能供给呼吸,利用了氧气的化学性质,故不选C;
D.氮气的化学性质稳定,所以氮气用作充氮包装,保存食品,利用了氮气的化学性质,故不选D。
故答案选B。
4.C
【详解】
A、FeCl3溶液可用作铜制线路板的蚀刻剂,说明Fe3+的氧化性比Cu2+强,与Fe比Cu活泼无关,选项A错误;
B、硅导电,用作半导体材料;SiO2熔点高,与用作半导体材料的硅单质,关系不对应,选项B错误;
C、NaC1O具有氧化性,可用于消菌杀毒,正确且有对应关系,选项C正确;
D、二氧化碳与镁反应生成氧化镁和碳,所以镁可以在二氧化碳中燃烧,因此镁着火时,不能用CO2来灭火,选项D错误;
故答案选C。
5.C
【详解】
A.CaO2与KHS摩尔质量都是72g/mol,72gCaO2与KHS的混合物为1mol,CaO2与KHS所含阴阳离子个数比都是1:1,即72gCaO2与KHS的混合物中含有的阴离子的数目为NA,故A正确;
B.根据2Mg+CO2=2MgO+C反应可知,0.1molCO2充分反应转移的电子数目为0.4NA,故B正确;
C.题干中没指明溶液的体积无法计算,故C错误;
D.标准状况下22.4 L氩气物质的量为1mol,氩原子含有18个质子,所以标准状况下22.4 L氩气含有的质子数为18NA,故D正确;
故选C。
6.A
【详解】
A.常温下Fe与氯气不反应,遇浓硫酸发生钝化,则用钢瓶储存液氯或浓硫酸,故A正确;
B.Mg能在CO2中燃烧生成MgO和C,则二氧化碳气体不可用作镁燃烧的灭火剂,故B错误;
C.蛋白质遇硫酸铜发生变性,变性是不可逆过程,盐析可用于蛋白质的分离和提纯,故D错误;
D.食盐中加的碘盐为KIO3,受热易分解,则在菜准备出锅时添加加碘食盐,是为了防止KIO3受热易分解,故D错误;
故答案为A。
7.C
【详解】
A.Fe与H2O(g)高温生成四氧化三铁,A错误;
B.二氧化硫不与氯化钡发生反应,B错误;
C.三氧化二铝和氢氧化钠反应生成偏铝酸钠和水,偏铝酸钠和水和二氧化碳生成氢氧化铝,C正确;
D.氯化镁溶液必须在氯化氢的氛围当中蒸干才能得到氯化镁固体,D错误;
故选D。
8.D
【详解】
A. 常温下铁在浓硫酸中钝化,浓硫酸可贮存在铁罐中,故A正确;
B. 二氧化氯中氯元素化合价为+4价,具有强氧化性,可用于自来水的杀菌消毒,故B正确;
C. 燃着的镁条放入盛满二氧化碳的集气瓶中,镁和二氧化碳反应生成氧化镁和碳,故C正确;
D. Cu与FeCl3发生氧化还原反应生成氯化亚铁和氯化铜,该反应表现Fe3+的氧化性,与铁比铜金属性强无关,故D错误;
选D。
9.D
【详解】
A.游离态的硫磺能破坏细菌表面的保护膜,具有杀菌作用,即火山附近的温泉因常常含有游离态硫而具有杀菌作用,故A正确;
B.氧化镁、氧化铝均是离子化合物,离子键强,导致熔点高,可作为耐高温耐火材料,故B正确;
C.某些硅酸盐具有多孔结构,吸附性强,可用于分离、提纯气体或液体混合物,还可作干燥剂、催化剂等,故C正确;
D.溴化银是一种重要的感光材料,可用于照相底片感光,碘化银常用于人工降雨,故D错误;
故选D。
10.A
【详解】
三种金属中,钠可以与水反应放出氢气,其产生氢气的量可认为只与钠的量有关;镁和铝需要跟盐酸反应才能生成氢气,其产生氢气的量一方面与金属的量有关,另一方面也跟盐酸的量有关;盐酸足量的情况下,质量均为mg的三种金属产生氢气的量的比例为:,即。考虑到实际生成的气体的体积关系,Mg生成的和Al生成的相同,所以只能是Mg,Al相对盐酸过量,那么消耗完0.1mol的盐酸需要Mg单质至少1.2g,Al单质至少0.9g,所以一定有m≥1.2g;又因为m≥1.2g时Mg和Al生成氢气的量为0.05mol,而Na生成氢气的量比二者都大,所以需要的n(Na)>0.1mol,即m>2.3g;综上所述,只有大于2.3g的数值才满足要求,A项正确;
答案选A。
11.A
【详解】
A.可以实现相关转化,A项正确;
B.电解氯化镁溶液不可能得到镁单质,B项错误;
C.氯化铁能够发生水解反应,因此蒸发氯化铁溶液不可能得到无水氯化铁,C项错误;
D.硫燃烧不能生成SO3,D项错误;
答案选A。
12.B
【分析】
标况下氢气11.2L即0.5mol,反应中转移电子数为1mol,先分别根据化学反应方程式计算四种金属单独与硫酸反应生成0.5mol氢气所需的质量,再判断26g混合物硫酸反应生成0.5mol氢气的可能组合。
【详解】
镁在反应中表现为+2价,提供1mol电子需要镁的质量是24g/mol×0.5mol=12g;
同理可证,铝在反应中表现为+3价,提供1mol电子需要铝的质量为9g;铁在反应中表现为+2价,提供1mol电子需要铝的质量为28g;铜不参与反应,故两两组合平均质量为26g,即可能的组合为铜和镁、铜和铝、铁和镁、铁和铝,共4种。
答案为B。
13.A
【详解】
A、AgNO3与HNO3、NO2、NO均不反应,而可以与溴溶于水后少量电离产生的Br-迅速反应生成黄色沉淀,反应极为灵敏,是鉴定溴的常用方法;故 A正确;
B、应该将燃着的镁条迅速伸入盛满CO2的集气瓶中,不能直接投入集气瓶,否则燃烧放出的大量热会导致集气瓶炸裂故B错误;
C、用氢氧化钠溶液滴定醋酸溶液是强碱滴定弱酸的中和滴定,在等当量点(等当点)时,溶液略带碱性(因为此时醋酸已被完全中和,但生成的醋酸钠要被水解而产生醋酸和氢氧化钠,醋酸微弱电离而氢氧化钠强烈离解使液略显碱性),因此要用变色范围在 pH 8.0-10.0 之间的酚酞作指示剂,而石蕊指示剂变色范围是pH5.0-8.0,甲基橙的变色范围是pH3.1-4.4,都不适合。故C错误;
D、生成的三溴苯酚溶解在过量的苯酚中,故D错误;
答案选A。
14.A
【详解】
A.用金属钠高温还原氯化铝制铝时,生产成本太高,工业上常用电解熔融氧化铝的方法制铝,A不正确;
B.热的纯碱溶液的碱性强,可促进油脂的水解,工业生产中,常用于清洗铁制品表面的油污,B正确;
C.制备Fe(OH)3胶体时,先将氯化铁饱和溶液滴入沸水中,然后继续加热煮沸直至液体呈红褐色为止,C正确;
D.干粉的主要成分为碳酸氢钠,它受热分解可生成碳酸钠、水和二氧化碳气体,因为燃烧的镁制品能在二氧化碳气体中继续燃烧,所以镁制品着火后不宜用干粉灭火器灭火,D正确;
故选A。
15.C
【详解】
A.Na→NaOH→Na2CO3→NaCl中反应方程式分别为:2Na+2H2O=2NaOH+H2↑、2NaOH+CO2=Na2CO3 +H2O、Na2CO3+CaCl2=CaCO3↓+2NaCl,所以能一步实现,故A不选;
B.Mg→MgCl2→MgCO3→Mg(OH)2中反应方程式分别为:Mg+2HCl=MgCl2+H2↑、MgCl2+Na2CO3=2NaCl+MgCO3↓、MgCO3+2NaOH=Mg(OH)2+Na2CO3,所以能一步实现,故B不选;
C.氧化铝和水不反应,所以不能一步生成氢氧化铝,故C选;
D.Fe→FeCl3→Fe(OH)3→Fe2O3中反应方程式分别是2Fe+3Cl2 2FeCl3、FeCl3+3NaOH=Fe(OH)3↓+3NaCl、2Fe(OH)3 Fe2O3+3H2O,所以能一步实现,故D不选;
故选:C。
16.D
【解析】
A.碳酸镁溶于盐酸生成氯化镁溶液,氯化镁溶液电解得到氢氧化镁,氢气和氯气,不能直接得到金属镁,应是电解熔融状态的氯化镁得到金属镁,故A错误;B.NaCl溶液中通入二氧化碳不反应,不能一步实现,故B错误;C.碱式碳酸铜加热分解生成氧化铜,氧化铜和水不反应,不能一步实现,故C错误;D.过量的二氧化硫和氨水反应生成亚硫酸铵,亚硫酸铵与硫酸反应生成硫酸铵、水和二氧化硫,能一步实现,故D正确;故选D。
17.C
【详解】
A.金属失去的电子数等于其金属阳离子结合的OH-的数目,则OH-的质量为1.7g,说明镁铝合金失去0.1mol电子,正确,不选A、
B.失去0.1mol电子,生成0.05mol氢气,标准状况下,体积为1.12L,正确,不选B;
C.金属完全溶解,盐酸可能有剩余,错误,选C;
D.假设全为金属镁,则0.05mol,质量为0.05 mol×24g/mol=1.2g;假设全为铝,则铝的物质的量为mol,则铝的质量为0.9g,正确,不选D。
答案选C。
18.bd H++OH-=H2O Mg2++2OH-=Mg(OH)2↓ Ag++Cl-=AgCl↓
【分析】
取一定质量的MgCl2固体配成溶液,溶解MgCl2固体应该在烧杯里并且用玻璃棒不断地搅拌。向该溶液中加入一定量的盐酸,然后再向混合溶液中加入NaOH溶液,首先发生的反应是NaOH与氯化氢反应生成氯化钠和水,然后发生的反应是镁离子与氢氧根离子反应生成氢氧化镁沉淀。据此解答。
【详解】
⑴溶解MgCl2固体,应该在烧杯里并且用玻璃棒不断地搅拌。故答案为:bd。
⑵OA段NaOH与氯化氢反应生成氯化钠和水,反应的离子方程式为:H++OH-=H2O
。故答案为:H++OH-=H2O。
⑶AB段镁离子与氢氧根离子反应生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓。故答案为:Mg2++2OH-=Mg(OH)2↓。
⑷根据以上分析B点时镁离子恰好完全沉淀,溶液的只剩氯化钠,所以滴加AgNO3溶液,观察到的现象立即出现白色沉淀,反应的离子方程式为:Ag++Cl-=AgCl↓。故答案为:Ag++Cl-=AgCl↓。
19.H2 C Al3+ Mg2+ Mg+H2SO4==MgSO4+H2↑ Na[Al(OH)4] Al3++4OH—=[Al(OH)4]— Mg2++2OH—==Mg(OH)2↓
【分析】
本题主要考查镁、铝相关知识。C与稀硫酸不发生反应,故固体Z为C,Mg、Al为活泼金属,能与非氧化性酸反应置换出H2,并生成相应的盐,故气体X为H2,滤液Y中溶质为H2SO4、MgSO4、Al2(SO4)3;加入过量的NaOH溶液后,生成可溶性的Na[Al(OH) 4]和Na2SO4以及难溶物Mg(OH)2,由此分析作答。
【详解】
(1)由上述分析可知,气体X为H2;固体Z为C;
(2)由上述分析可知,滤液Y中还含有的阳离子为Mg2+、Al3+;其中镁和稀硫酸的反应的方程式为:Mg + H2SO4== MgSO4 + H2↑;
(3)由上述分析可知,滤液N中还含有的溶质为Na[Al(OH) 4];生成Na[Al(OH) 4]的离子方程式为:Al 3+ + 4OH-== [Al(OH) 4] -;
(4)固体M为Mg(OH)2,生成Mg(OH)2的离子方程式为:Mg 2++ 2OH-== Mg(OH) 2↓
20.加快浸出速率 提高反应温度或适当增加硫酸浓度(或其他合理答案) MgSiO3+2H+=Mg2++H2SiO3 使Fe3+、Al3+沉淀从而分离出来 4.0×10-5 溶于适量氢氧化钠溶液,过滤得Fe(OH)3;向滤液中通入过量CO2,过滤得Al(OH)3 (NH4)2SO4 Mg(OH)2+2HCl=MgCl2+2H2O、MgCl2(熔融)Mg+Cl2↑
【详解】
浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率;因MgCO3、MgSiO3、Al2O3、Fe2O3能与硫酸反应,生成了MgSO4、Al2(SO4)2 和Fe2(SO4)3 ,其中H2SiO3形成滤渣1,滤液1中MgSO4、Al2(SO4)2 和Fe2(SO4)3,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe3+和Al3+已经完全沉淀,滤渣2的主要成分是Fe(OH)3 、Al(OH)3 ,滤液2中阴离子主要是SO42-,加入NH3·H2O后在调节pH至12.5时Mg2+完全沉淀,溶质主要成分是(NH4)2SO4。
(1)酸浸前,将固体废弃物研磨的目的是加快浸出速率,浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率,故答案为加快浸出速率,适当提高反应温度、增加浸出时间(或其他合理答案)
(2)因MgCO3、MgSiO3、Al2O3、Fe2O3能与硫酸反应,生成了MgSO4、Al2(SO4)2 和Fe2(SO4)3 ,其中H2SiO3形成滤渣;酸浸时,生成滤渣I的离子方程式为MgSiO3+2H+=Mg2++H2SiO3;(3)滤液I中含有MgSO4、Al2(SO4)2 和Fe2(SO4)3 ,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe3+和Al3+已经完全沉淀,滤渣2的主要成分是Fe(OH)3、Al(OH)3 ,第一次调节pH的目的是使Fe3+、Al3+沉淀从而分离出来;当加入氨水使Al3+开始沉淀时,溶液中c(Fe3+)/c(Al3+)=Ksp[Fe(OH)3 ]/Ksp[Al(OH)3 ]==4×10-38/1×10-33=4.0×10-5;(4)设计简单方案分离滤渣2,滤渣2的主要成分是Fe(OH)3、Al(OH)3 ,利用Al(OH)3 具有两性,分离操作:溶于适量氢氧化钠溶液,过滤得Fe(OH)3;向滤液中通入过量CO2,过滤得Al(OH)3 ;(7)上述过滤后滤液中阴离子主要是SO42-,加入NH3·H2O后在调节pH至12.5时Mg2+完全沉淀,溶质主要成分是(NH4)2SO4,故答案为(NH4)2 SO4;其阳离子的电子式为,(6)滤渣3为Mg(OH)2 ,工业上从滤渣3生产镁锭的反应:Mg(OH)2 +2HCl=MgCl2+2H2O、MgCl2(熔融)Mg+Cl2↑。
21.2Mg+CO22MgO+C Mg3N2 H2O2+2e-=2OH- 阳 将卤块粉碎(或加热、搅拌、适当增大盐酸浓度等) 1∶2 将溶液中的Fe3+尽可能多地除去,同时避免Mg2+形成沉淀 2Mg2++4HCO3-+2H2OMgCO3·Mg(OH)2·3H2O↓+3CO2↑ 操作Ⅱ过滤后所得固体为产品,还必须对产品进行洗涤、干燥
【详解】
(1)①单质镁能与CO2发生置换反应2Mg+CO22MgO+C,故答案为2Mg+CO22MgO+C;
②将燃烧产物X置于60℃的热水中并充分搅拌,最终得到白色固体,同时有能使湿润的红色石蕊试纸变蓝色的气体生成,由所述现象可知此为水解反应,产生的使湿润的红色石蕊试纸变蓝色的气体为氨气,沉淀为氢氧化镁,根据原子守恒以及“Mg能在氧气、空气、氮气、二氧化碳中燃烧”,反应物为Mg3N2,反应为Mg3N2+6H2O2NH3↑+3Mg(OH)2↓,故答案为Mg3N2;
(2)镁一过氧化氢电池由图可知总反应为Mg+ H2O2=Mg(OH)2,即镁电极为负极,石墨电极为正极,以海水为电解质溶液,即电解质环境为弱碱性,所以正极反应为H2O2+2e-=2OH-,故答案为H2O2+2e-=2OH-;氢氧化镁难溶于水,所以生成的氢氧化镁不能覆盖到镁电极上,因此需要镁离子通过隔膜到石墨电极附近生成氢氧化镁,即隔膜应选择阳离子膜,故答案为阳离子膜;
(3)①卤块为固体物质,提高酸浸速率的措施可将卤块粉碎、搅拌、加热、适当提高盐酸浓度等,故答案为将卤块粉碎(或搅拌、加热、适当提高盐酸浓度等);
②“氧化”过程是将Fe2+氧化为Fe3+以便调节pH将铁元素杂质除去,反应离子方程式为2H++ClO-+2Fe2+=2Fe3++Cl-+H2O,参加反应的氧化剂与还原剂的物质的量之比为1:2,故答案为1:2;
③加入NaOH溶液调节pH的目的是,通常控制pH在9.0左右,其目的是将溶液中的杂质Fe3+尽可能多地除去,同时避免Mg2+形成沉淀,故答案为将溶液中的杂质Fe3+尽可能多地除去,同时避免Mg2+形成沉淀;
④热解时,反应是Mg2+和HCO3-反应生成轻质碳酸镁和二氧化碳,所以离子反应方程式为:2Mg2++4HCO3-+2H2OMgCO3·Mg(OH)2·3H2O↓+3CO2↑,故答案为2Mg2++4HCO3-+2H2OMgCO3·Mg(OH)2·3H2O↓+3CO2↑
⑤操作I、Ⅱ均是将固体与液体分离,但操作I过滤后产品在滤液中,所以对固体是舍弃的,在操作Ⅱ过滤后所得固体为产品,所以要保留,还必须对产品进行洗涤、干燥,故答案为操作Ⅱ过滤后所得固体为产品,还必须对产品进行洗涤、干燥。
22. 1∶2∶3 6∶3∶2 Na>Al=Mg
【分析】
发生反应:2Na+2HCl=2NaCl+H2↑、Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,根据方程式计算解答。
【详解】
(1)2Na+2HCl=2NaCl+H2↑、
46g 1mol
Wg mol
Mg+2HCl=MgCl2+H2↑ 、
24g 1mol
Wg mol
2Al+6HCl=2AlCl3+3H2↑,
54g 3mol
Wg mol
故在相同条件下产生氢气的体积比= mol :mol: mol=,
因此,本题正确答案是:。
(2)分别取0.1mol钠、镁、铝与足量盐酸反应,则:
2Na+2HCl=2NaCl+H2↑
0.1mol 0.05mol
Mg+2HCl=MgCl2+H2↑
0.1mol 0.1mol
2Al+6HCl=2AlCl3+3H2↑
0.1mol 0.15mol
故在相同条件下产生氢气的体积比=0.05mol:0.1mol:0.15mol=1:2:3,
因此,本题正确答案是:1:2:3。
(3)若产生相同体积(同温同压下)的H2,说明三种金属提供电子的物质的量相同,设三种金属都失去6mol的电子,需钠的物质的量为6mol,镁的物质的量为3mol,铝的物质的量为2mol,所以所需的钠、镁、铝物质的量比为6:3:2。
因此,本题正确答案是:6:3:2。
(4)若将0.2 mol钠、镁、铝分别投入10 mL 1 mol·L-1的盐酸中,可以知道三种金属都过量,但金属钠活泼,能与水反应生成氢气,则生成氢气最多的是钠,镁和铝生成氢气的体积一样多,
因此,本题正确答案是:Na>Al=Mg。
一、选择题(共17题)
1.有200mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol/L,c(Cl-)为1.3mol/L。要使Mg2+、Al3+全部转化为沉淀,至少需加4mol/LNaOH溶液的体积为( )
A.40mL B.72mL C.65mL D.128mL
2.下列金属可与NaOH碱溶液发生反应的是( )
A.Fe B.Mg C.Cu D.Al
3.物质的性质决定其用途。下列物质的用途中,利用其物理性质的是( )
A.镁粉用于制作照明弹 B.稀有气体用于制作霓虹灯
C.氧气用于医疗急救 D.氮气用作充氮包装,保存食品
4.下列有关物质性质与用途具有对应关系的是
A.Fe比Cu活泼,FeCl3溶液可用作铜制线路板的蚀刻剂
B.SiO2熔点高,可用作半导体材料
C.NaC1O具有氧化性,可用于消菌杀毒
D.CO2密度比空气大且不支持燃烧,可用作镁着火时的灭火剂
5.用NA表示阿伏伽德罗常数的值,下列叙述不正确的是
A.72gCaO2与KHS的混合物中含有的阴离子的数目为NA
B.足量的Mg与0.1molCO2充分反应,转移的电子数目为0.4 NA
C.25℃时,pH=2的H2SO4,溶液中含有的H+数目为0.01 NA
D.标准状况下22.4 L氩气含有的质子数为18NA
6.化学与生产、生活息息相关。下列说法正确的是( )
A.可用钢瓶储存液氯或浓硫酸
B.二氧化碳气体可用作镁燃烧的灭火剂
C.鸡蛋清溶液中加入CuSO4溶液,有沉淀析出,该性质可用于蛋白质的分离与提纯
D.炒菜时加碘食盐要在菜准备出锅时添加,是为了防止食盐中的碘受热升华
7.在给定条件下,下列选项所示的物质间转化均能实现的是
A.
B.
C.
D.
8.下列有关物质性质或用途的说法不正确的是
A.常温下浓硫酸可贮存在铁罐中
B.ClO2具有氧化性,可用于自来水的杀菌消毒
C.燃着的镁条放入盛满二氧化碳的集气瓶中可继续燃烧
D.铁比铜金属性强,所以可用FeCl3腐蚀Cu刻制印刷电路板
9.下列说法不正确的是
A.火山附近的温泉因常常含有游离态硫而具有杀菌作用
B.氧化镁、氧化铝熔点高,都可用作耐火材料
C.某些硅酸盐具有多孔结构,可用于分离、提纯气体或液体混合物,还可作干燥剂、催化剂
D.溴化银是一种重要的感光材料,常用于人工降雨
10.在相同条件下,将质量均为m的Na、Mg、Al分别加入盛有100mL 1mol·L—1稀盐酸的甲、乙、丙三支试管中充分反应,生成气体的体积关系为:甲(Na)>乙(Mg)=丙(Al),则m可能是( )
A.4.0g B.2.3g C.1.2g D.1.8g
11.在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
A.粗硅SiCl4Si
B.Mg(OH)2MgCl2(aq) Mg
C.Fe2O3FeCl3(aq) 无水FeCl3
D.SSO3H2SO4
12.有镁、铝、铁、铜四种金属,若两两混合,取混合物26克与足量稀硫酸反应,若产生标况下氢气11.2L,此混合物的可能组合方式最多有
A.5种 B.4种 C.3种 D.2种
13.下列各实验的原理、操作、现象和结论均完全正确的是
A.证明某红棕色气体是溴蒸气还是NO2,可用AgNO3溶液检验,观察是否有沉淀生成
B.将点燃的镁条迅速投入到集满CO2的集气瓶中,观察到镁条在集气瓶底部继续燃烧
C.实验室用氢氧化钠标准溶液滴定未知浓度的醋酸溶液时,选用甲基橙做指示剂
D.向盛有5mL苯酚溶液的试管中滴入2~3滴稀溴水,边加边振荡,立即观察到有白色沉淀生成
14.下列说法不正确的是
A.铝合金常用于制造飞机部件,常用金属钠高温还原氯化铝制备金属铝
B.纯碱常用于清洗铁制品表面的油污
C.将氯化铁饱和溶液滴入沸水中,并煮沸至红褐色可制备Fe(OH)3胶体
D.镁制品着火后不宜用干粉灭火器灭火
15.下列物质间的转化关系中不能全部通过一步反应完成的是
A.Na→NaOH→Na2CO3→NaCl B.Mg→MgCl2→MgCO3→Mg(OH)2
C.Al→Al2O3→Al(OH)3→AlCl3 D.Fe→FeCl3→Fe(OH)3→Fe2O3
16.在给定条件下,下列选项所示的物质间转化均能实现的是
A.MgCO3MgCl2(aq)Mg
B.NaCl(aq)NaHCO3Na2CO3
C.Cu2(OH)2CO3CuOCu(OH)2
D.SO2NH4HSO3(NH4)2SO4
17.ag镁铝合金投入x mL2mol/L的盐酸中,金属完全溶解。再加入ymL1mol/L的NaOH溶液,沉淀达到最大值,质量为(a+1.7)g,则下列说法不正确的是
A.镁铝合金与盐酸反应转移电子数为0.1NA
B.产生的H2在标况下体积为1.12L
C.x一定等于50
D.a的取值范围为0.9
18.某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
请回答下列问题。
(1)溶解MgCl2固体所用的玻璃仪器有__________(填字母)。
a.天平 b.烧杯 c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为________________________。
(3)AB段反应的离子方程式为________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是有白色沉淀生成,反应的离子方程式为______________。
19.用C、Mg和Al组成的混合物进行如下图所示实验。填写下列空白。
(1)气体X为 _________,固体Z为_____________。
(2)滤液Y中除H+外,还含有的阳离子为_________与__________;其中镁和稀硫酸反应的化学方程式为_________________________________________。
(3)滤液N中除Na2SO4和NaOH外,还含有的溶质为____________(填化学式);生成该物质的离子方程式为:________________________________。
(4)生成固体M的离子方程式为:________________________________。
20.镁在工业、医疗等领域均有重要用途。某化学小组利用硼砂工厂的固体废弃物(主要含有MgCO3、MgSiO3、Al2O3和Fe2O3等),设计了回收其中镁的工艺流程:
(1)酸浸前,将固体废弃物研磨的目的是_______,为达到此目的,还可以采取的措施是_____(任写一条)。
(2)酸浸时,生成滤渣I的离子方程式为_________。
(3)第一次调节pH的目的是_____。当加入氨水使Al3+开始沉淀时,溶液中c(Fe3+)/c(Al3+)为 _________ 。已知Ksp[Fe(OH)3 ]=4×10-38,Ksp[Al(OH)3 ]=1×10-33.
(4)设计简单方案分离滤渣2,简述实验过程:______。
(5)滤液3中可回收利用的物质主要是_____(填化学式),其阳离子的电子式为 _______。
(6)写出工业上从滤渣3中获得镁锭的所有反应的化学方程式:_______。
21.金属镁及其化合物在科学研究及生产中具有广泛的用途。
(1)镁能在氧气、空气、氮气或二氧化碳中燃烧。
①点燃条件下,单质镁能与CO2发生置换反应并产生大量的热,反应的化学方程式为_____________________________________________。
②在空气中燃烧会发出眼的自光,将燃烧产物X置于60℃的热水中并充分搅拌,最终得到白色固体,同时有能使湿润的红色石蕊试纸变蓝色的气体生成。则产物X中除MgO外,还肯定含有的物质是_________(填化学式)。
(2)镁一过氧化氢电池具有能量高、安全方便等优点,可用于驱动无人驾驶的潜航器。某种镁一过氧化氢电池以海水为电解质溶液,其工作原理如右图所示(已知:氢氧化镁难溶于水)。
正极的电极反应式为___________________________,隔膜应选择_________ (填“阳”或“阴”)离子膜。
(3)轻质碳酸镁[MgCO3·Mg(OH)2·3H2O]在化工生产上有广泛的用途。以卤块(主要成分为MgCl2,含Fe2+、Fe3+等杂质离子)为原料制备它的工艺流程如下:
常温下,Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH:
Fe3+ Fe2+ Mg2+
开始沉淀时的pH 2.7 7.6 9.9
完全沉淀时的pH 3.7 9.6 11
[注:Fe(OH)2沉淀呈絮状,不易从溶液中除去]。
①写出一条能提高酸浸速率的措施:_______________________________________。
②“氧化”过程中,参加反应的氧化剂与还原剂的物质的量之比为__________________。
③加入NaOH溶液调节pH,通常控制pH在9.0左右,其目的是__________________。
④热解时,反应的离子方程式为____________________________________。
⑤操作I、Ⅱ均是将固体与液体分离,但在对分离后所得固体的操作上有明显差异,差异是_____________________________________________。
22.(1)分别取W g钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是_______。
(2)分别取0.1 mol钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是___________。
(3)若产生相同体积(同温同压下)的氢气,所需钠、镁、铝(与足量的盐酸反应)的物质的量之比为____________。
(4)若将0.2 mol钠、镁、铝分别投入10 mL 1 mol·L-1的盐酸中,在标准状况下,产生氢气的体积大小顺序是________。
参考答案
1.C
【详解】
根据题意可知,混合溶液中n(Cl-)=,n(Mg2+)= ,则有:n(Al3+)=。要使Mg2+、Al3+全部转化为沉淀,则所需的n(OH )=,则需加4mol/LNaOH溶液的体积为。
答案选C。
2.D
【详解】
A.Fe不与NaOH碱溶液发生反应,故A不符合题意;
B.Mg不与NaOH碱溶液发生反应,故B不符合题意;
C.Cu不与NaOH碱溶液发生反应,故C不符合题意;
D.Al既可与强酸反应又可与强碱反应,故D符合题意;
答案选D。
3.B
【详解】
A.镁粉燃烧发出耀眼的强光,用于制作照明弹,利用了化学性质,故不选A;
B.稀有气体用于制作霓虹灯,利用电子跃迁辐射能量,电子跃迁属于物理变化,利用了物理性质,故选B;
C.氧气用于医疗急救,是因为氧气能供给呼吸,利用了氧气的化学性质,故不选C;
D.氮气的化学性质稳定,所以氮气用作充氮包装,保存食品,利用了氮气的化学性质,故不选D。
故答案选B。
4.C
【详解】
A、FeCl3溶液可用作铜制线路板的蚀刻剂,说明Fe3+的氧化性比Cu2+强,与Fe比Cu活泼无关,选项A错误;
B、硅导电,用作半导体材料;SiO2熔点高,与用作半导体材料的硅单质,关系不对应,选项B错误;
C、NaC1O具有氧化性,可用于消菌杀毒,正确且有对应关系,选项C正确;
D、二氧化碳与镁反应生成氧化镁和碳,所以镁可以在二氧化碳中燃烧,因此镁着火时,不能用CO2来灭火,选项D错误;
故答案选C。
5.C
【详解】
A.CaO2与KHS摩尔质量都是72g/mol,72gCaO2与KHS的混合物为1mol,CaO2与KHS所含阴阳离子个数比都是1:1,即72gCaO2与KHS的混合物中含有的阴离子的数目为NA,故A正确;
B.根据2Mg+CO2=2MgO+C反应可知,0.1molCO2充分反应转移的电子数目为0.4NA,故B正确;
C.题干中没指明溶液的体积无法计算,故C错误;
D.标准状况下22.4 L氩气物质的量为1mol,氩原子含有18个质子,所以标准状况下22.4 L氩气含有的质子数为18NA,故D正确;
故选C。
6.A
【详解】
A.常温下Fe与氯气不反应,遇浓硫酸发生钝化,则用钢瓶储存液氯或浓硫酸,故A正确;
B.Mg能在CO2中燃烧生成MgO和C,则二氧化碳气体不可用作镁燃烧的灭火剂,故B错误;
C.蛋白质遇硫酸铜发生变性,变性是不可逆过程,盐析可用于蛋白质的分离和提纯,故D错误;
D.食盐中加的碘盐为KIO3,受热易分解,则在菜准备出锅时添加加碘食盐,是为了防止KIO3受热易分解,故D错误;
故答案为A。
7.C
【详解】
A.Fe与H2O(g)高温生成四氧化三铁,A错误;
B.二氧化硫不与氯化钡发生反应,B错误;
C.三氧化二铝和氢氧化钠反应生成偏铝酸钠和水,偏铝酸钠和水和二氧化碳生成氢氧化铝,C正确;
D.氯化镁溶液必须在氯化氢的氛围当中蒸干才能得到氯化镁固体,D错误;
故选D。
8.D
【详解】
A. 常温下铁在浓硫酸中钝化,浓硫酸可贮存在铁罐中,故A正确;
B. 二氧化氯中氯元素化合价为+4价,具有强氧化性,可用于自来水的杀菌消毒,故B正确;
C. 燃着的镁条放入盛满二氧化碳的集气瓶中,镁和二氧化碳反应生成氧化镁和碳,故C正确;
D. Cu与FeCl3发生氧化还原反应生成氯化亚铁和氯化铜,该反应表现Fe3+的氧化性,与铁比铜金属性强无关,故D错误;
选D。
9.D
【详解】
A.游离态的硫磺能破坏细菌表面的保护膜,具有杀菌作用,即火山附近的温泉因常常含有游离态硫而具有杀菌作用,故A正确;
B.氧化镁、氧化铝均是离子化合物,离子键强,导致熔点高,可作为耐高温耐火材料,故B正确;
C.某些硅酸盐具有多孔结构,吸附性强,可用于分离、提纯气体或液体混合物,还可作干燥剂、催化剂等,故C正确;
D.溴化银是一种重要的感光材料,可用于照相底片感光,碘化银常用于人工降雨,故D错误;
故选D。
10.A
【详解】
三种金属中,钠可以与水反应放出氢气,其产生氢气的量可认为只与钠的量有关;镁和铝需要跟盐酸反应才能生成氢气,其产生氢气的量一方面与金属的量有关,另一方面也跟盐酸的量有关;盐酸足量的情况下,质量均为mg的三种金属产生氢气的量的比例为:,即。考虑到实际生成的气体的体积关系,Mg生成的和Al生成的相同,所以只能是Mg,Al相对盐酸过量,那么消耗完0.1mol的盐酸需要Mg单质至少1.2g,Al单质至少0.9g,所以一定有m≥1.2g;又因为m≥1.2g时Mg和Al生成氢气的量为0.05mol,而Na生成氢气的量比二者都大,所以需要的n(Na)>0.1mol,即m>2.3g;综上所述,只有大于2.3g的数值才满足要求,A项正确;
答案选A。
11.A
【详解】
A.可以实现相关转化,A项正确;
B.电解氯化镁溶液不可能得到镁单质,B项错误;
C.氯化铁能够发生水解反应,因此蒸发氯化铁溶液不可能得到无水氯化铁,C项错误;
D.硫燃烧不能生成SO3,D项错误;
答案选A。
12.B
【分析】
标况下氢气11.2L即0.5mol,反应中转移电子数为1mol,先分别根据化学反应方程式计算四种金属单独与硫酸反应生成0.5mol氢气所需的质量,再判断26g混合物硫酸反应生成0.5mol氢气的可能组合。
【详解】
镁在反应中表现为+2价,提供1mol电子需要镁的质量是24g/mol×0.5mol=12g;
同理可证,铝在反应中表现为+3价,提供1mol电子需要铝的质量为9g;铁在反应中表现为+2价,提供1mol电子需要铝的质量为28g;铜不参与反应,故两两组合平均质量为26g,即可能的组合为铜和镁、铜和铝、铁和镁、铁和铝,共4种。
答案为B。
13.A
【详解】
A、AgNO3与HNO3、NO2、NO均不反应,而可以与溴溶于水后少量电离产生的Br-迅速反应生成黄色沉淀,反应极为灵敏,是鉴定溴的常用方法;故 A正确;
B、应该将燃着的镁条迅速伸入盛满CO2的集气瓶中,不能直接投入集气瓶,否则燃烧放出的大量热会导致集气瓶炸裂故B错误;
C、用氢氧化钠溶液滴定醋酸溶液是强碱滴定弱酸的中和滴定,在等当量点(等当点)时,溶液略带碱性(因为此时醋酸已被完全中和,但生成的醋酸钠要被水解而产生醋酸和氢氧化钠,醋酸微弱电离而氢氧化钠强烈离解使液略显碱性),因此要用变色范围在 pH 8.0-10.0 之间的酚酞作指示剂,而石蕊指示剂变色范围是pH5.0-8.0,甲基橙的变色范围是pH3.1-4.4,都不适合。故C错误;
D、生成的三溴苯酚溶解在过量的苯酚中,故D错误;
答案选A。
14.A
【详解】
A.用金属钠高温还原氯化铝制铝时,生产成本太高,工业上常用电解熔融氧化铝的方法制铝,A不正确;
B.热的纯碱溶液的碱性强,可促进油脂的水解,工业生产中,常用于清洗铁制品表面的油污,B正确;
C.制备Fe(OH)3胶体时,先将氯化铁饱和溶液滴入沸水中,然后继续加热煮沸直至液体呈红褐色为止,C正确;
D.干粉的主要成分为碳酸氢钠,它受热分解可生成碳酸钠、水和二氧化碳气体,因为燃烧的镁制品能在二氧化碳气体中继续燃烧,所以镁制品着火后不宜用干粉灭火器灭火,D正确;
故选A。
15.C
【详解】
A.Na→NaOH→Na2CO3→NaCl中反应方程式分别为:2Na+2H2O=2NaOH+H2↑、2NaOH+CO2=Na2CO3 +H2O、Na2CO3+CaCl2=CaCO3↓+2NaCl,所以能一步实现,故A不选;
B.Mg→MgCl2→MgCO3→Mg(OH)2中反应方程式分别为:Mg+2HCl=MgCl2+H2↑、MgCl2+Na2CO3=2NaCl+MgCO3↓、MgCO3+2NaOH=Mg(OH)2+Na2CO3,所以能一步实现,故B不选;
C.氧化铝和水不反应,所以不能一步生成氢氧化铝,故C选;
D.Fe→FeCl3→Fe(OH)3→Fe2O3中反应方程式分别是2Fe+3Cl2 2FeCl3、FeCl3+3NaOH=Fe(OH)3↓+3NaCl、2Fe(OH)3 Fe2O3+3H2O,所以能一步实现,故D不选;
故选:C。
16.D
【解析】
A.碳酸镁溶于盐酸生成氯化镁溶液,氯化镁溶液电解得到氢氧化镁,氢气和氯气,不能直接得到金属镁,应是电解熔融状态的氯化镁得到金属镁,故A错误;B.NaCl溶液中通入二氧化碳不反应,不能一步实现,故B错误;C.碱式碳酸铜加热分解生成氧化铜,氧化铜和水不反应,不能一步实现,故C错误;D.过量的二氧化硫和氨水反应生成亚硫酸铵,亚硫酸铵与硫酸反应生成硫酸铵、水和二氧化硫,能一步实现,故D正确;故选D。
17.C
【详解】
A.金属失去的电子数等于其金属阳离子结合的OH-的数目,则OH-的质量为1.7g,说明镁铝合金失去0.1mol电子,正确,不选A、
B.失去0.1mol电子,生成0.05mol氢气,标准状况下,体积为1.12L,正确,不选B;
C.金属完全溶解,盐酸可能有剩余,错误,选C;
D.假设全为金属镁,则0.05mol,质量为0.05 mol×24g/mol=1.2g;假设全为铝,则铝的物质的量为mol,则铝的质量为0.9g,正确,不选D。
答案选C。
18.bd H++OH-=H2O Mg2++2OH-=Mg(OH)2↓ Ag++Cl-=AgCl↓
【分析】
取一定质量的MgCl2固体配成溶液,溶解MgCl2固体应该在烧杯里并且用玻璃棒不断地搅拌。向该溶液中加入一定量的盐酸,然后再向混合溶液中加入NaOH溶液,首先发生的反应是NaOH与氯化氢反应生成氯化钠和水,然后发生的反应是镁离子与氢氧根离子反应生成氢氧化镁沉淀。据此解答。
【详解】
⑴溶解MgCl2固体,应该在烧杯里并且用玻璃棒不断地搅拌。故答案为:bd。
⑵OA段NaOH与氯化氢反应生成氯化钠和水,反应的离子方程式为:H++OH-=H2O
。故答案为:H++OH-=H2O。
⑶AB段镁离子与氢氧根离子反应生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓。故答案为:Mg2++2OH-=Mg(OH)2↓。
⑷根据以上分析B点时镁离子恰好完全沉淀,溶液的只剩氯化钠,所以滴加AgNO3溶液,观察到的现象立即出现白色沉淀,反应的离子方程式为:Ag++Cl-=AgCl↓。故答案为:Ag++Cl-=AgCl↓。
19.H2 C Al3+ Mg2+ Mg+H2SO4==MgSO4+H2↑ Na[Al(OH)4] Al3++4OH—=[Al(OH)4]— Mg2++2OH—==Mg(OH)2↓
【分析】
本题主要考查镁、铝相关知识。C与稀硫酸不发生反应,故固体Z为C,Mg、Al为活泼金属,能与非氧化性酸反应置换出H2,并生成相应的盐,故气体X为H2,滤液Y中溶质为H2SO4、MgSO4、Al2(SO4)3;加入过量的NaOH溶液后,生成可溶性的Na[Al(OH) 4]和Na2SO4以及难溶物Mg(OH)2,由此分析作答。
【详解】
(1)由上述分析可知,气体X为H2;固体Z为C;
(2)由上述分析可知,滤液Y中还含有的阳离子为Mg2+、Al3+;其中镁和稀硫酸的反应的方程式为:Mg + H2SO4== MgSO4 + H2↑;
(3)由上述分析可知,滤液N中还含有的溶质为Na[Al(OH) 4];生成Na[Al(OH) 4]的离子方程式为:Al 3+ + 4OH-== [Al(OH) 4] -;
(4)固体M为Mg(OH)2,生成Mg(OH)2的离子方程式为:Mg 2++ 2OH-== Mg(OH) 2↓
20.加快浸出速率 提高反应温度或适当增加硫酸浓度(或其他合理答案) MgSiO3+2H+=Mg2++H2SiO3 使Fe3+、Al3+沉淀从而分离出来 4.0×10-5 溶于适量氢氧化钠溶液,过滤得Fe(OH)3;向滤液中通入过量CO2,过滤得Al(OH)3 (NH4)2SO4 Mg(OH)2+2HCl=MgCl2+2H2O、MgCl2(熔融)Mg+Cl2↑
【详解】
浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率;因MgCO3、MgSiO3、Al2O3、Fe2O3能与硫酸反应,生成了MgSO4、Al2(SO4)2 和Fe2(SO4)3 ,其中H2SiO3形成滤渣1,滤液1中MgSO4、Al2(SO4)2 和Fe2(SO4)3,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe3+和Al3+已经完全沉淀,滤渣2的主要成分是Fe(OH)3 、Al(OH)3 ,滤液2中阴离子主要是SO42-,加入NH3·H2O后在调节pH至12.5时Mg2+完全沉淀,溶质主要成分是(NH4)2SO4。
(1)酸浸前,将固体废弃物研磨的目的是加快浸出速率,浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率,故答案为加快浸出速率,适当提高反应温度、增加浸出时间(或其他合理答案)
(2)因MgCO3、MgSiO3、Al2O3、Fe2O3能与硫酸反应,生成了MgSO4、Al2(SO4)2 和Fe2(SO4)3 ,其中H2SiO3形成滤渣;酸浸时,生成滤渣I的离子方程式为MgSiO3+2H+=Mg2++H2SiO3;(3)滤液I中含有MgSO4、Al2(SO4)2 和Fe2(SO4)3 ,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe3+和Al3+已经完全沉淀,滤渣2的主要成分是Fe(OH)3、Al(OH)3 ,第一次调节pH的目的是使Fe3+、Al3+沉淀从而分离出来;当加入氨水使Al3+开始沉淀时,溶液中c(Fe3+)/c(Al3+)=Ksp[Fe(OH)3 ]/Ksp[Al(OH)3 ]==4×10-38/1×10-33=4.0×10-5;(4)设计简单方案分离滤渣2,滤渣2的主要成分是Fe(OH)3、Al(OH)3 ,利用Al(OH)3 具有两性,分离操作:溶于适量氢氧化钠溶液,过滤得Fe(OH)3;向滤液中通入过量CO2,过滤得Al(OH)3 ;(7)上述过滤后滤液中阴离子主要是SO42-,加入NH3·H2O后在调节pH至12.5时Mg2+完全沉淀,溶质主要成分是(NH4)2SO4,故答案为(NH4)2 SO4;其阳离子的电子式为,(6)滤渣3为Mg(OH)2 ,工业上从滤渣3生产镁锭的反应:Mg(OH)2 +2HCl=MgCl2+2H2O、MgCl2(熔融)Mg+Cl2↑。
21.2Mg+CO22MgO+C Mg3N2 H2O2+2e-=2OH- 阳 将卤块粉碎(或加热、搅拌、适当增大盐酸浓度等) 1∶2 将溶液中的Fe3+尽可能多地除去,同时避免Mg2+形成沉淀 2Mg2++4HCO3-+2H2OMgCO3·Mg(OH)2·3H2O↓+3CO2↑ 操作Ⅱ过滤后所得固体为产品,还必须对产品进行洗涤、干燥
【详解】
(1)①单质镁能与CO2发生置换反应2Mg+CO22MgO+C,故答案为2Mg+CO22MgO+C;
②将燃烧产物X置于60℃的热水中并充分搅拌,最终得到白色固体,同时有能使湿润的红色石蕊试纸变蓝色的气体生成,由所述现象可知此为水解反应,产生的使湿润的红色石蕊试纸变蓝色的气体为氨气,沉淀为氢氧化镁,根据原子守恒以及“Mg能在氧气、空气、氮气、二氧化碳中燃烧”,反应物为Mg3N2,反应为Mg3N2+6H2O2NH3↑+3Mg(OH)2↓,故答案为Mg3N2;
(2)镁一过氧化氢电池由图可知总反应为Mg+ H2O2=Mg(OH)2,即镁电极为负极,石墨电极为正极,以海水为电解质溶液,即电解质环境为弱碱性,所以正极反应为H2O2+2e-=2OH-,故答案为H2O2+2e-=2OH-;氢氧化镁难溶于水,所以生成的氢氧化镁不能覆盖到镁电极上,因此需要镁离子通过隔膜到石墨电极附近生成氢氧化镁,即隔膜应选择阳离子膜,故答案为阳离子膜;
(3)①卤块为固体物质,提高酸浸速率的措施可将卤块粉碎、搅拌、加热、适当提高盐酸浓度等,故答案为将卤块粉碎(或搅拌、加热、适当提高盐酸浓度等);
②“氧化”过程是将Fe2+氧化为Fe3+以便调节pH将铁元素杂质除去,反应离子方程式为2H++ClO-+2Fe2+=2Fe3++Cl-+H2O,参加反应的氧化剂与还原剂的物质的量之比为1:2,故答案为1:2;
③加入NaOH溶液调节pH的目的是,通常控制pH在9.0左右,其目的是将溶液中的杂质Fe3+尽可能多地除去,同时避免Mg2+形成沉淀,故答案为将溶液中的杂质Fe3+尽可能多地除去,同时避免Mg2+形成沉淀;
④热解时,反应是Mg2+和HCO3-反应生成轻质碳酸镁和二氧化碳,所以离子反应方程式为:2Mg2++4HCO3-+2H2OMgCO3·Mg(OH)2·3H2O↓+3CO2↑,故答案为2Mg2++4HCO3-+2H2OMgCO3·Mg(OH)2·3H2O↓+3CO2↑
⑤操作I、Ⅱ均是将固体与液体分离,但操作I过滤后产品在滤液中,所以对固体是舍弃的,在操作Ⅱ过滤后所得固体为产品,所以要保留,还必须对产品进行洗涤、干燥,故答案为操作Ⅱ过滤后所得固体为产品,还必须对产品进行洗涤、干燥。
22. 1∶2∶3 6∶3∶2 Na>Al=Mg
【分析】
发生反应:2Na+2HCl=2NaCl+H2↑、Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,根据方程式计算解答。
【详解】
(1)2Na+2HCl=2NaCl+H2↑、
46g 1mol
Wg mol
Mg+2HCl=MgCl2+H2↑ 、
24g 1mol
Wg mol
2Al+6HCl=2AlCl3+3H2↑,
54g 3mol
Wg mol
故在相同条件下产生氢气的体积比= mol :mol: mol=,
因此,本题正确答案是:。
(2)分别取0.1mol钠、镁、铝与足量盐酸反应,则:
2Na+2HCl=2NaCl+H2↑
0.1mol 0.05mol
Mg+2HCl=MgCl2+H2↑
0.1mol 0.1mol
2Al+6HCl=2AlCl3+3H2↑
0.1mol 0.15mol
故在相同条件下产生氢气的体积比=0.05mol:0.1mol:0.15mol=1:2:3,
因此,本题正确答案是:1:2:3。
(3)若产生相同体积(同温同压下)的H2,说明三种金属提供电子的物质的量相同,设三种金属都失去6mol的电子,需钠的物质的量为6mol,镁的物质的量为3mol,铝的物质的量为2mol,所以所需的钠、镁、铝物质的量比为6:3:2。
因此,本题正确答案是:6:3:2。
(4)若将0.2 mol钠、镁、铝分别投入10 mL 1 mol·L-1的盐酸中,可以知道三种金属都过量,但金属钠活泼,能与水反应生成氢气,则生成氢气最多的是钠,镁和铝生成氢气的体积一样多,
因此,本题正确答案是:Na>Al=Mg。
同课章节目录
