1.3.2氧化性、还原性课件(共42张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.2氧化性、还原性课件(共42张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 11.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-07 09:46:16 | ||
图片预览










文档简介
(共42张PPT)
复习提问
1、怎么判断一个变化是不是氧化还原?
2、怎么判断氧化剂、还原剂?
3、怎么判断氧化产物、还原产物?
化合价有变化
化合价升高的为还原剂,降低的为氧化剂
还原剂得氧化产物,氧化剂得还原产物
背记口诀:升 失 氧化 还原剂,
降 得 还原 氧化剂
电子的转移
化合价有升降
氧化还原的本质:
氧化还原的判断依据:
概念的判断
指出下列反应的氧化剂、还原剂、氧化产物、还原产物。
MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑
△
氧化剂
还原剂
还原
产物
氧化
产物
还原剂
氧化剂
氧化产物
还原产物
2H2S + SO2 == 2H2O + 3S ↓
深度思考
LOGO
2KMnO4 = K2MnO4 + MnO2 + O2↑
指出氧化剂、还原剂、氧化产物、还原产物。
氧化剂
还原剂
还原产物
还原产物
氧化产物
1.下列反应中,属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
A.SO3+H2O=H2SO4 B.3NO2+H2O=2HNO3+NO
C.2F2+2H2O=4HF+O2 D.2Na+2H2O=2NaOH+H2↑
随堂演练 知识落实
B
第一章 物质及其变化
第三节 氧化还原反应
第二课时
双线桥、单线桥
氧化性、还原性
学习目标
2
1
本节重点
本节难点
双线桥、单线桥
氧化性、还原性的比较
双线桥表示电子转移
Fe2O3
2
+
+
+3
+2
+4
0
3
CO
3
CO2
得
Fe
2
3 e-
失 2 e-
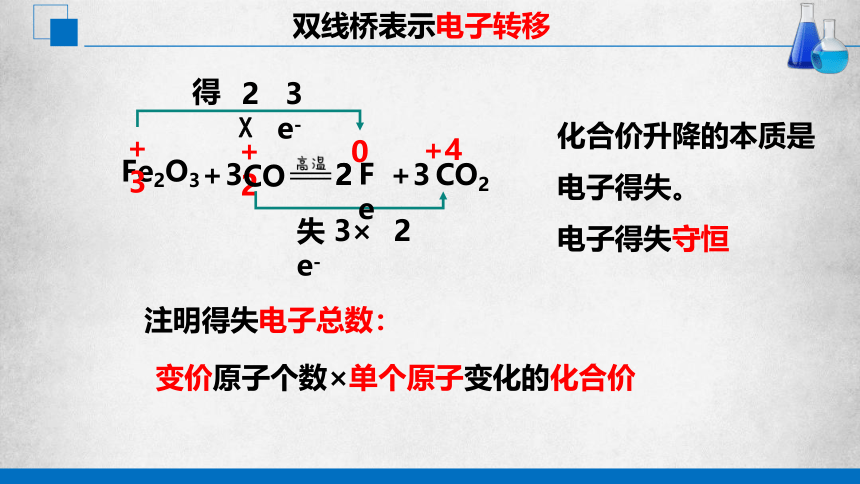
注明得失电子总数:
变价原子个数×单个原子变化的化合价
2 X
3×
化合价升降的本质是电子得失。
电子得失守恒
课堂练习
用“双线桥”法表示下列氧化还原反应的电子转移。
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
16个HCl中,作还原剂的HCl有几个?
产生5Cl2,电子转移多少?
单线桥表示电子转移
Fe2O3
2
+
+
+3
+2
+4
0
3
CO
3
CO2
Fe
6e-
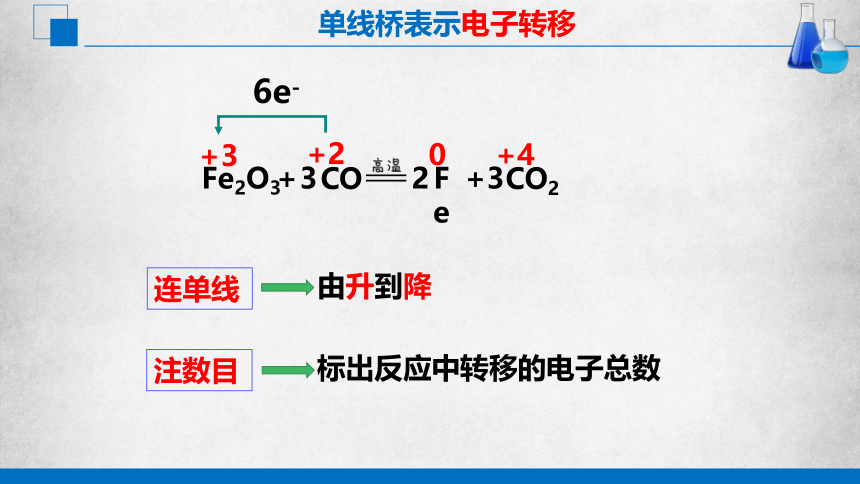
连单线
由升到降
注数目
标出反应中转移的电子总数
课堂练习
Cl2 + 2NaBr = 2NaCl + Br2
用“单线桥”法表示下列氧化还原反应的电子转移。
复习提问
1、怎么判断氧化剂、还原剂的个数?
2、怎么判断谁得电子、谁失电子?
3、怎么计算得失电子数?
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
变价原子个数 X 化合价变化
化合价升高的失电子,降低的得电子
变价个数
复习巩固
Cl2 + 2NaBr = 2NaCl + Br2
用“单线桥”法表示下列氧化还原反应的电子转移。
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
用“双线桥”法表示下列氧化还原反应的电子转移。
抗氧化成分哪家强?
(1) 氧化剂具有氧化性:
氧化性指物质 的能力。
氧化性、还原性的概念
得电子
失电子
越容易得电子,氧化性越强
越容易失电子,还原性越强
(2) 还原剂具有还原性:
还原性指物质 的能力。
提醒:
具有氧化性的物质和
具有还原性的物质不能共存!
1、根据反应方程式比较强弱
氧化性:氧化剂 氧化产物
还原性:还原剂 还原产物
>
>
氧化性、还原性强弱比较
氧化剂 + 还原剂 = 还原产物 + 氧化产物
Cl2 + 2NaBr = 2NaCl + Br2
氧化性:
还原性:
1.常温下,发生下列反应:
①16H++10Cl-+2MnO4-=2Mn2++5Cl2↑+8H2O;
②2Fe2++Br2=2Fe3++2Br-;
③2Br-+Cl2=Br2+2Cl-,
根据上述反应,可得知相关微粒氧化性由强到弱的顺序是 。
深度思考
MnO4- > Cl2 > Br2 > Fe3+
深度思考
2.(2019·石家庄期中)已知X2、Y2、Z2、W2四种物质的氧化性由强到弱的顺序为W2>Z2>X2>Y2,下列氧化还原反应能发生的是( )
A. 2NaW+Z2 = 2NaZ+W2
B. 2NaX+Z2 = 2NaZ+X2
C. 2NaW+Y2 = 2NaY+W2
D. 2NaZ+X2 = 2NaX+Z2
B
3.已知下列反应:
① Cl2 + 2NaBr = 2NaCl + Br2
② 2KI + Br2 = 2KBr + I2
③ Na2S + I2 = 2NaI + S↓
(1) Cl-、Br-、I-、S2-等离子的还原性由强到弱的顺序是 。
S2->I->Br->Cl-
(2)Cl2、Br2、I2、S等物质的氧化性由强到弱的顺序是________。
Cl2>Br2>I2>S
(3)判断Cl2与Na2S能否反应?_____(填“能”或“否”)。
能
(4)判断I2与NaBr能否共存?_____(填“能”或“否”)。
能
4.已知常温下,在溶液中可发生如下反应:
Ce4++Fe2+=Fe3++Ce3+,Sn2++2Fe3+=2Fe2++Sn4+。
由此推断Fe2+、Ce3+、Sn2+的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+ B.Fe2+、Ce3+、Sn2+
C.Fe2+、Sn2+、Ce3+ D.Ce3+、Fe2+、Sn2+
A
5.现有下列几个离子反应:
① +14H++6Cl- = 2Cr3++3Cl2↑+7H2O
②2Fe2++Br2 = 2Fe3++2Br-
③2Fe3++SO2+2H2O = 2Fe2++
下列有关性质的比较正确的是( )
A.氧化性:
B.氧化性:
C.还原性:SO2D.还原性:Cl->Cr3+>Fe2+
A
2、根据反应的难易(反应条件)比较下列物质的氧化性强弱
>
氧化性、还原性强弱比较
① 2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
② MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
可判断氧化性:KMnO4____MnO2
氧化性、还原性强弱比较
>
3、根据被氧化或被还原的程度比较下列物质的氧化性强弱
① 2Fe+3Cl2 2FeCl3
② Fe+S FeS
可判断氧化性:氯气 硫
Mg Mg2+
失电子
失电子
还原性
得电子
氧化性
得电子
得失电子与氧化、还原的辩证关系
还原性强
活动性强
容易失电子
活动性弱
不容易失电子
还原性弱
4、根据活动性顺序比较强弱
还原性强
氧化性强
越容易失电子,它的离子就越难得电子。
氧化性、还原性强弱比较
提醒:
氧化性、还原性的强弱与得失电子数无关,
与难易程度有关。
失电子
得电子
容易得电子
容易
不容易
根据活动性顺序比较强弱
氧化性逐渐减弱
得电子能力减弱
还原性逐渐增强
失电子能力增强
越容易得电子,相应的离子就越难失电子
氧化性、还原性强弱比较
谁强,谁优先反应
反应先后
思考:把氯气通入FeBr2溶液时, 氯气量少时反应如何写?氯气量多时反应如何写?
常见氧化性强弱顺序:MnO4->Cl2>Br2>Fe3+>I2
常见还原性强弱顺序:S2->SO32->I->Fe2+>Br->Cl-
强强联合
已知:Cl2 + 2Fe2+=2Fe3++2Cl- Cl2 + 2Br-=Br2+2Cl-
已知三个氧化还原反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2 ②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中Cl-、Fe2+和I-共存,要想除去I-而又不影响Fe2+和Cl-,可加入的试剂是( )
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
C
解析:氧化性:MnO42- >Cl2>Fe3+>I2;
还原性:I->Fe2+>Cl->Mn2+。
反应先后 深度思考
2.(2019·西安高一调研)某种飞船以N2H4和N2O4为动力源,发生反应:2N2H4+N2O4=3N2+4H2O,反应温度可高达2700℃,对于该反应,下列说法中正确的是
A.该反应属于置换反应 B.N2H4是氧化剂
C.N2O4是还原剂 D.N2既是氧化产物又是还原产物
√
3.氢化钙可作为生氢剂,反应的化学方程式为
CaH2+2H2O=Ca(OH)2+2H2↑。
下列说法错误的是( )
A.氢化钙既是氧化剂又是还原剂
B.氢气既是氧化产物又是还原产物
C.氢化钙是还原剂,水是氧化剂
D.氧化产物与还原产物的质量比为1∶1
背记口诀:升失氧化 还原剂,
降得还原 氧化剂
还原剂:
化合价升高,具有还原性,被氧化,发生氧化反应,
产生氧化产物。
氧化剂:
化合价降低,具有氧化性,被还原,发生还原反应,
产生还原产物。
电子的转移
化合价的升降
氧化还原的本质:
氧化还原的判断依据:
1.氧化性、还原性的概念
(1)氧化性:物质___电子的性质(能力)。
(2)还原性:物质___电子的性质(能力)。
2.物质的氧化性及还原性与核心元素化合价的关系
二、氧化性、还原性强弱比较
核心元素化合价 实例 性质
最高价 只有______
中间价 既有______
又有______
最低价 只有______
得
失
氧化性
氧化性
还原性
还原性
课堂达标
1、下列说法正确的是( )
A.氧化还原反应中一定有氧元素参加
B.得电子的物质是氧化剂,失电子的物质是还原剂
C.在一个氧化还原反应中,有一种元素被氧化,必有另一种元素被还原
D.某元素从游离态变为化合态,该元素一定被氧化
B
2:下列反应中,氯元素被氧化的是( )
2KClO3===MnO2+2KCl+3O2↑
2P+5Cl2===2PCl5
MnO2+4HCl(浓)===MnCl2+2H2O+Cl2↑
H2+Cl2===2HCl
Δ
点燃
Δ
光照
D
3.下列变化过程中,属于氧化反应的是 ( )
A.MnO2―→Mn2+ B.CuO―→CuCl2
C.Ag+―→Ag2O D.Sn2+―→Sn4+
D
4:下列化学反应中电子转移的表示方法正确的是 ( )
B
Cu + 2H2SO4(浓) CuSO4 + SO2 ↑ + 2H2O
5、用化合价升降的观点判断下面反应,是不是氧化还原反应
0
+6
+4
+2
在反应中,
元素化合价升高, 电子,被 (填“氧化”或“还原”),
发生 (填“氧化”或“还原”)反应;
元素化合价降低, 电子,被 (填“氧化”或“还原”),
发生 (填“氧化”或“还原”)反应。
氧化剂 _____还原剂______氧化产物________还原产物_______
Cu
失
氧化
氧化
S
还原
还原
得
Cu
H2SO4
CuSO4
SO2
6、根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题。
(1)氧化剂________, 还原剂___________;
(2)氧化产物______, 还原产物___________;
(3)用单线桥的方法表示
该反应的电子转移情况。
(4)用双线桥的方法
表示该反应的电子转移情况。
(5)当有8个NH3分子参加反时,转移的电子个数为_____。
Cl2 NH3
N2 NH4Cl
6
复习提问
1、怎么判断一个变化是不是氧化还原?
2、怎么判断氧化剂、还原剂?
3、怎么判断氧化产物、还原产物?
化合价有变化
化合价升高的为还原剂,降低的为氧化剂
还原剂得氧化产物,氧化剂得还原产物
背记口诀:升 失 氧化 还原剂,
降 得 还原 氧化剂
电子的转移
化合价有升降
氧化还原的本质:
氧化还原的判断依据:
概念的判断
指出下列反应的氧化剂、还原剂、氧化产物、还原产物。
MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑
△
氧化剂
还原剂
还原
产物
氧化
产物
还原剂
氧化剂
氧化产物
还原产物
2H2S + SO2 == 2H2O + 3S ↓
深度思考
LOGO
2KMnO4 = K2MnO4 + MnO2 + O2↑
指出氧化剂、还原剂、氧化产物、还原产物。
氧化剂
还原剂
还原产物
还原产物
氧化产物
1.下列反应中,属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
A.SO3+H2O=H2SO4 B.3NO2+H2O=2HNO3+NO
C.2F2+2H2O=4HF+O2 D.2Na+2H2O=2NaOH+H2↑
随堂演练 知识落实
B
第一章 物质及其变化
第三节 氧化还原反应
第二课时
双线桥、单线桥
氧化性、还原性
学习目标
2
1
本节重点
本节难点
双线桥、单线桥
氧化性、还原性的比较
双线桥表示电子转移
Fe2O3
2
+
+
+3
+2
+4
0
3
CO
3
CO2
得
Fe
2
3 e-
失 2 e-
注明得失电子总数:
变价原子个数×单个原子变化的化合价
2 X
3×
化合价升降的本质是电子得失。
电子得失守恒
课堂练习
用“双线桥”法表示下列氧化还原反应的电子转移。
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
16个HCl中,作还原剂的HCl有几个?
产生5Cl2,电子转移多少?
单线桥表示电子转移
Fe2O3
2
+
+
+3
+2
+4
0
3
CO
3
CO2
Fe
6e-
连单线
由升到降
注数目
标出反应中转移的电子总数
课堂练习
Cl2 + 2NaBr = 2NaCl + Br2
用“单线桥”法表示下列氧化还原反应的电子转移。
复习提问
1、怎么判断氧化剂、还原剂的个数?
2、怎么判断谁得电子、谁失电子?
3、怎么计算得失电子数?
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
变价原子个数 X 化合价变化
化合价升高的失电子,降低的得电子
变价个数
复习巩固
Cl2 + 2NaBr = 2NaCl + Br2
用“单线桥”法表示下列氧化还原反应的电子转移。
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
用“双线桥”法表示下列氧化还原反应的电子转移。
抗氧化成分哪家强?
(1) 氧化剂具有氧化性:
氧化性指物质 的能力。
氧化性、还原性的概念
得电子
失电子
越容易得电子,氧化性越强
越容易失电子,还原性越强
(2) 还原剂具有还原性:
还原性指物质 的能力。
提醒:
具有氧化性的物质和
具有还原性的物质不能共存!
1、根据反应方程式比较强弱
氧化性:氧化剂 氧化产物
还原性:还原剂 还原产物
>
>
氧化性、还原性强弱比较
氧化剂 + 还原剂 = 还原产物 + 氧化产物
Cl2 + 2NaBr = 2NaCl + Br2
氧化性:
还原性:
1.常温下,发生下列反应:
①16H++10Cl-+2MnO4-=2Mn2++5Cl2↑+8H2O;
②2Fe2++Br2=2Fe3++2Br-;
③2Br-+Cl2=Br2+2Cl-,
根据上述反应,可得知相关微粒氧化性由强到弱的顺序是 。
深度思考
MnO4- > Cl2 > Br2 > Fe3+
深度思考
2.(2019·石家庄期中)已知X2、Y2、Z2、W2四种物质的氧化性由强到弱的顺序为W2>Z2>X2>Y2,下列氧化还原反应能发生的是( )
A. 2NaW+Z2 = 2NaZ+W2
B. 2NaX+Z2 = 2NaZ+X2
C. 2NaW+Y2 = 2NaY+W2
D. 2NaZ+X2 = 2NaX+Z2
B
3.已知下列反应:
① Cl2 + 2NaBr = 2NaCl + Br2
② 2KI + Br2 = 2KBr + I2
③ Na2S + I2 = 2NaI + S↓
(1) Cl-、Br-、I-、S2-等离子的还原性由强到弱的顺序是 。
S2->I->Br->Cl-
(2)Cl2、Br2、I2、S等物质的氧化性由强到弱的顺序是________。
Cl2>Br2>I2>S
(3)判断Cl2与Na2S能否反应?_____(填“能”或“否”)。
能
(4)判断I2与NaBr能否共存?_____(填“能”或“否”)。
能
4.已知常温下,在溶液中可发生如下反应:
Ce4++Fe2+=Fe3++Ce3+,Sn2++2Fe3+=2Fe2++Sn4+。
由此推断Fe2+、Ce3+、Sn2+的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+ B.Fe2+、Ce3+、Sn2+
C.Fe2+、Sn2+、Ce3+ D.Ce3+、Fe2+、Sn2+
A
5.现有下列几个离子反应:
① +14H++6Cl- = 2Cr3++3Cl2↑+7H2O
②2Fe2++Br2 = 2Fe3++2Br-
③2Fe3++SO2+2H2O = 2Fe2++
下列有关性质的比较正确的是( )
A.氧化性:
B.氧化性:
C.还原性:SO2
A
2、根据反应的难易(反应条件)比较下列物质的氧化性强弱
>
氧化性、还原性强弱比较
① 2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
② MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
可判断氧化性:KMnO4____MnO2
氧化性、还原性强弱比较
>
3、根据被氧化或被还原的程度比较下列物质的氧化性强弱
① 2Fe+3Cl2 2FeCl3
② Fe+S FeS
可判断氧化性:氯气 硫
Mg Mg2+
失电子
失电子
还原性
得电子
氧化性
得电子
得失电子与氧化、还原的辩证关系
还原性强
活动性强
容易失电子
活动性弱
不容易失电子
还原性弱
4、根据活动性顺序比较强弱
还原性强
氧化性强
越容易失电子,它的离子就越难得电子。
氧化性、还原性强弱比较
提醒:
氧化性、还原性的强弱与得失电子数无关,
与难易程度有关。
失电子
得电子
容易得电子
容易
不容易
根据活动性顺序比较强弱
氧化性逐渐减弱
得电子能力减弱
还原性逐渐增强
失电子能力增强
越容易得电子,相应的离子就越难失电子
氧化性、还原性强弱比较
谁强,谁优先反应
反应先后
思考:把氯气通入FeBr2溶液时, 氯气量少时反应如何写?氯气量多时反应如何写?
常见氧化性强弱顺序:MnO4->Cl2>Br2>Fe3+>I2
常见还原性强弱顺序:S2->SO32->I->Fe2+>Br->Cl-
强强联合
已知:Cl2 + 2Fe2+=2Fe3++2Cl- Cl2 + 2Br-=Br2+2Cl-
已知三个氧化还原反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2 ②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中Cl-、Fe2+和I-共存,要想除去I-而又不影响Fe2+和Cl-,可加入的试剂是( )
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
C
解析:氧化性:MnO42- >Cl2>Fe3+>I2;
还原性:I->Fe2+>Cl->Mn2+。
反应先后 深度思考
2.(2019·西安高一调研)某种飞船以N2H4和N2O4为动力源,发生反应:2N2H4+N2O4=3N2+4H2O,反应温度可高达2700℃,对于该反应,下列说法中正确的是
A.该反应属于置换反应 B.N2H4是氧化剂
C.N2O4是还原剂 D.N2既是氧化产物又是还原产物
√
3.氢化钙可作为生氢剂,反应的化学方程式为
CaH2+2H2O=Ca(OH)2+2H2↑。
下列说法错误的是( )
A.氢化钙既是氧化剂又是还原剂
B.氢气既是氧化产物又是还原产物
C.氢化钙是还原剂,水是氧化剂
D.氧化产物与还原产物的质量比为1∶1
背记口诀:升失氧化 还原剂,
降得还原 氧化剂
还原剂:
化合价升高,具有还原性,被氧化,发生氧化反应,
产生氧化产物。
氧化剂:
化合价降低,具有氧化性,被还原,发生还原反应,
产生还原产物。
电子的转移
化合价的升降
氧化还原的本质:
氧化还原的判断依据:
1.氧化性、还原性的概念
(1)氧化性:物质___电子的性质(能力)。
(2)还原性:物质___电子的性质(能力)。
2.物质的氧化性及还原性与核心元素化合价的关系
二、氧化性、还原性强弱比较
核心元素化合价 实例 性质
最高价 只有______
中间价 既有______
又有______
最低价 只有______
得
失
氧化性
氧化性
还原性
还原性
课堂达标
1、下列说法正确的是( )
A.氧化还原反应中一定有氧元素参加
B.得电子的物质是氧化剂,失电子的物质是还原剂
C.在一个氧化还原反应中,有一种元素被氧化,必有另一种元素被还原
D.某元素从游离态变为化合态,该元素一定被氧化
B
2:下列反应中,氯元素被氧化的是( )
2KClO3===MnO2+2KCl+3O2↑
2P+5Cl2===2PCl5
MnO2+4HCl(浓)===MnCl2+2H2O+Cl2↑
H2+Cl2===2HCl
Δ
点燃
Δ
光照
D
3.下列变化过程中,属于氧化反应的是 ( )
A.MnO2―→Mn2+ B.CuO―→CuCl2
C.Ag+―→Ag2O D.Sn2+―→Sn4+
D
4:下列化学反应中电子转移的表示方法正确的是 ( )
B
Cu + 2H2SO4(浓) CuSO4 + SO2 ↑ + 2H2O
5、用化合价升降的观点判断下面反应,是不是氧化还原反应
0
+6
+4
+2
在反应中,
元素化合价升高, 电子,被 (填“氧化”或“还原”),
发生 (填“氧化”或“还原”)反应;
元素化合价降低, 电子,被 (填“氧化”或“还原”),
发生 (填“氧化”或“还原”)反应。
氧化剂 _____还原剂______氧化产物________还原产物_______
Cu
失
氧化
氧化
S
还原
还原
得
Cu
H2SO4
CuSO4
SO2
6、根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题。
(1)氧化剂________, 还原剂___________;
(2)氧化产物______, 还原产物___________;
(3)用单线桥的方法表示
该反应的电子转移情况。
(4)用双线桥的方法
表示该反应的电子转移情况。
(5)当有8个NH3分子参加反时,转移的电子个数为_____。
Cl2 NH3
N2 NH4Cl
6
