1.3.1氧化还原反应课件(共19张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.1氧化还原反应课件(共19张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 22.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-07 09:46:59 | ||
图片预览





文档简介
(共19张PPT)
第一章 物质及其变化
第三节 氧化还原反应
第一课时
氧化还原反应
为什么苹果削皮后颜色很快会变暗
生产、生活中的氧化还原反应
生产、生活中的氧化还原反应
学习目标
2
1
本节重点
本节难点
三个角度认识氧化还原反应
氧化还原反应中概念的掌握
1、根据法国化学家拉瓦锡的燃烧的氧化学说
氧化还原反应的概念的发展
失去氧,被还原,还原反应
得到氧,被氧化,氧化反应
Fe2O3 + 3CO 2Fe + 3CO2
从得失氧的角度认识氧化还原反应
失去氧元素,变成 。
Fe2O3
Fe2O3失去氧,被 ,
发生 反应。
得到氧元素,变成 。
CO得到氧,被 ,
发生 反应。
CO
Fe
还原
还原
CO2
氧化
氧化
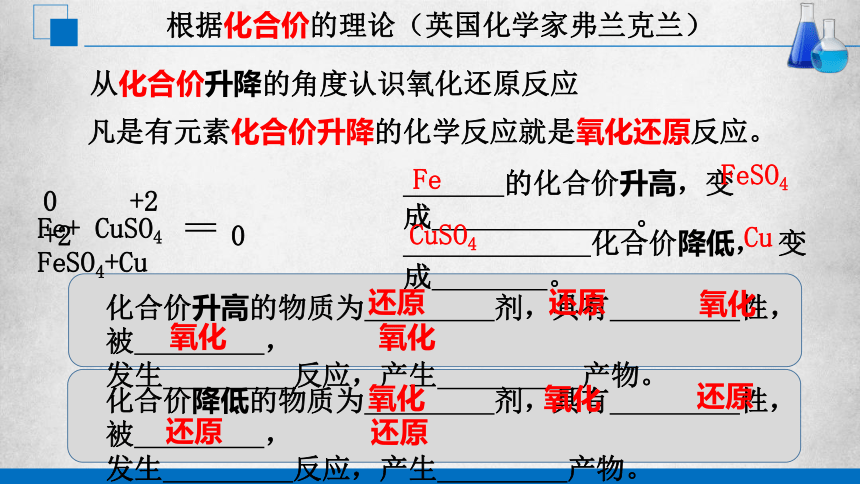
氧化还原反应
的化合价升高,变成 。
化合价降低, 变成 。
凡是有元素化合价升降的化学反应就是氧化还原反应。
根据化合价的理论(英国化学家弗兰克兰)
从化合价升降的角度认识氧化还原反应
Fe+ CuSO4 FeSO4+Cu
0 +2 +2 0
化合价升高的物质为 剂,具有 性,被 ,
发生 反应,产生 产物。
Fe
FeSO4
CuSO4
Cu
化合价降低的物质为 剂,具有 性,被 ,
发生 反应,产生 产物。
还原
还原
氧化
氧化
氧化
氧化
氧化
还原
还原
还原
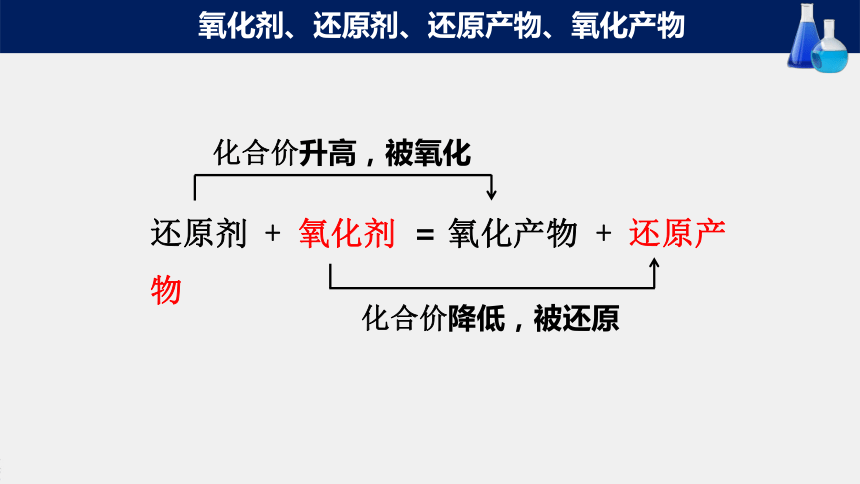
氧化剂、还原剂、还原产物、氧化产物
还原剂 + 氧化剂 = 氧化产物 + 还原产物
化合价升高,被氧化
化合价降低,被还原
根据化合价的理论(英国化学家弗兰克兰)
Fe+ CuSO4 FeSO4+Cu
0 +2 +2 0
Fe的化合价升高,Fe为还原剂,被氧化,发生氧化反应,FeSO4为氧化产物
CuSO4的化合价降低, CuSO4为氧化剂,被还原,发生还原反应,Cu为还原产物。
思考:化合价升降的本质是什么?
电子的得失或偏移
NaCl的形成过程
Na Na+
Cl Cl-
根据英国物理学家汤姆孙的电子理论
Na Cl
+11
2
+17
8
1
2
8
7
8
Na+ Cl-
NaCl
氧化还原的本质就是
电子的得失
失去电子
得到电子
HCl的形成过程
+1
+17
Cl
H
共用电子对
偏向
偏离
根据英国物理学家汤姆孙的电子理论
氧化还原的本质就是
电子对的偏移
有电子的转移(包括得失、偏移)
有化合价的升降
小结:氧化还原反应
氧化还原的本质:
氧化还原的判断依据:
化合价变化、电子得失、反应、剂四者关系如下
背记口诀:升 失 氧化 还原剂, 降 得 还原 氧化剂
概念的判断
指出下列反应的氧化剂、还原剂、氧化产物、还原产物。
MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑
2H2S + SO2 == 3S ↓ + 2H2O
△
氧化剂
还原剂
还原
产物
氧化
产物
还原剂
氧化剂
氧化产物
还原产物
氧化还原反应与四种基本反应类型之间的关系
归纳总结
p 24 图1-14
分析下列反应并按要求填空。
(1) 2Fe+3Cl2 2FeCl3
氧化剂是_____,还原剂是____;
发生还原反应的是_____,发生氧化反应的是____。
(2) 2KMnO4 K2MnO4+MnO2+O2↑
氧化剂是________,还原剂是________;
被氧化的元素是____,被还原的元素是_____。
Cl2
Fe
Fe
Cl2
KMnO4
KMnO4
O
Mn
应用体验
(3) 2H2S+SO2=3S↓+2H2O
氧化剂是_____,还原剂是_____;
氧化产物是____,还原产物是_____。
(4) H2O2+2H++2Fe2+=2Fe3++2H2O
氧化剂是_____,还原剂是_____;
氧化产物是_____,还原产物是____。
(5)5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O
氧化剂是_______,还原剂是______;
氧化产物是____,还原产物是_______。
SO2
H2S
S
S
H2O2
Fe2+
Fe3+
H2O
KMnO4
H2O2
O2
MnSO4
背记口诀:升失氧化 还原剂,
降得还原 氧化剂
还原剂:
化合价升高,具有还原性,被氧化,发生氧化反应,
产生氧化产物。
氧化剂:
化合价降低,具有氧化性,被还原,发生还原反应,
产生还原产物。
电子的转移
化合价的升降
氧化还原的本质:
氧化还原的判断依据:
第一章 物质及其变化
第三节 氧化还原反应
第一课时
氧化还原反应
为什么苹果削皮后颜色很快会变暗
生产、生活中的氧化还原反应
生产、生活中的氧化还原反应
学习目标
2
1
本节重点
本节难点
三个角度认识氧化还原反应
氧化还原反应中概念的掌握
1、根据法国化学家拉瓦锡的燃烧的氧化学说
氧化还原反应的概念的发展
失去氧,被还原,还原反应
得到氧,被氧化,氧化反应
Fe2O3 + 3CO 2Fe + 3CO2
从得失氧的角度认识氧化还原反应
失去氧元素,变成 。
Fe2O3
Fe2O3失去氧,被 ,
发生 反应。
得到氧元素,变成 。
CO得到氧,被 ,
发生 反应。
CO
Fe
还原
还原
CO2
氧化
氧化
氧化还原反应
的化合价升高,变成 。
化合价降低, 变成 。
凡是有元素化合价升降的化学反应就是氧化还原反应。
根据化合价的理论(英国化学家弗兰克兰)
从化合价升降的角度认识氧化还原反应
Fe+ CuSO4 FeSO4+Cu
0 +2 +2 0
化合价升高的物质为 剂,具有 性,被 ,
发生 反应,产生 产物。
Fe
FeSO4
CuSO4
Cu
化合价降低的物质为 剂,具有 性,被 ,
发生 反应,产生 产物。
还原
还原
氧化
氧化
氧化
氧化
氧化
还原
还原
还原
氧化剂、还原剂、还原产物、氧化产物
还原剂 + 氧化剂 = 氧化产物 + 还原产物
化合价升高,被氧化
化合价降低,被还原
根据化合价的理论(英国化学家弗兰克兰)
Fe+ CuSO4 FeSO4+Cu
0 +2 +2 0
Fe的化合价升高,Fe为还原剂,被氧化,发生氧化反应,FeSO4为氧化产物
CuSO4的化合价降低, CuSO4为氧化剂,被还原,发生还原反应,Cu为还原产物。
思考:化合价升降的本质是什么?
电子的得失或偏移
NaCl的形成过程
Na Na+
Cl Cl-
根据英国物理学家汤姆孙的电子理论
Na Cl
+11
2
+17
8
1
2
8
7
8
Na+ Cl-
NaCl
氧化还原的本质就是
电子的得失
失去电子
得到电子
HCl的形成过程
+1
+17
Cl
H
共用电子对
偏向
偏离
根据英国物理学家汤姆孙的电子理论
氧化还原的本质就是
电子对的偏移
有电子的转移(包括得失、偏移)
有化合价的升降
小结:氧化还原反应
氧化还原的本质:
氧化还原的判断依据:
化合价变化、电子得失、反应、剂四者关系如下
背记口诀:升 失 氧化 还原剂, 降 得 还原 氧化剂
概念的判断
指出下列反应的氧化剂、还原剂、氧化产物、还原产物。
MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑
2H2S + SO2 == 3S ↓ + 2H2O
△
氧化剂
还原剂
还原
产物
氧化
产物
还原剂
氧化剂
氧化产物
还原产物
氧化还原反应与四种基本反应类型之间的关系
归纳总结
p 24 图1-14
分析下列反应并按要求填空。
(1) 2Fe+3Cl2 2FeCl3
氧化剂是_____,还原剂是____;
发生还原反应的是_____,发生氧化反应的是____。
(2) 2KMnO4 K2MnO4+MnO2+O2↑
氧化剂是________,还原剂是________;
被氧化的元素是____,被还原的元素是_____。
Cl2
Fe
Fe
Cl2
KMnO4
KMnO4
O
Mn
应用体验
(3) 2H2S+SO2=3S↓+2H2O
氧化剂是_____,还原剂是_____;
氧化产物是____,还原产物是_____。
(4) H2O2+2H++2Fe2+=2Fe3++2H2O
氧化剂是_____,还原剂是_____;
氧化产物是_____,还原产物是____。
(5)5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O
氧化剂是_______,还原剂是______;
氧化产物是____,还原产物是_______。
SO2
H2S
S
S
H2O2
Fe2+
Fe3+
H2O
KMnO4
H2O2
O2
MnSO4
背记口诀:升失氧化 还原剂,
降得还原 氧化剂
还原剂:
化合价升高,具有还原性,被氧化,发生氧化反应,
产生氧化产物。
氧化剂:
化合价降低,具有氧化性,被还原,发生还原反应,
产生还原产物。
电子的转移
化合价的升降
氧化还原的本质:
氧化还原的判断依据:
