化学人教版(2019)必修第一册2.1.1活泼的金属单质—鈉 课件(共18张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.1活泼的金属单质—鈉 课件(共18张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 43.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-07 00:00:00 | ||
图片预览





文档简介
(共18张PPT)
第2章 海水中的重要元素——钠和氯
第1节 钠及其化合物
第一课时
活泼的金属单质——钠
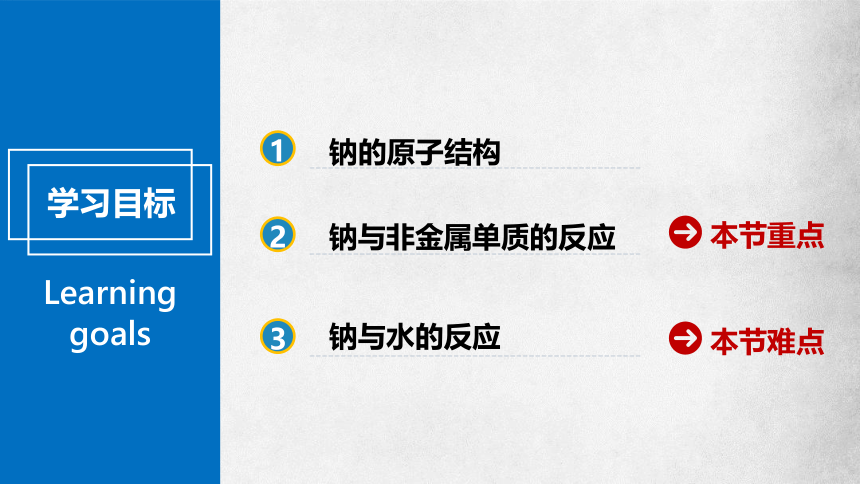
Learning goals
学习目标
3
2
本节重点
本节难点
钠与水的反应
钠的原子结构
钠与非金属单质的反应
1
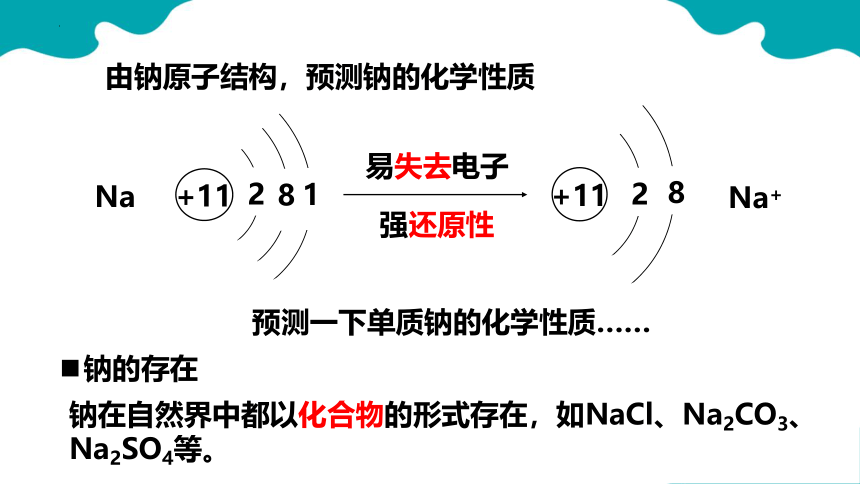
钠的存在
钠在自然界中都以化合物的形式存在,如NaCl、Na2CO3、Na2SO4等。
+11
2
1
8
+11
2
8
易失去电子
强还原性
Na
Na+
预测一下单质钠的化学性质……
由钠原子结构,预测钠的化学性质
探究一:认识钠
实验探究
关注问题:
1、保存在哪里?为什么要这么保存?
2、怎么切开的?说明什么?
3、切开以后是什么颜色?有什么变化?原因是什么?
钠常常保存在
石蜡油或煤油中
切割钠
实验探究
颜色
密度 硬度 传导性 熔点 银白色、有金属光泽
ρ(水)>ρ(钠)>ρ(煤油)
软,可用小刀切割
可导热、可导电
熔点低于100℃
钠的物理性质
1、常温时,Na与O2的反应
新切开的钠,光亮的表面很快变暗。
在实验室中,要把钠保存在石蜡油或煤油中,用以隔绝空气,防止与氧气反应被氧化。
钠的化学性质
(氧化钠,白色固体)
常温时:4Na+O2══2Na2O
2、加热条件下,钠与氧气的反应
钠的化学性质
关注问题:
1、直接烧起来的吗?
过程中经历了什么变化?
2、最后生成物颜色?
2、加热条件下,钠与氧气的反应
钠的化学性质
钠与氧气的反应
常温
加热
4Na+O2 ══ 2Na2O
2Na+O2 Na2O2
Δ
说明:条件不同,现象不同,产物不同。
钠与其他非金属单质的反应
2Na+S = Na2S (研磨爆炸)
2Na+Cl2 2NaCl
点燃
黄色火焰,白烟。
2Na+H2 2NaH
6Na+N2 2Na3N
点燃
钠与水的反应
实验探究
探究:在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一块绿豆大的钠放入水中。
钠与水的反应
钠与水的反应
现象 结论
1.钠 在水面上。 1.钠的密度比水 。
2.钠熔化成 。 2.钠熔点较 ,且反应 。
3.小球在水面上迅速 , 逐渐变小,最后 。 3.反应产生的 推动小球运动。
4.与水反应发出 响声。 4.钠与水反应生成气体。
5.反应后溶液的颜色逐渐变 。 5.有 生成。
浮
小
明亮的小球
嘶嘶
放热
游动
消失
红
NaOH
浮
响
熔
游
红
低
气体
单质钠与水反应生成的气体是什么物质?
你会从化合价升降的角度进行分析吗?
思考交流
Na + H2O NaOH +
Na与H2O反应的实质:单质钠与水电离出的H+反应,产生H2。
反应方程式: 2Na+2H2O ═ 2NaOH+H2↑
深度思考
试分析甲、乙、丙中发生的化学反应
总结规律
“先酸后水”
Na与酸溶液反应:
“先水后盐”
Na与盐溶液反应:
提醒:金属钠不能从盐溶液中置换出金属
第2章 海水中的重要元素——钠和氯
第1节 钠及其化合物
第一课时
活泼的金属单质——钠
Learning goals
学习目标
3
2
本节重点
本节难点
钠与水的反应
钠的原子结构
钠与非金属单质的反应
1
钠的存在
钠在自然界中都以化合物的形式存在,如NaCl、Na2CO3、Na2SO4等。
+11
2
1
8
+11
2
8
易失去电子
强还原性
Na
Na+
预测一下单质钠的化学性质……
由钠原子结构,预测钠的化学性质
探究一:认识钠
实验探究
关注问题:
1、保存在哪里?为什么要这么保存?
2、怎么切开的?说明什么?
3、切开以后是什么颜色?有什么变化?原因是什么?
钠常常保存在
石蜡油或煤油中
切割钠
实验探究
颜色
密度 硬度 传导性 熔点 银白色、有金属光泽
ρ(水)>ρ(钠)>ρ(煤油)
软,可用小刀切割
可导热、可导电
熔点低于100℃
钠的物理性质
1、常温时,Na与O2的反应
新切开的钠,光亮的表面很快变暗。
在实验室中,要把钠保存在石蜡油或煤油中,用以隔绝空气,防止与氧气反应被氧化。
钠的化学性质
(氧化钠,白色固体)
常温时:4Na+O2══2Na2O
2、加热条件下,钠与氧气的反应
钠的化学性质
关注问题:
1、直接烧起来的吗?
过程中经历了什么变化?
2、最后生成物颜色?
2、加热条件下,钠与氧气的反应
钠的化学性质
钠与氧气的反应
常温
加热
4Na+O2 ══ 2Na2O
2Na+O2 Na2O2
Δ
说明:条件不同,现象不同,产物不同。
钠与其他非金属单质的反应
2Na+S = Na2S (研磨爆炸)
2Na+Cl2 2NaCl
点燃
黄色火焰,白烟。
2Na+H2 2NaH
6Na+N2 2Na3N
点燃
钠与水的反应
实验探究
探究:在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一块绿豆大的钠放入水中。
钠与水的反应
钠与水的反应
现象 结论
1.钠 在水面上。 1.钠的密度比水 。
2.钠熔化成 。 2.钠熔点较 ,且反应 。
3.小球在水面上迅速 , 逐渐变小,最后 。 3.反应产生的 推动小球运动。
4.与水反应发出 响声。 4.钠与水反应生成气体。
5.反应后溶液的颜色逐渐变 。 5.有 生成。
浮
小
明亮的小球
嘶嘶
放热
游动
消失
红
NaOH
浮
响
熔
游
红
低
气体
单质钠与水反应生成的气体是什么物质?
你会从化合价升降的角度进行分析吗?
思考交流
Na + H2O NaOH +
Na与H2O反应的实质:单质钠与水电离出的H+反应,产生H2。
反应方程式: 2Na+2H2O ═ 2NaOH+H2↑
深度思考
试分析甲、乙、丙中发生的化学反应
总结规律
“先酸后水”
Na与酸溶液反应:
“先水后盐”
Na与盐溶液反应:
提醒:金属钠不能从盐溶液中置换出金属
