2.1.2钠的几种化合物 焰色试验课件(共38张PPT)+2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.1.2钠的几种化合物 焰色试验课件(共38张PPT)+2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 31.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-07 09:49:29 | ||
图片预览









文档简介
(共38张PPT)
钠的拓展与应用准备:化学书、笔记本、导学案2.1.1和2.1.2作业:导学案2.1.1(P2-3的课后巩固)1、钠的物理性质:
2、钠与氧气反应:
3、钠与水反应:
4、钠的保存和取用:
5、钠的灭火:
银白色有金属光泽金属,密度小、质地软、熔点低。
2Na + 2H2O = 2NaOH + H2↑
现象:浮、熔、游、响、红。
用镊子夹取,剩余钠放回原瓶。
煤油或石蜡油中。
用干沙盖灭。
回顾:
4Na + O2 = 2Na2O(白色)
2Na + O2 Na2O2(淡黄色)
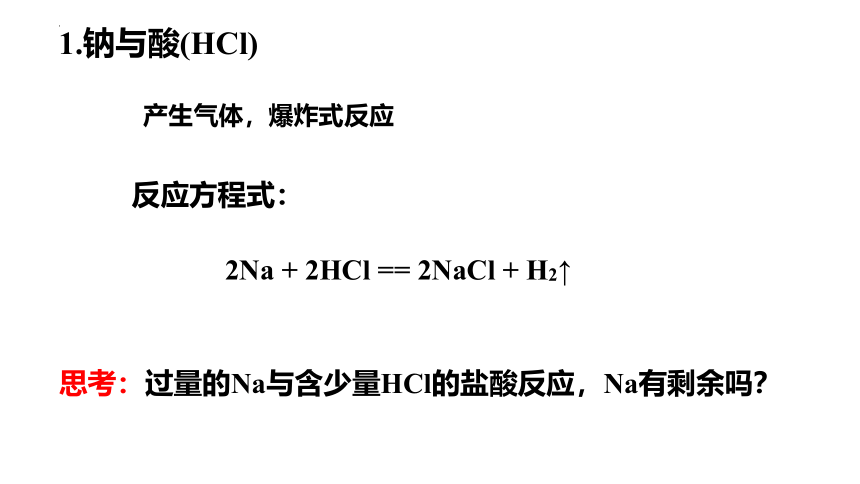
1.钠与酸(HCl)
产生气体,爆炸式反应
2Na + 2HCl == 2NaCl + H2↑
反应方程式:
思考:过量的Na与含少量HCl的盐酸反应,Na有剩余吗?
根据金属活动性顺序,Na可以置换几乎所有的金属,那么Na能否从CuSO4溶液中置换出Cu呢?
拓展学习
2.钠与盐
(1)与CuSO4溶液:
a.浮、熔、游、响
b.生成蓝色沉淀。
2Na + 2H2O == 2NaOH + H2↑
CuSO4 + 2NaOH == Cu(OH)2↓+ Na2SO4
反应方程式:
2.将一小块钠投入下列溶液时,既能产生气体又出现沉淀的是( )
A.稀H2SO4 B.氢氧化钠溶液
C.硫酸铜溶液 D.氯化钠溶液
C
当堂检测
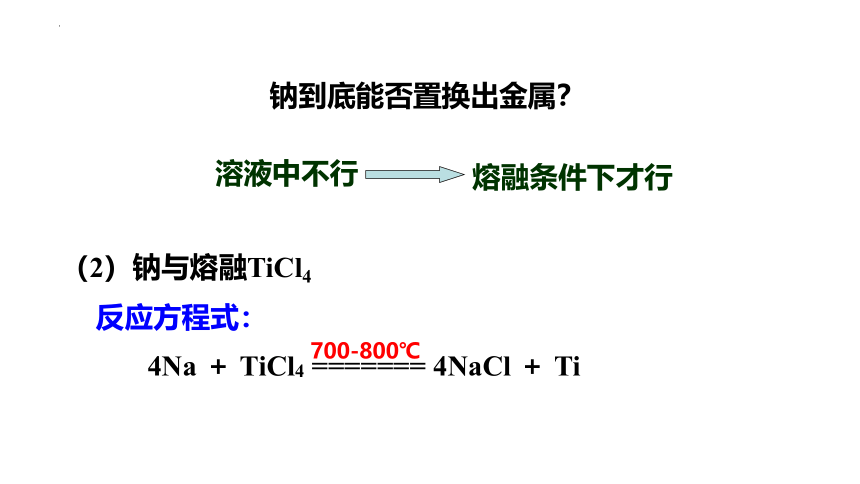
溶液中不行
熔融条件下才行
钠到底能否置换出金属?
(2)钠与熔融TiCl4
反应方程式:
4Na + TiCl4 ======= 4NaCl + Ti
700-800℃
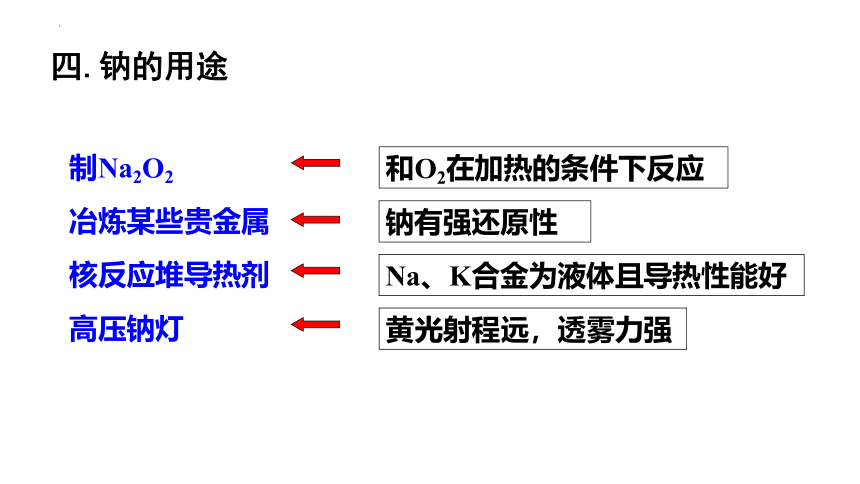
四.钠的用途
制Na2O2
核反应堆导热剂
冶炼某些贵金属
和O2在加热的条件下反应
Na、K合金为液体且导热性能好
黄光射程远,透雾力强
钠有强还原性
高压钠灯
钠的几种化合物
一、氧化钠和过氧化钠
思考:回忆前面做过的实验,描述氧化钠和过氧化钠的颜色、状态。
Na2O是白色固体,Na2O2是淡黄色固体。
钠的化合物
一、钠的氧化物:
从物质分类的角度分析:
氧化钠属于金属氧化物和碱性氧化物
碱性氧化物的反应
与水反应只生成碱
与酸性氧化物反应只生成盐
与酸反应生成盐和水
氧化钠(Na2O)
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
Na2O + 2HCl =2NaCl+H2O
氧化钠是一种比较典型的碱性氧化物
钠的化合物
一、钠的氧化物:
氧化钠(Na2O)
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
从氧化还原反应的角度出发,同学们判断一下:过氧化钠与水反应生成物只有氢氧化钠是否合理?
过氧化钠与水反应生成物如果只有氢氧化钠,则反应不存在化合价的升高,因此产物除氢氧化钠之外还应有其他产物
过氧化钠(Na2O2)
Na2O + 2HCl =2NaCl+H2O
钠的化合物
一、钠的氧化物:
氧化钠(Na2O)
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
从氧化还原反应的角度出发,同学们判断一下:过氧化钠与水反应生成物除氢氧化钠以外还应该有什么?
为保证化合价有升降,还应该得到氧气
过氧化钠(Na2O2)
如何证明生成了氧气?
带火星的木条复燃
Na2O + 2HCl =2NaCl+H2O
过氧化钠与水的反应:
向试管中加入过氧化钠固体,向其中滴加蒸馏水,将带火星的木条深入试管。用手轻轻触摸试管外壁,最后向反应后的溶液中滴加酚酞。注意观察现象。
观察到的现象:
有气泡
带火星的木条复燃
试管温度升高
滴加酚酞,溶液显红色
红色褪去
有气体生成
有氧气生成
反应放热
生成碱
有漂白性
关于漂白性的问题,我们将在下一节中学习
根据上面的分析和判断,写出过氧化钠与水反应的方程式:
2Na2O2 + 2H2O = 4NaOH + O2↑
对此反应进行双线桥的分析
2Na2O2 + 2H2O = 4NaOH + O2↑
失去2×e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
反应中的氧化剂和还原剂都是过氧化钠,反应转移电子数为2e-
钠的化合物
一、钠的氧化物:
氧化钠(Na2O)
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
过氧化钠(Na2O2)
2Na2O2 + 2H2O = 4NaOH + O2↑
?
2Na2O2 + 2CO2 = 2Na2CO3 + O2
对上面的反应进行双线桥分析
Na2O + 2HCl =2NaCl+H2O
钠的化合物
一、钠的氧化物:
氧化钠(Na2O)
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
2Na2O2 + 2CO2 = 2Na2CO3 + O2
对上面的反应进行双线桥分析
2Na2O2 + 2CO2 = 2Na2CO3+ O2↑
失去2×e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
Na2O + 2HCl =2NaCl+H2O
钠的化合物
一、钠的氧化物:
氧化钠(Na2O)
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
过氧化钠(Na2O2)
2Na2O2 + 2H2O = 4NaOH + O2↑
?
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑
碱性氧化物
不是碱性氧化物
在呼吸面具和潜艇中作为供氧剂
Na2O + 2HCl =2NaCl+H2O
2Na2O2 +2H2O == 4NaOH+O2↑
复习回顾
2Na2O2 +2CO2 == 2Na2CO3+O2
1.氧化钠和过氧化钠
氧化钠是碱性氧化物,尝试写出氧化钠和水/二氧化碳的反应
再回顾过氧化钠与水/二氧化碳的反应
双线桥
Na2O +H2O == 2NaOH
Na2O+CO2 == Na2CO3
碳 酸 钠:Na2CO3
碳酸氢钠:NaHCO3
学习新知
Na2CO3 NaHCO3 解释
联系
它们之间的联系
除杂
溶液
固体
Na2CO3 NaHCO3 解释
水溶性
水溶液 酸碱性
差异探究1
相同浓度时,碱性
Na2CO3>NaHCO3
相同温度下,溶解度
Na2CO3>NaHCO3
〖现象〗①无明显现象;
②澄清石灰水变浑浊。
差异探究2
②
①
能不能换成氯化钡
Na2CO3 NaHCO3 解释
热稳定性
稳定
不稳定
差异探究2
【活动与探究】在两支洁净的试管中分别加入少量Na2CO3和NaHCO3固体,再各加入少量盐酸,观察实验现象。
差异探究3
Na2CO3 NaHCO3 解释
与HCl
反应
反应
反应剧烈程度
Na2CO3<NaHCO3
为什么NaHCO3与酸反应比Na2CO3剧烈呢?
(1)Na2CO3+2HCl=== 2NaCl+H2O+CO2↑
包含2步:①Na2CO3+HCl == NaCl+NaHCO3
②NaHCO3+HCl == NaCl+H2O+CO2↑
(2)NaHCO3+HCl=== NaCl+H2O+CO2↑
差异探究3
【活动与探究】在两支洁净的试管中各加入1~2 mL的CaCl2溶液,再分别向两支试管中滴加Na2CO3和NaHCO3溶液,振荡,观察实验现象。
BaCl2
差异探究4
Na2CO3 NaHCO3 解释
与CaCl2
白色沉淀
无现象
Na2CO3+CaCl2=== CaCO3↓+2NaCl
【活动与探究】在两支洁净的试管中各加入1~2mL澄清石灰水,再分别向两支试管中滴加Na2CO3和NaHCO3溶液,振荡,观察实验现象。
Ba(OH)2溶液
差异探究5
Na2CO3 NaHCO3 解释
与Ca(OH)2
白色沉淀
白色沉淀
Na2CO3+Ca(OH)2=== CaCO3↓+2NaOH
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O
(NaHCO3少量)
碳酸钠的用途
去油污
碳酸氢钠的用途
疏松剂
胃药
灭火剂
Na2CO3、NaHCO3均可与胃酸(盐酸)反应,为何不选用Na2CO3作抗酸药 ?
问题解决1
原因:碱性 Na2CO3>NaHCO3
友情提醒:胃溃疡患者不能服用碳酸氢钠治疗胃酸过多,产生的CO2会导致胃穿孔哦!可使用Al(OH)3进行替代。
某化学兴趣小组欲在实验室里自制简易
灭火器,设计了如下装置,你认为应
选用碳酸钠还是碳酸氢钠与盐酸反应?
为什么?
问题解决2
√
拓展视野
候德榜制碱法:
二氧化碳通入氨的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠从溶液中析出(同时可得到氮肥),再加热生成碳酸钠
NaCl+H2O+NH3+CO2=== NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+H2O+CO2↑
焰色试验
定义:某些金属或其化合物在无色火焰中灼烧时使火焰呈现特征颜色的过程。
注意:物理变化,针对元素。
操作步骤:用铂丝蘸取盐酸置于酒精灯上灼烧,反复几次至无色(准备步骤),再蘸取待测物灼烧观察焰色(试验步骤),最后蘸取盐酸灼烧至无色(清洗步骤)。
焰色试验
Na元素与K元素的检验
焰色试验
拓展视野
金属 元素 锂 钠 钾 铷 钙 锶 钡 铜
焰色 紫红色 黄色 紫色 紫色 砖红色 洋红色 黄绿色 绿色
钠的拓展与应用准备:化学书、笔记本、导学案2.1.1和2.1.2作业:导学案2.1.1(P2-3的课后巩固)1、钠的物理性质:
2、钠与氧气反应:
3、钠与水反应:
4、钠的保存和取用:
5、钠的灭火:
银白色有金属光泽金属,密度小、质地软、熔点低。
2Na + 2H2O = 2NaOH + H2↑
现象:浮、熔、游、响、红。
用镊子夹取,剩余钠放回原瓶。
煤油或石蜡油中。
用干沙盖灭。
回顾:
4Na + O2 = 2Na2O(白色)
2Na + O2 Na2O2(淡黄色)
1.钠与酸(HCl)
产生气体,爆炸式反应
2Na + 2HCl == 2NaCl + H2↑
反应方程式:
思考:过量的Na与含少量HCl的盐酸反应,Na有剩余吗?
根据金属活动性顺序,Na可以置换几乎所有的金属,那么Na能否从CuSO4溶液中置换出Cu呢?
拓展学习
2.钠与盐
(1)与CuSO4溶液:
a.浮、熔、游、响
b.生成蓝色沉淀。
2Na + 2H2O == 2NaOH + H2↑
CuSO4 + 2NaOH == Cu(OH)2↓+ Na2SO4
反应方程式:
2.将一小块钠投入下列溶液时,既能产生气体又出现沉淀的是( )
A.稀H2SO4 B.氢氧化钠溶液
C.硫酸铜溶液 D.氯化钠溶液
C
当堂检测
溶液中不行
熔融条件下才行
钠到底能否置换出金属?
(2)钠与熔融TiCl4
反应方程式:
4Na + TiCl4 ======= 4NaCl + Ti
700-800℃
四.钠的用途
制Na2O2
核反应堆导热剂
冶炼某些贵金属
和O2在加热的条件下反应
Na、K合金为液体且导热性能好
黄光射程远,透雾力强
钠有强还原性
高压钠灯
钠的几种化合物
一、氧化钠和过氧化钠
思考:回忆前面做过的实验,描述氧化钠和过氧化钠的颜色、状态。
Na2O是白色固体,Na2O2是淡黄色固体。
钠的化合物
一、钠的氧化物:
从物质分类的角度分析:
氧化钠属于金属氧化物和碱性氧化物
碱性氧化物的反应
与水反应只生成碱
与酸性氧化物反应只生成盐
与酸反应生成盐和水
氧化钠(Na2O)
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
Na2O + 2HCl =2NaCl+H2O
氧化钠是一种比较典型的碱性氧化物
钠的化合物
一、钠的氧化物:
氧化钠(Na2O)
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
从氧化还原反应的角度出发,同学们判断一下:过氧化钠与水反应生成物只有氢氧化钠是否合理?
过氧化钠与水反应生成物如果只有氢氧化钠,则反应不存在化合价的升高,因此产物除氢氧化钠之外还应有其他产物
过氧化钠(Na2O2)
Na2O + 2HCl =2NaCl+H2O
钠的化合物
一、钠的氧化物:
氧化钠(Na2O)
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
从氧化还原反应的角度出发,同学们判断一下:过氧化钠与水反应生成物除氢氧化钠以外还应该有什么?
为保证化合价有升降,还应该得到氧气
过氧化钠(Na2O2)
如何证明生成了氧气?
带火星的木条复燃
Na2O + 2HCl =2NaCl+H2O
过氧化钠与水的反应:
向试管中加入过氧化钠固体,向其中滴加蒸馏水,将带火星的木条深入试管。用手轻轻触摸试管外壁,最后向反应后的溶液中滴加酚酞。注意观察现象。
观察到的现象:
有气泡
带火星的木条复燃
试管温度升高
滴加酚酞,溶液显红色
红色褪去
有气体生成
有氧气生成
反应放热
生成碱
有漂白性
关于漂白性的问题,我们将在下一节中学习
根据上面的分析和判断,写出过氧化钠与水反应的方程式:
2Na2O2 + 2H2O = 4NaOH + O2↑
对此反应进行双线桥的分析
2Na2O2 + 2H2O = 4NaOH + O2↑
失去2×e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
反应中的氧化剂和还原剂都是过氧化钠,反应转移电子数为2e-
钠的化合物
一、钠的氧化物:
氧化钠(Na2O)
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
过氧化钠(Na2O2)
2Na2O2 + 2H2O = 4NaOH + O2↑
?
2Na2O2 + 2CO2 = 2Na2CO3 + O2
对上面的反应进行双线桥分析
Na2O + 2HCl =2NaCl+H2O
钠的化合物
一、钠的氧化物:
氧化钠(Na2O)
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
2Na2O2 + 2CO2 = 2Na2CO3 + O2
对上面的反应进行双线桥分析
2Na2O2 + 2CO2 = 2Na2CO3+ O2↑
失去2×e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
Na2O + 2HCl =2NaCl+H2O
钠的化合物
一、钠的氧化物:
氧化钠(Na2O)
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
过氧化钠(Na2O2)
2Na2O2 + 2H2O = 4NaOH + O2↑
?
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑
碱性氧化物
不是碱性氧化物
在呼吸面具和潜艇中作为供氧剂
Na2O + 2HCl =2NaCl+H2O
2Na2O2 +2H2O == 4NaOH+O2↑
复习回顾
2Na2O2 +2CO2 == 2Na2CO3+O2
1.氧化钠和过氧化钠
氧化钠是碱性氧化物,尝试写出氧化钠和水/二氧化碳的反应
再回顾过氧化钠与水/二氧化碳的反应
双线桥
Na2O +H2O == 2NaOH
Na2O+CO2 == Na2CO3
碳 酸 钠:Na2CO3
碳酸氢钠:NaHCO3
学习新知
Na2CO3 NaHCO3 解释
联系
它们之间的联系
除杂
溶液
固体
Na2CO3 NaHCO3 解释
水溶性
水溶液 酸碱性
差异探究1
相同浓度时,碱性
Na2CO3>NaHCO3
相同温度下,溶解度
Na2CO3>NaHCO3
〖现象〗①无明显现象;
②澄清石灰水变浑浊。
差异探究2
②
①
能不能换成氯化钡
Na2CO3 NaHCO3 解释
热稳定性
稳定
不稳定
差异探究2
【活动与探究】在两支洁净的试管中分别加入少量Na2CO3和NaHCO3固体,再各加入少量盐酸,观察实验现象。
差异探究3
Na2CO3 NaHCO3 解释
与HCl
反应
反应
反应剧烈程度
Na2CO3<NaHCO3
为什么NaHCO3与酸反应比Na2CO3剧烈呢?
(1)Na2CO3+2HCl=== 2NaCl+H2O+CO2↑
包含2步:①Na2CO3+HCl == NaCl+NaHCO3
②NaHCO3+HCl == NaCl+H2O+CO2↑
(2)NaHCO3+HCl=== NaCl+H2O+CO2↑
差异探究3
【活动与探究】在两支洁净的试管中各加入1~2 mL的CaCl2溶液,再分别向两支试管中滴加Na2CO3和NaHCO3溶液,振荡,观察实验现象。
BaCl2
差异探究4
Na2CO3 NaHCO3 解释
与CaCl2
白色沉淀
无现象
Na2CO3+CaCl2=== CaCO3↓+2NaCl
【活动与探究】在两支洁净的试管中各加入1~2mL澄清石灰水,再分别向两支试管中滴加Na2CO3和NaHCO3溶液,振荡,观察实验现象。
Ba(OH)2溶液
差异探究5
Na2CO3 NaHCO3 解释
与Ca(OH)2
白色沉淀
白色沉淀
Na2CO3+Ca(OH)2=== CaCO3↓+2NaOH
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O
(NaHCO3少量)
碳酸钠的用途
去油污
碳酸氢钠的用途
疏松剂
胃药
灭火剂
Na2CO3、NaHCO3均可与胃酸(盐酸)反应,为何不选用Na2CO3作抗酸药 ?
问题解决1
原因:碱性 Na2CO3>NaHCO3
友情提醒:胃溃疡患者不能服用碳酸氢钠治疗胃酸过多,产生的CO2会导致胃穿孔哦!可使用Al(OH)3进行替代。
某化学兴趣小组欲在实验室里自制简易
灭火器,设计了如下装置,你认为应
选用碳酸钠还是碳酸氢钠与盐酸反应?
为什么?
问题解决2
√
拓展视野
候德榜制碱法:
二氧化碳通入氨的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠从溶液中析出(同时可得到氮肥),再加热生成碳酸钠
NaCl+H2O+NH3+CO2=== NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+H2O+CO2↑
焰色试验
定义:某些金属或其化合物在无色火焰中灼烧时使火焰呈现特征颜色的过程。
注意:物理变化,针对元素。
操作步骤:用铂丝蘸取盐酸置于酒精灯上灼烧,反复几次至无色(准备步骤),再蘸取待测物灼烧观察焰色(试验步骤),最后蘸取盐酸灼烧至无色(清洗步骤)。
焰色试验
Na元素与K元素的检验
焰色试验
拓展视野
金属 元素 锂 钠 钾 铷 钙 锶 钡 铜
焰色 紫红色 黄色 紫色 紫色 砖红色 洋红色 黄绿色 绿色
