2.1.3活化能课件(共18张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.1.3活化能课件(共18张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-07 17:45:18 | ||
图片预览




文档简介
(共18张PPT)
第一节 化学反应速率
第3课时 活化能
教 学 目 标
核 心 素 养
1.知道化学反应是有历程的;
2.认识基元反应活化能对化学反应速率的影响;
3.能用一定的理论模型说明外界条件改变对化学反应速率的影响。
1.证据推理与模型认知:能根据碰撞理论模型推断温度、浓度、催化剂等是如何影响化学反应速率的。
2.科学探究与创新意识:初步形成探究化学规律的思路与方法,发展创造性体验和想象创新能力。
思考:
为什么浓度、温度、压强、催化剂等外界条件能改变化学反应速率?
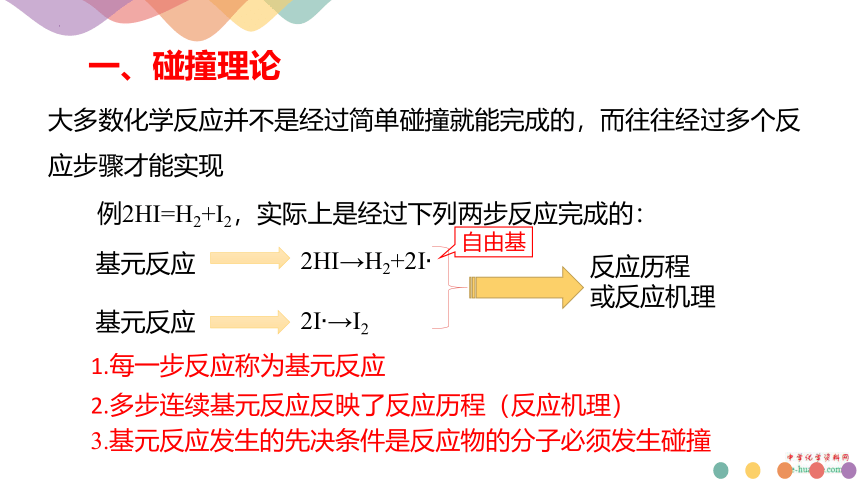
一、碰撞理论
大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现
2HI→H2+2I
2I →I2
例2HI=H2+I2,实际上是经过下列两步反应完成的:
基元反应
基元反应
反应历程
或反应机理
1.每一步反应称为基元反应
2.多步连续基元反应反映了反应历程(反应机理)
3.基元反应发生的先决条件是反应物的分子必须发生碰撞
自由基
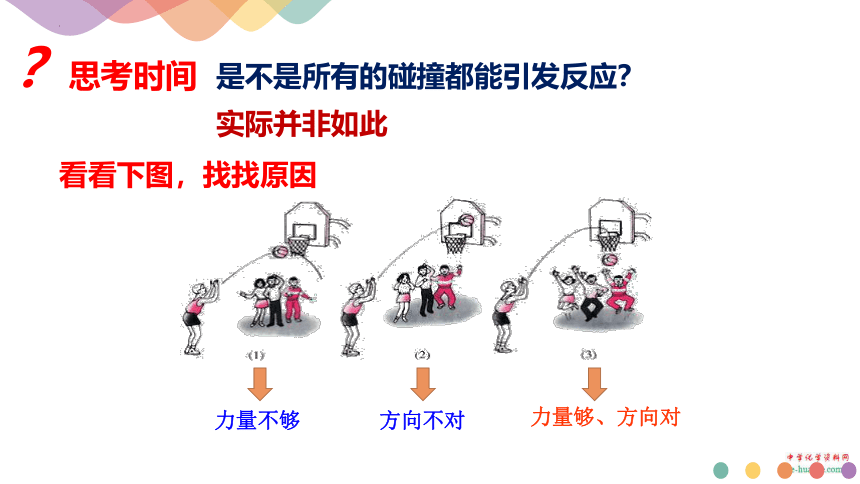
是不是所有的碰撞都能引发反应?
?思考时间
实际并非如此
看看下图,找找原因
力量不够
方向不对
力量够、方向对
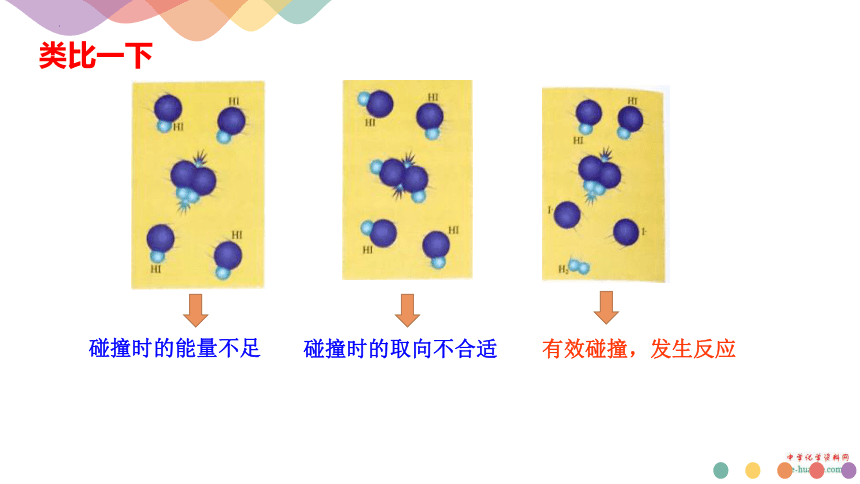
类比一下
碰撞时的取向不合适
有效碰撞,发生反应
碰撞时的能量不足
1. 有效碰撞
能够发生化学反应的碰撞
有效碰撞的条件
①必须是活化分子间的碰撞
②碰撞时要有合适的取向
什么是活化分子呢?
2.活化分子:
具有较高能量,能够发生有效碰撞的分子
注意:1.发生有效碰撞的分子一定是活化分子;
2.活化分子的碰撞不一定是有效碰撞;
(由于取向问题)
4.有效碰撞次数的多少与单位体积内反应物中活化分子数目的多少有关。
3.其他条件不变时,同一反应活化分子在反应物
中所占的百分数是一定的。
3.活化能:
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
该反应是吸热反应还是放热反应
反应热
活化能与反应热有关吗
活化分子具有的平均能量与反应物分子具有的平均能量之差。
放热
无关
逆反应的活化能
思考与讨论:阅读教材P26-27
用碰撞理论解释外界条件对反应速率的影响
影响 外界条件 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数
增大反应物浓度
增大压强
升高温度
加催化剂
增加
增加
不变
增加
加快
增加
增加
不变
增加
加快
不变
增加
增加
增加
加快
不变
增加
增加
增加
加快
二、外界条件对反应速率的影响
反应物浓度增大,即单位体积内反应物分子总数增大
单位体积内活化分子数增加
有效碰撞次数增多
反应速率加快
(1)浓度对反应速率的影响
(2)压强对反应速率的影响
压强增大
反应物浓度增大
单位体积内活化分子数增加
反应速率加快
有效碰撞次数增多
温度升高
单位体积内活化分子数增多(活化分子百分数增大)
有效碰撞次数增多
反应速率加快
(3)温度对反应速率的影响
分子活得更高能量
生成物平均能量
活化分子具有能量
反应物平均能量
能量
无催化剂
活化分子能量
反应物平均能量
生成物平均能量
有催化剂
(4)催化剂对反应速率的影响
使用催化剂
改变反应历程
降低活化能
活化分子百分数增大(活化分子数目增多)
有效碰撞次数增多
化学反应速率加快
反应过程
E1
E2
ΔH
无催化反应
催化反应
(1)使用适当的催化剂能降低活化能。
(2)使用催化剂能改变反应速率,但反应热没变。
小结:外界条件对化学反应速率产生影响的本质
系统集成P20 1.有关碰撞理论,下列说法不正确的是( )
A.具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应
B.增大反应物的浓度,单位体积内活化分子数增多,有效碰撞的概率增大,反应速率增大
C.升高温度,活化分子百分数增大,有效碰撞的几率增大,反应速率增大
D.催化剂能降低反应的活化能,增大活化分子百分数,有效碰撞的概率增大,反应速率增大
课堂练习:
系统集成P21 1.已知Cl2(g)+CO(g)??COCl2(g)的速率方程v=kc1/2(Cl2)·c(CO)(k为速率常数,只受温度影响),该反应可认为经过以下反应历程:
第一步:Cl2??2Cl 快速反应
第二步:Cl+CO??COCl 快速反应
第三步:COCl+Cl2―→COCl2+Cl 慢反应
下列说法正确的是( )
A.第一步反应和第二步反应的活化能较高
B.c(CO)、c(Cl2)分别增大相同的倍数,对总反应速率的影响程度相同
C.该总反应的速率主要取决于第三步反应
D.第三步反应的有效碰撞频率较大
A
C
3.我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]的反应历程,如图所示,其中吸附在金催化剂表面上的物种用 标注。
可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E=_________eV,写出该步骤的化学方程式_ ______________________。
小于
2.02
COOH*+H*+H2O*= COOH*+2H*+OH*(或H2O*=H*+OH*)
知识拓展
艾哈迈德·泽维尔( ,Ahmed Hassan Zewail),埃及化学家,飞秒化学专家。他研究的技术能将研究化学反应的时间尺度缩减至飞秒,透过摄影将化学反应中每个微细变化忠实地纪录。
飞秒化学 —— 参照课本 P28
第一节 化学反应速率
第3课时 活化能
教 学 目 标
核 心 素 养
1.知道化学反应是有历程的;
2.认识基元反应活化能对化学反应速率的影响;
3.能用一定的理论模型说明外界条件改变对化学反应速率的影响。
1.证据推理与模型认知:能根据碰撞理论模型推断温度、浓度、催化剂等是如何影响化学反应速率的。
2.科学探究与创新意识:初步形成探究化学规律的思路与方法,发展创造性体验和想象创新能力。
思考:
为什么浓度、温度、压强、催化剂等外界条件能改变化学反应速率?
一、碰撞理论
大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现
2HI→H2+2I
2I →I2
例2HI=H2+I2,实际上是经过下列两步反应完成的:
基元反应
基元反应
反应历程
或反应机理
1.每一步反应称为基元反应
2.多步连续基元反应反映了反应历程(反应机理)
3.基元反应发生的先决条件是反应物的分子必须发生碰撞
自由基
是不是所有的碰撞都能引发反应?
?思考时间
实际并非如此
看看下图,找找原因
力量不够
方向不对
力量够、方向对
类比一下
碰撞时的取向不合适
有效碰撞,发生反应
碰撞时的能量不足
1. 有效碰撞
能够发生化学反应的碰撞
有效碰撞的条件
①必须是活化分子间的碰撞
②碰撞时要有合适的取向
什么是活化分子呢?
2.活化分子:
具有较高能量,能够发生有效碰撞的分子
注意:1.发生有效碰撞的分子一定是活化分子;
2.活化分子的碰撞不一定是有效碰撞;
(由于取向问题)
4.有效碰撞次数的多少与单位体积内反应物中活化分子数目的多少有关。
3.其他条件不变时,同一反应活化分子在反应物
中所占的百分数是一定的。
3.活化能:
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
该反应是吸热反应还是放热反应
反应热
活化能与反应热有关吗
活化分子具有的平均能量与反应物分子具有的平均能量之差。
放热
无关
逆反应的活化能
思考与讨论:阅读教材P26-27
用碰撞理论解释外界条件对反应速率的影响
影响 外界条件 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数
增大反应物浓度
增大压强
升高温度
加催化剂
增加
增加
不变
增加
加快
增加
增加
不变
增加
加快
不变
增加
增加
增加
加快
不变
增加
增加
增加
加快
二、外界条件对反应速率的影响
反应物浓度增大,即单位体积内反应物分子总数增大
单位体积内活化分子数增加
有效碰撞次数增多
反应速率加快
(1)浓度对反应速率的影响
(2)压强对反应速率的影响
压强增大
反应物浓度增大
单位体积内活化分子数增加
反应速率加快
有效碰撞次数增多
温度升高
单位体积内活化分子数增多(活化分子百分数增大)
有效碰撞次数增多
反应速率加快
(3)温度对反应速率的影响
分子活得更高能量
生成物平均能量
活化分子具有能量
反应物平均能量
能量
无催化剂
活化分子能量
反应物平均能量
生成物平均能量
有催化剂
(4)催化剂对反应速率的影响
使用催化剂
改变反应历程
降低活化能
活化分子百分数增大(活化分子数目增多)
有效碰撞次数增多
化学反应速率加快
反应过程
E1
E2
ΔH
无催化反应
催化反应
(1)使用适当的催化剂能降低活化能。
(2)使用催化剂能改变反应速率,但反应热没变。
小结:外界条件对化学反应速率产生影响的本质
系统集成P20 1.有关碰撞理论,下列说法不正确的是( )
A.具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应
B.增大反应物的浓度,单位体积内活化分子数增多,有效碰撞的概率增大,反应速率增大
C.升高温度,活化分子百分数增大,有效碰撞的几率增大,反应速率增大
D.催化剂能降低反应的活化能,增大活化分子百分数,有效碰撞的概率增大,反应速率增大
课堂练习:
系统集成P21 1.已知Cl2(g)+CO(g)??COCl2(g)的速率方程v=kc1/2(Cl2)·c(CO)(k为速率常数,只受温度影响),该反应可认为经过以下反应历程:
第一步:Cl2??2Cl 快速反应
第二步:Cl+CO??COCl 快速反应
第三步:COCl+Cl2―→COCl2+Cl 慢反应
下列说法正确的是( )
A.第一步反应和第二步反应的活化能较高
B.c(CO)、c(Cl2)分别增大相同的倍数,对总反应速率的影响程度相同
C.该总反应的速率主要取决于第三步反应
D.第三步反应的有效碰撞频率较大
A
C
3.我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]的反应历程,如图所示,其中吸附在金催化剂表面上的物种用 标注。
可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E=_________eV,写出该步骤的化学方程式_ ______________________。
小于
2.02
COOH*+H*+H2O*= COOH*+2H*+OH*(或H2O*=H*+OH*)
知识拓展
艾哈迈德·泽维尔( ,Ahmed Hassan Zewail),埃及化学家,飞秒化学专家。他研究的技术能将研究化学反应的时间尺度缩减至飞秒,透过摄影将化学反应中每个微细变化忠实地纪录。
飞秒化学 —— 参照课本 P28
