2.2.1分子的空间构型价电子互斥理论课件(共17张PPT)2023-2024学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.2.1分子的空间构型价电子互斥理论课件(共17张PPT)2023-2024学年下学期高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-07 17:47:39 | ||
图片预览



文档简介
(共17张PPT)
第二章 分子结构与性质
第二节 分子的空间结构
第1课时 分子的空间结构、价电子互斥理论
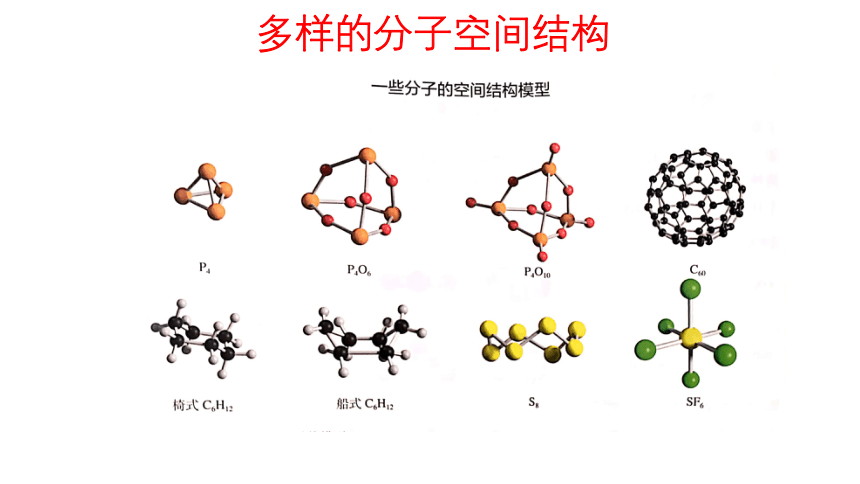
多样的分子空间结构
任务一:探究影响分子结构的因素
动动笔,书写下列分子的电子式、结构式:CO2 H2O CH2O NH3 CH4
C
H
H
H
H
··
··
··
··
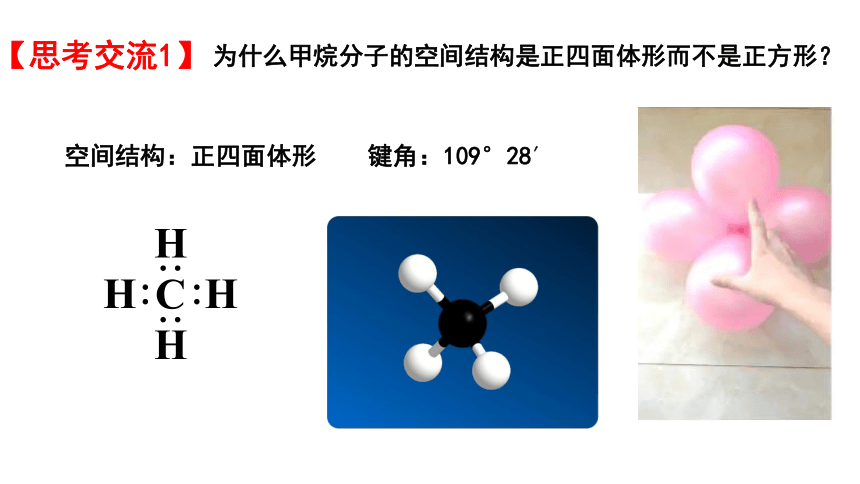
空间结构:正四面体形 键角:109°28′
为什么甲烷分子的空间结构是正四面体形而不是正方形?
【思考交流1】
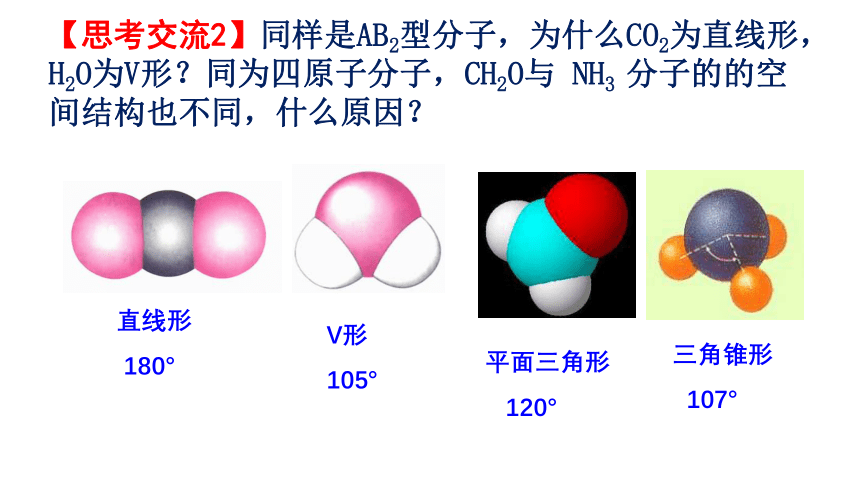
【思考交流2】同样是AB2型分子,为什么CO2为直线形,H2O为V形?同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?
直线形
180°
V形
105°
平面三角形
120°
三角锥形
107°
分子的空间结构除了和中心原子与结合原子间的成键电子对有关,还和中心原子的孤电子对有关,两者合称为中心原子的“价层电子对”。
课堂小结
1940年,英国化学家西奇威克提出了价层电子对互斥理论,20世纪60年代加拿大化学家吉来斯必等发展了这一理论。
分子的空间结构是中心原子的“价层电子对”相互排斥的结果。
价层电子对是指分子中的中心原子与结合原子间的σ键电子对和中心原子上的孤电子对。多重键只计其中的σ键电子对,不计π电子对。
Valence-shell Electron-pair Repulsion
【任务二:价层电子对互斥理论】
价层电子对互斥模型(VSEPR模型)
价层电子对数目: 2 3 4
VSEPR模型:
直线
平面三角形
四面体
如何计算价层电子对数
【思考交流3】
思考
中心原子上的孤电子对数 = (a-xb)
σ键电子对数 = 与中心原子结合的原子数(x)
= σ键电子对数+中心原子上的孤电子对数
价层电子对数
(1)a为中心原子的价电子数,对于主族元素来说,价电子数等于原子的最外层电子数;
(2)x为与中心原子结合的原子数;
(3)b为与中心原子结合的原子最多能接受的电子数,氢为1,其他原子对于“8-该原子的价电子数”。
方法总结
σ键电子对数 孤电子对数 VSEPR模型及名称 分子的空间结构及名称
CO2
H2O
NH3
CH4
电子式
O C O
::
::
:
:
:
:
2
0
直线形
直线形
C
O
O
:
:
:
H O H
:
2
2
四面体形
V形
:
:
:
H N H
:
H
3
1
四面体形
三角锥形
:
:
:
H C H
:
H
H
4
0
正四面体形
正四面体形
价层电子对互斥理论
σ键电子对
中心原子上的
孤对电子数目
价层电子对数
价层电子对
互斥
VSEPR模型
略去孤电子对
分子的空间结构
课堂小结
【问题3】:为什么H2O的键角(105°)小于NH3的键角(107°)?
【问题1】:根据VSEPR理论推测HCN、SO2、SO3的空间结构?
【问题2】:根据VSEPR理论推测NH4+、CO32-、SO32-的空间结构?
运用提升
VSEPR模型与空间结构
价层 电子对 σ键 电子对 孤 电子对 VSEPR 模型名称 空间结构名称 键角
2
3
4
2
0
3
0
0
2
1
4
3
2
1
2
直线形
正四面体形
直线形
平面三角形
平面三角形
平面三角形
V形
四面体形
四面体形
正四面体形
三角锥形
V形
180°
小于120°
120°
小于109°28′
109°28′
价层电子对之间相互排斥作用大小的一般规律:
孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对。
随着孤电子对数目的增多,孤电子对与成键电子对之间的斥力增大,键角减小。
价层电子对互斥模型不能用于预测以过渡金属为中心原子的分子
运用价层电子对互斥理论推测 PCl5、SCl6的分子空间结构,并用合适的道具制作其结构模型?
猜想与实践
第二章 分子结构与性质
第二节 分子的空间结构
第1课时 分子的空间结构、价电子互斥理论
多样的分子空间结构
任务一:探究影响分子结构的因素
动动笔,书写下列分子的电子式、结构式:CO2 H2O CH2O NH3 CH4
C
H
H
H
H
··
··
··
··
空间结构:正四面体形 键角:109°28′
为什么甲烷分子的空间结构是正四面体形而不是正方形?
【思考交流1】
【思考交流2】同样是AB2型分子,为什么CO2为直线形,H2O为V形?同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?
直线形
180°
V形
105°
平面三角形
120°
三角锥形
107°
分子的空间结构除了和中心原子与结合原子间的成键电子对有关,还和中心原子的孤电子对有关,两者合称为中心原子的“价层电子对”。
课堂小结
1940年,英国化学家西奇威克提出了价层电子对互斥理论,20世纪60年代加拿大化学家吉来斯必等发展了这一理论。
分子的空间结构是中心原子的“价层电子对”相互排斥的结果。
价层电子对是指分子中的中心原子与结合原子间的σ键电子对和中心原子上的孤电子对。多重键只计其中的σ键电子对,不计π电子对。
Valence-shell Electron-pair Repulsion
【任务二:价层电子对互斥理论】
价层电子对互斥模型(VSEPR模型)
价层电子对数目: 2 3 4
VSEPR模型:
直线
平面三角形
四面体
如何计算价层电子对数
【思考交流3】
思考
中心原子上的孤电子对数 = (a-xb)
σ键电子对数 = 与中心原子结合的原子数(x)
= σ键电子对数+中心原子上的孤电子对数
价层电子对数
(1)a为中心原子的价电子数,对于主族元素来说,价电子数等于原子的最外层电子数;
(2)x为与中心原子结合的原子数;
(3)b为与中心原子结合的原子最多能接受的电子数,氢为1,其他原子对于“8-该原子的价电子数”。
方法总结
σ键电子对数 孤电子对数 VSEPR模型及名称 分子的空间结构及名称
CO2
H2O
NH3
CH4
电子式
O C O
::
::
:
:
:
:
2
0
直线形
直线形
C
O
O
:
:
:
H O H
:
2
2
四面体形
V形
:
:
:
H N H
:
H
3
1
四面体形
三角锥形
:
:
:
H C H
:
H
H
4
0
正四面体形
正四面体形
价层电子对互斥理论
σ键电子对
中心原子上的
孤对电子数目
价层电子对数
价层电子对
互斥
VSEPR模型
略去孤电子对
分子的空间结构
课堂小结
【问题3】:为什么H2O的键角(105°)小于NH3的键角(107°)?
【问题1】:根据VSEPR理论推测HCN、SO2、SO3的空间结构?
【问题2】:根据VSEPR理论推测NH4+、CO32-、SO32-的空间结构?
运用提升
VSEPR模型与空间结构
价层 电子对 σ键 电子对 孤 电子对 VSEPR 模型名称 空间结构名称 键角
2
3
4
2
0
3
0
0
2
1
4
3
2
1
2
直线形
正四面体形
直线形
平面三角形
平面三角形
平面三角形
V形
四面体形
四面体形
正四面体形
三角锥形
V形
180°
小于120°
120°
小于109°28′
109°28′
价层电子对之间相互排斥作用大小的一般规律:
孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对。
随着孤电子对数目的增多,孤电子对与成键电子对之间的斥力增大,键角减小。
价层电子对互斥模型不能用于预测以过渡金属为中心原子的分子
运用价层电子对互斥理论推测 PCl5、SCl6的分子空间结构,并用合适的道具制作其结构模型?
猜想与实践
