2.2.2价层电子对互斥模型课件(共34张PPT)2023-2024学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.2.2价层电子对互斥模型课件(共34张PPT)2023-2024学年下学期高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-07 17:48:58 | ||
图片预览




文档简介
(共34张PPT)
第二章 分子结构与性质
第二节 分子的空间结构
第2课时 价层电子对互斥模型
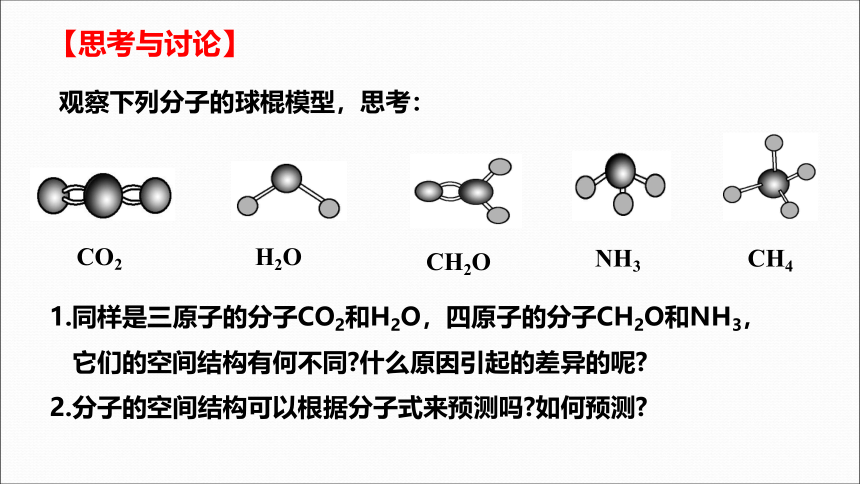
观察下列分子的球棍模型,思考:
CO2
H2O
CH2O
NH3
CH4
1.同样是三原子的分子CO2和H2O,四原子的分子CH2O和NH3,
它们的空间结构有何不同 什么原因引起的差异的呢
2.分子的空间结构可以根据分子式来预测吗 如何预测
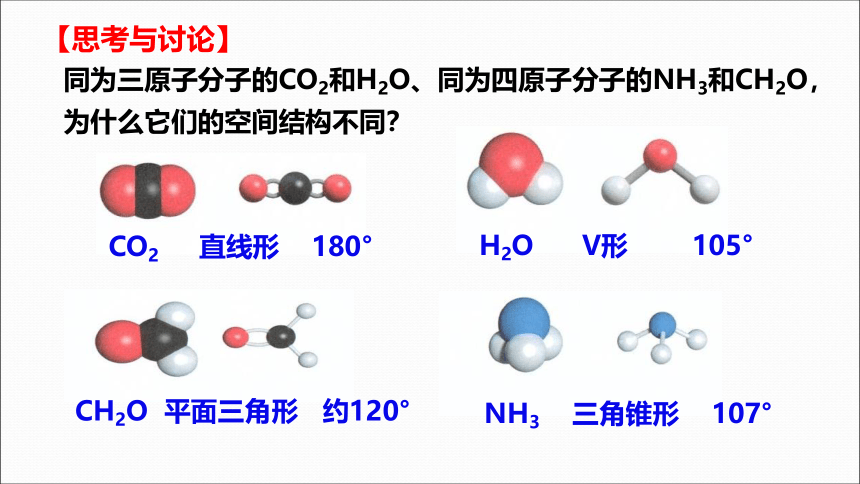
【思考与讨论】
CO2 直线形 180°
H2O V形 105°
CH2O 平面三角形 约120°
NH3 三角锥形 107°
同为三原子分子的CO2和H2O、同为四原子分子的NH3和CH2O,
为什么它们的空间结构不同?
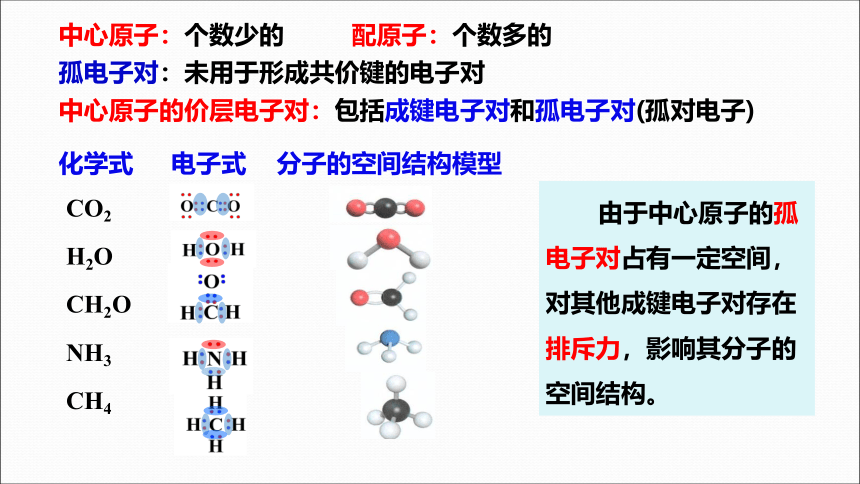
【思考与讨论】
化学式 电子式 分子的空间结构模型
CO2
H2O
CH2O
NH3
CH4
由于中心原子的孤电子对占有一定空间,对其他成键电子对存在排斥力,影响其分子的空间结构。
中心原子:个数少的 配原子:个数多的
孤电子对:未用于形成共价键的电子对
中心原子的价层电子对:包括成键电子对和孤电子对(孤对电子)
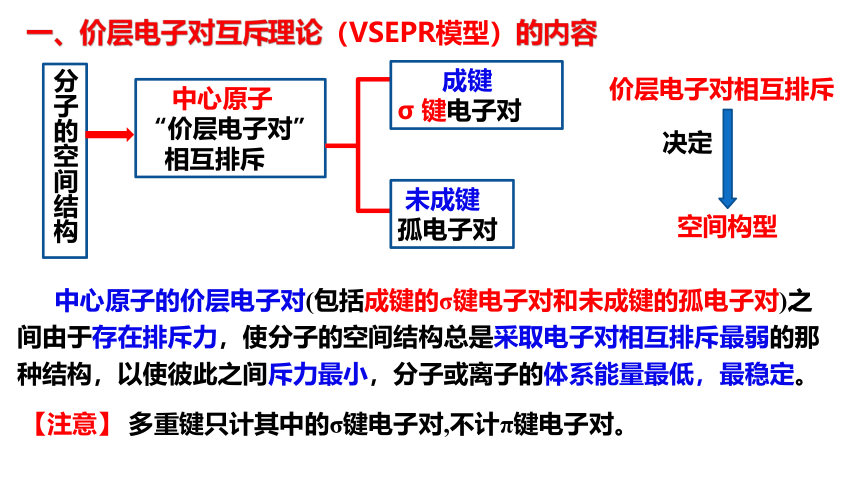
一、价层电子对互斥理论(VSEPR模型)的内容
分子的空间结构
中心原子
“价层电子对”
相互排斥
成键
σ 键电子对
未成键
孤电子对
空间构型
价层电子对相互排斥
决定
中心原子的价层电子对(包括成键的σ键电子对和未成键的孤电子对)之间由于存在排斥力,使分子的空间结构总是采取电子对相互排斥最弱的那种结构,以使彼此之间斥力最小,分子或离子的体系能量最低,最稳定。
【注意】 多重键只计其中的σ键电子对,不计π键电子对。
σ键电子对数+孤电子对数=价层电子对数
价层电子对互斥理论
VSEPR模型
略去孤电子对
分子或离子的空间结构
3.价层电子对互斥模型的确定空间结构的步骤
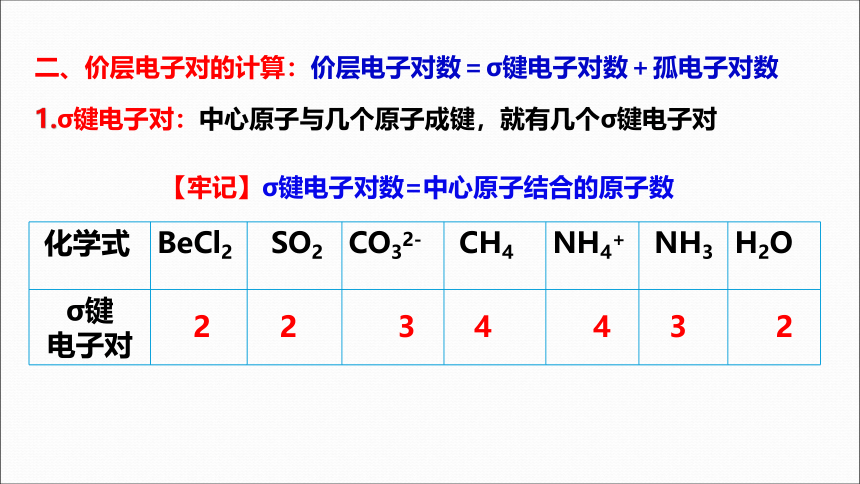
化学式 BeCl2 SO2 CO32- CH4 NH4+ NH3 H2O
σ键 电子对
2
2
3
4
4
3
2
二、价层电子对的计算:价层电子对数=σ键电子对数+孤电子对数
1.σ键电子对:中心原子与几个原子成键,就有几个σ键电子对
【牢记】σ键电子对数=中心原子结合的原子数
a:中心原子的价电子数
主族元素:a=最外层电子数=主族序数
阳离子:a=价电子数-离子所带电荷数
阴离子:a=价电子数+离子所带电荷数
x:中心原子结合
的原子数(配原子数)
b:与中心原子结合的原子(配原子 )最多能接受的电子数
(H为1,其他原子:b=8-配原子的价电子数)
中心原子上的孤电子对数 =
化学式 BeCl2 SO2 CO32- CH4 NH4+ NH3 H2O
孤电子对
0
1
0
0
0
1
2
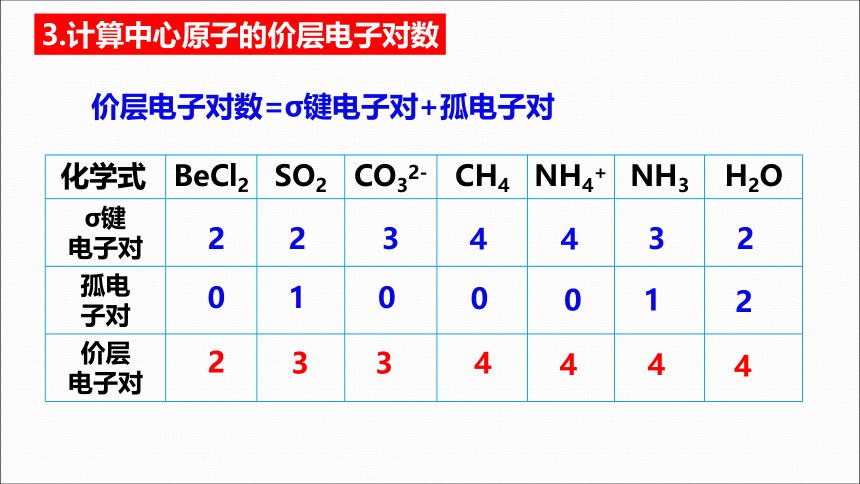
化学式 BeCl2 SO2 CO32- CH4 NH4+ NH3 H2O
σ键 电子对
孤电 子对
价层 电子对
2
2
3
4
4
3
2
0
1
0
0
0
1
2
2
3
3
4
4
4
4
3.计算中心原子的价层电子对数
价层电子对数=σ键电子对+孤电子对
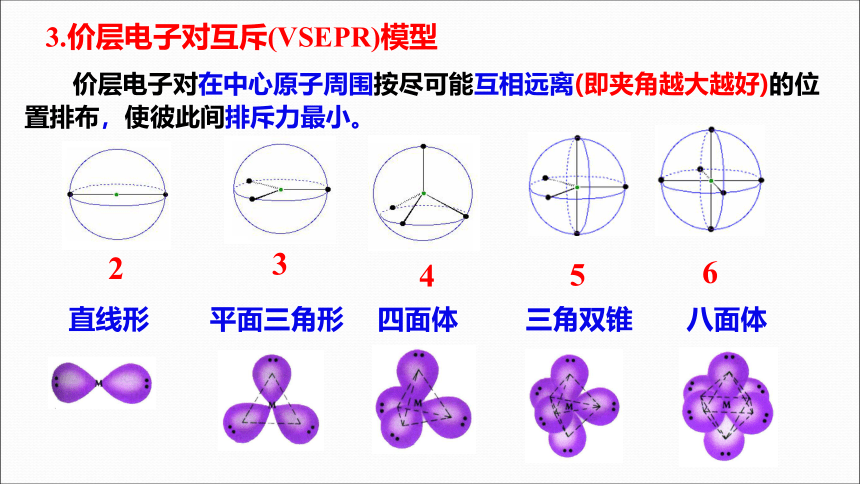
2
4
3
5
6
直线形 平面三角形 四面体 三角双锥 八面体
3.价层电子对互斥(VSEPR)模型
价层电子对在中心原子周围按尽可能互相远离(即夹角越大越好)的位 置排布,使彼此间排斥力最小。
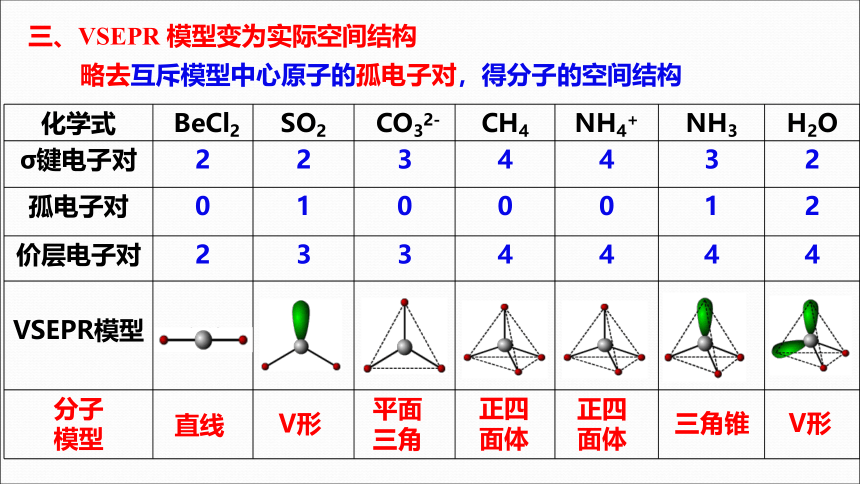
化学式 BeCl2 SO2 CO32- CH4 NH4+ NH3 H2O
σ键电子对 2 2 3 4 4 3 2
孤电子对 0 1 0 0 0 1 2
价层电子对 2 3 3 4 4 4 4
VSEPR模型
分子 模型
直线
平面
三角
平面
三角
四面体
四面体
四面体
四面体
直线
V形
平面
三角
正四
面体
正四
面体
三角锥
V形
三、VSEPR 模型变为实际空间结构
略去互斥模型中心原子的孤电子对,得分子的空间结构
3.价层电子对互斥模型和分子空间结构的区别与联系
(1)区别
①价层电子对互斥构型(VSEPR模型)是价层电子对的空间构型
②分子的空间构型指的是成键电子对的空间构型,略去孤电子对
(2)联系:两者是否一致取决于中心原子上有无孤电子对
①当中心原子上无孤电子对时,两者的构型一致
②当中心原子上有孤电子对时,两者的构型不一致
【注意】价层电子对互斥模型不能用于预测以过渡金属为中心原子的分子
CH4、NH3、H2O分子的VSEPR模型均为四面体形,为何键角有差异?
【思考与讨论】
4.价层电子对之间的斥力大小顺序:
①孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对
②孤电子对越多,排斥力越大,键角越小
化学式 H3O+ NH2- O3 CHCl3 COCl2 PCl3
σ键 电子对
孤电 子对
价层电子对
分子空间结构
1.用VSEPR模型推测下列微粒的空间结构:
3
1
三角锥形
2
2
V形
2
1
V形
4
0
四面体形
3
0
平面
三角形
3
1
三角锥形
4
4
4
4
3
3
【课堂练习】
分子类型 中心原子 空间构型
AB2 有孤对电子 V型
无孤对电子 直线形
AB3 有孤对电子 三角锥形
无孤对电子 平面三角形
AB4 无孤对电子 四面体形
【归纳小结】
2.下列分子的VSEPR模型与分子的空间结构相同的是 ( )
A
A. CCl4 B.SO32- C.NH3 D.H2O
3.下列分子或离子的中心原子上未用于成键的价电子对最多的是( )
A.H2O B.HCl C.NH4+ D.PCl3
A
4.用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,
也可推测键角大小,下列判断正确的是
A.PCl3为平面三角形 B.SO3与 为平面三角形
C.SO2键角大于120o D.BF3是三角锥形分子
解析:HCl分子属于AB型分子,没有中心原子
B
5.下列关于价层电子对互斥模型(VSEPR 模型)的叙述中不正确的是
A.VSEPR 模型可用预测分子的立体构型
B.VSEPR 模型不能用于预测以过渡金属为中心原子的分子
C.中心原子上的孤电子对也要占据中心原子周围的空间并参
与互相排斥
D.分子中键角越大,价层电子对相互排斥力越大,分子越稳定
D
课堂小结
价电子对互斥模型
σ键电子对
中心原子上的
孤电子对数
价层电子对数
价层电子对
互斥模型
VSEPR模型
略去孤电子对
分子的立体构型
第二章 分子结构与性质
第二节 分子的立体构型
第3课时 杂化轨道理论
1.请根据价层电子对互斥理论分析CH4的立体构型。
2.写出碳原子的核外电子排布图,思考为什么碳原子与氢原子结
合形成CH4,而不是CH2 ?
C原子轨道排布图
1s2
2s2
2p2
H原子轨道排布图
1s1
思考
杂化轨道理论
杂化理论简介
1.概念
在形成分子时,由于原子的相互影响,原子内部能量相近的原子轨道
混杂起来,重新组合形成新的原子轨道的过程叫做原子轨道的杂化。
杂化后的新轨道就称为杂化轨道
3.杂化过程
基态→(激发态)→杂化→轨道重组(形成杂化轨道)
2.杂化条件:①只有在形成化学键时才能杂化。
②只有能量相近的轨道间才能杂化:2s和2p,3s和3p ......
4.杂化轨道的类型:sp、sp2、sp3、spd、sp3d .......
杂化方式由价层电子对数量决定!
价层电子对数 杂化方式 杂化轨道数目 杂化轨道空间构型
2 sp 直线形
3 sp2 平面三角形
4 sp3 正四面体形
【牢记】①杂化轨道空间构型与VSEPR模型完全相同!
②杂化轨道数=价层电子对数=σ键电子对数+中心原子的孤电子对数
2
3
4
4.杂化轨道的形成:
sp 杂化:1个s 轨道与1个p 轨道进行的杂化, 形成2个sp杂化轨道sp杂化轨道的形状为一头大,一头小,含有1/2 s 轨道和1/2 p 轨道的成分,两个轨道间的夹角为180°,呈直线形。
x
y
z
x
y
z
z
x
y
z
x
y
z
180°
180°
sp2杂化:1个s 轨道与2个p 轨道进行的杂化, 形成3个sp2 杂化轨道。每个sp2杂化轨道的形状也为一头大,一头小,含有 1/3 s 轨道和 2/3 p 轨道的成分,每两个轨道间的夹角为120°,呈平面三角形。
4.杂化轨道的形成
x
y
z
x
y
z
z
x
y
z
x
y
z
120°
4.杂化轨道的形成:
sp3杂化:1个s 轨道与3个p 轨道进行的杂化,形成4个sp3 杂化轨道,每个sp3杂化轨道的形状也为一头大,一头小, 含有 1/4 s 轨道和 3/4 p 轨道的成分,每两个轨道间的夹角为109°28’,空间构型为正四面体形。
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
杂化轨道有什么特征呢?
5.杂化轨道的特征
(1)杂化前后轨道数不变。
(2)杂化过程中轨道的形状发生变化。
(3)杂化后形成的化学键更稳定。
(4)杂化后的新轨道能量、形状都相同。
(5)杂化后的轨道之间尽可能远离。
(6)杂化轨道只用于形成σ键和容纳孤电子对。
6.杂化轨道类型的判断方式
1、从价层电子对数判断
2、从VSEPR 模型判断
3、从键角判断(键角 sp :180° sp2 : 120° sp3: 109°28’
4、从化学键的类型判断(针对 C 原子):单键sp3、双键sp2、三键sp
路易斯结构式:用短线表示共用电子对,小黑点表示未键合的孤电子对的结构式。
1.判断正误(对的在括号内打“√”,错的在括号内打“×”)
(1)CH2Cl2分子只有一种,可说明CH4的空间结构为正四面体形 ( )
(2)分子的VSEPR模型和相应分子的空间结构是相同的。 ( )
(3)SO2分子与CO2分子的组成相似,故它们都是直线形分子 ( )
√
×
×
课堂练习
2.下列分子结构与分子中共价键键角对应正确的是 ( )
A.直线形分子:180° B.平面正三角形:120°
C.三角锥形:109°28′ D.正四面体形:109°28′
B
HCl也是直线形分子,因只有一个共价键,故不存在键角
氨分子呈三角锥形,键角为107°
白磷分子是正四面体形分子,但键角分别60°
当堂检测
1.下列分子或离子中,不含有孤对电子的是( )
A.H2O B.H3O+ C.NH3 D.NH4+
2. 下列粒子中,含有孤电子对的是( )
A.SiH4 B.H2O C.CH4 D.NH4+
3. 下列粒子的价电子对数正确的是( )
A.CH4 4 B.CO2 1 C.BF3 2 D.SO3 2
A
B
D
4.下列物质中,分子的立体结构与水分子相似的是( )
A.CO2 B.H2S C.PCl3 D.SiCl4
5.下列分子的立体结构,其中属于直线形分子的是( )
A. H2O B.CO2 C.CH4 D. SO2
6.下列分子立体结构其中属正八面体型分子的( )
A.H3O + B.CO32— C.PCl5 D.SF6
B
B
D
7.以下分子或离子的结构为正四面体,且键角为109°28′ 的是( )
①CH4 ②NH4+ ③CH3Cl ④P4 ⑤SO42-
A.①②③ B.①②④ C.①②⑤ D.①④⑤
8.用价层电子对互斥模型判断SO3的分子构型( )
A.正四面体形 B.V形 C.三角锥形 D.平面三角形
当堂检测
C
D
9.(1)计算下列分子或离子中心原子的价电子对数。
① CCl4_________ ② BeCl2_______
③ BCl3_________ ④ PCl3 ________
4
2
3
4
(2)计算下列分子或离子中心原子的孤电子对数。
① H2S__________ ② PCl5________
③ BF3__________ ④ NH3_________
2
0
0
1
第二章 分子结构与性质
第二节 分子的空间结构
第2课时 价层电子对互斥模型
观察下列分子的球棍模型,思考:
CO2
H2O
CH2O
NH3
CH4
1.同样是三原子的分子CO2和H2O,四原子的分子CH2O和NH3,
它们的空间结构有何不同 什么原因引起的差异的呢
2.分子的空间结构可以根据分子式来预测吗 如何预测
【思考与讨论】
CO2 直线形 180°
H2O V形 105°
CH2O 平面三角形 约120°
NH3 三角锥形 107°
同为三原子分子的CO2和H2O、同为四原子分子的NH3和CH2O,
为什么它们的空间结构不同?
【思考与讨论】
化学式 电子式 分子的空间结构模型
CO2
H2O
CH2O
NH3
CH4
由于中心原子的孤电子对占有一定空间,对其他成键电子对存在排斥力,影响其分子的空间结构。
中心原子:个数少的 配原子:个数多的
孤电子对:未用于形成共价键的电子对
中心原子的价层电子对:包括成键电子对和孤电子对(孤对电子)
一、价层电子对互斥理论(VSEPR模型)的内容
分子的空间结构
中心原子
“价层电子对”
相互排斥
成键
σ 键电子对
未成键
孤电子对
空间构型
价层电子对相互排斥
决定
中心原子的价层电子对(包括成键的σ键电子对和未成键的孤电子对)之间由于存在排斥力,使分子的空间结构总是采取电子对相互排斥最弱的那种结构,以使彼此之间斥力最小,分子或离子的体系能量最低,最稳定。
【注意】 多重键只计其中的σ键电子对,不计π键电子对。
σ键电子对数+孤电子对数=价层电子对数
价层电子对互斥理论
VSEPR模型
略去孤电子对
分子或离子的空间结构
3.价层电子对互斥模型的确定空间结构的步骤
化学式 BeCl2 SO2 CO32- CH4 NH4+ NH3 H2O
σ键 电子对
2
2
3
4
4
3
2
二、价层电子对的计算:价层电子对数=σ键电子对数+孤电子对数
1.σ键电子对:中心原子与几个原子成键,就有几个σ键电子对
【牢记】σ键电子对数=中心原子结合的原子数
a:中心原子的价电子数
主族元素:a=最外层电子数=主族序数
阳离子:a=价电子数-离子所带电荷数
阴离子:a=价电子数+离子所带电荷数
x:中心原子结合
的原子数(配原子数)
b:与中心原子结合的原子(配原子 )最多能接受的电子数
(H为1,其他原子:b=8-配原子的价电子数)
中心原子上的孤电子对数 =
化学式 BeCl2 SO2 CO32- CH4 NH4+ NH3 H2O
孤电子对
0
1
0
0
0
1
2
化学式 BeCl2 SO2 CO32- CH4 NH4+ NH3 H2O
σ键 电子对
孤电 子对
价层 电子对
2
2
3
4
4
3
2
0
1
0
0
0
1
2
2
3
3
4
4
4
4
3.计算中心原子的价层电子对数
价层电子对数=σ键电子对+孤电子对
2
4
3
5
6
直线形 平面三角形 四面体 三角双锥 八面体
3.价层电子对互斥(VSEPR)模型
价层电子对在中心原子周围按尽可能互相远离(即夹角越大越好)的位 置排布,使彼此间排斥力最小。
化学式 BeCl2 SO2 CO32- CH4 NH4+ NH3 H2O
σ键电子对 2 2 3 4 4 3 2
孤电子对 0 1 0 0 0 1 2
价层电子对 2 3 3 4 4 4 4
VSEPR模型
分子 模型
直线
平面
三角
平面
三角
四面体
四面体
四面体
四面体
直线
V形
平面
三角
正四
面体
正四
面体
三角锥
V形
三、VSEPR 模型变为实际空间结构
略去互斥模型中心原子的孤电子对,得分子的空间结构
3.价层电子对互斥模型和分子空间结构的区别与联系
(1)区别
①价层电子对互斥构型(VSEPR模型)是价层电子对的空间构型
②分子的空间构型指的是成键电子对的空间构型,略去孤电子对
(2)联系:两者是否一致取决于中心原子上有无孤电子对
①当中心原子上无孤电子对时,两者的构型一致
②当中心原子上有孤电子对时,两者的构型不一致
【注意】价层电子对互斥模型不能用于预测以过渡金属为中心原子的分子
CH4、NH3、H2O分子的VSEPR模型均为四面体形,为何键角有差异?
【思考与讨论】
4.价层电子对之间的斥力大小顺序:
①孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对
②孤电子对越多,排斥力越大,键角越小
化学式 H3O+ NH2- O3 CHCl3 COCl2 PCl3
σ键 电子对
孤电 子对
价层电子对
分子空间结构
1.用VSEPR模型推测下列微粒的空间结构:
3
1
三角锥形
2
2
V形
2
1
V形
4
0
四面体形
3
0
平面
三角形
3
1
三角锥形
4
4
4
4
3
3
【课堂练习】
分子类型 中心原子 空间构型
AB2 有孤对电子 V型
无孤对电子 直线形
AB3 有孤对电子 三角锥形
无孤对电子 平面三角形
AB4 无孤对电子 四面体形
【归纳小结】
2.下列分子的VSEPR模型与分子的空间结构相同的是 ( )
A
A. CCl4 B.SO32- C.NH3 D.H2O
3.下列分子或离子的中心原子上未用于成键的价电子对最多的是( )
A.H2O B.HCl C.NH4+ D.PCl3
A
4.用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,
也可推测键角大小,下列判断正确的是
A.PCl3为平面三角形 B.SO3与 为平面三角形
C.SO2键角大于120o D.BF3是三角锥形分子
解析:HCl分子属于AB型分子,没有中心原子
B
5.下列关于价层电子对互斥模型(VSEPR 模型)的叙述中不正确的是
A.VSEPR 模型可用预测分子的立体构型
B.VSEPR 模型不能用于预测以过渡金属为中心原子的分子
C.中心原子上的孤电子对也要占据中心原子周围的空间并参
与互相排斥
D.分子中键角越大,价层电子对相互排斥力越大,分子越稳定
D
课堂小结
价电子对互斥模型
σ键电子对
中心原子上的
孤电子对数
价层电子对数
价层电子对
互斥模型
VSEPR模型
略去孤电子对
分子的立体构型
第二章 分子结构与性质
第二节 分子的立体构型
第3课时 杂化轨道理论
1.请根据价层电子对互斥理论分析CH4的立体构型。
2.写出碳原子的核外电子排布图,思考为什么碳原子与氢原子结
合形成CH4,而不是CH2 ?
C原子轨道排布图
1s2
2s2
2p2
H原子轨道排布图
1s1
思考
杂化轨道理论
杂化理论简介
1.概念
在形成分子时,由于原子的相互影响,原子内部能量相近的原子轨道
混杂起来,重新组合形成新的原子轨道的过程叫做原子轨道的杂化。
杂化后的新轨道就称为杂化轨道
3.杂化过程
基态→(激发态)→杂化→轨道重组(形成杂化轨道)
2.杂化条件:①只有在形成化学键时才能杂化。
②只有能量相近的轨道间才能杂化:2s和2p,3s和3p ......
4.杂化轨道的类型:sp、sp2、sp3、spd、sp3d .......
杂化方式由价层电子对数量决定!
价层电子对数 杂化方式 杂化轨道数目 杂化轨道空间构型
2 sp 直线形
3 sp2 平面三角形
4 sp3 正四面体形
【牢记】①杂化轨道空间构型与VSEPR模型完全相同!
②杂化轨道数=价层电子对数=σ键电子对数+中心原子的孤电子对数
2
3
4
4.杂化轨道的形成:
sp 杂化:1个s 轨道与1个p 轨道进行的杂化, 形成2个sp杂化轨道sp杂化轨道的形状为一头大,一头小,含有1/2 s 轨道和1/2 p 轨道的成分,两个轨道间的夹角为180°,呈直线形。
x
y
z
x
y
z
z
x
y
z
x
y
z
180°
180°
sp2杂化:1个s 轨道与2个p 轨道进行的杂化, 形成3个sp2 杂化轨道。每个sp2杂化轨道的形状也为一头大,一头小,含有 1/3 s 轨道和 2/3 p 轨道的成分,每两个轨道间的夹角为120°,呈平面三角形。
4.杂化轨道的形成
x
y
z
x
y
z
z
x
y
z
x
y
z
120°
4.杂化轨道的形成:
sp3杂化:1个s 轨道与3个p 轨道进行的杂化,形成4个sp3 杂化轨道,每个sp3杂化轨道的形状也为一头大,一头小, 含有 1/4 s 轨道和 3/4 p 轨道的成分,每两个轨道间的夹角为109°28’,空间构型为正四面体形。
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
杂化轨道有什么特征呢?
5.杂化轨道的特征
(1)杂化前后轨道数不变。
(2)杂化过程中轨道的形状发生变化。
(3)杂化后形成的化学键更稳定。
(4)杂化后的新轨道能量、形状都相同。
(5)杂化后的轨道之间尽可能远离。
(6)杂化轨道只用于形成σ键和容纳孤电子对。
6.杂化轨道类型的判断方式
1、从价层电子对数判断
2、从VSEPR 模型判断
3、从键角判断(键角 sp :180° sp2 : 120° sp3: 109°28’
4、从化学键的类型判断(针对 C 原子):单键sp3、双键sp2、三键sp
路易斯结构式:用短线表示共用电子对,小黑点表示未键合的孤电子对的结构式。
1.判断正误(对的在括号内打“√”,错的在括号内打“×”)
(1)CH2Cl2分子只有一种,可说明CH4的空间结构为正四面体形 ( )
(2)分子的VSEPR模型和相应分子的空间结构是相同的。 ( )
(3)SO2分子与CO2分子的组成相似,故它们都是直线形分子 ( )
√
×
×
课堂练习
2.下列分子结构与分子中共价键键角对应正确的是 ( )
A.直线形分子:180° B.平面正三角形:120°
C.三角锥形:109°28′ D.正四面体形:109°28′
B
HCl也是直线形分子,因只有一个共价键,故不存在键角
氨分子呈三角锥形,键角为107°
白磷分子是正四面体形分子,但键角分别60°
当堂检测
1.下列分子或离子中,不含有孤对电子的是( )
A.H2O B.H3O+ C.NH3 D.NH4+
2. 下列粒子中,含有孤电子对的是( )
A.SiH4 B.H2O C.CH4 D.NH4+
3. 下列粒子的价电子对数正确的是( )
A.CH4 4 B.CO2 1 C.BF3 2 D.SO3 2
A
B
D
4.下列物质中,分子的立体结构与水分子相似的是( )
A.CO2 B.H2S C.PCl3 D.SiCl4
5.下列分子的立体结构,其中属于直线形分子的是( )
A. H2O B.CO2 C.CH4 D. SO2
6.下列分子立体结构其中属正八面体型分子的( )
A.H3O + B.CO32— C.PCl5 D.SF6
B
B
D
7.以下分子或离子的结构为正四面体,且键角为109°28′ 的是( )
①CH4 ②NH4+ ③CH3Cl ④P4 ⑤SO42-
A.①②③ B.①②④ C.①②⑤ D.①④⑤
8.用价层电子对互斥模型判断SO3的分子构型( )
A.正四面体形 B.V形 C.三角锥形 D.平面三角形
当堂检测
C
D
9.(1)计算下列分子或离子中心原子的价电子对数。
① CCl4_________ ② BeCl2_______
③ BCl3_________ ④ PCl3 ________
4
2
3
4
(2)计算下列分子或离子中心原子的孤电子对数。
① H2S__________ ② PCl5________
③ BF3__________ ④ NH3_________
2
0
0
1
