鲁科版 高中化学 必修第二册 2.3化学反应的快慢和限度同步练习(含答案)
文档属性
| 名称 | 鲁科版 高中化学 必修第二册 2.3化学反应的快慢和限度同步练习(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-07 21:33:56 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2.3化学反应的快慢和限度同步练习-鲁科版高中化学必修第二册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在两个恒容密闭容器中进行下列两个可逆反应:(甲)C(s)+H2O(g)CO(g)+H2(g);(乙)CO(g)+H2O(g)CO2(g)+H2(g)。现有下列状态:①混合气体的平均相对分子质量不再改变 ②恒温时,气体的压强不再改变 ③各气体组分浓度相等 ④混合气体的密度保持不变 ⑤单位时间内,消耗水蒸气的质量与生成氢气的质量比为9:1⑥同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明(甲)、(乙)容器中反应都达到平衡状态的是
A.①②⑤ B.③④⑥ C.①⑥ D.⑥
2.CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,下列说法正确的是
A.改变压强,平衡不发生移动,反应放出的热量不变
B.加入催化剂,改变了反应的途径,反应的△H也随之改变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
3.反应2SO2 + O2 2SO3是工业生产硫酸的关键步骤,下列说法不正确的
A.实际生产中,此反应在接触室进行
B.过量空气能提高SO2的转化率
C.使用催化剂能提高该反应的反应速率
D.2molSO2与1molO2混合一定能生成2molSO3
4.在一定条件下容积不变的密闭容器中,发生可逆反应N2(g)+3H2(g) 2NH3(g)下列情况不能说明该反应一定达到化学平衡的是
A.NH3的质量保持不变 B.N2、H2和NH3的物质的量之比为1:3:2
C.正反应和逆反应的速率相等 D.容器内压强不再改变
5.在室温下,将形状和质量都相同的两块铁片分别与下列物质反应,化学反应速率最快的是
A.的盐酸 B.的盐酸
C.的硫酸 D.的浓硫酸
6.化学与生产、生活密切相关,下列说法正确的是
A.《本草纲目拾遗》中对强水的记载:“性最猛烈,能蚀五金”,强水为强电解质
B.“阳燧火镜也。以铜铸成,其面凹,摩热向日,以艾承之,则得火”,阳燧是一种将太阳能转化为热能的装置
C.“丹砂烧之成水银,积变又还成丹砂”描述的是可逆反应
D.“火树银花合,星桥铁锁开”中只涉及化学能转化为热能
7.一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g) H2(g)+I2(g)。若c(HI)由0.1mol/L降到0.08mol/L时,需要20s,那么c(HI)由0.08mol/L降到0.07mol/L时,所需反应的时间为
A.等于5s B.等于10s C.大于10s D.小于10s
8.在一定温度下,可逆反应A(g) + 3B(g)2C(g)达到平衡的标志是
A.A的生成速率与C的分解速率相等
B.单位时间内生成n mol A,同时生成3n mol B
C.A、B、C的浓度不再变化
D.A、B、C的浓度之比为1:3:2
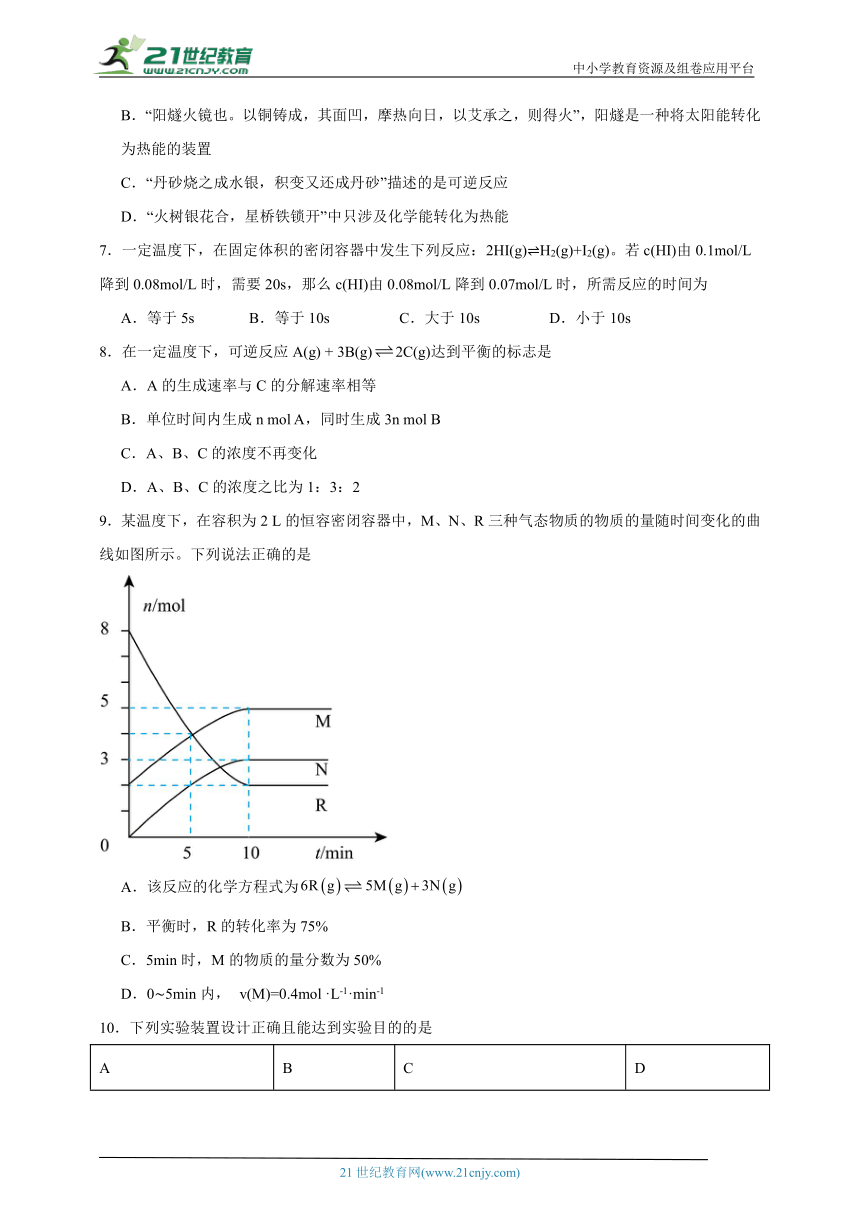
9.某温度下,在容积为2 L的恒容密闭容器中,M、N、R三种气态物质的物质的量随时间变化的曲线如图所示。下列说法正确的是
A.该反应的化学方程式为
B.平衡时,R的转化率为75%
C.5min时,M的物质的量分数为50%
D.0 5min内, v(M)=0.4mol ·L-1·min-1
10.下列实验装置设计正确且能达到实验目的的是
A B C D
处理尾气 检验二氧化硫的漂白性 探究对和反应速率的影响 制取并较长时间观察到白色沉淀
A.A B.B C.C D.D
二、填空题
11.将气体A、B置于的密闭容器中,发生如下反应:,反应进行到末,测得A的物质的量为,C的物质的量为,内D的反应速率为,则:
(1)用C表示内反应的平均反应速率为 。
(2)生成物D的化学计量数n为 。
(3)末反应物A的转化率为 。
(4)若只改变下列一个条件,生成C的速率分别如何变化?请填写表中空格。
编号 改变的条件 生成C的速率(填“增大”或“减小”或“不变)
① 升高温度
② 增大B的物质的量
③ 扩大容器体积
(5)反应进程中,正反应速率随时间的变化曲线如图所示:
①该反应为 反应(填“吸热”或“放热”),理由是 。
②反应在c点处v(正) v(逆)(填“>”或“=”或“<”)。
③若,反应物B的转化率:段 段(填“>”或“=”或“<”)。
12.(1)已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
时间(min) 1 2 3 4 5
氢气体积(mL) 30 120 280 350 370
①反应速率最大的(即0~1、l~2、2~3、3~4、4~5min)时间段为 . 原因是
②反应速率最小的时间段为 , 原因是
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他的做法可行的是 (填相应字母);做法不可行的理由是 .
13.I.硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
(1)图1中与图2中M、N对应的物质分别是 、 。
(2)X与Y反应中氧化剂与还原剂的物质的量之比为 。
(3)SO2和氯水都有漂白性,为了增强漂白效果,有人将氯水和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因为 。
II.为探究影响H2O2分解速率的因素,设计如表实验:
编号 温度 c(H2O2)/mol·L 1 V(H2O2)/mL 催化剂
① 20℃ 0.4 10 无
② 20℃ 0.8 10 无
③ 30℃ 0.4 10 无
④ 30℃ 0.4 10 MnO2
(4)实验①③研究的是 对H2O2分解速率的影响。
(5)记录实验①在第5min时收集到气体22.4mL(已折算成标准状况),则5min内,v(H2O2)= 。
(6)实验①②研究的是 对H2O2分解速率的影响。
(7)若向0.4mol/LH2O2中加入少量KI,H2O2的分解机理为:
第一步:H2O2+I-→H2O+IO-
第二步:H2O2+IO-→H2O+O2+I-
据此说明KI在H2O2的分解中起 作用。
14.汽车尾气中CO、在一定条件下可发生反应,一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和,的物质的量随时间的变化曲线如图所示:
(1)0~10min内该反应的平均反应速率
(2)恒温恒容条件下,不能说明该反应已经达到平衡状态的是 (填序号)
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.容器内混合气体密度保持不变
15.烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)烟气脱硫、脱硝的环境意义是 ;
(2)一种选择性催化脱硝(NO2)的原理为:6NO2+8NH3 7N2+12H2O
① 上述反应中被还原的元素是 (填元素符号),反应中每转移3mol电子,生成标准状况下N2的体积为 ;
② 超音速飞机排放的尾气是平流层中NOx的主要来源.它们破坏臭氧层的主要机理为:
Ⅰ 、O3O+O2 Ⅱ 、NO+O3→NO2+O2 Ⅲ 、 NO2+O→ NO+O2
上述反应中NOx所起的作用是 ;
(3)下表列出了2种燃煤烟气脱硫方法的原理。
方法Ⅰ 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4
方法Ⅱ 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫
①方法Ⅰ中用氨水吸收燃煤烟气中的SO2转化为NH4HSO3,是利用了SO2的 性质(选填字母编号)。
A.漂白性 B.氧化性 C.还原性 D.酸性氧化物
②方法Ⅰ中氨水吸收燃煤烟气中SO2的化学反应为:2NH3+SO2+H2O=(NH4)2SO3
(NH4)2SO3+SO2+H2O=2NH4HSO3,能提高燃煤烟气中SO2去除率的措施有 (填字母).
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
③采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的CO2,原因是 (用离子方程式表示)。
16.(1)某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如下图所示,由图中数据分析得:
①该反应的化学方程式为 ;
②反应开始至4min时,B的平均反应速率为 ,A的反应速率为 ,A的转化率为 。
③4min时,反应是否达到平衡状态? (填“是”或“否”),8min时,v(正) v(逆)(填“>”、“<”或“=”)。
(2)下图表示在密闭容器中反应:2SO2(g) + O2(g) 2SO3(g)△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是 ;b时改变的条件可能是 。
17.SO2、CO、NOx的过度排放会对环境和人体健康带来极大的危害,工业上可采取多种方法减少这些有害气体的排放。回答下列问题:
I.用钙钠双碱工艺脱除SO2:
①用NaOH溶液吸收SO2生成Na2SO3溶液;
②用CaO使NaOH溶液再生NaOH溶液Na2SO3
(1)CaO在水中存在如下转化:CaO(s)+H2O(l)=Ca(OH)2(s) Ca2+(aq)+2OH-(aq)。从平衡移动的角度,简述过程②NaOH再生的原理 。
(2)25℃时,氢氧化钠溶液吸收SO2,当得到pH=9的吸收液,该吸收液中c(SO)∶c(HSO)= 。(已知25℃时,亚硫酸Ka1=1.3×10-2;Ka2=6.2×10–7)
II.汽车尾气中的NO和CO在催化转化器中反应生成两种无毒无害的气体:2NO+2CON2+2CO2,可减少尾气中有害气体排放。已知该反应的v正=k正c2(NO)c2(CO),v逆=k逆c(N2)c2(CO2)(k正、k逆为速率常数,只与温度有关)。
(3)已知:碳的燃烧热为393.5kJ/mol
N2(g)+O2(g)=2NO(g) H1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g) H2=-221kJ/mol
则:2NO(g)+2CO(g)N2(g)+2CO2(g) H= kJ/mol。若平衡后升高温度,则 (填“增大”、“不变”或“减小”)
(4)将CO和NO按不同比例投入一密闭容器中,控制一定温度(T1或T2),发生反应达到平衡时,所得的混合气体中含N2的体积分数随的变化曲线如图所示。
①图中a、b、c、d中对应NO转化率最大的是 。
②若=1,T1温度下,反应达平衡时,体系的总压强为aPa、N2的体积分数为20%,该温度下反应的平衡常数Kp为 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)催化剂性能决定了尾气处理效果。将NO和CO以一定的流速通过两种不同的催化剂(I、II)进行反应,测量逸出气体中NO含量,可测算尾气脱氮率。相同时间内,脱氮率随温度变化曲线如图所示。
①曲线上a点的脱氮率 (填“>”、“<”或“=”)对应温度下的平衡脱氮率。
②催化剂II条件下,450℃后,脱氮率随温度升高而下降的原因可能是 。
18.利用甲醇和水蒸气重整为燃料电池提供氢气。甲醇和水蒸气重整的主要反应是:反应i:CH3OH(g)+H2O(g)CO2(g)+3H2(g) △H1= +49 kJ/mol。同时,存在副反应:反应ii:CH3OH(g)CO(g)+2H2(g) △H2= +91 kJ/mol
(1)反应i的平衡常数K的表达式是 。
(2)为探究条件对反应i平衡的影响,X、 Y(Y1、Y2)可分别代表压强或温度。下图表示Y一定时,反应i中H2O(g)的平衡转化率随X的变化关系。
① X代表的物理量是 。
② 判断Y1 Y2(填“>”或“<”),理由是 。
(3)CO易使反应i的催化剂中毒,研究温度和投料比对甲醇转化率及重整气中CO物质的量分数的影响,结果如图所示。
①选择250℃、水/甲醇投料比为2作为最佳条件进行反应,原因是 。
②250℃时CO物质的量分数始终高于200℃时CO物质的量分数的原因可能是 。
19.在2L绝热密闭容器中投入2molSO2和bmolO2,下图是部分反应物随时间的变化曲线。
①10 min时,v(SO3)= 。
②反应达到平衡时,SO2的转化率为 。
③下列情况能说明该反应达到化学平衡的是 。
A.v(SO3)=v(SO2) B.混合气体的密度保持不变
C.t时刻,体系的温度不再发生改变 D.混合气体的总物质的量不再改变
20.碘及其化合物在生产生活中有重要作用。
(1)单质碘可与氢气反应生成碘化氢。将物质的量比为的氢气和碘蒸气放入恒容密闭容器中进行反应:,反应经过5分钟测得碘化氢的浓度为,碘蒸气的浓度为。
①前5分钟平均反应速率 ,的初始浓度是 。
②下列能说明反应已达平衡状态的是(填序号)
a.氢气的生成速率等于碘化氢的消耗速率
b.单位时间内断裂的键数目与断裂的键数目相等
c.
d.
e.反应混合体系的压强不再发生变化
f.反应混合体系的颜色不再发生变化
(2)某化学兴趣小组为探究影响化学反应速率的因素,根据反应,设计并进行实验。实验数据如下:
试验编号 起始浓度() 起始浓度() 温度/℃ 3s内的平均反应速率/()
1 0.1000 0.1000 25 0.0076
2 0.1000 0.2000 25 0.0152
3 0.1000 0.3000 25 v
4 0.1000 c 35 0.0304
i.该实验1、2、3探究 ,对反应速率的影响,因此v= 。
ii.实验4是为了探究温度对化学反应速率影响的对比实验,若温度每升高10℃,速率变为原来的4倍,则表中c= 。
三、实验题
21.研究不同 pH 时 CuSO4 溶液对 H2O2 分解的催化作用。资料:a.Cu2O 为红色固体,难溶于水,能溶于硫酸,生成 Cu 和Cu2+。b.CuO2 为棕褐色固体,难溶于水,能溶于硫酸,生成 Cu2+和 H2O2。c.H2O2 有弱酸性:H2O2 H+ +HO2-,HO2- H+ +O22-。
编号 实验 现象
Ⅰ 向 1 mL pH=2 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 出现少量气泡
Ⅱ 向 1 mL pH=3 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 立即产生少量棕黄色沉淀,出现较明显气泡
Ⅲ 向 1 mL pH=5 的 1 mol·L 1CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 立即产生大量棕褐色沉淀,产生大量气泡
(1) 经检验生成的气体均为 O2,Ⅰ中 CuSO4 催化分解 H2O2 的化学方程式是 。
(2)对Ⅲ中棕褐色沉淀的成分提出 2 种假设:ⅰ.CuO2,ⅱ.Cu2O 和CuO2 的混合物。为检验上述假设,进行实验Ⅳ:过滤Ⅲ中的沉淀,洗涤,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。
①若Ⅲ中生成的沉淀为 CuO2,其反应的离子方程式是 。
②依据Ⅳ中沉淀完全溶解,甲同学认为假设ⅱ不成立,乙同学不同意甲同学的观点,理由是 。
③为探究沉淀中是否存在 Cu2O,设计如下实验:
将Ⅲ中沉淀洗涤、干燥后,取 a g 固体溶于过量稀硫酸,充分加热。冷却后调节溶液 pH,以 PAN 为指示剂,向溶液中滴加 c mol·L 1EDTA 溶液至滴定终点,消耗 EDTA 溶液 V mL。V= ,可知沉淀中不含 Cu2O,假设ⅰ成立。(已知:Cu2++EDTA= EDTA-Cu2+,M(CuO2)=96 g·mol 1,M(Cu2O)=144 g·mol 1)
(3)结合方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因 。
(4)研究Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 分解速率不同的原因。
实验Ⅴ:在试管中分别取 1 mL pH=2、3、5 的 1 mol·L 1 Na2SO4 溶液,向其中各加入 0.5 mL 30% H2O2 溶液,三支试管中均无明显现象。
实验Ⅵ: (填实验操作和现象),说明 CuO2 能够催化 H2O2 分解。
(5)综合上述实验,Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 的分解速率不同的原因是 。
22.小组同学研究H2O2分解速率的影响因素。查阅资料得到70℃时,不同条件下H2O2浓度随时间的变化图。(其中Mn2+做催化剂)
(1)H2O2分解反应的化学方程式是 。
(2)由甲可知,一定条件下,H2O2的初始浓度越大,反应速率越 (填“快”或者“慢”)。
(3) A同学根据图乙得出结论:“其他条件保持不变,溶液碱性越强,H2O2分解速率越大”,此处的“其他条件”具体是指 。
(4)B同学得出结论:“催化剂能加快H2O2分解速率”。 C同学认为该结论有其合理的一面,也有不合理的一面。请结合图象说明:
① 认为该结论合理的依据是 ;
② 认为该结论不合理的依据是 。
23.某同学用硫代硫酸钠(Na2S2O3)与盐酸进行探究实验,实验方法如图所示:
实验序号 Na2S2O3溶液 盐酸溶液 蒸馏水 温度/℃
浓度(mol/L) 体积/mL 浓度(mol/L) 体积/mL 体积/mL
I 0.1 1.5 0.1 1.5 10 20
II 0.1 2.5 0.1 1.5 9 a
III 0.1 b 0.1 1.5 9 30
(1)该探究实验的实验目的为 。
(2)表中,a为 ,b为 。
(3)实验表明,实验III的反应速率最快,支持这一结论的实验现象为 。
(4)为了更好的完成这个探究实验,你认为还可以进行探究的因素有 。
参考答案:
1.D
2.A
3.D
4.B
5.C
6.B
7.C
8.C
9.B
10.D
11. 0.025 4 25%或0.25 增大 增大 减小 放热 随着反应的进行,反应物浓度不断减小,由此引发反应速率减小,只有放热反应使温度升高,导致初始阶段反应速率增大 > <
12. 2~3min 该反应为放热反应,此时温度最高 4~5min 此时氢离子浓度最小 AC 构成原电池,加快反应速率
13.(1) CaSO4·2H2O、Na2SO4·10H2O CuFeS2
(2)1∶2
(3)Cl2+SO2+2H2O=2Cl-+SO+4H+
(4)温度
(5)0.04mol/(L·min)
(6)过氧化氢浓度
(7)催化
14. C
15. 防止酸雨的发生 N 19.6 L 催化剂 D A、C HCO3-+SO2=CO2+HSO3-
16. 2A B 0.025mol/(L min) 0.05mol/(L min) 50% 否 = 升温 分离出SO3
17.(1)SO与Ca2+生成CaSO3沉淀,平衡向正向移动,生成NaOH
(2)620
(3) -746.5 增大
(4) c Pa-1
(5) < 温度超过450℃时,催化剂的活性可能降低,催化效果减弱,相同时间内脱氮率下降或反应已达平衡,温度升高平衡逆向移动
18. K= 温度 > 反应i的正反应方向气体体积增大,当温度一定时,压强增大,反应向左移动,H2O(g)平衡转化率减小。 此条件下甲醇的平衡转化率最高,且CO的物质的量分数较小。 投料比一定,温度升高,反应ii向右移动,反应i也向右移动使c(CH3OH)减少而使反应ii左移,温度对反应ii的影响较后者大,所以整体表现为250℃时CO含量较高。
19. 0.05mol/(L·min) 70% CD
20.(1) 0.02mol·L-1·min-1 0.4 d f
(2) 浓度 0.0228 0.1000
21. 2H2O2 O2↑+2H2O H2O2+Cu2+=CuO2↓+2H+ CuO2与H+反应产生的H2O2具有强氧化性,在酸性条件下可能会氧化Cu2O或Cu,无法观察到红色沉淀Cu 溶液中存在H2O2H+ +HO2-,HO2-H+ +O22-,溶液pH增大,两个平衡均正向移动,O22-浓度增大,使得CuO2沉淀量增大 将Ⅲ中沉淀过滤,洗涤,干燥,称取少量于试管中,加入30%H2O2溶液,立即产生大量气泡,反应结束后,测得干燥后固体的质量不变 CuO2的催化能力强于Cu2+;随pH增大,Cu2+与H2O2反应生成CuO2增多
22. 2H2O2 2H2O+O2↑ 快 温度70℃、H2O2初始浓度为0.16 mol/L、无催化剂 由图丁可知,在0.1mol/L NaOH溶液的体系中,有催化剂时,双氧水分解速率加快 由图丙可知,当溶液中氢氧化钠浓度为0 时,有催化剂时,双氧水也不能分解
23. 探究浓度与温度对化学反应速率的影响 20 2.5 实验III溶液中生成黄色沉淀的时间最短 催化剂等
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2.3化学反应的快慢和限度同步练习-鲁科版高中化学必修第二册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在两个恒容密闭容器中进行下列两个可逆反应:(甲)C(s)+H2O(g)CO(g)+H2(g);(乙)CO(g)+H2O(g)CO2(g)+H2(g)。现有下列状态:①混合气体的平均相对分子质量不再改变 ②恒温时,气体的压强不再改变 ③各气体组分浓度相等 ④混合气体的密度保持不变 ⑤单位时间内,消耗水蒸气的质量与生成氢气的质量比为9:1⑥同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明(甲)、(乙)容器中反应都达到平衡状态的是
A.①②⑤ B.③④⑥ C.①⑥ D.⑥
2.CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,下列说法正确的是
A.改变压强,平衡不发生移动,反应放出的热量不变
B.加入催化剂,改变了反应的途径,反应的△H也随之改变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
3.反应2SO2 + O2 2SO3是工业生产硫酸的关键步骤,下列说法不正确的
A.实际生产中,此反应在接触室进行
B.过量空气能提高SO2的转化率
C.使用催化剂能提高该反应的反应速率
D.2molSO2与1molO2混合一定能生成2molSO3
4.在一定条件下容积不变的密闭容器中,发生可逆反应N2(g)+3H2(g) 2NH3(g)下列情况不能说明该反应一定达到化学平衡的是
A.NH3的质量保持不变 B.N2、H2和NH3的物质的量之比为1:3:2
C.正反应和逆反应的速率相等 D.容器内压强不再改变
5.在室温下,将形状和质量都相同的两块铁片分别与下列物质反应,化学反应速率最快的是
A.的盐酸 B.的盐酸
C.的硫酸 D.的浓硫酸
6.化学与生产、生活密切相关,下列说法正确的是
A.《本草纲目拾遗》中对强水的记载:“性最猛烈,能蚀五金”,强水为强电解质
B.“阳燧火镜也。以铜铸成,其面凹,摩热向日,以艾承之,则得火”,阳燧是一种将太阳能转化为热能的装置
C.“丹砂烧之成水银,积变又还成丹砂”描述的是可逆反应
D.“火树银花合,星桥铁锁开”中只涉及化学能转化为热能
7.一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g) H2(g)+I2(g)。若c(HI)由0.1mol/L降到0.08mol/L时,需要20s,那么c(HI)由0.08mol/L降到0.07mol/L时,所需反应的时间为
A.等于5s B.等于10s C.大于10s D.小于10s
8.在一定温度下,可逆反应A(g) + 3B(g)2C(g)达到平衡的标志是
A.A的生成速率与C的分解速率相等
B.单位时间内生成n mol A,同时生成3n mol B
C.A、B、C的浓度不再变化
D.A、B、C的浓度之比为1:3:2
9.某温度下,在容积为2 L的恒容密闭容器中,M、N、R三种气态物质的物质的量随时间变化的曲线如图所示。下列说法正确的是
A.该反应的化学方程式为
B.平衡时,R的转化率为75%
C.5min时,M的物质的量分数为50%
D.0 5min内, v(M)=0.4mol ·L-1·min-1
10.下列实验装置设计正确且能达到实验目的的是
A B C D
处理尾气 检验二氧化硫的漂白性 探究对和反应速率的影响 制取并较长时间观察到白色沉淀
A.A B.B C.C D.D
二、填空题
11.将气体A、B置于的密闭容器中,发生如下反应:,反应进行到末,测得A的物质的量为,C的物质的量为,内D的反应速率为,则:
(1)用C表示内反应的平均反应速率为 。
(2)生成物D的化学计量数n为 。
(3)末反应物A的转化率为 。
(4)若只改变下列一个条件,生成C的速率分别如何变化?请填写表中空格。
编号 改变的条件 生成C的速率(填“增大”或“减小”或“不变)
① 升高温度
② 增大B的物质的量
③ 扩大容器体积
(5)反应进程中,正反应速率随时间的变化曲线如图所示:
①该反应为 反应(填“吸热”或“放热”),理由是 。
②反应在c点处v(正) v(逆)(填“>”或“=”或“<”)。
③若,反应物B的转化率:段 段(填“>”或“=”或“<”)。
12.(1)已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
时间(min) 1 2 3 4 5
氢气体积(mL) 30 120 280 350 370
①反应速率最大的(即0~1、l~2、2~3、3~4、4~5min)时间段为 . 原因是
②反应速率最小的时间段为 , 原因是
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他的做法可行的是 (填相应字母);做法不可行的理由是 .
13.I.硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
(1)图1中与图2中M、N对应的物质分别是 、 。
(2)X与Y反应中氧化剂与还原剂的物质的量之比为 。
(3)SO2和氯水都有漂白性,为了增强漂白效果,有人将氯水和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因为 。
II.为探究影响H2O2分解速率的因素,设计如表实验:
编号 温度 c(H2O2)/mol·L 1 V(H2O2)/mL 催化剂
① 20℃ 0.4 10 无
② 20℃ 0.8 10 无
③ 30℃ 0.4 10 无
④ 30℃ 0.4 10 MnO2
(4)实验①③研究的是 对H2O2分解速率的影响。
(5)记录实验①在第5min时收集到气体22.4mL(已折算成标准状况),则5min内,v(H2O2)= 。
(6)实验①②研究的是 对H2O2分解速率的影响。
(7)若向0.4mol/LH2O2中加入少量KI,H2O2的分解机理为:
第一步:H2O2+I-→H2O+IO-
第二步:H2O2+IO-→H2O+O2+I-
据此说明KI在H2O2的分解中起 作用。
14.汽车尾气中CO、在一定条件下可发生反应,一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和,的物质的量随时间的变化曲线如图所示:
(1)0~10min内该反应的平均反应速率
(2)恒温恒容条件下,不能说明该反应已经达到平衡状态的是 (填序号)
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.容器内混合气体密度保持不变
15.烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)烟气脱硫、脱硝的环境意义是 ;
(2)一种选择性催化脱硝(NO2)的原理为:6NO2+8NH3 7N2+12H2O
① 上述反应中被还原的元素是 (填元素符号),反应中每转移3mol电子,生成标准状况下N2的体积为 ;
② 超音速飞机排放的尾气是平流层中NOx的主要来源.它们破坏臭氧层的主要机理为:
Ⅰ 、O3O+O2 Ⅱ 、NO+O3→NO2+O2 Ⅲ 、 NO2+O→ NO+O2
上述反应中NOx所起的作用是 ;
(3)下表列出了2种燃煤烟气脱硫方法的原理。
方法Ⅰ 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4
方法Ⅱ 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫
①方法Ⅰ中用氨水吸收燃煤烟气中的SO2转化为NH4HSO3,是利用了SO2的 性质(选填字母编号)。
A.漂白性 B.氧化性 C.还原性 D.酸性氧化物
②方法Ⅰ中氨水吸收燃煤烟气中SO2的化学反应为:2NH3+SO2+H2O=(NH4)2SO3
(NH4)2SO3+SO2+H2O=2NH4HSO3,能提高燃煤烟气中SO2去除率的措施有 (填字母).
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
③采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的CO2,原因是 (用离子方程式表示)。
16.(1)某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如下图所示,由图中数据分析得:
①该反应的化学方程式为 ;
②反应开始至4min时,B的平均反应速率为 ,A的反应速率为 ,A的转化率为 。
③4min时,反应是否达到平衡状态? (填“是”或“否”),8min时,v(正) v(逆)(填“>”、“<”或“=”)。
(2)下图表示在密闭容器中反应:2SO2(g) + O2(g) 2SO3(g)△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是 ;b时改变的条件可能是 。
17.SO2、CO、NOx的过度排放会对环境和人体健康带来极大的危害,工业上可采取多种方法减少这些有害气体的排放。回答下列问题:
I.用钙钠双碱工艺脱除SO2:
①用NaOH溶液吸收SO2生成Na2SO3溶液;
②用CaO使NaOH溶液再生NaOH溶液Na2SO3
(1)CaO在水中存在如下转化:CaO(s)+H2O(l)=Ca(OH)2(s) Ca2+(aq)+2OH-(aq)。从平衡移动的角度,简述过程②NaOH再生的原理 。
(2)25℃时,氢氧化钠溶液吸收SO2,当得到pH=9的吸收液,该吸收液中c(SO)∶c(HSO)= 。(已知25℃时,亚硫酸Ka1=1.3×10-2;Ka2=6.2×10–7)
II.汽车尾气中的NO和CO在催化转化器中反应生成两种无毒无害的气体:2NO+2CON2+2CO2,可减少尾气中有害气体排放。已知该反应的v正=k正c2(NO)c2(CO),v逆=k逆c(N2)c2(CO2)(k正、k逆为速率常数,只与温度有关)。
(3)已知:碳的燃烧热为393.5kJ/mol
N2(g)+O2(g)=2NO(g) H1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g) H2=-221kJ/mol
则:2NO(g)+2CO(g)N2(g)+2CO2(g) H= kJ/mol。若平衡后升高温度,则 (填“增大”、“不变”或“减小”)
(4)将CO和NO按不同比例投入一密闭容器中,控制一定温度(T1或T2),发生反应达到平衡时,所得的混合气体中含N2的体积分数随的变化曲线如图所示。
①图中a、b、c、d中对应NO转化率最大的是 。
②若=1,T1温度下,反应达平衡时,体系的总压强为aPa、N2的体积分数为20%,该温度下反应的平衡常数Kp为 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)催化剂性能决定了尾气处理效果。将NO和CO以一定的流速通过两种不同的催化剂(I、II)进行反应,测量逸出气体中NO含量,可测算尾气脱氮率。相同时间内,脱氮率随温度变化曲线如图所示。
①曲线上a点的脱氮率 (填“>”、“<”或“=”)对应温度下的平衡脱氮率。
②催化剂II条件下,450℃后,脱氮率随温度升高而下降的原因可能是 。
18.利用甲醇和水蒸气重整为燃料电池提供氢气。甲醇和水蒸气重整的主要反应是:反应i:CH3OH(g)+H2O(g)CO2(g)+3H2(g) △H1= +49 kJ/mol。同时,存在副反应:反应ii:CH3OH(g)CO(g)+2H2(g) △H2= +91 kJ/mol
(1)反应i的平衡常数K的表达式是 。
(2)为探究条件对反应i平衡的影响,X、 Y(Y1、Y2)可分别代表压强或温度。下图表示Y一定时,反应i中H2O(g)的平衡转化率随X的变化关系。
① X代表的物理量是 。
② 判断Y1 Y2(填“>”或“<”),理由是 。
(3)CO易使反应i的催化剂中毒,研究温度和投料比对甲醇转化率及重整气中CO物质的量分数的影响,结果如图所示。
①选择250℃、水/甲醇投料比为2作为最佳条件进行反应,原因是 。
②250℃时CO物质的量分数始终高于200℃时CO物质的量分数的原因可能是 。
19.在2L绝热密闭容器中投入2molSO2和bmolO2,下图是部分反应物随时间的变化曲线。
①10 min时,v(SO3)= 。
②反应达到平衡时,SO2的转化率为 。
③下列情况能说明该反应达到化学平衡的是 。
A.v(SO3)=v(SO2) B.混合气体的密度保持不变
C.t时刻,体系的温度不再发生改变 D.混合气体的总物质的量不再改变
20.碘及其化合物在生产生活中有重要作用。
(1)单质碘可与氢气反应生成碘化氢。将物质的量比为的氢气和碘蒸气放入恒容密闭容器中进行反应:,反应经过5分钟测得碘化氢的浓度为,碘蒸气的浓度为。
①前5分钟平均反应速率 ,的初始浓度是 。
②下列能说明反应已达平衡状态的是(填序号)
a.氢气的生成速率等于碘化氢的消耗速率
b.单位时间内断裂的键数目与断裂的键数目相等
c.
d.
e.反应混合体系的压强不再发生变化
f.反应混合体系的颜色不再发生变化
(2)某化学兴趣小组为探究影响化学反应速率的因素,根据反应,设计并进行实验。实验数据如下:
试验编号 起始浓度() 起始浓度() 温度/℃ 3s内的平均反应速率/()
1 0.1000 0.1000 25 0.0076
2 0.1000 0.2000 25 0.0152
3 0.1000 0.3000 25 v
4 0.1000 c 35 0.0304
i.该实验1、2、3探究 ,对反应速率的影响,因此v= 。
ii.实验4是为了探究温度对化学反应速率影响的对比实验,若温度每升高10℃,速率变为原来的4倍,则表中c= 。
三、实验题
21.研究不同 pH 时 CuSO4 溶液对 H2O2 分解的催化作用。资料:a.Cu2O 为红色固体,难溶于水,能溶于硫酸,生成 Cu 和Cu2+。b.CuO2 为棕褐色固体,难溶于水,能溶于硫酸,生成 Cu2+和 H2O2。c.H2O2 有弱酸性:H2O2 H+ +HO2-,HO2- H+ +O22-。
编号 实验 现象
Ⅰ 向 1 mL pH=2 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 出现少量气泡
Ⅱ 向 1 mL pH=3 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 立即产生少量棕黄色沉淀,出现较明显气泡
Ⅲ 向 1 mL pH=5 的 1 mol·L 1CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 立即产生大量棕褐色沉淀,产生大量气泡
(1) 经检验生成的气体均为 O2,Ⅰ中 CuSO4 催化分解 H2O2 的化学方程式是 。
(2)对Ⅲ中棕褐色沉淀的成分提出 2 种假设:ⅰ.CuO2,ⅱ.Cu2O 和CuO2 的混合物。为检验上述假设,进行实验Ⅳ:过滤Ⅲ中的沉淀,洗涤,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。
①若Ⅲ中生成的沉淀为 CuO2,其反应的离子方程式是 。
②依据Ⅳ中沉淀完全溶解,甲同学认为假设ⅱ不成立,乙同学不同意甲同学的观点,理由是 。
③为探究沉淀中是否存在 Cu2O,设计如下实验:
将Ⅲ中沉淀洗涤、干燥后,取 a g 固体溶于过量稀硫酸,充分加热。冷却后调节溶液 pH,以 PAN 为指示剂,向溶液中滴加 c mol·L 1EDTA 溶液至滴定终点,消耗 EDTA 溶液 V mL。V= ,可知沉淀中不含 Cu2O,假设ⅰ成立。(已知:Cu2++EDTA= EDTA-Cu2+,M(CuO2)=96 g·mol 1,M(Cu2O)=144 g·mol 1)
(3)结合方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因 。
(4)研究Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 分解速率不同的原因。
实验Ⅴ:在试管中分别取 1 mL pH=2、3、5 的 1 mol·L 1 Na2SO4 溶液,向其中各加入 0.5 mL 30% H2O2 溶液,三支试管中均无明显现象。
实验Ⅵ: (填实验操作和现象),说明 CuO2 能够催化 H2O2 分解。
(5)综合上述实验,Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 的分解速率不同的原因是 。
22.小组同学研究H2O2分解速率的影响因素。查阅资料得到70℃时,不同条件下H2O2浓度随时间的变化图。(其中Mn2+做催化剂)
(1)H2O2分解反应的化学方程式是 。
(2)由甲可知,一定条件下,H2O2的初始浓度越大,反应速率越 (填“快”或者“慢”)。
(3) A同学根据图乙得出结论:“其他条件保持不变,溶液碱性越强,H2O2分解速率越大”,此处的“其他条件”具体是指 。
(4)B同学得出结论:“催化剂能加快H2O2分解速率”。 C同学认为该结论有其合理的一面,也有不合理的一面。请结合图象说明:
① 认为该结论合理的依据是 ;
② 认为该结论不合理的依据是 。
23.某同学用硫代硫酸钠(Na2S2O3)与盐酸进行探究实验,实验方法如图所示:
实验序号 Na2S2O3溶液 盐酸溶液 蒸馏水 温度/℃
浓度(mol/L) 体积/mL 浓度(mol/L) 体积/mL 体积/mL
I 0.1 1.5 0.1 1.5 10 20
II 0.1 2.5 0.1 1.5 9 a
III 0.1 b 0.1 1.5 9 30
(1)该探究实验的实验目的为 。
(2)表中,a为 ,b为 。
(3)实验表明,实验III的反应速率最快,支持这一结论的实验现象为 。
(4)为了更好的完成这个探究实验,你认为还可以进行探究的因素有 。
参考答案:
1.D
2.A
3.D
4.B
5.C
6.B
7.C
8.C
9.B
10.D
11. 0.025 4 25%或0.25 增大 增大 减小 放热 随着反应的进行,反应物浓度不断减小,由此引发反应速率减小,只有放热反应使温度升高,导致初始阶段反应速率增大 > <
12. 2~3min 该反应为放热反应,此时温度最高 4~5min 此时氢离子浓度最小 AC 构成原电池,加快反应速率
13.(1) CaSO4·2H2O、Na2SO4·10H2O CuFeS2
(2)1∶2
(3)Cl2+SO2+2H2O=2Cl-+SO+4H+
(4)温度
(5)0.04mol/(L·min)
(6)过氧化氢浓度
(7)催化
14. C
15. 防止酸雨的发生 N 19.6 L 催化剂 D A、C HCO3-+SO2=CO2+HSO3-
16. 2A B 0.025mol/(L min) 0.05mol/(L min) 50% 否 = 升温 分离出SO3
17.(1)SO与Ca2+生成CaSO3沉淀,平衡向正向移动,生成NaOH
(2)620
(3) -746.5 增大
(4) c Pa-1
(5) < 温度超过450℃时,催化剂的活性可能降低,催化效果减弱,相同时间内脱氮率下降或反应已达平衡,温度升高平衡逆向移动
18. K= 温度 > 反应i的正反应方向气体体积增大,当温度一定时,压强增大,反应向左移动,H2O(g)平衡转化率减小。 此条件下甲醇的平衡转化率最高,且CO的物质的量分数较小。 投料比一定,温度升高,反应ii向右移动,反应i也向右移动使c(CH3OH)减少而使反应ii左移,温度对反应ii的影响较后者大,所以整体表现为250℃时CO含量较高。
19. 0.05mol/(L·min) 70% CD
20.(1) 0.02mol·L-1·min-1 0.4 d f
(2) 浓度 0.0228 0.1000
21. 2H2O2 O2↑+2H2O H2O2+Cu2+=CuO2↓+2H+ CuO2与H+反应产生的H2O2具有强氧化性,在酸性条件下可能会氧化Cu2O或Cu,无法观察到红色沉淀Cu 溶液中存在H2O2H+ +HO2-,HO2-H+ +O22-,溶液pH增大,两个平衡均正向移动,O22-浓度增大,使得CuO2沉淀量增大 将Ⅲ中沉淀过滤,洗涤,干燥,称取少量于试管中,加入30%H2O2溶液,立即产生大量气泡,反应结束后,测得干燥后固体的质量不变 CuO2的催化能力强于Cu2+;随pH增大,Cu2+与H2O2反应生成CuO2增多
22. 2H2O2 2H2O+O2↑ 快 温度70℃、H2O2初始浓度为0.16 mol/L、无催化剂 由图丁可知,在0.1mol/L NaOH溶液的体系中,有催化剂时,双氧水分解速率加快 由图丙可知,当溶液中氢氧化钠浓度为0 时,有催化剂时,双氧水也不能分解
23. 探究浓度与温度对化学反应速率的影响 20 2.5 实验III溶液中生成黄色沉淀的时间最短 催化剂等
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
