鲁科版 高中化学 必修第一册 3.2硫的转化同步练习(含答案)
文档属性
| 名称 | 鲁科版 高中化学 必修第一册 3.2硫的转化同步练习(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 669.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-07 21:39:04 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
3.2硫的转化同步练习-鲁科版高中化学必修第一册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.根据下列实验操作和现象,所得结论正确的是( )
实验操作、现象 结论
A 火柴梗上滴少量的浓硫酸;火柴梗变黑 浓硫酸具有强氧化性
B 含锈的铁浸泡在NH4Cl溶液里;铁锈逐渐溶解 NH4Cl溶液显酸性
C Ba(NO3)2溶液通入SO2气体;产生白色沉淀 BaSO3难溶
D 某无色溶液中通入过量的CO2气体;有白色沉淀 一定含有AlO2-
A.A B.B C.C D.D
2.我国的科技发展日新月异,在科技发明、生产生活、环境保护等方面取得了很多世界瞩目的成果。下列说法错误的是
A.二氧化碳到淀粉的人工全合成技术,减少了的排放和酸雨的形成
B.“天和”核心舱电推进系统中的腔体氮化硼陶瓷属于新型无机非金属材料
C.港珠澳大桥用到的合金材料,具有强度大、密度小、耐腐蚀等性能
D.北京冬奥会使用的二氧化碳跨临界制冰机组,与传统制冷剂氟利昂相比更加环保
3.下列关于浓硫酸的叙述正确的是
A.浓H2SO4使蔗糖炭化变黑,体现了浓H2SO4的氧化性
B.浓H2SO4使蓝色胆矾变成白色,体现了浓H2SO4的脱水性
C.浓H2SO4滴在润湿的蓝色石蕊试纸,试纸先变红,然后褪色,最后变黑,说明浓H2SO4具有酸性、氧化性和脱水性
D.100 mL 18 mol/L的浓H2SO4中加入足量的Cu并加热,被还原的H2SO4的物质的量为0.9 mol
4.室温下,1体积的水能溶解约40体积的SO2。用试管收集SO2后进行如下实验。对实验现象的分析正确的是
A.试管内液面上升,证明SO2与水发生了反应
B.试管中剩余少量气体,是因为SO2的溶解已达饱和
C.取出试管中的溶液,立即滴入紫色石蕊试液,溶液显红色,原因是:SO2+H2O H2SO3、H2SO3 H++、 H++
D.取出试管中溶液,在空气中放置一段时间后pH下降,是由于SO2挥发
5.下列有关物质特征判断的说法中正确的是
A.纳米材料的直径介于1nm~100nm之间,故纳米铜属于胶体
B.、均能与酸和碱发生反应,故二者均为两性化合物
C.由反应可知为一元酸
D.浓硫酸具有强氧化性,实验室不能使用浓硫酸干燥二氧化硫气体
6.向某溶液中加入Ba(OH)2溶液后生成白色沉淀,加入足量稀盐酸后沉淀部分溶解,同时有无色无味的气体生成,将该气体通入澄清石灰水,澄清石灰水变浑浊。下列离子组符合上述现象的是
A.、 B.、
C.Cl-、 D.、OH-
7.化学与人类生产、生活等密切相关,下列说法错误的是
A.可以通过加入Na2S除去工业废水中的、等重金属离子
B.向次氯酸钠的水溶液中滴入紫色石蕊试液,溶液显红色
C.向肉制品类中加入适量的食盐可以防腐
D.为防止电池中的重金属污染土壤和水体,应积极研究废旧电池的回收利用
8.下列根据实验操作和现象所得出的结论正确的是
实验操作 现象 解释或结论
A 向酸性KMnO4溶液中通入SO2 溶液紫红色褪去 SO2具有漂白性
B 向某溶液中加入盐酸酸化的BaCl2溶液 产生白色沉淀 该溶液中不一定含有SO42-
C 常温下,分别将Fe、Cu分别放入浓HNO3中 Cu表面有气泡,而Fe表面无现象 金属性:Cu>Fe
D 将稀盐酸滴入碳酸钠溶液中产生的气体通入硅酸钠溶液中 有白色沉淀生成 非金属性Cl>C>Si
A.A B.B C.C D.D
9.下列除杂过程中,所选用的试剂和操作方法正确的是
选项 物质 杂质(少量) 试剂和操作方法
A 固体 加热
B 溶液 加入过量的铜粉后过滤
C 固体 置于硬质玻璃管中充分加热
D 二氧化硫气体 氯化氢气体 通过饱和溶液,洗气
A.A B.B C.C D.D
10.pH试纸上有甲基红、溴甲酚绿、百里酚蓝三种指示剂,实验室常用pH试纸检测物质的酸碱度(本实验使用的广泛pH试纸范围在1~14)。下列方案设计、现象和结论都正确的是
选项 方案设计 现象和结论
A 将1~2mL水滴入1~2g过氧化钠固体的试管中,用pH试纸测定溶液的酸碱性强弱 pH试纸显蓝色,pH为12,说明有碱性物质产生,溶液无漂白性
B 把充满的试管倒立在含水的水槽中,一段时间后,取出试管,用pH试纸测定溶液的酸碱性强弱 pH试纸显红色,pH为2,说明有酸性物质产生,溶液无漂白性
C 收集某地雨水于锥形瓶中,每隔一段时间测定雨水样品的pH 测得雨水pH在5到6之间波动,说明该地区雨水为酸雨
D 用玻璃棒蘸取新制氯水,滴在pH试纸上 观察到试纸由里到外的颜色为白色、红色、黄色,说明产物显酸性且氯气具有漂白性
A.A B.B C.C D.D
二、填空题
11.硫及其化合物有如下转化关系
(1)发生氧化还原反应的是 (填序号)
(2)写出(5)的反应方程式 ,说明浓硫酸具有 ,制取CuSO4, 方法最好(填序号);
(3)SO2是造成空气污染,形成酸雨的主要物质。SO2在水的存在下与氧气反应生成硫酸,反应方程式为 。验证二氧化硫的方法是 。
(4)某溶液中含有Cl-、SO42-,可能含有Na+、Fe2+或其中一种。
①验证Cl-、SO42-的方法是
A.先加BaCl2溶液,等沉淀后,再加AgNO3溶液
B.先加AgNO3溶液,等沉淀后,再加BaCl2溶液
C.先加Ba(NO3)2溶液,等沉淀后,再加AgNO3溶液
②验证Na+或Fe2+最简单的方法是 。
12.SO2在生产、生活中具有重要的作用,据所学知识回答相关问题。
(1) SO2通入Na2CO3溶液中有CO2生成,说明H2SO3具有 (填“酸性”、“氧化性”、“还原性”或“漂白性”,下同),SO2通入品红溶液中,品红溶液褪色,说明SO2具有 。
(2)已知SO2通入FeCl3溶液会发生反应,还原产物为 (填化学式,下同),氧化产物为 。
(3)向含锌粉的悬浊液中通入SO2可制备ZnS2O4。
①该反应的化学方程式为 ,若反应中有0.1mol电子转移,则生成ZnS2O4 g。
②向反应后的溶液中加入过量盐酸,溶液出现黄色浑浊,且有刺激性气体产生,反应的化学方程式为 。
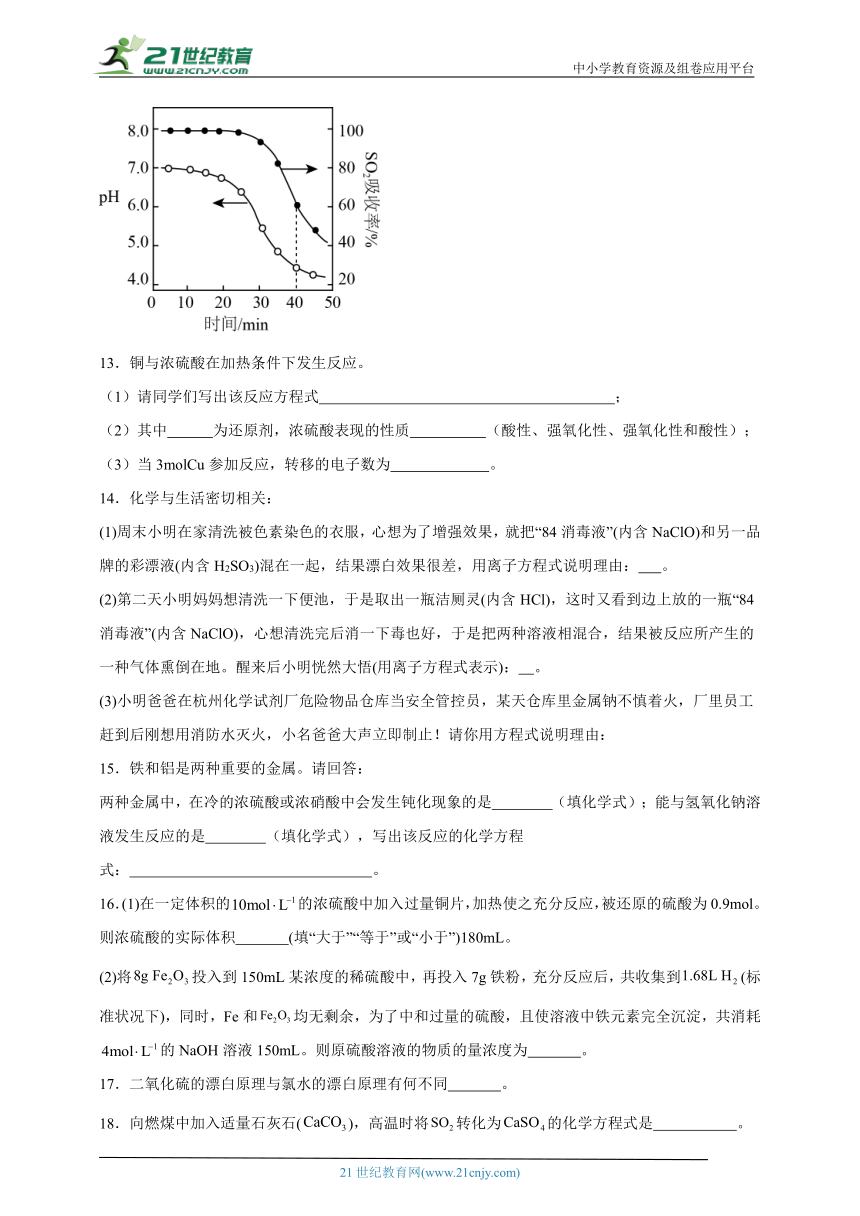
(4)已知室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水。ZnO水悬浊液常用于吸收烟气中的SO2。向ZnO水悬浊液中缓慢匀速通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH的变化如图。0~20min内,溶液pH几乎不变的原因是 ,SO2吸收率在30min后迅速降低,其原因是 。
13.铜与浓硫酸在加热条件下发生反应。
(1)请同学们写出该反应方程式 ;
(2)其中 为还原剂,浓硫酸表现的性质 (酸性、强氧化性、强氧化性和酸性);
(3)当3molCu参加反应,转移的电子数为 。
14.化学与生活密切相关:
(1)周末小明在家清洗被色素染色的衣服,心想为了增强效果,就把“84消毒液”(内含NaClO)和另一品牌的彩漂液(内含H2SO3)混在一起,结果漂白效果很差,用离子方程式说明理由: 。
(2)第二天小明妈妈想清洗一下便池,于是取出一瓶洁厕灵(内含HCl),这时又看到边上放的一瓶“84消毒液”(内含NaClO),心想清洗完后消一下毒也好,于是把两种溶液相混合,结果被反应所产生的一种气体熏倒在地。醒来后小明恍然大悟(用离子方程式表示): 。
(3)小明爸爸在杭州化学试剂厂危险物品仓库当安全管控员,某天仓库里金属钠不慎着火,厂里员工赶到后刚想用消防水灭火,小名爸爸大声立即制止!请你用方程式说明理由:
15.铁和铝是两种重要的金属。请回答:
两种金属中,在冷的浓硫酸或浓硝酸中会发生钝化现象的是 (填化学式);能与氢氧化钠溶液发生反应的是 (填化学式),写出该反应的化学方程式: 。
16.(1)在一定体积的的浓硫酸中加入过量铜片,加热使之充分反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积 (填“大于”“等于”或“小于”)180mL。
(2)将投入到150mL某浓度的稀硫酸中,再投入7g铁粉,充分反应后,共收集到(标准状况下),同时,Fe和均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗的NaOH溶液150mL。则原硫酸溶液的物质的量浓度为 。
17.二氧化硫的漂白原理与氯水的漂白原理有何不同 。
18.向燃煤中加入适量石灰石(),高温时将转化为的化学方程式是 。
19.发生天然气井喷事故中喷发出的天然气含有硫化氢气体,请你用学到的知识回答下列问题:
(1)为防止井喷事故中更大的人员伤亡,抢救人员欲采用点火燃烧方法来除去有毒气体,试写出反应的化学方程式
(2)在石油钻井中,为防止井喷事故,要根据井下压强,将重晶石(密度4.5g/cm3左右)与泥浆按一定比例混合后灌入井中。写出重晶石的化学式 试说明重晶石粉做压井材料的原因
(3)含硫地区钻井液的pH值应控制9.5以上,若用氢氧化钠溶液做控制液,写出发生反应的化学方程式
20.《化学与生活》,根据要求完成下列填空
(1)近年来,全国多个省市出现雾霾天气,进入冬季后,雾霾尤为严重。防治污染,改善生态环境已成为全民共识。
①空气污染指数API表明了空气的质量。空气污染指数主要是根据空气中 、NO2和可吸入颗粒物等污染物的浓度计算出来的数值。
②下列行为可能会导致雾霾现象加重的是 (选填字母)。
a.燃煤脱硫 b.静电除尘 c.燃放鞭炮
③氨气与氮氧化物(NOx)在一定条件下反应可生成对空气无污染的物质,则该反应的化学方程式为 。
(2)合理选择饮食,正确使用药物,可以促进身心健康。
①糖类是生命活动的基础能源,油脂、蛋白质也能为人体提供能量。等质量的上述物质中,提供能量最多的是 (选填字母)。
a.糖类 b.油脂 c.蛋白质
②人体牙龈出血、患坏血病主要是缺乏 (选填字母)。
a.维生素A b.维生素B c.维生素C
③合理食用加碘盐是防止缺碘性疾病的有效方法之一。在人体必需元素中,碘属于
(选填“常量”或“微量”)元素。
④复方氢氧化铝可治疗胃酸过多,氢氧化铝与胃酸(HCl)反应的离子方程式为: 。
(3)材料的不断发展可以促进社会进步。
①碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·x H2O]常用作塑料阻燃剂。
化学式中a、b、c、d的代数关系式为 。
②聚乙烯塑料可用于食品的包装袋,其结构简式为 。
③橡胶是制造轮胎的重要原料,天然橡胶通过 处理,使其转化为体型结构,从而增大橡胶的强度。
④体育场馆的建设需要大量的钢筋、水泥、玻璃等建筑材料。
生产水泥、玻璃共同的原料是 (填名称)。钢筋主要是Fe和 (填化学符号)的合金。钢梁结构露置在潮湿的空气中易发生电化学腐蚀,写出发生电化学腐蚀时负极的电极反应式 。
三、实验题
21.实验小组用如图装置探究FeSO4固体受热分解的产物。
已知:
物质 熔点/℃ 沸点℃
SO2 -72 -10
SO3 16.8 44.8
实验过程和现象为:
步骤 实验过程 实验现象
① 通入一段时间N2后关闭活塞K,充分加热 A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体
② 用带火星的木条靠近装置D的导管口 木条不复燃
③ 充分反应,停止加热,打开活塞K继续通入N2,至装置冷却,取A中固体,加足量盐酸 固体溶解,溶液呈黄色
④ 将③所得溶液滴入D试管中 溶液变为浅绿色
(1)步骤①中通入N2的目的是 ;
(2)步骤③和步骤④中发生反应的离子方程式分别为 , ;
(3)本实验中FeSO4分解的产物是 ;
(4)对在步骤①装置D中收集到的物质,列举一种检验方法 。
22.氧和硫属于同主族元素,其单质和化合物在生产生活中用途很广。
SO2可用于防腐剂、消毒剂,也是一种重要的冷冻介质。实验室可用如图所示装置制备SO2,并用纯净SO2进行相关实验。
(1)上述方法制备的SO2,往往因伴有硫酸小液滴而呈白雾状。除去白雾可在制备装置后连接除杂装置,请画出除杂装置并标明装置中的试剂 。
(2)将SO2通入0.1mol/L Ba(NO3)2溶液得到白色沉淀,该反应的离子方程式为 。
分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:
(3)实验C中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,用化学用语表示其原因 。
(4)实验B中出现白色沉淀比实验A快很多。由此得出的结论是 。
(5)测定水中溶解O2的量,常用的方法是:
i.量取a mL水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞好塞子,振荡使反应均匀。
ii.开塞,迅速加入适量的硫酸,此时有I2生成。
iii.向ii所得溶液中滴加2滴淀粉溶液为指示剂,用b mol/LNa2S2O3标准溶液滴定至终点共消耗了Na2S2O3溶液V mL。
有关反应方程式为:2Mn2+ + O2+ 4OH- = 2MnO(OH)2(反应很快)
MnO(OH)2 + 2I- + 4H+= Mn2+ + I2 + 3H2O
I2 + 2S2O32- = 2I- + S4O62-
①水中溶解 O2的量(以mg/L为单位)为 。
②判断达到滴定终点的实验依据为 。
23.某同学用如图装置进行铜与浓硫酸反应的实验(加热和夹持装置已略去):
实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A;
③将铜丝上提离开液面,停止加热。
(1)A中发生反应的化学方程式为 。
(2)若仪器B的作用是收集反应产生的SO2,请在虚线框中将该装置补充完整 。
(3)证明仪器B中SO2气体已经收集满的现象是 。
(4)下列有关该实验说法不正确的是 。
A.浓硫酸与铜的反应中,浓硫酸只表现酸性
B.上下移动A中铜丝可控制生成SO2的量
C.实验后为避免仪器A中残留SO2泄漏,可将导管通入盛有NaOH溶液的烧杯中,打开旋塞E,缓缓从E向A中鼓入足量空气
D.如果铜丝足量,仪器A中的硫酸可反应完全
参考答案:
1.B
2.A
3.C
4.C
5.C
6.A
7.B
8.B
9.C
10.B
11. ①②⑤ 2H2SO4(浓)+CuCuSO4+SO2↑+2H2O 强氧化性 ⑥ 2SO2+O2+2H2O=2H2SO4 将某气体通入盛品红溶液的试管中,品红褪色,再加热,又出现红色,证明是SO2 C 若溶液为无色,则溶液中只有Na+;若溶液显绿色,一定有Fe2+,再做焰色反应,以证明Na+的存在
12. 酸性 漂白性 Fe2+ SO Zn+2SO2=ZnS2O4 9.65 2ZnS2O4+4HCl=2ZnCl2+S↓ +2H2O+3SO2↑ 可知0~20min内,悬浊液中的ZnO吸收大量SO2,生成微溶于水的ZnSO3,此时溶液pH几乎不变 ZnO完全反应生成ZnSO3后,ZnSO3继续吸收SO2生成易溶于水的Zn(HSO3)2,此时溶液pH逐渐变小,SO2的吸收率迅速降低
13. Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O Cu(或铜) 强氧化性和酸性 6NA(或3.612×1024)
14. ClO-+=+Cl- ClO-+Cl-+2H+=Cl2↑+H2O 2Na+2H2O=2NaOH+H2↑
15. Fe、Al Al 2Al+2NaOH+2H2O===2NaAlO2+3H2↑
16.(1)大于
(2)
17.二氧化硫和品红等有色物质结合成不稳定的无色物质,加热后又会变回原来的颜色,二氧化硫的漂白性只是暂时的、是可逆的;
氯水是氯气和水生成具有漂白性的物质次氯酸,次氯酸具有强氧化性,能够氧化有色物质,其漂泊是不可逆的,属于氧化性漂白。
18.
19. 2H2S + 3O2= 2SO2+ 2H2O BaSO4 密度大 H2S + 2NaOH = Na2S + H2O
20.(1) SO2(或二氧化硫) c 4xNH3+6NOx (2x+3)N2+6xH2O
(2) b c 微量 Al(OH)3+3H+==Al3++3H2O
(3) 2a+3b=c+2d 硫化 石灰石(或碳酸钙) C Fe-2e—== Fe2+
21. 排尽装置内的空气,以免干扰实验 Fe2O3+6H+=2Fe3++3H2O 2H2O+2Fe3++SO2=2Fe2+++4H+ Fe2O3 SO2 SO3 取品红溶液少量于试管,滴加D中的无色液体,振荡,观察到品红溶液褪色;再对试管进行加热,发现品红溶液颜色恢复,说明为SO2
22. 饱和NaHSO3 溶液 3Ba2+ + 3SO2 + 2NO3-+ 2H2O=3BaSO4↓ +2NO↑ +4H+ SO2 + H2O H2SO3 H2SO3 H++ HSO3﹣ 在水溶液中O2氧化SO2 的速率比NO3﹣快 当滴定至溶液蓝色恰好褪去,且半分钟内不恢复蓝色
23. Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O C中品红溶液褪色(或变浅) AD
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
3.2硫的转化同步练习-鲁科版高中化学必修第一册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.根据下列实验操作和现象,所得结论正确的是( )
实验操作、现象 结论
A 火柴梗上滴少量的浓硫酸;火柴梗变黑 浓硫酸具有强氧化性
B 含锈的铁浸泡在NH4Cl溶液里;铁锈逐渐溶解 NH4Cl溶液显酸性
C Ba(NO3)2溶液通入SO2气体;产生白色沉淀 BaSO3难溶
D 某无色溶液中通入过量的CO2气体;有白色沉淀 一定含有AlO2-
A.A B.B C.C D.D
2.我国的科技发展日新月异,在科技发明、生产生活、环境保护等方面取得了很多世界瞩目的成果。下列说法错误的是
A.二氧化碳到淀粉的人工全合成技术,减少了的排放和酸雨的形成
B.“天和”核心舱电推进系统中的腔体氮化硼陶瓷属于新型无机非金属材料
C.港珠澳大桥用到的合金材料,具有强度大、密度小、耐腐蚀等性能
D.北京冬奥会使用的二氧化碳跨临界制冰机组,与传统制冷剂氟利昂相比更加环保
3.下列关于浓硫酸的叙述正确的是
A.浓H2SO4使蔗糖炭化变黑,体现了浓H2SO4的氧化性
B.浓H2SO4使蓝色胆矾变成白色,体现了浓H2SO4的脱水性
C.浓H2SO4滴在润湿的蓝色石蕊试纸,试纸先变红,然后褪色,最后变黑,说明浓H2SO4具有酸性、氧化性和脱水性
D.100 mL 18 mol/L的浓H2SO4中加入足量的Cu并加热,被还原的H2SO4的物质的量为0.9 mol
4.室温下,1体积的水能溶解约40体积的SO2。用试管收集SO2后进行如下实验。对实验现象的分析正确的是
A.试管内液面上升,证明SO2与水发生了反应
B.试管中剩余少量气体,是因为SO2的溶解已达饱和
C.取出试管中的溶液,立即滴入紫色石蕊试液,溶液显红色,原因是:SO2+H2O H2SO3、H2SO3 H++、 H++
D.取出试管中溶液,在空气中放置一段时间后pH下降,是由于SO2挥发
5.下列有关物质特征判断的说法中正确的是
A.纳米材料的直径介于1nm~100nm之间,故纳米铜属于胶体
B.、均能与酸和碱发生反应,故二者均为两性化合物
C.由反应可知为一元酸
D.浓硫酸具有强氧化性,实验室不能使用浓硫酸干燥二氧化硫气体
6.向某溶液中加入Ba(OH)2溶液后生成白色沉淀,加入足量稀盐酸后沉淀部分溶解,同时有无色无味的气体生成,将该气体通入澄清石灰水,澄清石灰水变浑浊。下列离子组符合上述现象的是
A.、 B.、
C.Cl-、 D.、OH-
7.化学与人类生产、生活等密切相关,下列说法错误的是
A.可以通过加入Na2S除去工业废水中的、等重金属离子
B.向次氯酸钠的水溶液中滴入紫色石蕊试液,溶液显红色
C.向肉制品类中加入适量的食盐可以防腐
D.为防止电池中的重金属污染土壤和水体,应积极研究废旧电池的回收利用
8.下列根据实验操作和现象所得出的结论正确的是
实验操作 现象 解释或结论
A 向酸性KMnO4溶液中通入SO2 溶液紫红色褪去 SO2具有漂白性
B 向某溶液中加入盐酸酸化的BaCl2溶液 产生白色沉淀 该溶液中不一定含有SO42-
C 常温下,分别将Fe、Cu分别放入浓HNO3中 Cu表面有气泡,而Fe表面无现象 金属性:Cu>Fe
D 将稀盐酸滴入碳酸钠溶液中产生的气体通入硅酸钠溶液中 有白色沉淀生成 非金属性Cl>C>Si
A.A B.B C.C D.D
9.下列除杂过程中,所选用的试剂和操作方法正确的是
选项 物质 杂质(少量) 试剂和操作方法
A 固体 加热
B 溶液 加入过量的铜粉后过滤
C 固体 置于硬质玻璃管中充分加热
D 二氧化硫气体 氯化氢气体 通过饱和溶液,洗气
A.A B.B C.C D.D
10.pH试纸上有甲基红、溴甲酚绿、百里酚蓝三种指示剂,实验室常用pH试纸检测物质的酸碱度(本实验使用的广泛pH试纸范围在1~14)。下列方案设计、现象和结论都正确的是
选项 方案设计 现象和结论
A 将1~2mL水滴入1~2g过氧化钠固体的试管中,用pH试纸测定溶液的酸碱性强弱 pH试纸显蓝色,pH为12,说明有碱性物质产生,溶液无漂白性
B 把充满的试管倒立在含水的水槽中,一段时间后,取出试管,用pH试纸测定溶液的酸碱性强弱 pH试纸显红色,pH为2,说明有酸性物质产生,溶液无漂白性
C 收集某地雨水于锥形瓶中,每隔一段时间测定雨水样品的pH 测得雨水pH在5到6之间波动,说明该地区雨水为酸雨
D 用玻璃棒蘸取新制氯水,滴在pH试纸上 观察到试纸由里到外的颜色为白色、红色、黄色,说明产物显酸性且氯气具有漂白性
A.A B.B C.C D.D
二、填空题
11.硫及其化合物有如下转化关系
(1)发生氧化还原反应的是 (填序号)
(2)写出(5)的反应方程式 ,说明浓硫酸具有 ,制取CuSO4, 方法最好(填序号);
(3)SO2是造成空气污染,形成酸雨的主要物质。SO2在水的存在下与氧气反应生成硫酸,反应方程式为 。验证二氧化硫的方法是 。
(4)某溶液中含有Cl-、SO42-,可能含有Na+、Fe2+或其中一种。
①验证Cl-、SO42-的方法是
A.先加BaCl2溶液,等沉淀后,再加AgNO3溶液
B.先加AgNO3溶液,等沉淀后,再加BaCl2溶液
C.先加Ba(NO3)2溶液,等沉淀后,再加AgNO3溶液
②验证Na+或Fe2+最简单的方法是 。
12.SO2在生产、生活中具有重要的作用,据所学知识回答相关问题。
(1) SO2通入Na2CO3溶液中有CO2生成,说明H2SO3具有 (填“酸性”、“氧化性”、“还原性”或“漂白性”,下同),SO2通入品红溶液中,品红溶液褪色,说明SO2具有 。
(2)已知SO2通入FeCl3溶液会发生反应,还原产物为 (填化学式,下同),氧化产物为 。
(3)向含锌粉的悬浊液中通入SO2可制备ZnS2O4。
①该反应的化学方程式为 ,若反应中有0.1mol电子转移,则生成ZnS2O4 g。
②向反应后的溶液中加入过量盐酸,溶液出现黄色浑浊,且有刺激性气体产生,反应的化学方程式为 。
(4)已知室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水。ZnO水悬浊液常用于吸收烟气中的SO2。向ZnO水悬浊液中缓慢匀速通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH的变化如图。0~20min内,溶液pH几乎不变的原因是 ,SO2吸收率在30min后迅速降低,其原因是 。
13.铜与浓硫酸在加热条件下发生反应。
(1)请同学们写出该反应方程式 ;
(2)其中 为还原剂,浓硫酸表现的性质 (酸性、强氧化性、强氧化性和酸性);
(3)当3molCu参加反应,转移的电子数为 。
14.化学与生活密切相关:
(1)周末小明在家清洗被色素染色的衣服,心想为了增强效果,就把“84消毒液”(内含NaClO)和另一品牌的彩漂液(内含H2SO3)混在一起,结果漂白效果很差,用离子方程式说明理由: 。
(2)第二天小明妈妈想清洗一下便池,于是取出一瓶洁厕灵(内含HCl),这时又看到边上放的一瓶“84消毒液”(内含NaClO),心想清洗完后消一下毒也好,于是把两种溶液相混合,结果被反应所产生的一种气体熏倒在地。醒来后小明恍然大悟(用离子方程式表示): 。
(3)小明爸爸在杭州化学试剂厂危险物品仓库当安全管控员,某天仓库里金属钠不慎着火,厂里员工赶到后刚想用消防水灭火,小名爸爸大声立即制止!请你用方程式说明理由:
15.铁和铝是两种重要的金属。请回答:
两种金属中,在冷的浓硫酸或浓硝酸中会发生钝化现象的是 (填化学式);能与氢氧化钠溶液发生反应的是 (填化学式),写出该反应的化学方程式: 。
16.(1)在一定体积的的浓硫酸中加入过量铜片,加热使之充分反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积 (填“大于”“等于”或“小于”)180mL。
(2)将投入到150mL某浓度的稀硫酸中,再投入7g铁粉,充分反应后,共收集到(标准状况下),同时,Fe和均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗的NaOH溶液150mL。则原硫酸溶液的物质的量浓度为 。
17.二氧化硫的漂白原理与氯水的漂白原理有何不同 。
18.向燃煤中加入适量石灰石(),高温时将转化为的化学方程式是 。
19.发生天然气井喷事故中喷发出的天然气含有硫化氢气体,请你用学到的知识回答下列问题:
(1)为防止井喷事故中更大的人员伤亡,抢救人员欲采用点火燃烧方法来除去有毒气体,试写出反应的化学方程式
(2)在石油钻井中,为防止井喷事故,要根据井下压强,将重晶石(密度4.5g/cm3左右)与泥浆按一定比例混合后灌入井中。写出重晶石的化学式 试说明重晶石粉做压井材料的原因
(3)含硫地区钻井液的pH值应控制9.5以上,若用氢氧化钠溶液做控制液,写出发生反应的化学方程式
20.《化学与生活》,根据要求完成下列填空
(1)近年来,全国多个省市出现雾霾天气,进入冬季后,雾霾尤为严重。防治污染,改善生态环境已成为全民共识。
①空气污染指数API表明了空气的质量。空气污染指数主要是根据空气中 、NO2和可吸入颗粒物等污染物的浓度计算出来的数值。
②下列行为可能会导致雾霾现象加重的是 (选填字母)。
a.燃煤脱硫 b.静电除尘 c.燃放鞭炮
③氨气与氮氧化物(NOx)在一定条件下反应可生成对空气无污染的物质,则该反应的化学方程式为 。
(2)合理选择饮食,正确使用药物,可以促进身心健康。
①糖类是生命活动的基础能源,油脂、蛋白质也能为人体提供能量。等质量的上述物质中,提供能量最多的是 (选填字母)。
a.糖类 b.油脂 c.蛋白质
②人体牙龈出血、患坏血病主要是缺乏 (选填字母)。
a.维生素A b.维生素B c.维生素C
③合理食用加碘盐是防止缺碘性疾病的有效方法之一。在人体必需元素中,碘属于
(选填“常量”或“微量”)元素。
④复方氢氧化铝可治疗胃酸过多,氢氧化铝与胃酸(HCl)反应的离子方程式为: 。
(3)材料的不断发展可以促进社会进步。
①碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·x H2O]常用作塑料阻燃剂。
化学式中a、b、c、d的代数关系式为 。
②聚乙烯塑料可用于食品的包装袋,其结构简式为 。
③橡胶是制造轮胎的重要原料,天然橡胶通过 处理,使其转化为体型结构,从而增大橡胶的强度。
④体育场馆的建设需要大量的钢筋、水泥、玻璃等建筑材料。
生产水泥、玻璃共同的原料是 (填名称)。钢筋主要是Fe和 (填化学符号)的合金。钢梁结构露置在潮湿的空气中易发生电化学腐蚀,写出发生电化学腐蚀时负极的电极反应式 。
三、实验题
21.实验小组用如图装置探究FeSO4固体受热分解的产物。
已知:
物质 熔点/℃ 沸点℃
SO2 -72 -10
SO3 16.8 44.8
实验过程和现象为:
步骤 实验过程 实验现象
① 通入一段时间N2后关闭活塞K,充分加热 A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体
② 用带火星的木条靠近装置D的导管口 木条不复燃
③ 充分反应,停止加热,打开活塞K继续通入N2,至装置冷却,取A中固体,加足量盐酸 固体溶解,溶液呈黄色
④ 将③所得溶液滴入D试管中 溶液变为浅绿色
(1)步骤①中通入N2的目的是 ;
(2)步骤③和步骤④中发生反应的离子方程式分别为 , ;
(3)本实验中FeSO4分解的产物是 ;
(4)对在步骤①装置D中收集到的物质,列举一种检验方法 。
22.氧和硫属于同主族元素,其单质和化合物在生产生活中用途很广。
SO2可用于防腐剂、消毒剂,也是一种重要的冷冻介质。实验室可用如图所示装置制备SO2,并用纯净SO2进行相关实验。
(1)上述方法制备的SO2,往往因伴有硫酸小液滴而呈白雾状。除去白雾可在制备装置后连接除杂装置,请画出除杂装置并标明装置中的试剂 。
(2)将SO2通入0.1mol/L Ba(NO3)2溶液得到白色沉淀,该反应的离子方程式为 。
分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:
(3)实验C中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,用化学用语表示其原因 。
(4)实验B中出现白色沉淀比实验A快很多。由此得出的结论是 。
(5)测定水中溶解O2的量,常用的方法是:
i.量取a mL水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞好塞子,振荡使反应均匀。
ii.开塞,迅速加入适量的硫酸,此时有I2生成。
iii.向ii所得溶液中滴加2滴淀粉溶液为指示剂,用b mol/LNa2S2O3标准溶液滴定至终点共消耗了Na2S2O3溶液V mL。
有关反应方程式为:2Mn2+ + O2+ 4OH- = 2MnO(OH)2(反应很快)
MnO(OH)2 + 2I- + 4H+= Mn2+ + I2 + 3H2O
I2 + 2S2O32- = 2I- + S4O62-
①水中溶解 O2的量(以mg/L为单位)为 。
②判断达到滴定终点的实验依据为 。
23.某同学用如图装置进行铜与浓硫酸反应的实验(加热和夹持装置已略去):
实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A;
③将铜丝上提离开液面,停止加热。
(1)A中发生反应的化学方程式为 。
(2)若仪器B的作用是收集反应产生的SO2,请在虚线框中将该装置补充完整 。
(3)证明仪器B中SO2气体已经收集满的现象是 。
(4)下列有关该实验说法不正确的是 。
A.浓硫酸与铜的反应中,浓硫酸只表现酸性
B.上下移动A中铜丝可控制生成SO2的量
C.实验后为避免仪器A中残留SO2泄漏,可将导管通入盛有NaOH溶液的烧杯中,打开旋塞E,缓缓从E向A中鼓入足量空气
D.如果铜丝足量,仪器A中的硫酸可反应完全
参考答案:
1.B
2.A
3.C
4.C
5.C
6.A
7.B
8.B
9.C
10.B
11. ①②⑤ 2H2SO4(浓)+CuCuSO4+SO2↑+2H2O 强氧化性 ⑥ 2SO2+O2+2H2O=2H2SO4 将某气体通入盛品红溶液的试管中,品红褪色,再加热,又出现红色,证明是SO2 C 若溶液为无色,则溶液中只有Na+;若溶液显绿色,一定有Fe2+,再做焰色反应,以证明Na+的存在
12. 酸性 漂白性 Fe2+ SO Zn+2SO2=ZnS2O4 9.65 2ZnS2O4+4HCl=2ZnCl2+S↓ +2H2O+3SO2↑ 可知0~20min内,悬浊液中的ZnO吸收大量SO2,生成微溶于水的ZnSO3,此时溶液pH几乎不变 ZnO完全反应生成ZnSO3后,ZnSO3继续吸收SO2生成易溶于水的Zn(HSO3)2,此时溶液pH逐渐变小,SO2的吸收率迅速降低
13. Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O Cu(或铜) 强氧化性和酸性 6NA(或3.612×1024)
14. ClO-+=+Cl- ClO-+Cl-+2H+=Cl2↑+H2O 2Na+2H2O=2NaOH+H2↑
15. Fe、Al Al 2Al+2NaOH+2H2O===2NaAlO2+3H2↑
16.(1)大于
(2)
17.二氧化硫和品红等有色物质结合成不稳定的无色物质,加热后又会变回原来的颜色,二氧化硫的漂白性只是暂时的、是可逆的;
氯水是氯气和水生成具有漂白性的物质次氯酸,次氯酸具有强氧化性,能够氧化有色物质,其漂泊是不可逆的,属于氧化性漂白。
18.
19. 2H2S + 3O2= 2SO2+ 2H2O BaSO4 密度大 H2S + 2NaOH = Na2S + H2O
20.(1) SO2(或二氧化硫) c 4xNH3+6NOx (2x+3)N2+6xH2O
(2) b c 微量 Al(OH)3+3H+==Al3++3H2O
(3) 2a+3b=c+2d 硫化 石灰石(或碳酸钙) C Fe-2e—== Fe2+
21. 排尽装置内的空气,以免干扰实验 Fe2O3+6H+=2Fe3++3H2O 2H2O+2Fe3++SO2=2Fe2+++4H+ Fe2O3 SO2 SO3 取品红溶液少量于试管,滴加D中的无色液体,振荡,观察到品红溶液褪色;再对试管进行加热,发现品红溶液颜色恢复,说明为SO2
22. 饱和NaHSO3 溶液 3Ba2+ + 3SO2 + 2NO3-+ 2H2O=3BaSO4↓ +2NO↑ +4H+ SO2 + H2O H2SO3 H2SO3 H++ HSO3﹣ 在水溶液中O2氧化SO2 的速率比NO3﹣快 当滴定至溶液蓝色恰好褪去,且半分钟内不恢复蓝色
23. Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O C中品红溶液褪色(或变浅) AD
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
