2024人教版新教材高中化学选择性必修2同步练习--第三章 晶体结构与性质综合拔高练(含解析)
文档属性
| 名称 | 2024人教版新教材高中化学选择性必修2同步练习--第三章 晶体结构与性质综合拔高练(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 837.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-08 10:44:40 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024人教版新教材高中化学选择性必修2
综合拔高练
五年高考练
考点1 晶胞中粒子数目的计算
1.(2021辽宁,7)单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是( )
A.S位于元素周期表p区
B.该物质的化学式为H3S
C.S位于H构成的八面体空隙中
D.该晶体属于分子晶体
2.(高考组合)(1)(2021湖南,18节选)下图是Mg、Ge、O三种元素形成的某化合物的晶胞示意图。
已知化合物中Ge和O的原子个数比为1∶4,图中Z表示 原子(填元素符号),该化合物的化学式为 。
(2)(2021天津,13节选)用X射线衍射测定,得到Fe的两种晶胞A、B,其结构如图所示。晶胞A中每个Fe原子紧邻的原子数为 。每个晶胞B中含Fe原子数为 。
(3)(2021山东,16节选)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为()。已知Xe—F键长为r pm,则B点原子的分数坐标为 。
考点2 金属晶体的结构
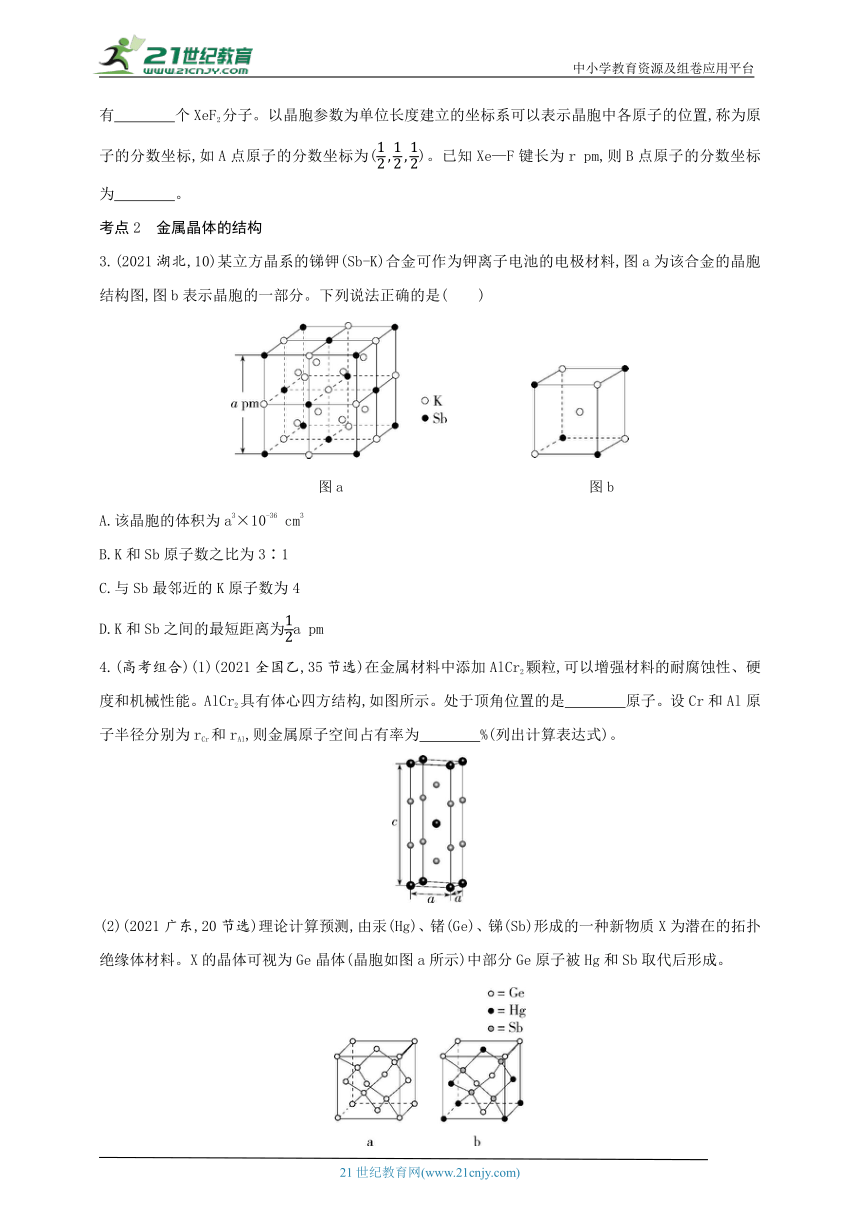
3.(2021湖北,10)某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构图,图b表示晶胞的一部分。下列说法正确的是( )
图a 图b
A.该晶胞的体积为a3×10-36 cm3
B.K和Sb原子数之比为3∶1
C.与Sb最邻近的K原子数为4
D.K和Sb之间的最短距离为a pm
4.(高考组合)(1)(2021全国乙,35节选)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示。处于顶角位置的是 原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为 %(列出计算表达式)。
(2)(2021广东,20节选)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为 ;该晶胞中粒子个数比Hg∶Ge∶Sb= 。
③设X的最简式的式量为Mr,则X晶体的密度为 g/cm3(列出算式)。
考点3 离子晶体的结构与性质
5.(高考组合)(1)(2020课标Ⅱ,35节选)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是 。
化合物 TiF4 TiCl4 TiBr4 TiI4
熔点/℃ 377 -24.12 38.3 155
(2)(2020课标Ⅱ,35节选)CaTiO3的晶胞如图所示,金属离子与氧离子间的作用力为 ,Ca2+的配位数是 。
(3)(2020天津,13改编)Fe、Co、Ni三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为 。
考点4 晶体的相关计算
6.(高考组合)(1)(2021湖南,18节选)下图是Mg、Ge、O三种元素形成的某化合物的晶胞示意图。
已知该晶胞的晶胞参数分别为a nm、b nm、c nm,α=β=γ=90°,则该晶体的密度ρ= g·cm-3(设阿伏加德罗常数的值为NA,用含a、b、c、NA的代数式表示)。
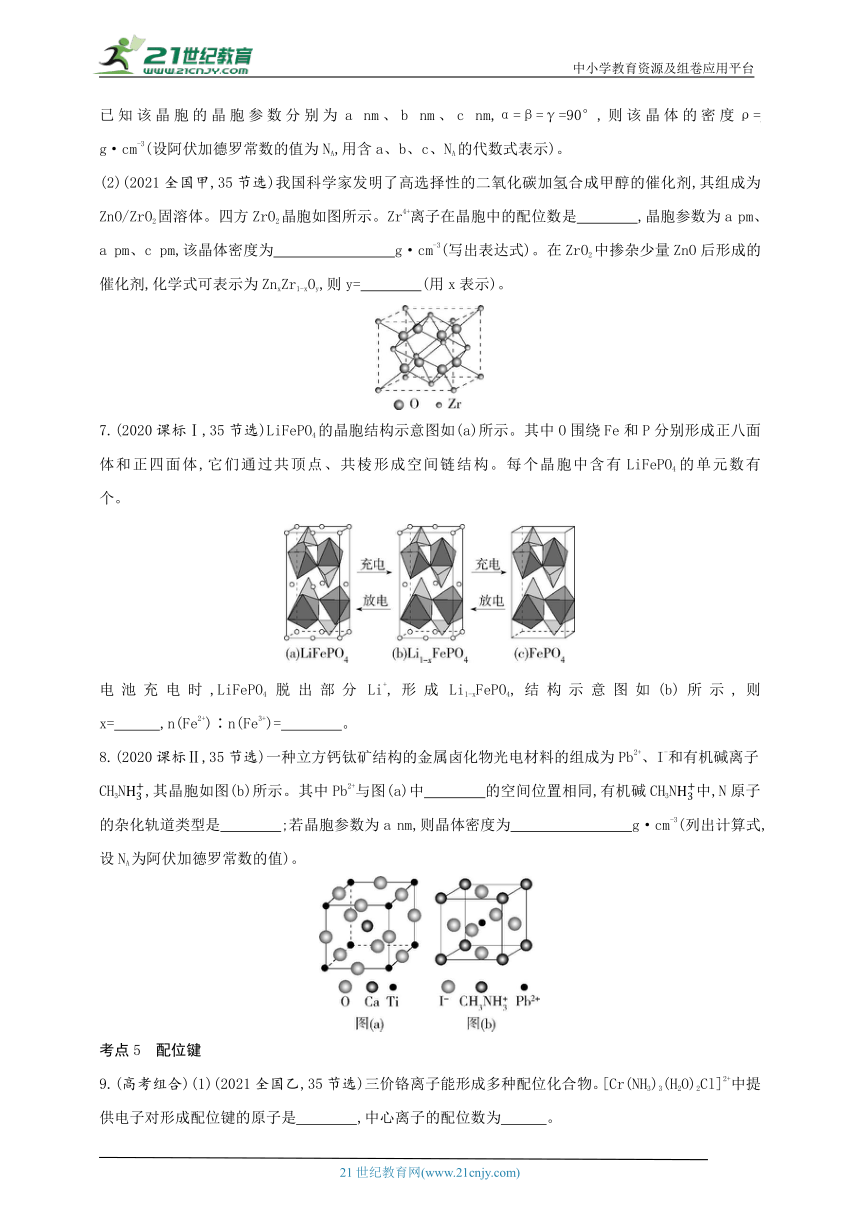
(2)(2021全国甲,35节选)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是 ,晶胞参数为a pm、a pm、c pm,该晶体密度为 g·cm-3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y= (用x表示)。
7.(2020课标Ⅰ,35节选)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有 个。
电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x= ,n(Fe2+)∶n(Fe3+)= 。
8.(2020课标Ⅱ,35节选)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3N,其晶胞如图(b)所示。其中Pb2+与图(a)中 的空间位置相同,有机碱CH3N中,N原子的杂化轨道类型是 ;若晶胞参数为a nm,则晶体密度为 g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
考点5 配位键
9.(高考组合)(1)(2021全国乙,35节选)三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是 ,中心离子的配位数为 。
(2)(2021湖南,18节选)SiCl4与N-甲基咪唑()反应可以得到M2+,其结构如图所示:
N-甲基咪唑分子中碳原子的杂化轨道类型为 ,1个M2+中含有 个σ键。
10.(2020山东,17节选)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如下图所示,1 mol该配合物中通过螯合作用形成的配位键有 mol,该螯合物中N的杂化方式有 种。
11.(2020课标Ⅲ,35节选)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。
(2)NH3BH3分子中,N—B化学键称为 键,其电子对由 提供。
三年模拟练
应用实践
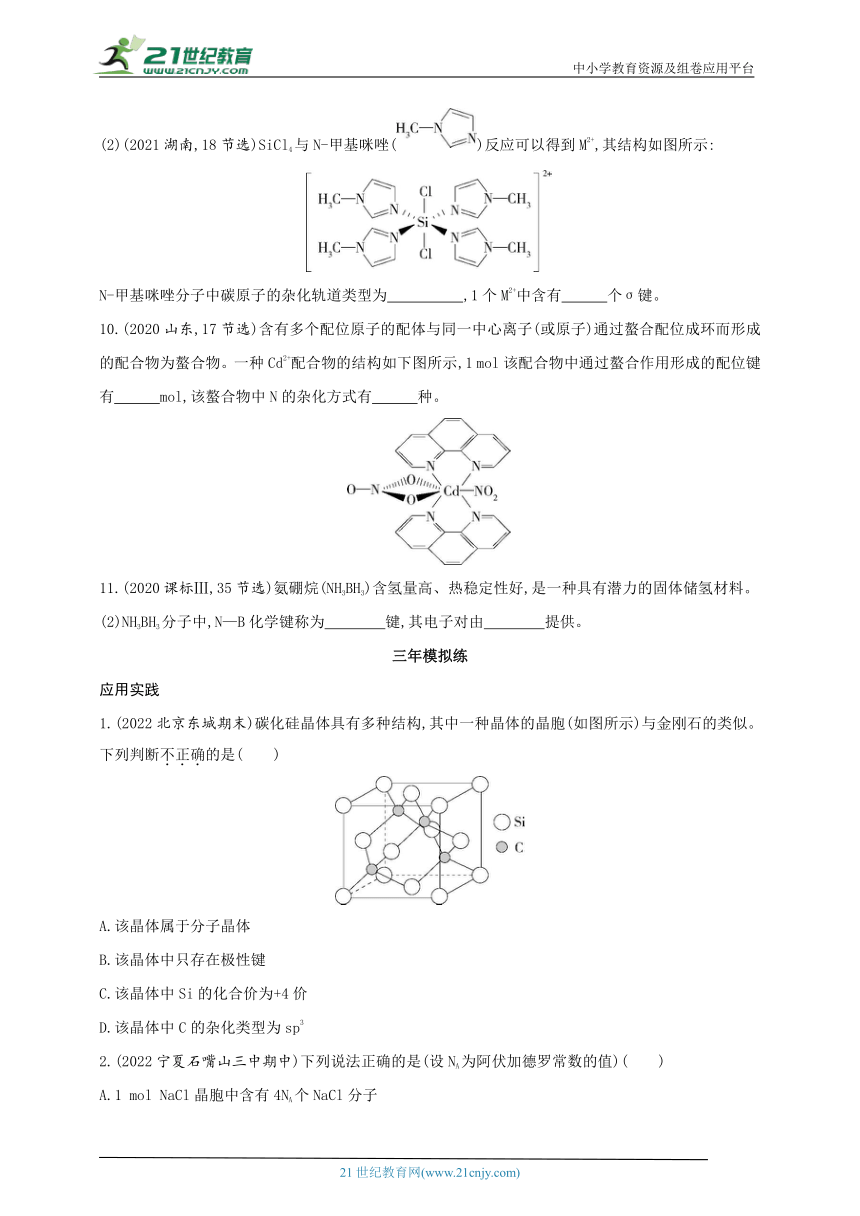
1.(2022北京东城期末)碳化硅晶体具有多种结构,其中一种晶体的晶胞(如图所示)与金刚石的类似。下列判断不正确的是( )
A.该晶体属于分子晶体
B.该晶体中只存在极性键
C.该晶体中Si的化合价为+4价
D.该晶体中C的杂化类型为sp3
2.(2022宁夏石嘴山三中期中)下列说法正确的是(设NA为阿伏加德罗常数的值)( )
A.1 mol NaCl晶胞中含有4NA个NaCl分子
B.一个铜晶胞的质量为g
C.60 g SiO2含有Si—O键的个数为2NA
D.1 mol SiC含有C—Si键的个数为4NA
3.(2022江苏盐城阜宁中学检测)下列有关说法正确的是( )
A.Ti属于元素周期表中的ds区元素
B.硒、硅分别与氢元素形成的简单氢化物的分子的空间结构均为正四面体形
C.在NaCl晶体(晶胞如图1)中,与Na+最接近且距离相等的Cl-形成正四面体
D.某水合金属离子的模型如图2所示,则1个该水合金属离子中含有4个配位键
4.(2021山东济南月考)厦门大学郑兰荪院士合成了一种富勒烯足球状分子(C70Cl10),它是由C70与Cl2反应得到的。在C70分子中每个碳原子均与周围相邻的其他3个碳原子相连,70个碳原子组成若干个正六边形和正五边形,碳元素均为+4价,则下列有关说法中不正确的是( )
A.C70的熔点比石墨的熔点低
B.C70分子中碳原子的杂化方式与碳酸中碳原子的相同
C.1个C70分子中含有70个σ键、35个π键
D.1个C70Cl10分子中共用电子对的数目为145
5.(2021河北石家庄一中月考)Co(NH3)5BrSO4可形成两种钴的配合物,P:[Co(NH3)5Br]SO4,Q:[Co(SO4)(NH3)5]Br,向P、Q的溶液中分别加入BaCl2溶液后,下列有关说法错误的是 ( )
A.Q溶液中会产生白色沉淀
B.P溶液中会产生白色沉淀
C.Q中S是配体
D.P、Q的配位数均是6
6.(2021北京东城阶段检测)二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,二茂铁的熔点是173 ℃(在100 ℃时开始升华),沸点是249 ℃,它是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是( )
A.二茂铁中Fe2+与环戊二烯离子(C5)之间为配位键
B.1 mol环戊二烯()中含有σ键的数目为11NA
C.二茂铁分子中存在π键
D.二茂铁是离子晶体
7.(2022河北唐山期末)磷被首次发现存在于恒星爆炸后的宇宙残余物里。它是在深空发现的两大元素之一,可能给科学家提供有关生命在宇宙里的可能性的线索。磷至少有10种同素异形体,其中主要的是白磷、红磷和黑磷三种。回答下列问题:
(1)基态磷原子最外层单电子数与成对电子数之比为 。
(2)白磷晶体是由P4分子()组成的分子晶体,P4分子中键角为 。
(3)白磷隔绝空气加热到533 K转化为红磷,它是一种暗红色粉末。红磷的结构为,磷原子的杂化方式为 , (填“难”或“易”)溶于水。
(4)黑磷是磷的一种最稳定的同素异形体,其具有类似于石墨的片状结构(如图),片状结构间通过 相结合。
(5)磷有多种含氧酸,磷酸是其中一种,磷酸通过分子间脱水缩合形成多磷酸,如:
++
若4个磷酸分子间脱水形成环状的多磷酸,则该多磷酸的分子式可写成 。
(6)磷的卤化物有PX3和PX5两种类型,其中PCl5是白色固体,在气态和液态时PCl5以分子形态存在,固态时PCl5不再保持该结构,而形成离子晶体。晶胞中含有正四面体的[PCl4]+和正八面体的 ,其晶胞结构最合理的是 (填字母)。
8.(2021福建适应性测试)ZnGeP2和KTiOPO4都是非线性光学晶体材料,在激光技术方面有广泛用途。以Zn为顶点的ZnGeP2晶胞结构如图所示。
(1)距离Zn原子最近且距离相等的P原子有 个。
(2)以Ge为顶点的晶胞中,Zn原子位于 。
9.(2021福建厦门外国语学校期末)贵金属磷化物Rh2P(摩尔质量为237 g·mol-1)可用作电解水的高效催化剂,其立方晶胞如图所示:
已知晶胞参数为a nm,晶体中与P距离最近的Rh的数目为 ,晶体的密度为 g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
10.第Ⅷ族元素Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
(1)基态Ni原子核外能级最高的电子位于 能级,同周期元素中,基态原子未成对电子数与Ni相同的元素名称为 。
(2)Fe3+与酚类物质的显色反应常用于离子检验,已知Fe3+遇邻苯二酚()和对苯二酚()均显绿色。邻苯二酚的熔、沸点比对苯二酚的 (填“高”或“低”),原因是 。
(3)NiO晶体结构中阴、阳离子的配位数均为6,则晶胞的俯视图可能是 (填字母)。若晶胞参数为a pm,阿伏加德罗常数的值为NA,则NiO晶体的密度是 g·cm-3。
迁移创新
11.(2021山东聊城一模)氢能作为一种新型的能量密度高的绿色能源,正引起世界各国的重视。储存技术是氢能利用的关键,储氢材料是当今研究的重点课题之一,金属镍与镧(La)形成的合金是一种良好的储氢材料。
(1)Ni原子的核外电子排布式为 。
(2)NiO、FeO、MgO的晶体结构类型均与氯化钠相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点:NiO (填“<”或“>”)FeO;某同学画出的MgO晶胞结构示意图如图所示,请改正图中的错误: 。
(3)NiO晶胞中Ni和O的配位数分别为 、 。
(4)金属镍与镧(La)形成的晶体的晶胞结构示意图如图所示(部分原子间连线未画出)。该合金的化学式为 。
答案全解全析
五年高考练
1.D A项,S的价层电子排布式为3s23p4,位于元素周期表p区,正确;B项,由题图可知,该晶胞中S原子数目为8×+1=2,H原子数目为12×=6,S、H原子数目比为1∶3,该物质的化学式为H3S,正确;C项,S原子位于H原子构成的八面体空隙中,如图所示:,正确;D项,该晶体是一种新型超导材料,而分子晶体通常不导电,故该晶体不属于分子晶体,错误。
2.答案 (1)O Mg2GeO4 (2)8 4 (3)2 (0,0,)
解析 (1)由题图可知,一个晶胞中X原子数目为8×+3=8,Y原子数目为4,Z原子数目为16,Ge和O的原子个数比为1∶4,则Z表示O原子,Y表示Ge原子,X表示Mg原子,该化合物的化学式为Mg2GeO4。(2)由题图可知,晶胞A中每个Fe原子紧邻的原子数为8。根据均摊法,每个晶胞B中含Fe原子数为8×=4。(3)图中大球的个数为8×+1=2,小球的个数为8×+2=4,根据XeF2的原子个数比知大球是Xe原子,小球是F原子,该晶胞中有2个XeF2分子;由A点坐标知该原子位于晶胞的中心,B点在棱的处,其坐标为(0,0,)。
3.B 1 pm=10-10 cm,故该晶胞的体积为a3×10-30 cm3,A项错误;根据图b利用均摊法可知含有K原子数目为1+4×,含有Sb原子数目为4×,故K和Sb原子数之比为3∶1,B项正确;由图b可知立方体体心K原子与Sb原子紧邻,每个顶点的Sb原子被8个立方体共用,故与Sb原子紧邻的K原子数为8,C项错误;K和Sb之间的最短距离为晶胞体对角线长度的,即a pm,D项错误。
4.答案 (1)Al ×100
(2)①不能无隙并置成晶体,不是最小重复单元
②4 1∶1∶2 ③
解析 (1)根据均摊法,该晶胞中黑球的个数为8×+1=2,灰球的个数为8×+2=4,个数之比为1∶2,根据化学式AlCr2可知,黑球代表Al,灰球代表Cr,故处于顶角位置的为Al原子。晶胞的体积为a2×c,晶胞所含原子的体积为),则金属原子的空间占有率为×100%。
(2)①组成晶体的最小重复单位称为晶胞,整块晶体可以看成是无数晶胞无隙并置而成的,而图b不符合此条件,故不是晶胞。②图c晶胞中底面面心的原子是Hg原子,与其距离最近的Sb有两个,其下方的晶胞中还有两个距离最近的Sb,故X的晶体中与Hg距离最近的Sb的数目为4;每个晶胞中Hg原子数目为4×=4,Ge原子数目为8×+1=4,Sb原子数目为8,故该晶胞中粒子个数比为Hg∶Ge∶Sb=1∶1∶2。③每个晶胞含有的“HgGeSb2”数目为4,则1 mol“HgGeSb2”的体积为×NA,1 mol“HgGeSb2”的质量为Mr g,故X晶体的密度为 g/cm3。
5.答案 (1)TiF4为离子化合物,熔点高,其他三种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高
(2)离子键 12
(3)NiO>CoO>FeO
解析 (1)氟元素非金属性强,TiF4为离子化合物,熔点最高,TiCl4、TiBr4、TiI4为共价化合物,熔点较低,且TiCl4、TiBr4、TiI4结构相似,相对分子质量越大,分子间作用力越强,熔点越高。
(2)阴、阳离子间的作用力为离子键;距离Ca2+最近的为O2-,共有12个O2-与位于体心的Ca2+距离相等且最近,故Ca2+的配位数为12。
(3)由于FeO、CoO、NiO的晶胞类型相同,而离子半径:Fe2+>Co2+>Ni2+,则熔点:NiO>CoO>FeO。
6.答案 (1)
(2)8 2-x
解析 (1)1个晶胞的体积为abc×10-21 cm3,1个晶胞的质量为 g,故其密度为 g·cm-3。
(2)配位数是指一个离子周围最邻近的异电性离子的数目,根据四方ZrO2晶胞图知,顶点处Zr4+每个晶胞中最近的O2-有1个,周围有8个晶胞,故其配位数为8;利用均摊法,1个晶胞中含Zr原子数为8×=4,O原子数为8,晶胞体积为a2c pm3=a2c×10-30 cm3,故其密度为 g·cm-3;根据化合物中各元素正、负化合价代数和为0知,(+2)x+(+4)(1-x)+(-2)y=0,解得y=2-x。
7.答案 4 13∶3
解析 图(a)中每个晶胞含有Li+个数为8×=4,故每个晶胞中含有LiFePO4的单元数为4;图(b)中每个晶胞含有Li+个数为8×,则LiFePO4与Li1-xFePO4中Li+数目之比为1∶(1-x)=4∶;设Li1-xFePO4中Fe2+、Fe3+个数分别为a、b,则有,解得,故n(Fe2+)∶n(Fe3+)=a∶b=13∶3。
8.答案 Ti4+ sp3 ×1021
解析 距离Pb2+最近的是处于面心的I-,Pb2+的配位数为6,图(a)中Ti4+的配位数也为6,其与图(b)中Pb2+的空间位置相同;CH3N中,氮原子形成4个单键,其中有1个是配位键,N原子采取sp3杂化;根据均摊法,1个晶胞中含有I-的个数为6×1/2=3,CH3N的个数为8×1/8= 1,Pb2+的个数为1,化学式为PbCH3NH3I3,摩尔质量为620 g·mol-1,一个晶胞的质量为 g,体积为(a×10-7)3 cm3,则晶体密度为×1021 g·cm-3。
9.答案 (1)N、O、Cl 6 (2)sp3、sp2 54
解析 (1)H2O中的氧原子、NH3中的氮原子和Cl-中都有孤电子对,可作配位原子,故配位原子为O、N、Cl,中心离子的配位数为3+2+1=6。
(2)由结构可知,N-甲基咪唑分子中含有甲基和碳碳双键,则该分子中碳原子的杂化轨道类型为sp2、sp3;1个N-甲基咪唑分子中含有6个C—H键、4个C—N键、1个碳碳双键和1个碳氮双键,单键、配位键属于σ键,1个双键中有1个σ键和1个π键,所以1个M2+中含有12×4+6=54个σ键。
10.答案 6 1
解析 由题意可知,只有成环的配位键才能起到螯合作用,再结合题给结构可知N中的2个O原子和C、N杂环上的4个N原子通过螯合作用与Cd2+形成配位键,故1 mol该配合物中通过螯合作用形成6 mol配位键;N中N原子价层电子对数为3+0=3,N中N原子价层电子对数为2+1=3,C、N杂环上的4个N原子价层电子对数为3,故该配合物中N原子均采取sp2杂化。
11.答案 (2)配位 N
解析 (2)NH3BH3分子中,N原子核外有1个孤电子对,B原子含有空轨道,故N原子提供孤电子对与B原子形成N→B配位键。
三年模拟练
1.A 碳化硅晶体属于共价晶体,故A错误。
2.D NaCl是离子晶体,其晶胞中没有NaCl分子,故A错误;一个铜晶胞占用4个铜原子,一个铜晶胞的质量为g,故B错误;60 g SiO2的物质的量是1 mol,含有Si—O键的个数为4NA,故C错误;1个Si和周围4个C形成4个C—Si键,1个C和周围4个Si形成4个C—Si键,1 mol SiC含有C—Si键的个数为4NA,故D正确。
3.D Ti是22号元素,价层电子排布式为3d24s2,属于元素周期表中的d区元素,A错误;硒、硅分别与氢元素形成的简单氢化物为H2Se、SiH4,空间结构分别为V形和正四面体形,B错误;在NaCl晶体中,与Na+最接近且距离相等的Cl-形成正八面体,C错误;由图2可知,每个水分子与金属离子形成1个配位键,则1个该水合金属离子中含有4个配位键,D正确。
4.C C70的熔点比石墨的熔点低,故A正确;C70分子中每个碳原子均与周围相邻的其他3个碳原子相连,所以碳原子是sp2杂化,碳酸中的碳原子与3个氧原子形成3个σ键和1个π键,也是sp2杂化,故B正确;C70分子中1个碳原子占有个σ键和个π键,所以1个C70分子中σ键数为70×=105,π键数为70×=35,故C错误;C70→C70Cl10相当于5个π键断裂发生加成反应,一个π键断裂多一对共用电子,所以1个C70Cl10分子中共用电子对数目为105+35+5=145,故D正确。
5.A 由P、Q的化学式知P的外界是S,Q的外界是Br-,在溶液中前者能电离出S而后者不能,故加入BaCl2溶液后Q溶液中不能产生白色沉淀。
6.D 二茂铁中Fe2+与环戊二烯离子(C5)之间为配位键,A正确;1个环戊二烯()分子中含有σ键的数目为11,B正确;由题给信息可知二茂铁分子中存在π键,C正确;由题中信息可知二茂铁是分子晶体,D错误。
7.答案 (1)3∶2 (2)60° (3)sp3 难 (4)范德华力 (5)H4P4O12 (6)[PCl6]- B
解析 (1)基态磷原子最外层电子排布式为3s23p3,3s能级的2个电子已成对,但是3p能级的3个电子分占3个不同的p轨道,故单电子数与成对电子数之比为3∶2。(2)P4分子的空间结构是正四面体形,每个面都是正三角形,键角为60°。(3)从红磷的结构可知,每个P原子形成3个σ键,每个P原子有1个孤电子对,故磷原子的价层电子对数是4,其杂化方式为sp3;红磷具有高聚合结构,有较高的稳定性,难溶于水。(4)黑磷是磷的一种最稳定的同素异形体,其具有类似于石墨的片状结构,片状结构间通过范德华力相结合。(5)依据题意,磷酸分子可通过脱水缩合形成多磷酸,若4个磷酸分子间脱水形成环状的多磷酸,则脱去4个水分子,根据原子守恒,则该多磷酸的分子式可写成H4P4O12。(6)根据题意,固态时PCl5形成离子晶体,且晶胞中含有正四面体的[PCl4]+,则阴离子是正八面体的[PCl6]-;A晶胞中,带不同电荷的离子的数目之比为1∶2;B晶胞中,阴、阳离子数之比为1∶1,且每个离子的配位数是4,这4个离子构成正四面体,6个面心构成正八面体;C晶胞中,带不同电荷的离子的数目之比为1∶2;D的晶胞中不存在正四面体和正八面体,因此晶胞结构最合理的是B。
8.答案 (1)4 (2)面心、棱心
解析 (1)以体心的Zn为例,距离其最近且距离相等的P原子有4个。(2)结合晶胞结构示意图可知,以Ge为顶点的晶胞中,Zn原子位于棱心、面心。
9.答案 8
解析 以顶面面心的P为例,该晶胞中有4个Rh距离P最近,该晶胞上方晶胞中还有4个,所以与P距离最近的Rh有8个;1个晶胞中含有4个P原子和8个Rh原子,则一个晶胞的质量为g;一个晶胞的体积为(a×10-7)3 cm3,则晶体的密度为 g·cm-3。
10.答案 (1)4s 钛、锗、硒 (2)低 邻苯二酚形成分子内氢键,对苯二酚形成分子间氢键 (3)CD
解析 (1)Ni为28号元素,基态Ni原子的电子排布式为[Ar]3d84s2,核外能级最高的电子位于4s能级;根据基态Ni原子的电子排布式可知,其3d能级上未成对电子数为2,同周期中,未成对电子数为2的还有:22号元素钛,其基态原子电子排布式为[Ar]3d24s2;32号元素锗,其基态原子电子排布式为[Ar]3d104s24p2;34号元素硒,其基态原子电子排布式为[Ar]3d104s24p4。(2)邻苯二酚形成分子内氢键,对苯二酚形成分子间氢键,后者分子间作用力较大,故邻苯二酚的熔、沸点比对苯二酚低。(3)NiO晶体结构中阴、阳离子的配位数均为6,晶胞的俯视图应类似于NaCl晶胞,故选CD;根据均摊法,1个晶胞中含Ni2+个数为8×=4,含O2-个数为12×+1=4,NiO的摩尔质量为75 g·mol-1,1个晶胞的质量为 g,晶胞的体积为(a×10-10 cm)3,则晶体的密度为 g·cm-3。
11.答案 (1)1s22s22p63s23p63d84s2或[Ar]3d84s2
(2)> 8处应为灰色球(或8处应为Mg2+)
(3)6 6 (4)LaNi5
解析 (1)Ni是28号元素,核外电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2。(2)其他因素相同时,离子半径越大,离子晶体熔点越低。(3)由信息可知NiO与氯化钠的晶胞结构相似,所以Ni和O的配位数均为6。(4)La原子在8个顶点上,所以晶胞单独占有的La原子数为8×=1;Ni原子有4个位于前、后、左、右四个面的面心,有1个位于体心,有4个在上、下两个面上,所以晶胞单独占有的Ni原子数为(4+4)×+1=5,La与Ni的原子数之比为1∶5,则化学式为LaNi5。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024人教版新教材高中化学选择性必修2
综合拔高练
五年高考练
考点1 晶胞中粒子数目的计算
1.(2021辽宁,7)单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是( )
A.S位于元素周期表p区
B.该物质的化学式为H3S
C.S位于H构成的八面体空隙中
D.该晶体属于分子晶体
2.(高考组合)(1)(2021湖南,18节选)下图是Mg、Ge、O三种元素形成的某化合物的晶胞示意图。
已知化合物中Ge和O的原子个数比为1∶4,图中Z表示 原子(填元素符号),该化合物的化学式为 。
(2)(2021天津,13节选)用X射线衍射测定,得到Fe的两种晶胞A、B,其结构如图所示。晶胞A中每个Fe原子紧邻的原子数为 。每个晶胞B中含Fe原子数为 。
(3)(2021山东,16节选)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为()。已知Xe—F键长为r pm,则B点原子的分数坐标为 。
考点2 金属晶体的结构
3.(2021湖北,10)某立方晶系的锑钾(Sb-K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构图,图b表示晶胞的一部分。下列说法正确的是( )
图a 图b
A.该晶胞的体积为a3×10-36 cm3
B.K和Sb原子数之比为3∶1
C.与Sb最邻近的K原子数为4
D.K和Sb之间的最短距离为a pm
4.(高考组合)(1)(2021全国乙,35节选)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示。处于顶角位置的是 原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为 %(列出计算表达式)。
(2)(2021广东,20节选)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为 ;该晶胞中粒子个数比Hg∶Ge∶Sb= 。
③设X的最简式的式量为Mr,则X晶体的密度为 g/cm3(列出算式)。
考点3 离子晶体的结构与性质
5.(高考组合)(1)(2020课标Ⅱ,35节选)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是 。
化合物 TiF4 TiCl4 TiBr4 TiI4
熔点/℃ 377 -24.12 38.3 155
(2)(2020课标Ⅱ,35节选)CaTiO3的晶胞如图所示,金属离子与氧离子间的作用力为 ,Ca2+的配位数是 。
(3)(2020天津,13改编)Fe、Co、Ni三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为 。
考点4 晶体的相关计算
6.(高考组合)(1)(2021湖南,18节选)下图是Mg、Ge、O三种元素形成的某化合物的晶胞示意图。
已知该晶胞的晶胞参数分别为a nm、b nm、c nm,α=β=γ=90°,则该晶体的密度ρ= g·cm-3(设阿伏加德罗常数的值为NA,用含a、b、c、NA的代数式表示)。
(2)(2021全国甲,35节选)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是 ,晶胞参数为a pm、a pm、c pm,该晶体密度为 g·cm-3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y= (用x表示)。
7.(2020课标Ⅰ,35节选)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有 个。
电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x= ,n(Fe2+)∶n(Fe3+)= 。
8.(2020课标Ⅱ,35节选)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3N,其晶胞如图(b)所示。其中Pb2+与图(a)中 的空间位置相同,有机碱CH3N中,N原子的杂化轨道类型是 ;若晶胞参数为a nm,则晶体密度为 g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
考点5 配位键
9.(高考组合)(1)(2021全国乙,35节选)三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是 ,中心离子的配位数为 。
(2)(2021湖南,18节选)SiCl4与N-甲基咪唑()反应可以得到M2+,其结构如图所示:
N-甲基咪唑分子中碳原子的杂化轨道类型为 ,1个M2+中含有 个σ键。
10.(2020山东,17节选)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如下图所示,1 mol该配合物中通过螯合作用形成的配位键有 mol,该螯合物中N的杂化方式有 种。
11.(2020课标Ⅲ,35节选)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。
(2)NH3BH3分子中,N—B化学键称为 键,其电子对由 提供。
三年模拟练
应用实践
1.(2022北京东城期末)碳化硅晶体具有多种结构,其中一种晶体的晶胞(如图所示)与金刚石的类似。下列判断不正确的是( )
A.该晶体属于分子晶体
B.该晶体中只存在极性键
C.该晶体中Si的化合价为+4价
D.该晶体中C的杂化类型为sp3
2.(2022宁夏石嘴山三中期中)下列说法正确的是(设NA为阿伏加德罗常数的值)( )
A.1 mol NaCl晶胞中含有4NA个NaCl分子
B.一个铜晶胞的质量为g
C.60 g SiO2含有Si—O键的个数为2NA
D.1 mol SiC含有C—Si键的个数为4NA
3.(2022江苏盐城阜宁中学检测)下列有关说法正确的是( )
A.Ti属于元素周期表中的ds区元素
B.硒、硅分别与氢元素形成的简单氢化物的分子的空间结构均为正四面体形
C.在NaCl晶体(晶胞如图1)中,与Na+最接近且距离相等的Cl-形成正四面体
D.某水合金属离子的模型如图2所示,则1个该水合金属离子中含有4个配位键
4.(2021山东济南月考)厦门大学郑兰荪院士合成了一种富勒烯足球状分子(C70Cl10),它是由C70与Cl2反应得到的。在C70分子中每个碳原子均与周围相邻的其他3个碳原子相连,70个碳原子组成若干个正六边形和正五边形,碳元素均为+4价,则下列有关说法中不正确的是( )
A.C70的熔点比石墨的熔点低
B.C70分子中碳原子的杂化方式与碳酸中碳原子的相同
C.1个C70分子中含有70个σ键、35个π键
D.1个C70Cl10分子中共用电子对的数目为145
5.(2021河北石家庄一中月考)Co(NH3)5BrSO4可形成两种钴的配合物,P:[Co(NH3)5Br]SO4,Q:[Co(SO4)(NH3)5]Br,向P、Q的溶液中分别加入BaCl2溶液后,下列有关说法错误的是 ( )
A.Q溶液中会产生白色沉淀
B.P溶液中会产生白色沉淀
C.Q中S是配体
D.P、Q的配位数均是6
6.(2021北京东城阶段检测)二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,二茂铁的熔点是173 ℃(在100 ℃时开始升华),沸点是249 ℃,它是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是( )
A.二茂铁中Fe2+与环戊二烯离子(C5)之间为配位键
B.1 mol环戊二烯()中含有σ键的数目为11NA
C.二茂铁分子中存在π键
D.二茂铁是离子晶体
7.(2022河北唐山期末)磷被首次发现存在于恒星爆炸后的宇宙残余物里。它是在深空发现的两大元素之一,可能给科学家提供有关生命在宇宙里的可能性的线索。磷至少有10种同素异形体,其中主要的是白磷、红磷和黑磷三种。回答下列问题:
(1)基态磷原子最外层单电子数与成对电子数之比为 。
(2)白磷晶体是由P4分子()组成的分子晶体,P4分子中键角为 。
(3)白磷隔绝空气加热到533 K转化为红磷,它是一种暗红色粉末。红磷的结构为,磷原子的杂化方式为 , (填“难”或“易”)溶于水。
(4)黑磷是磷的一种最稳定的同素异形体,其具有类似于石墨的片状结构(如图),片状结构间通过 相结合。
(5)磷有多种含氧酸,磷酸是其中一种,磷酸通过分子间脱水缩合形成多磷酸,如:
++
若4个磷酸分子间脱水形成环状的多磷酸,则该多磷酸的分子式可写成 。
(6)磷的卤化物有PX3和PX5两种类型,其中PCl5是白色固体,在气态和液态时PCl5以分子形态存在,固态时PCl5不再保持该结构,而形成离子晶体。晶胞中含有正四面体的[PCl4]+和正八面体的 ,其晶胞结构最合理的是 (填字母)。
8.(2021福建适应性测试)ZnGeP2和KTiOPO4都是非线性光学晶体材料,在激光技术方面有广泛用途。以Zn为顶点的ZnGeP2晶胞结构如图所示。
(1)距离Zn原子最近且距离相等的P原子有 个。
(2)以Ge为顶点的晶胞中,Zn原子位于 。
9.(2021福建厦门外国语学校期末)贵金属磷化物Rh2P(摩尔质量为237 g·mol-1)可用作电解水的高效催化剂,其立方晶胞如图所示:
已知晶胞参数为a nm,晶体中与P距离最近的Rh的数目为 ,晶体的密度为 g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
10.第Ⅷ族元素Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
(1)基态Ni原子核外能级最高的电子位于 能级,同周期元素中,基态原子未成对电子数与Ni相同的元素名称为 。
(2)Fe3+与酚类物质的显色反应常用于离子检验,已知Fe3+遇邻苯二酚()和对苯二酚()均显绿色。邻苯二酚的熔、沸点比对苯二酚的 (填“高”或“低”),原因是 。
(3)NiO晶体结构中阴、阳离子的配位数均为6,则晶胞的俯视图可能是 (填字母)。若晶胞参数为a pm,阿伏加德罗常数的值为NA,则NiO晶体的密度是 g·cm-3。
迁移创新
11.(2021山东聊城一模)氢能作为一种新型的能量密度高的绿色能源,正引起世界各国的重视。储存技术是氢能利用的关键,储氢材料是当今研究的重点课题之一,金属镍与镧(La)形成的合金是一种良好的储氢材料。
(1)Ni原子的核外电子排布式为 。
(2)NiO、FeO、MgO的晶体结构类型均与氯化钠相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点:NiO (填“<”或“>”)FeO;某同学画出的MgO晶胞结构示意图如图所示,请改正图中的错误: 。
(3)NiO晶胞中Ni和O的配位数分别为 、 。
(4)金属镍与镧(La)形成的晶体的晶胞结构示意图如图所示(部分原子间连线未画出)。该合金的化学式为 。
答案全解全析
五年高考练
1.D A项,S的价层电子排布式为3s23p4,位于元素周期表p区,正确;B项,由题图可知,该晶胞中S原子数目为8×+1=2,H原子数目为12×=6,S、H原子数目比为1∶3,该物质的化学式为H3S,正确;C项,S原子位于H原子构成的八面体空隙中,如图所示:,正确;D项,该晶体是一种新型超导材料,而分子晶体通常不导电,故该晶体不属于分子晶体,错误。
2.答案 (1)O Mg2GeO4 (2)8 4 (3)2 (0,0,)
解析 (1)由题图可知,一个晶胞中X原子数目为8×+3=8,Y原子数目为4,Z原子数目为16,Ge和O的原子个数比为1∶4,则Z表示O原子,Y表示Ge原子,X表示Mg原子,该化合物的化学式为Mg2GeO4。(2)由题图可知,晶胞A中每个Fe原子紧邻的原子数为8。根据均摊法,每个晶胞B中含Fe原子数为8×=4。(3)图中大球的个数为8×+1=2,小球的个数为8×+2=4,根据XeF2的原子个数比知大球是Xe原子,小球是F原子,该晶胞中有2个XeF2分子;由A点坐标知该原子位于晶胞的中心,B点在棱的处,其坐标为(0,0,)。
3.B 1 pm=10-10 cm,故该晶胞的体积为a3×10-30 cm3,A项错误;根据图b利用均摊法可知含有K原子数目为1+4×,含有Sb原子数目为4×,故K和Sb原子数之比为3∶1,B项正确;由图b可知立方体体心K原子与Sb原子紧邻,每个顶点的Sb原子被8个立方体共用,故与Sb原子紧邻的K原子数为8,C项错误;K和Sb之间的最短距离为晶胞体对角线长度的,即a pm,D项错误。
4.答案 (1)Al ×100
(2)①不能无隙并置成晶体,不是最小重复单元
②4 1∶1∶2 ③
解析 (1)根据均摊法,该晶胞中黑球的个数为8×+1=2,灰球的个数为8×+2=4,个数之比为1∶2,根据化学式AlCr2可知,黑球代表Al,灰球代表Cr,故处于顶角位置的为Al原子。晶胞的体积为a2×c,晶胞所含原子的体积为),则金属原子的空间占有率为×100%。
(2)①组成晶体的最小重复单位称为晶胞,整块晶体可以看成是无数晶胞无隙并置而成的,而图b不符合此条件,故不是晶胞。②图c晶胞中底面面心的原子是Hg原子,与其距离最近的Sb有两个,其下方的晶胞中还有两个距离最近的Sb,故X的晶体中与Hg距离最近的Sb的数目为4;每个晶胞中Hg原子数目为4×=4,Ge原子数目为8×+1=4,Sb原子数目为8,故该晶胞中粒子个数比为Hg∶Ge∶Sb=1∶1∶2。③每个晶胞含有的“HgGeSb2”数目为4,则1 mol“HgGeSb2”的体积为×NA,1 mol“HgGeSb2”的质量为Mr g,故X晶体的密度为 g/cm3。
5.答案 (1)TiF4为离子化合物,熔点高,其他三种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高
(2)离子键 12
(3)NiO>CoO>FeO
解析 (1)氟元素非金属性强,TiF4为离子化合物,熔点最高,TiCl4、TiBr4、TiI4为共价化合物,熔点较低,且TiCl4、TiBr4、TiI4结构相似,相对分子质量越大,分子间作用力越强,熔点越高。
(2)阴、阳离子间的作用力为离子键;距离Ca2+最近的为O2-,共有12个O2-与位于体心的Ca2+距离相等且最近,故Ca2+的配位数为12。
(3)由于FeO、CoO、NiO的晶胞类型相同,而离子半径:Fe2+>Co2+>Ni2+,则熔点:NiO>CoO>FeO。
6.答案 (1)
(2)8 2-x
解析 (1)1个晶胞的体积为abc×10-21 cm3,1个晶胞的质量为 g,故其密度为 g·cm-3。
(2)配位数是指一个离子周围最邻近的异电性离子的数目,根据四方ZrO2晶胞图知,顶点处Zr4+每个晶胞中最近的O2-有1个,周围有8个晶胞,故其配位数为8;利用均摊法,1个晶胞中含Zr原子数为8×=4,O原子数为8,晶胞体积为a2c pm3=a2c×10-30 cm3,故其密度为 g·cm-3;根据化合物中各元素正、负化合价代数和为0知,(+2)x+(+4)(1-x)+(-2)y=0,解得y=2-x。
7.答案 4 13∶3
解析 图(a)中每个晶胞含有Li+个数为8×=4,故每个晶胞中含有LiFePO4的单元数为4;图(b)中每个晶胞含有Li+个数为8×,则LiFePO4与Li1-xFePO4中Li+数目之比为1∶(1-x)=4∶;设Li1-xFePO4中Fe2+、Fe3+个数分别为a、b,则有,解得,故n(Fe2+)∶n(Fe3+)=a∶b=13∶3。
8.答案 Ti4+ sp3 ×1021
解析 距离Pb2+最近的是处于面心的I-,Pb2+的配位数为6,图(a)中Ti4+的配位数也为6,其与图(b)中Pb2+的空间位置相同;CH3N中,氮原子形成4个单键,其中有1个是配位键,N原子采取sp3杂化;根据均摊法,1个晶胞中含有I-的个数为6×1/2=3,CH3N的个数为8×1/8= 1,Pb2+的个数为1,化学式为PbCH3NH3I3,摩尔质量为620 g·mol-1,一个晶胞的质量为 g,体积为(a×10-7)3 cm3,则晶体密度为×1021 g·cm-3。
9.答案 (1)N、O、Cl 6 (2)sp3、sp2 54
解析 (1)H2O中的氧原子、NH3中的氮原子和Cl-中都有孤电子对,可作配位原子,故配位原子为O、N、Cl,中心离子的配位数为3+2+1=6。
(2)由结构可知,N-甲基咪唑分子中含有甲基和碳碳双键,则该分子中碳原子的杂化轨道类型为sp2、sp3;1个N-甲基咪唑分子中含有6个C—H键、4个C—N键、1个碳碳双键和1个碳氮双键,单键、配位键属于σ键,1个双键中有1个σ键和1个π键,所以1个M2+中含有12×4+6=54个σ键。
10.答案 6 1
解析 由题意可知,只有成环的配位键才能起到螯合作用,再结合题给结构可知N中的2个O原子和C、N杂环上的4个N原子通过螯合作用与Cd2+形成配位键,故1 mol该配合物中通过螯合作用形成6 mol配位键;N中N原子价层电子对数为3+0=3,N中N原子价层电子对数为2+1=3,C、N杂环上的4个N原子价层电子对数为3,故该配合物中N原子均采取sp2杂化。
11.答案 (2)配位 N
解析 (2)NH3BH3分子中,N原子核外有1个孤电子对,B原子含有空轨道,故N原子提供孤电子对与B原子形成N→B配位键。
三年模拟练
1.A 碳化硅晶体属于共价晶体,故A错误。
2.D NaCl是离子晶体,其晶胞中没有NaCl分子,故A错误;一个铜晶胞占用4个铜原子,一个铜晶胞的质量为g,故B错误;60 g SiO2的物质的量是1 mol,含有Si—O键的个数为4NA,故C错误;1个Si和周围4个C形成4个C—Si键,1个C和周围4个Si形成4个C—Si键,1 mol SiC含有C—Si键的个数为4NA,故D正确。
3.D Ti是22号元素,价层电子排布式为3d24s2,属于元素周期表中的d区元素,A错误;硒、硅分别与氢元素形成的简单氢化物为H2Se、SiH4,空间结构分别为V形和正四面体形,B错误;在NaCl晶体中,与Na+最接近且距离相等的Cl-形成正八面体,C错误;由图2可知,每个水分子与金属离子形成1个配位键,则1个该水合金属离子中含有4个配位键,D正确。
4.C C70的熔点比石墨的熔点低,故A正确;C70分子中每个碳原子均与周围相邻的其他3个碳原子相连,所以碳原子是sp2杂化,碳酸中的碳原子与3个氧原子形成3个σ键和1个π键,也是sp2杂化,故B正确;C70分子中1个碳原子占有个σ键和个π键,所以1个C70分子中σ键数为70×=105,π键数为70×=35,故C错误;C70→C70Cl10相当于5个π键断裂发生加成反应,一个π键断裂多一对共用电子,所以1个C70Cl10分子中共用电子对数目为105+35+5=145,故D正确。
5.A 由P、Q的化学式知P的外界是S,Q的外界是Br-,在溶液中前者能电离出S而后者不能,故加入BaCl2溶液后Q溶液中不能产生白色沉淀。
6.D 二茂铁中Fe2+与环戊二烯离子(C5)之间为配位键,A正确;1个环戊二烯()分子中含有σ键的数目为11,B正确;由题给信息可知二茂铁分子中存在π键,C正确;由题中信息可知二茂铁是分子晶体,D错误。
7.答案 (1)3∶2 (2)60° (3)sp3 难 (4)范德华力 (5)H4P4O12 (6)[PCl6]- B
解析 (1)基态磷原子最外层电子排布式为3s23p3,3s能级的2个电子已成对,但是3p能级的3个电子分占3个不同的p轨道,故单电子数与成对电子数之比为3∶2。(2)P4分子的空间结构是正四面体形,每个面都是正三角形,键角为60°。(3)从红磷的结构可知,每个P原子形成3个σ键,每个P原子有1个孤电子对,故磷原子的价层电子对数是4,其杂化方式为sp3;红磷具有高聚合结构,有较高的稳定性,难溶于水。(4)黑磷是磷的一种最稳定的同素异形体,其具有类似于石墨的片状结构,片状结构间通过范德华力相结合。(5)依据题意,磷酸分子可通过脱水缩合形成多磷酸,若4个磷酸分子间脱水形成环状的多磷酸,则脱去4个水分子,根据原子守恒,则该多磷酸的分子式可写成H4P4O12。(6)根据题意,固态时PCl5形成离子晶体,且晶胞中含有正四面体的[PCl4]+,则阴离子是正八面体的[PCl6]-;A晶胞中,带不同电荷的离子的数目之比为1∶2;B晶胞中,阴、阳离子数之比为1∶1,且每个离子的配位数是4,这4个离子构成正四面体,6个面心构成正八面体;C晶胞中,带不同电荷的离子的数目之比为1∶2;D的晶胞中不存在正四面体和正八面体,因此晶胞结构最合理的是B。
8.答案 (1)4 (2)面心、棱心
解析 (1)以体心的Zn为例,距离其最近且距离相等的P原子有4个。(2)结合晶胞结构示意图可知,以Ge为顶点的晶胞中,Zn原子位于棱心、面心。
9.答案 8
解析 以顶面面心的P为例,该晶胞中有4个Rh距离P最近,该晶胞上方晶胞中还有4个,所以与P距离最近的Rh有8个;1个晶胞中含有4个P原子和8个Rh原子,则一个晶胞的质量为g;一个晶胞的体积为(a×10-7)3 cm3,则晶体的密度为 g·cm-3。
10.答案 (1)4s 钛、锗、硒 (2)低 邻苯二酚形成分子内氢键,对苯二酚形成分子间氢键 (3)CD
解析 (1)Ni为28号元素,基态Ni原子的电子排布式为[Ar]3d84s2,核外能级最高的电子位于4s能级;根据基态Ni原子的电子排布式可知,其3d能级上未成对电子数为2,同周期中,未成对电子数为2的还有:22号元素钛,其基态原子电子排布式为[Ar]3d24s2;32号元素锗,其基态原子电子排布式为[Ar]3d104s24p2;34号元素硒,其基态原子电子排布式为[Ar]3d104s24p4。(2)邻苯二酚形成分子内氢键,对苯二酚形成分子间氢键,后者分子间作用力较大,故邻苯二酚的熔、沸点比对苯二酚低。(3)NiO晶体结构中阴、阳离子的配位数均为6,晶胞的俯视图应类似于NaCl晶胞,故选CD;根据均摊法,1个晶胞中含Ni2+个数为8×=4,含O2-个数为12×+1=4,NiO的摩尔质量为75 g·mol-1,1个晶胞的质量为 g,晶胞的体积为(a×10-10 cm)3,则晶体的密度为 g·cm-3。
11.答案 (1)1s22s22p63s23p63d84s2或[Ar]3d84s2
(2)> 8处应为灰色球(或8处应为Mg2+)
(3)6 6 (4)LaNi5
解析 (1)Ni是28号元素,核外电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2。(2)其他因素相同时,离子半径越大,离子晶体熔点越低。(3)由信息可知NiO与氯化钠的晶胞结构相似,所以Ni和O的配位数均为6。(4)La原子在8个顶点上,所以晶胞单独占有的La原子数为8×=1;Ni原子有4个位于前、后、左、右四个面的面心,有1个位于体心,有4个在上、下两个面上,所以晶胞单独占有的Ni原子数为(4+4)×+1=5,La与Ni的原子数之比为1∶5,则化学式为LaNi5。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
