化学人教版(2019)选择性必修1 2.4化学反应的调控(共39张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.4化学反应的调控(共39张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 22.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-07 18:05:54 | ||
图片预览









文档简介
(共39张PPT)
第二章 化学反应速率与化学平衡
第四节 化学反应的调控
学习目标
1、认识化学反应速率和化学平衡的综合调控在生产、生活和科学研究中的重要意义,能讨论化学反应条件的选择和优化。
2、能从限度、速率等角度对化学反应和化工生产条件进行综合分析。
思考:假如你是一个化工厂的老板对工业生产你主要应考虑哪些问题?
1、经济效益
2、社会效益
提高综合经济效益
理论
实际
单位时间里提高合成氨的产量
(从化学反应的速率考虑)
提高平衡混合物中氨的含量
(从化学平衡的移动考虑)
从生产成本、动力、材料、设备等对上述理论探讨进一步论证,以得出合理的结论。
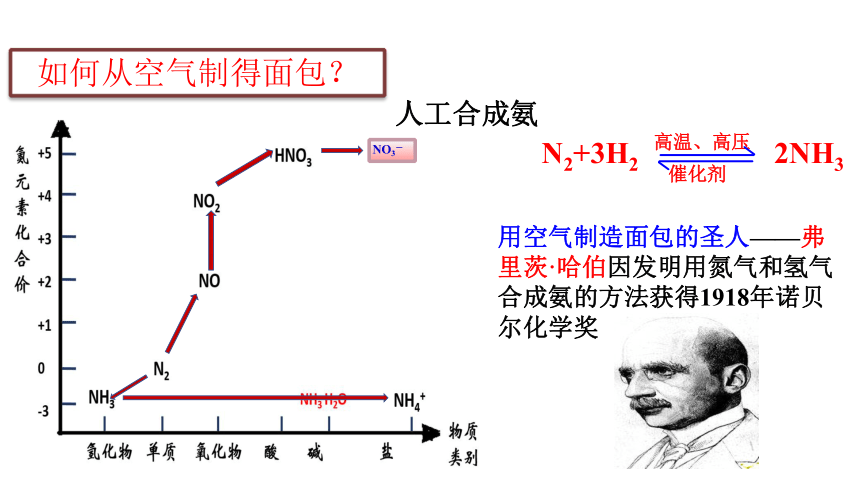
人工合成氨
N2+3H2 2NH3
高温、高压
催化剂
NO3-
用空气制造面包的圣人——弗里茨·哈伯因发明用氮气和氢气合成氨的方法获得1918年诺贝尔化学奖
如何从空气制得面包?
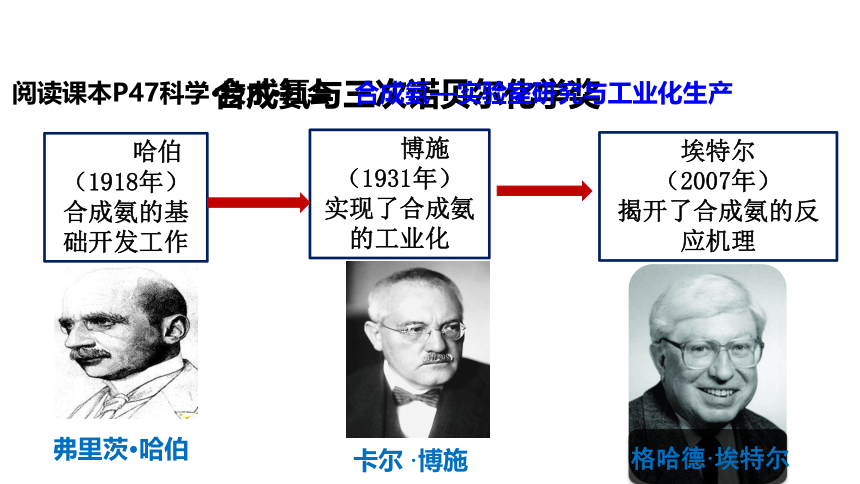
哈伯
(1918年)
合成氨的基础开发工作
合成氨与三次诺贝尔化学奖
博施
(1931年)
实现了合成氨的工业化
埃特尔
(2007年)
揭开了合成氨的反应机理
卡尔 ·博施
格哈德·埃特尔
弗里茨·哈伯
阅读课本P47科学·技术·社会 合成氨—实验室研究与工业化生产
工业合成氨的发展
阅读课本P47科学·技术·社会 合成氨—实验室研究与工业化生产
氮短缺事关人类的存亡,某一天将会有一位化学家寻找出一种方法,将成对的氮原子间三键打破,制出一种能为植物吸收的氮的化合物。
——威廉 克鲁克斯(英国)
18世纪末,有人试图在常温常压下合成氨,也有人在常温加压下进行实验。——都失败了。
【学习任务二 】寻找工业合成氨的适宜条件
哈伯合成氨所用装置
冷却室
反应器
出水口
干燥室
液态NH3
出口
进水口
未反应气体通过循环泵返回
压缩N2和H2进口
德国化学家哈伯向合成氨发起冲击。1908年7月,他在实验室用氮气和氢气在600 ℃、20 MPa下得到了氨,但是产率只有2%。
思考与交流1:合成氨很难吗?合成氨不容易,难在哪儿?如果是你,你会怎样分析?
1.反应原理:
2.反应特点
(1)可逆性:反应为 反应。
(2)熵变:ΔS 0,正反应是气体体积 的反应。
(3)焓变:ΔH 0,是 反应。
一、合成氨反应条件的原理分析:
可逆
<
缩小
<
放热
(4)该反应的自发性如何?
N2(g)+3H2(g) 2NH3(g) △H=-92.2kJ mol-1 S=-198.2J K-1 mol-1
请根据反应的焓变和熵变分析在298K时合成氨反应能否正向自发进行?
△ G=△H-T△S = -33.14 kJ·mol-1<0,可以自发
查表:K(298K)=4 × 106,接近完全
工业合成氨时主要考虑的因素?
(3)便宜
(4)绿色
(2)快
(1)多
即提高平衡混合物里氨的含量
——化学平衡问题
即提高单位时间里氨的产量
——化学反应速率问题
降低成本,提高原料利用率。
保护环境,对设备的要求。
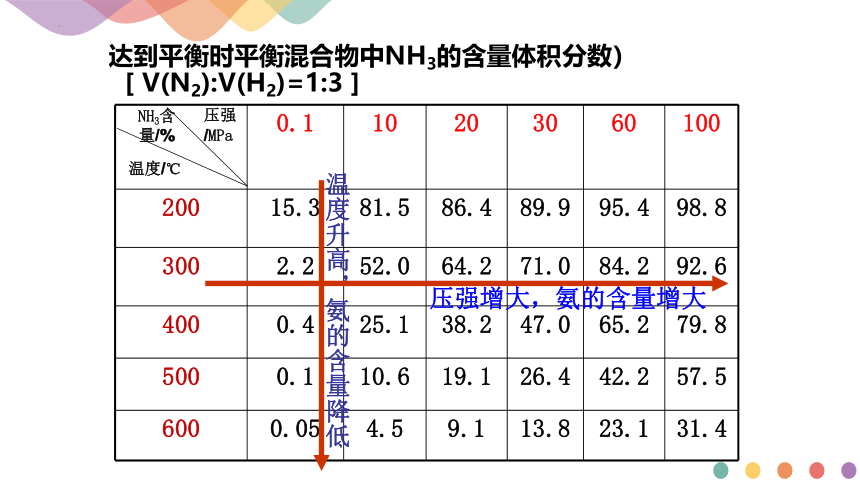
【交流·研讨】
达到平衡时平衡混合物中NH3的含量体积分数)[ V(N2):V(H2)=1:3 ]
0.1 10 20 30 60 100
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.2 52.0 64.2 71.0 84.2 92.6
400 0.4 25.1 38.2 47.0 65.2 79.8
500 0.1 10.6 19.1 26.4 42.2 57.5
600 0.05 4.5 9.1 13.8 23.1 31.4
压强/MPa
NH3含 量/%
温度/℃
温度升高,氨的含量降低
压强增大,氨的含量增大
合成氨的适宜条件的选择
增大浓度
高压
高温
使用
增大浓度
高压
低温
无影响
增大浓度
矛盾
催化剂
温度
压强
外界条件
反应物的浓度
速 率 分 析
平 衡 分 析
使NH3生产得多
使NH3生产得快
理论选择
适宜条件
高压
?
?
一致
1、压强
但是对材料的强度和设备的
制造要求也越高,
需要的动力也越大,
这将会大大增加生产投资,
并可能降低综合经济效益。
目前,我国的合成氨厂
一般采用的压强为10~30MPa
压强越大,速率、转化率都大
综合分析
三、工业合成氨反应条件的控制:
N2(g)+3H2(g) 2NH3(g) △H=-92.2kJ mol-1
2、温度
综合分析
低温能提高平衡转化率,但速率慢,到达平衡时间长,经济效益差,
高温温能提高速率,但转化率小,且催化剂在500 ℃时活性最大
目前,一般采用的温度为400 ~ 500 ℃
三、工业合成氨反应条件的控制:
N2(g)+3H2(g) 2NH3(g) △H=-92.2kJ mol-1
3、催化剂
催化剂,改变反应历程,降低反应的活化能,使反应物在较低温度时能较快地进行反应。
弗里茨·哈伯:锇或用铀—碳化铀作催化剂
锇:效果好,但储量极少且锇蒸汽有剧毒。铀:价格昂贵 ,性质过于敏感
卡尔 ·博施:寻找廉价、安全、稳定的催化剂。
6500次试验,2500种不同配方,最终选用活化温度700K左右的含铅镁促进剂的铁触媒。
铁触媒
三、工业合成氨反应条件的控制:
图2:催化剂不同温度下的催化能力
②混有的杂质使催化剂“中毒”,原料气必须经过净化
①催化剂铁触媒在500 ℃左右时的活性最大
4、浓度
图:NH3的平衡体积分数随投料比变化的曲线
①从化学平衡的角度分析,在氮气和氢气的物质的量比为1:3时,平衡转化率最大,但是实验测得适当提高N2的浓度,即N2和H2的物质的量比为1:2.8时,更能促进氨的合成。
②不断地补充反应物或者及时的分离生成物有利于工业生产
a、迅速冷却氨气成液态并及时分离
b 、将氨分离后的原料气循环使用,并及时补充氮气和氢气,
使反应物保持一定的浓度。
在温度与压强的最佳条件下,平衡混合物中氨的含量仍不高
三、工业合成氨反应条件的控制:
N2(g)+3H2(g) 2NH3(g) △H=-92.2kJ mol-1
1、合成氨常用的生产条件:
①催化剂:铁触媒
②温度:400~500 ℃ ③压强: 10 MPa~30 MPa
④浓度:将氨及时分离出来,原料气循环使用,补充N2和H2
小结:工业合成氨的适宜条件
2、合成氨工业流程:
(二)流程分析
1、原料气干燥、净化:除去原料气中的水蒸气及其他气体杂质,防止与催化剂接触时,导致催化剂“中毒”而降低或丧失催化活性
2、压缩机加压:增大压强
3、热交换:合成氨反应为放热反应,反应体系温度逐渐升高,为原料气反应提供热量,故热交换可充分利用能源,提高经济效益。
4、冷却:生成物NH3的液化需较低温度采取迅速冷却的方法,可使气态氨变成液氨后及时从平衡混合物中分离出来,以促使平衡向生成NH3的方向移动。
5、循环使用原料气:因合成氨反应为可逆反应,平衡混合物中含有原料气,将NH3分离后的原料气循环利用,并及时补充N2和H2,使反应物保持一定的浓度,以利于合成氨反应,提高经济效益。
利用原料气在合成塔中合成NH3,为提高N2的转化率所采取的措施是( )
A.高温 B.高压
C.使用催化剂 D.增大N2的浓度
B
随堂练习
有关合成氨工业的说法中,正确的是( )
A.增大H2的浓度,可提高H2的转化率
B.由于氨易液化,N2、H2在实际生产中会循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在400~500 ℃,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是10 MPa~30 MPa,因为该压强下铁触媒的活性最大
B
随堂练习
四、影响化学反应进行的两个因素
(一)参加反应的物质组成、结构和性质等本身因素
(二)温度、压强、浓度、催化剂等反应条件
1、定义:就是通过改变反应条件使一个可能发生的反应按照某一方向进行。
2、考虑因素:在实际生产中常常需要结合设备条件、安全操作、经济成本等情况,综合考虑影响化学反应速率和化学平衡的因素,寻找适宜的生产条件。此外,还要根据环境保护及社会效益等方面的规定和要求做出分析,权衡利弊,才能实施生产。
五、化学反应的调控
3、控制反应条件的目的
(1)促进有利的化学反应:通过控制反应条件,可以加快化学反应速率,提高反应物的转化率,从而促进有利的化学反应进行。
(2)抑制有害的化学反应:通过控制反应条件,也可以减缓化学反应速率,减少甚至消除有害物质的产生或控制副反应的发生,从而抑制有害的化学反应继续进行。
4、控制反应条件的基本措施
(1)控制化学反应速率的措施:通过改变反应体系的温度、溶液的浓度、气体的压强(或浓度)、固体的表面积以及使用催化剂等途径调控反应速率。
(2)提高转化率的措施:通过改变可逆反应体系的温度、溶液的浓度、气体的压强(或浓度)等改变可逆反应的限度,从而提高转化率。
(1)温度越高越利于合成氨反应平衡正向移动。 ( )
(2)合成氨反应中,压强越大越利于增大反应速率和平衡正向移动。 ( )
(3)使用催化剂能提高合成氨反应物的平衡转化率。 ( )
(4)充入的N2越多越有利于NH3的合成。 ( )
(5)恒容条件下充入稀有气体有利于NH3的合成。 ( )
(6)工业合成氨的反应是熵增加的放热反应,在任何温度下都可自发进行。( )
1.判断正误(正确的打“√”,错误的打“×”)
×
×
√
×
×
×
随堂巩固
1×105 Pa 1×106 Pa 5×106 Pa 1×107 Pa
450 ℃ 97.5% 99.2% 99.6% 99.7%
550 ℃ 85.6% 94.9% 97.7% 98.3%
压强
温度
转化率
回答下列1-5题:
随堂巩固
2. 在硫酸工业中,通过下列反应使SO2氧化成SO3:
2SO2(g)+O2(g) 2SO3(g) ΔH=-198 kJ·mol-1。(已知催化剂是V2O5,在400~500 ℃时催化效果最好)下表为不同温度和压强下SO2的转化率(%):
1.根据化学理论和以上数据综合分析,为了使二氧化硫尽可能转化为三氧化硫,可控制的条件是什么
2.在实际生产中,选定400~500 ℃作为操作温度,其原因是什么
3.根据上表中的数据分析,制取SO3时为什么不采用高压
4.在生产中,通入过量空气的目的是什么
5.尾气中的SO2必须回收的目的是什么
提示:常压、450 ℃、催化剂。
提示:兼顾速率和平衡,且在此温度下催化剂的活性最高。
提示:在常压下SO2的转化率就已经很高了(97.5%),若采用高压,平衡能向右移动,但效果并不明显,且采用高压时会增大设备的成本,得不偿失。
提示:增大反应物O2的浓度,提高SO2的转化率。
提示:防止污染环境;循环利用,提高原料的利用率。
1×105 Pa 1×106 Pa 5×106 Pa 1×107 Pa
450 ℃ 97.5% 99.2% 99.6% 99.7%
550 ℃ 85.6% 94.9% 97.7% 98.3%
3.有关合成氨工业的说法中,正确的是( )
A.增大H2的浓度,可提高H2的转化率
B.由于氨易液化,N2、H2在实际生产中会循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在400~500 ℃,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是10 MPa~30 MPa,因为该压强下铁触媒的活性最大
随堂巩固
B
4.硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关接触氧化反应2SO2+O2 2SO3的说法中正确的是( )
A.只要选择适宜的条件,SO2和O2就能全部转化为SO3
B.该反应达到平衡后,反应就完全停止了,即正、逆反应速率均为零
C.在达到平衡的体系中,充入由18O原子组成的O2后,SO2中18O含量减少,SO3中18O含量增多
D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
随堂巩固
D
5.有平衡体系:CO(g)+2H2(g) CH3OH(g) ΔH<0。为了增加甲醇(CH3OH)的产量,应采取的正确措施是( )
A.高温,高压 B.适宜温度,高压,催化剂
C.低温,低压 D.高温,高压,催化剂
B
随堂巩固
6.工业上合成氨一般采用400~500 ℃的温度,其原因是 ( )
①适当提高氨的合成速率 ②提高H2的转化率 ③提高氨的产率 ④催化剂在500 ℃左右活性最大
A.只有① B.只有①② C.②③④ D.只有①④
D
7.相同温度下,有体积相同的甲、乙两个容器,甲容器中充入1 g N2和1 g H2,乙容器中充入2 g N2和2 g H2,分别进行合成氨反应。下列叙述中错误的是( )
A.化学反应速率:乙>甲
B.平衡后N2的浓度:乙>甲
C.H2的平衡转化率:乙>甲
D.平衡混合气体中H2的体积分数:乙>甲
D
随堂巩固
C
随堂巩固
8.某温度下,对于反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
A.将1 mol氮气、3 mol氢气置于1 L密闭容器中发生反应,放出的热量为
92.4 kJ
B.平衡状态由A变为B时,平衡常数K(A)C.上述反应在达到平衡后,增大压强,H2的转化率增大
D.升高温度,平衡常数K增大
D
随堂巩固
9.在一定条件下,可逆反应N2(g)+3H2(g) 2NH3(g)(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是( )
A.加催化剂,v(正)、v(逆)都发生变化且变化的倍数相等
B.加压,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
C.降温,v(正)、v(逆)都减小,且v(正)减小的倍数小于v(逆)减小的倍数
D.等容条件下加入氩气,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
10.某工业生产中发生反应:2A(g)+B(g) 2M(g) ΔH<0。下列有关该工业生产的说法正确的是( )
A.工业上合成M时,一定采用高压条件,因为高压有利于M的生成
B.若物质B价廉易得,工业上一般采用加入过量的B以提高A和B的转化率
C.工业上一般采用较高温度合成M,因温度越高,反应物的转化率越高
D.工业生产中常采用催化剂,因为生产中使用催化剂可提高M的日产量
D
随堂巩固
随堂巩固
①表中x=______mol·L-1;前2 min内CH4的平均反应速率为______________。
t/min CH4/(mol·L-1) H2O/(mol·L-1) CO/(mol·L-1) H2/(mol·L-1)
0 0.2 0.3 0 0
2 n1 n2 n3 0.3
3 n1 n2 n3 0.3
4 0.09 0.19 x 0.33
0.11
0.05 mol·L-1· min-1
11.已知反应:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0。一定温度下,在1 L容器中发生上述反应,各物质的物质的量浓度变化如下表:
②反应在3~4 min之间,氢气的物质的量增多的原因可能是____(填字母)。
A.充入水蒸气 B.升高温度 C.使用催化剂 D.充入氢气
B
感谢您的观看
第二章 化学反应速率与化学平衡
第四节 化学反应的调控
学习目标
1、认识化学反应速率和化学平衡的综合调控在生产、生活和科学研究中的重要意义,能讨论化学反应条件的选择和优化。
2、能从限度、速率等角度对化学反应和化工生产条件进行综合分析。
思考:假如你是一个化工厂的老板对工业生产你主要应考虑哪些问题?
1、经济效益
2、社会效益
提高综合经济效益
理论
实际
单位时间里提高合成氨的产量
(从化学反应的速率考虑)
提高平衡混合物中氨的含量
(从化学平衡的移动考虑)
从生产成本、动力、材料、设备等对上述理论探讨进一步论证,以得出合理的结论。
人工合成氨
N2+3H2 2NH3
高温、高压
催化剂
NO3-
用空气制造面包的圣人——弗里茨·哈伯因发明用氮气和氢气合成氨的方法获得1918年诺贝尔化学奖
如何从空气制得面包?
哈伯
(1918年)
合成氨的基础开发工作
合成氨与三次诺贝尔化学奖
博施
(1931年)
实现了合成氨的工业化
埃特尔
(2007年)
揭开了合成氨的反应机理
卡尔 ·博施
格哈德·埃特尔
弗里茨·哈伯
阅读课本P47科学·技术·社会 合成氨—实验室研究与工业化生产
工业合成氨的发展
阅读课本P47科学·技术·社会 合成氨—实验室研究与工业化生产
氮短缺事关人类的存亡,某一天将会有一位化学家寻找出一种方法,将成对的氮原子间三键打破,制出一种能为植物吸收的氮的化合物。
——威廉 克鲁克斯(英国)
18世纪末,有人试图在常温常压下合成氨,也有人在常温加压下进行实验。——都失败了。
【学习任务二 】寻找工业合成氨的适宜条件
哈伯合成氨所用装置
冷却室
反应器
出水口
干燥室
液态NH3
出口
进水口
未反应气体通过循环泵返回
压缩N2和H2进口
德国化学家哈伯向合成氨发起冲击。1908年7月,他在实验室用氮气和氢气在600 ℃、20 MPa下得到了氨,但是产率只有2%。
思考与交流1:合成氨很难吗?合成氨不容易,难在哪儿?如果是你,你会怎样分析?
1.反应原理:
2.反应特点
(1)可逆性:反应为 反应。
(2)熵变:ΔS 0,正反应是气体体积 的反应。
(3)焓变:ΔH 0,是 反应。
一、合成氨反应条件的原理分析:
可逆
<
缩小
<
放热
(4)该反应的自发性如何?
N2(g)+3H2(g) 2NH3(g) △H=-92.2kJ mol-1 S=-198.2J K-1 mol-1
请根据反应的焓变和熵变分析在298K时合成氨反应能否正向自发进行?
△ G=△H-T△S = -33.14 kJ·mol-1<0,可以自发
查表:K(298K)=4 × 106,接近完全
工业合成氨时主要考虑的因素?
(3)便宜
(4)绿色
(2)快
(1)多
即提高平衡混合物里氨的含量
——化学平衡问题
即提高单位时间里氨的产量
——化学反应速率问题
降低成本,提高原料利用率。
保护环境,对设备的要求。
【交流·研讨】
达到平衡时平衡混合物中NH3的含量体积分数)[ V(N2):V(H2)=1:3 ]
0.1 10 20 30 60 100
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.2 52.0 64.2 71.0 84.2 92.6
400 0.4 25.1 38.2 47.0 65.2 79.8
500 0.1 10.6 19.1 26.4 42.2 57.5
600 0.05 4.5 9.1 13.8 23.1 31.4
压强/MPa
NH3含 量/%
温度/℃
温度升高,氨的含量降低
压强增大,氨的含量增大
合成氨的适宜条件的选择
增大浓度
高压
高温
使用
增大浓度
高压
低温
无影响
增大浓度
矛盾
催化剂
温度
压强
外界条件
反应物的浓度
速 率 分 析
平 衡 分 析
使NH3生产得多
使NH3生产得快
理论选择
适宜条件
高压
?
?
一致
1、压强
但是对材料的强度和设备的
制造要求也越高,
需要的动力也越大,
这将会大大增加生产投资,
并可能降低综合经济效益。
目前,我国的合成氨厂
一般采用的压强为10~30MPa
压强越大,速率、转化率都大
综合分析
三、工业合成氨反应条件的控制:
N2(g)+3H2(g) 2NH3(g) △H=-92.2kJ mol-1
2、温度
综合分析
低温能提高平衡转化率,但速率慢,到达平衡时间长,经济效益差,
高温温能提高速率,但转化率小,且催化剂在500 ℃时活性最大
目前,一般采用的温度为400 ~ 500 ℃
三、工业合成氨反应条件的控制:
N2(g)+3H2(g) 2NH3(g) △H=-92.2kJ mol-1
3、催化剂
催化剂,改变反应历程,降低反应的活化能,使反应物在较低温度时能较快地进行反应。
弗里茨·哈伯:锇或用铀—碳化铀作催化剂
锇:效果好,但储量极少且锇蒸汽有剧毒。铀:价格昂贵 ,性质过于敏感
卡尔 ·博施:寻找廉价、安全、稳定的催化剂。
6500次试验,2500种不同配方,最终选用活化温度700K左右的含铅镁促进剂的铁触媒。
铁触媒
三、工业合成氨反应条件的控制:
图2:催化剂不同温度下的催化能力
②混有的杂质使催化剂“中毒”,原料气必须经过净化
①催化剂铁触媒在500 ℃左右时的活性最大
4、浓度
图:NH3的平衡体积分数随投料比变化的曲线
①从化学平衡的角度分析,在氮气和氢气的物质的量比为1:3时,平衡转化率最大,但是实验测得适当提高N2的浓度,即N2和H2的物质的量比为1:2.8时,更能促进氨的合成。
②不断地补充反应物或者及时的分离生成物有利于工业生产
a、迅速冷却氨气成液态并及时分离
b 、将氨分离后的原料气循环使用,并及时补充氮气和氢气,
使反应物保持一定的浓度。
在温度与压强的最佳条件下,平衡混合物中氨的含量仍不高
三、工业合成氨反应条件的控制:
N2(g)+3H2(g) 2NH3(g) △H=-92.2kJ mol-1
1、合成氨常用的生产条件:
①催化剂:铁触媒
②温度:400~500 ℃ ③压强: 10 MPa~30 MPa
④浓度:将氨及时分离出来,原料气循环使用,补充N2和H2
小结:工业合成氨的适宜条件
2、合成氨工业流程:
(二)流程分析
1、原料气干燥、净化:除去原料气中的水蒸气及其他气体杂质,防止与催化剂接触时,导致催化剂“中毒”而降低或丧失催化活性
2、压缩机加压:增大压强
3、热交换:合成氨反应为放热反应,反应体系温度逐渐升高,为原料气反应提供热量,故热交换可充分利用能源,提高经济效益。
4、冷却:生成物NH3的液化需较低温度采取迅速冷却的方法,可使气态氨变成液氨后及时从平衡混合物中分离出来,以促使平衡向生成NH3的方向移动。
5、循环使用原料气:因合成氨反应为可逆反应,平衡混合物中含有原料气,将NH3分离后的原料气循环利用,并及时补充N2和H2,使反应物保持一定的浓度,以利于合成氨反应,提高经济效益。
利用原料气在合成塔中合成NH3,为提高N2的转化率所采取的措施是( )
A.高温 B.高压
C.使用催化剂 D.增大N2的浓度
B
随堂练习
有关合成氨工业的说法中,正确的是( )
A.增大H2的浓度,可提高H2的转化率
B.由于氨易液化,N2、H2在实际生产中会循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在400~500 ℃,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是10 MPa~30 MPa,因为该压强下铁触媒的活性最大
B
随堂练习
四、影响化学反应进行的两个因素
(一)参加反应的物质组成、结构和性质等本身因素
(二)温度、压强、浓度、催化剂等反应条件
1、定义:就是通过改变反应条件使一个可能发生的反应按照某一方向进行。
2、考虑因素:在实际生产中常常需要结合设备条件、安全操作、经济成本等情况,综合考虑影响化学反应速率和化学平衡的因素,寻找适宜的生产条件。此外,还要根据环境保护及社会效益等方面的规定和要求做出分析,权衡利弊,才能实施生产。
五、化学反应的调控
3、控制反应条件的目的
(1)促进有利的化学反应:通过控制反应条件,可以加快化学反应速率,提高反应物的转化率,从而促进有利的化学反应进行。
(2)抑制有害的化学反应:通过控制反应条件,也可以减缓化学反应速率,减少甚至消除有害物质的产生或控制副反应的发生,从而抑制有害的化学反应继续进行。
4、控制反应条件的基本措施
(1)控制化学反应速率的措施:通过改变反应体系的温度、溶液的浓度、气体的压强(或浓度)、固体的表面积以及使用催化剂等途径调控反应速率。
(2)提高转化率的措施:通过改变可逆反应体系的温度、溶液的浓度、气体的压强(或浓度)等改变可逆反应的限度,从而提高转化率。
(1)温度越高越利于合成氨反应平衡正向移动。 ( )
(2)合成氨反应中,压强越大越利于增大反应速率和平衡正向移动。 ( )
(3)使用催化剂能提高合成氨反应物的平衡转化率。 ( )
(4)充入的N2越多越有利于NH3的合成。 ( )
(5)恒容条件下充入稀有气体有利于NH3的合成。 ( )
(6)工业合成氨的反应是熵增加的放热反应,在任何温度下都可自发进行。( )
1.判断正误(正确的打“√”,错误的打“×”)
×
×
√
×
×
×
随堂巩固
1×105 Pa 1×106 Pa 5×106 Pa 1×107 Pa
450 ℃ 97.5% 99.2% 99.6% 99.7%
550 ℃ 85.6% 94.9% 97.7% 98.3%
压强
温度
转化率
回答下列1-5题:
随堂巩固
2. 在硫酸工业中,通过下列反应使SO2氧化成SO3:
2SO2(g)+O2(g) 2SO3(g) ΔH=-198 kJ·mol-1。(已知催化剂是V2O5,在400~500 ℃时催化效果最好)下表为不同温度和压强下SO2的转化率(%):
1.根据化学理论和以上数据综合分析,为了使二氧化硫尽可能转化为三氧化硫,可控制的条件是什么
2.在实际生产中,选定400~500 ℃作为操作温度,其原因是什么
3.根据上表中的数据分析,制取SO3时为什么不采用高压
4.在生产中,通入过量空气的目的是什么
5.尾气中的SO2必须回收的目的是什么
提示:常压、450 ℃、催化剂。
提示:兼顾速率和平衡,且在此温度下催化剂的活性最高。
提示:在常压下SO2的转化率就已经很高了(97.5%),若采用高压,平衡能向右移动,但效果并不明显,且采用高压时会增大设备的成本,得不偿失。
提示:增大反应物O2的浓度,提高SO2的转化率。
提示:防止污染环境;循环利用,提高原料的利用率。
1×105 Pa 1×106 Pa 5×106 Pa 1×107 Pa
450 ℃ 97.5% 99.2% 99.6% 99.7%
550 ℃ 85.6% 94.9% 97.7% 98.3%
3.有关合成氨工业的说法中,正确的是( )
A.增大H2的浓度,可提高H2的转化率
B.由于氨易液化,N2、H2在实际生产中会循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在400~500 ℃,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是10 MPa~30 MPa,因为该压强下铁触媒的活性最大
随堂巩固
B
4.硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关接触氧化反应2SO2+O2 2SO3的说法中正确的是( )
A.只要选择适宜的条件,SO2和O2就能全部转化为SO3
B.该反应达到平衡后,反应就完全停止了,即正、逆反应速率均为零
C.在达到平衡的体系中,充入由18O原子组成的O2后,SO2中18O含量减少,SO3中18O含量增多
D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
随堂巩固
D
5.有平衡体系:CO(g)+2H2(g) CH3OH(g) ΔH<0。为了增加甲醇(CH3OH)的产量,应采取的正确措施是( )
A.高温,高压 B.适宜温度,高压,催化剂
C.低温,低压 D.高温,高压,催化剂
B
随堂巩固
6.工业上合成氨一般采用400~500 ℃的温度,其原因是 ( )
①适当提高氨的合成速率 ②提高H2的转化率 ③提高氨的产率 ④催化剂在500 ℃左右活性最大
A.只有① B.只有①② C.②③④ D.只有①④
D
7.相同温度下,有体积相同的甲、乙两个容器,甲容器中充入1 g N2和1 g H2,乙容器中充入2 g N2和2 g H2,分别进行合成氨反应。下列叙述中错误的是( )
A.化学反应速率:乙>甲
B.平衡后N2的浓度:乙>甲
C.H2的平衡转化率:乙>甲
D.平衡混合气体中H2的体积分数:乙>甲
D
随堂巩固
C
随堂巩固
8.某温度下,对于反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
A.将1 mol氮气、3 mol氢气置于1 L密闭容器中发生反应,放出的热量为
92.4 kJ
B.平衡状态由A变为B时,平衡常数K(A)
D.升高温度,平衡常数K增大
D
随堂巩固
9.在一定条件下,可逆反应N2(g)+3H2(g) 2NH3(g)(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是( )
A.加催化剂,v(正)、v(逆)都发生变化且变化的倍数相等
B.加压,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
C.降温,v(正)、v(逆)都减小,且v(正)减小的倍数小于v(逆)减小的倍数
D.等容条件下加入氩气,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
10.某工业生产中发生反应:2A(g)+B(g) 2M(g) ΔH<0。下列有关该工业生产的说法正确的是( )
A.工业上合成M时,一定采用高压条件,因为高压有利于M的生成
B.若物质B价廉易得,工业上一般采用加入过量的B以提高A和B的转化率
C.工业上一般采用较高温度合成M,因温度越高,反应物的转化率越高
D.工业生产中常采用催化剂,因为生产中使用催化剂可提高M的日产量
D
随堂巩固
随堂巩固
①表中x=______mol·L-1;前2 min内CH4的平均反应速率为______________。
t/min CH4/(mol·L-1) H2O/(mol·L-1) CO/(mol·L-1) H2/(mol·L-1)
0 0.2 0.3 0 0
2 n1 n2 n3 0.3
3 n1 n2 n3 0.3
4 0.09 0.19 x 0.33
0.11
0.05 mol·L-1· min-1
11.已知反应:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0。一定温度下,在1 L容器中发生上述反应,各物质的物质的量浓度变化如下表:
②反应在3~4 min之间,氢气的物质的量增多的原因可能是____(填字母)。
A.充入水蒸气 B.升高温度 C.使用催化剂 D.充入氢气
B
感谢您的观看
