2024苏教版新教材高中化学选择性必修1同步练习--第1课时 原电池的工作原理(含解析)
文档属性
| 名称 | 2024苏教版新教材高中化学选择性必修1同步练习--第1课时 原电池的工作原理(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 540.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-08 19:24:48 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024苏教版新教材高中化学选择性必修1
第二单元 化学能与电能的转化
第1课时 原电池的工作原理
基础过关练
题组一 原电池的形成条件
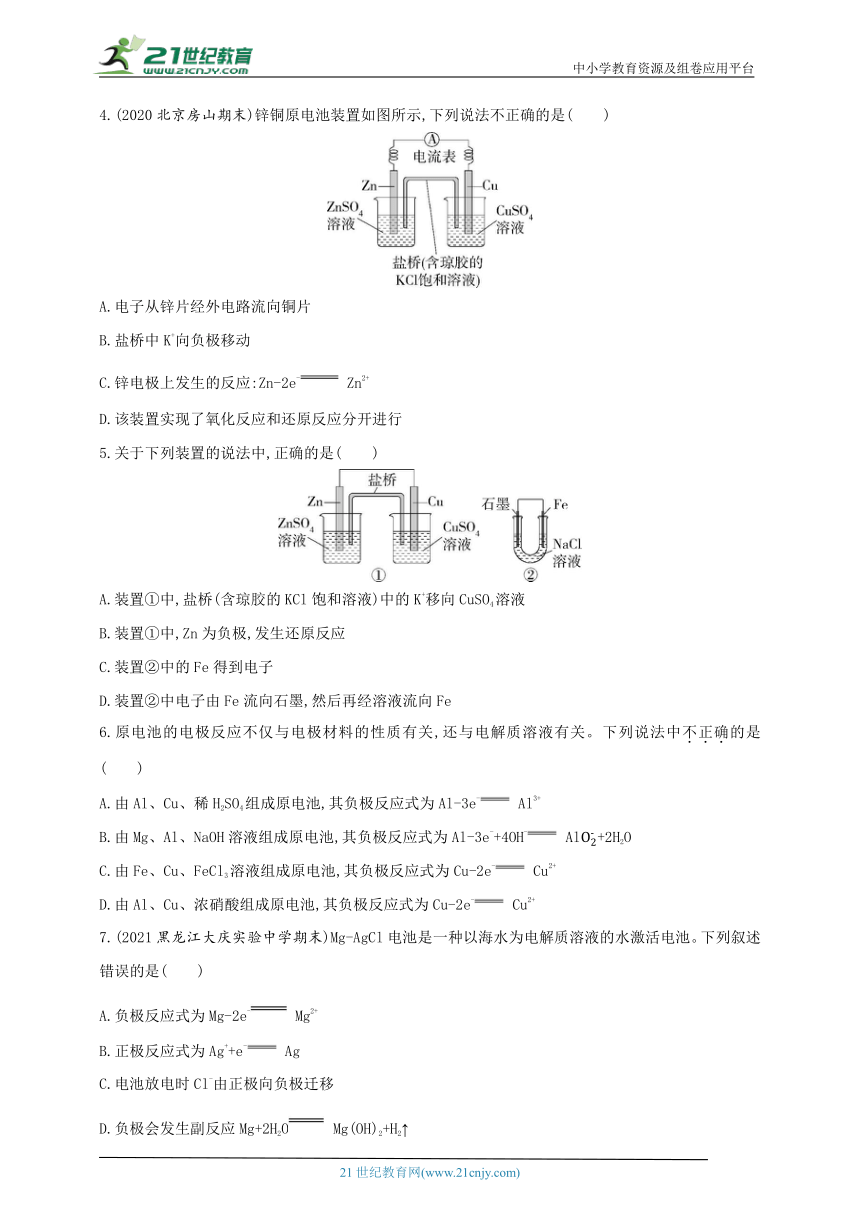
1.(2021东北三省联考)选用稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成下图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转,则其可能的组合共有( )
A.6种 B.5种 C.4种 D.3种
2.(2020山东德州一中月考)下列装置中,电流表指针不能发生偏转的是( )
题组二 原电池的工作原理
3.(2021福建厦门一中月考)如图所示进行实验,下列说法不正确的是( )
A.装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生
B.甲、乙装置中的能量变化均为化学能转化为电能
C.装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转
D.装置乙中负极的电极反应式:Zn-2e- Zn2+
4.(2020北京房山期末)锌铜原电池装置如图所示,下列说法不正确的是( )
A.电子从锌片经外电路流向铜片
B.盐桥中K+向负极移动
C.锌电极上发生的反应:Zn-2e- Zn2+
D.该装置实现了氧化反应和还原反应分开进行
5.关于下列装置的说法中,正确的是( )
A.装置①中,盐桥(含琼胶的KCl饱和溶液)中的K+移向CuSO4溶液
B.装置①中,Zn为负极,发生还原反应
C.装置②中的Fe得到电子
D.装置②中电子由Fe流向石墨,然后再经溶液流向Fe
6.原电池的电极反应不仅与电极材料的性质有关,还与电解质溶液有关。下列说法中不正确的是( )
A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为Al-3e- Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为Al-3e-+4OH- Al+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为Cu-2e- Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为Cu-2e- Cu2+
7.(2021黑龙江大庆实验中学期末)Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是( )
A.负极反应式为Mg-2e- Mg2+
B.正极反应式为Ag++e- Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O Mg(OH)2+H2↑
题组三 原电池原理的应用
8.等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中滴入少量的CuSO4溶液,如图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )
9.(2021江苏扬州中学开学检测)一种微生物电池处理含氮(N)废水的装置如图所示。下列说法正确的是( )
A.电池放电时将电能转化为化学能
B.放电时,电极B附近溶液的pH降低
C.放电时的负极反应为C6H12O6-24e-+6H2O 6CO2↑+24H+
D.理论上,电极A每消耗1 mol C6H12O6,电极B处生成1 mol N2
10.现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下。
实验分组 所用金属 电子流向
① A、Fe A→Fe
② C、D D→C
③ A、C C→A
④ B、Fe Fe→B
⑤ …… ……
根据上述情况,回答下列问题:
(1)上述五种金属的活动性顺序: 。
(2)在①中,Fe片上观察到的现象是 。
(3)在②中,溶液中H+向金属片 (填“C”或“D”)移动。
(4)如果实验⑤用B、D,则导线中电流方向为 (填“B→D”或“D→B”)。
(5)已知反应:Cu+2Fe3+ Cu2++2Fe2+。请用下列试剂和材料,用上图所示装置,将此反应设计成原电池。
试剂:CuCl2溶液、FeCl3溶液、FeCl2溶液、KSCN溶液、K3[Fe(CN)6]溶液、双氧水、NaOH溶液。
材料:Cu片、Fe片、石墨棒。
设计原电池应选用的试剂和材料是 。
答案全解全析
基础过关练
1.B 符合条件的原电池组合有:①铁棒、铜棒、稀H2SO4;②铁棒、铜棒、Fe2(SO4)3溶液;③铁棒、铂棒、稀H2SO4;④铁棒、铂棒、Fe2(SO4)3溶液;⑤铜棒、铂棒、Fe2(SO4)3溶液。
2.A 锌插入氯化铜溶液,锌置换出铜,电子不经过导线,没有电流产生,则电流表指针不发生偏转,A项正确;镁为负极,铝为正极,可构成原电池,电流表指针发生偏转,B项错误;锌为负极,铜为正极,可构成原电池,电流表指针发生偏转,C项错误;锌为负极,铜为正极,可构成原电池,电流表指针发生偏转,D项错误。
3.B 装置甲中锌片与硫酸反应生成硫酸锌和氢气,装置乙中锌片、铜片和稀硫酸形成原电池,铜片作正极,正极上氢离子得电子发生还原反应,所以装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生,故A正确;装置甲没有形成原电池,故B错误;装置乙中锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转,C正确;装置乙中锌片作负极,电极反应式:Zn-2e- Zn2+,故D正确。
4.B 该原电池装置中Zn作为负极,Cu作为正极,电子从负极(锌片)经外电路流向正极(铜片),A项正确;在正极,Cu2++2e- Cu,正极区溶液中阳离子减少,所以盐桥中K+向正极移动,B项错误;锌电极为负极,发生的反应为Zn-2e- Zn2+,C项正确;负极Zn失电子发生氧化反应,正极Cu2+得电子发生还原反应,实现了氧化反应和还原反应分开进行,D项正确。
5.A 装置①为原电池,锌比铜活泼,锌作为负极,铜作为正极,盐桥中的K+移向CuSO4溶液,即向正极移动,A项正确;装置①中,Zn为负极,发生氧化反应,B项错误;装置②中Fe失去电子,C项错误;电子只能经过外电路,不能经过溶液,D项错误。
6.C 由Al、Cu、稀H2SO4组成的原电池中铝是负极,负极反应式为Al-3e- Al3+,A正确;由Mg、Al、NaOH溶液组成的原电池中铝和氢氧化钠溶液反应,铝是负极,负极反应式为Al-3e-+4OH- Al+2H2O,B正确;由Fe、Cu、FeCl3溶液组成的原电池中铁是负极,负极反应式为Fe-2e- Fe2+,C错误;由Al、Cu、浓硝酸组成的原电池中铝在浓硝酸中钝化,因此铜是负极,负极反应式为Cu-2e- Cu2+,D正确。
7.B Mg-AgCl电池中,活泼金属Mg是还原剂、AgCl是氧化剂,金属Mg作负极,负极反应式为Mg-2e- Mg2+,正极反应式为2AgCl+2e- 2Cl-+2Ag,故A正确、B错误;原电池中阴离子移向负极,则Cl-由正极向负极迁移,故C正确;镁是活泼金属,与水反应,化学方程式为Mg+2H2O Mg(OH)2+H2↑,D正确。
8.D 由于两份Zn粉的质量相等,a中Zn与CuSO4反应置换出Cu,Zn的量减少,故产生H2的量减少,但a中Zn、Cu和稀H2SO4形成原电池,加快反应速率,D项图示符合。
9.C 电池放电时为原电池,将化学能转化为电能,A项错误;放电时,电极B上N得电子,生成氮气,电极反应式为2N+10e-+12H+ N2↑+6H2O,H+被消耗,附近溶液的pH升高,B项错误;放电时,电极A上C6H12O6失去电子,生成二氧化碳和H+,电极反应式为C6H12O6-24e-+6H2O 6CO2↑+24H+,C项正确;由B、C项分析可知,电极A每消耗1 mol C6H12O6,电极B处生成N2 2.4 mol,D项错误。
10.答案 (1)D>C>A>Fe>B (2)有无色气泡生成 (3)C (4)B→D (5)FeCl3溶液、Fe片、石墨棒
解析 (1)原电池工作时,电子从负极经导线流向正极,以稀硫酸为电解质溶液时负极较活泼,由电子流向可知金属活动性:A>Fe、D>C、C>A、Fe>B,则金属活动性:D>C>A>Fe>B。
(2)在①中,Fe为正极,氢离子得电子生成氢气,可观察到Fe片上有无色气泡生成。
(3)在②中,溶液中H+向正极移动,即向C移动。
(4)如果实验⑤用B、D,因活泼性B(5)根据反应Cu+2Fe3+ Cu2++2Fe2+设计原电池,Cu被氧化,应为负极,正极可为石墨棒,电解质溶液为氯化铁溶液。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024苏教版新教材高中化学选择性必修1
第二单元 化学能与电能的转化
第1课时 原电池的工作原理
基础过关练
题组一 原电池的形成条件
1.(2021东北三省联考)选用稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成下图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转,则其可能的组合共有( )
A.6种 B.5种 C.4种 D.3种
2.(2020山东德州一中月考)下列装置中,电流表指针不能发生偏转的是( )
题组二 原电池的工作原理
3.(2021福建厦门一中月考)如图所示进行实验,下列说法不正确的是( )
A.装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生
B.甲、乙装置中的能量变化均为化学能转化为电能
C.装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转
D.装置乙中负极的电极反应式:Zn-2e- Zn2+
4.(2020北京房山期末)锌铜原电池装置如图所示,下列说法不正确的是( )
A.电子从锌片经外电路流向铜片
B.盐桥中K+向负极移动
C.锌电极上发生的反应:Zn-2e- Zn2+
D.该装置实现了氧化反应和还原反应分开进行
5.关于下列装置的说法中,正确的是( )
A.装置①中,盐桥(含琼胶的KCl饱和溶液)中的K+移向CuSO4溶液
B.装置①中,Zn为负极,发生还原反应
C.装置②中的Fe得到电子
D.装置②中电子由Fe流向石墨,然后再经溶液流向Fe
6.原电池的电极反应不仅与电极材料的性质有关,还与电解质溶液有关。下列说法中不正确的是( )
A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为Al-3e- Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为Al-3e-+4OH- Al+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为Cu-2e- Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为Cu-2e- Cu2+
7.(2021黑龙江大庆实验中学期末)Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是( )
A.负极反应式为Mg-2e- Mg2+
B.正极反应式为Ag++e- Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O Mg(OH)2+H2↑
题组三 原电池原理的应用
8.等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中滴入少量的CuSO4溶液,如图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )
9.(2021江苏扬州中学开学检测)一种微生物电池处理含氮(N)废水的装置如图所示。下列说法正确的是( )
A.电池放电时将电能转化为化学能
B.放电时,电极B附近溶液的pH降低
C.放电时的负极反应为C6H12O6-24e-+6H2O 6CO2↑+24H+
D.理论上,电极A每消耗1 mol C6H12O6,电极B处生成1 mol N2
10.现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下。
实验分组 所用金属 电子流向
① A、Fe A→Fe
② C、D D→C
③ A、C C→A
④ B、Fe Fe→B
⑤ …… ……
根据上述情况,回答下列问题:
(1)上述五种金属的活动性顺序: 。
(2)在①中,Fe片上观察到的现象是 。
(3)在②中,溶液中H+向金属片 (填“C”或“D”)移动。
(4)如果实验⑤用B、D,则导线中电流方向为 (填“B→D”或“D→B”)。
(5)已知反应:Cu+2Fe3+ Cu2++2Fe2+。请用下列试剂和材料,用上图所示装置,将此反应设计成原电池。
试剂:CuCl2溶液、FeCl3溶液、FeCl2溶液、KSCN溶液、K3[Fe(CN)6]溶液、双氧水、NaOH溶液。
材料:Cu片、Fe片、石墨棒。
设计原电池应选用的试剂和材料是 。
答案全解全析
基础过关练
1.B 符合条件的原电池组合有:①铁棒、铜棒、稀H2SO4;②铁棒、铜棒、Fe2(SO4)3溶液;③铁棒、铂棒、稀H2SO4;④铁棒、铂棒、Fe2(SO4)3溶液;⑤铜棒、铂棒、Fe2(SO4)3溶液。
2.A 锌插入氯化铜溶液,锌置换出铜,电子不经过导线,没有电流产生,则电流表指针不发生偏转,A项正确;镁为负极,铝为正极,可构成原电池,电流表指针发生偏转,B项错误;锌为负极,铜为正极,可构成原电池,电流表指针发生偏转,C项错误;锌为负极,铜为正极,可构成原电池,电流表指针发生偏转,D项错误。
3.B 装置甲中锌片与硫酸反应生成硫酸锌和氢气,装置乙中锌片、铜片和稀硫酸形成原电池,铜片作正极,正极上氢离子得电子发生还原反应,所以装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生,故A正确;装置甲没有形成原电池,故B错误;装置乙中锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转,C正确;装置乙中锌片作负极,电极反应式:Zn-2e- Zn2+,故D正确。
4.B 该原电池装置中Zn作为负极,Cu作为正极,电子从负极(锌片)经外电路流向正极(铜片),A项正确;在正极,Cu2++2e- Cu,正极区溶液中阳离子减少,所以盐桥中K+向正极移动,B项错误;锌电极为负极,发生的反应为Zn-2e- Zn2+,C项正确;负极Zn失电子发生氧化反应,正极Cu2+得电子发生还原反应,实现了氧化反应和还原反应分开进行,D项正确。
5.A 装置①为原电池,锌比铜活泼,锌作为负极,铜作为正极,盐桥中的K+移向CuSO4溶液,即向正极移动,A项正确;装置①中,Zn为负极,发生氧化反应,B项错误;装置②中Fe失去电子,C项错误;电子只能经过外电路,不能经过溶液,D项错误。
6.C 由Al、Cu、稀H2SO4组成的原电池中铝是负极,负极反应式为Al-3e- Al3+,A正确;由Mg、Al、NaOH溶液组成的原电池中铝和氢氧化钠溶液反应,铝是负极,负极反应式为Al-3e-+4OH- Al+2H2O,B正确;由Fe、Cu、FeCl3溶液组成的原电池中铁是负极,负极反应式为Fe-2e- Fe2+,C错误;由Al、Cu、浓硝酸组成的原电池中铝在浓硝酸中钝化,因此铜是负极,负极反应式为Cu-2e- Cu2+,D正确。
7.B Mg-AgCl电池中,活泼金属Mg是还原剂、AgCl是氧化剂,金属Mg作负极,负极反应式为Mg-2e- Mg2+,正极反应式为2AgCl+2e- 2Cl-+2Ag,故A正确、B错误;原电池中阴离子移向负极,则Cl-由正极向负极迁移,故C正确;镁是活泼金属,与水反应,化学方程式为Mg+2H2O Mg(OH)2+H2↑,D正确。
8.D 由于两份Zn粉的质量相等,a中Zn与CuSO4反应置换出Cu,Zn的量减少,故产生H2的量减少,但a中Zn、Cu和稀H2SO4形成原电池,加快反应速率,D项图示符合。
9.C 电池放电时为原电池,将化学能转化为电能,A项错误;放电时,电极B上N得电子,生成氮气,电极反应式为2N+10e-+12H+ N2↑+6H2O,H+被消耗,附近溶液的pH升高,B项错误;放电时,电极A上C6H12O6失去电子,生成二氧化碳和H+,电极反应式为C6H12O6-24e-+6H2O 6CO2↑+24H+,C项正确;由B、C项分析可知,电极A每消耗1 mol C6H12O6,电极B处生成N2 2.4 mol,D项错误。
10.答案 (1)D>C>A>Fe>B (2)有无色气泡生成 (3)C (4)B→D (5)FeCl3溶液、Fe片、石墨棒
解析 (1)原电池工作时,电子从负极经导线流向正极,以稀硫酸为电解质溶液时负极较活泼,由电子流向可知金属活动性:A>Fe、D>C、C>A、Fe>B,则金属活动性:D>C>A>Fe>B。
(2)在①中,Fe为正极,氢离子得电子生成氢气,可观察到Fe片上有无色气泡生成。
(3)在②中,溶液中H+向正极移动,即向C移动。
(4)如果实验⑤用B、D,因活泼性B
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
