2024苏教版新教材高中化学选择性必修1同步练习--第2课时 酸碱中和滴定(含解析)
文档属性
| 名称 | 2024苏教版新教材高中化学选择性必修1同步练习--第2课时 酸碱中和滴定(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 540.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-08 19:28:33 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2024苏教版新教材高中化学选择性必修1
第2课时 酸碱中和滴定
基础过关练
题组一 酸碱中和滴定实验
1.(2021山西朔州怀仁期中)中和滴定实验中,下列有关叙述正确的是( )
A.滴定前应排出滴定管尖嘴部分的气泡
B.在进行滴定时左手操作锥形瓶,右手操作滴定管
C.下端连有橡胶管的滴定管为酸式滴定管
D.滴定过程中两眼应注视滴定管内液面的变化
2.(2021重庆万州第三中学期中)在盐酸滴定NaOH溶液的实验中,以甲基橙为指示剂,滴到终点时的颜色变化是( )
A.由黄色变红色 B.由黄色变橙色
C.由橙色变红色 D.由红色变橙色
3.常温下,用2 mol·L-1 NaOH溶液中和某浓度的硫酸溶液时,溶液的pH和所加NaOH溶液的体积关系如图所示,则原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )
A.0.5 mol·L-1、120 mL
B.0.5 mol·L-1、80 mL
C.0.8 mol·L-1、90 mL
D.1.0 mol·L-1、60 mL
题组二 酸碱中和滴定误差分析
4.中和滴定实验中,用NaOH标准溶液滴定稀盐酸时,下列操作(其他操作正确)会造成测定的盐酸浓度偏高的是( )
A.滴定终点读数时俯视
B.判断终点用甲基橙作指示剂
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分滴定前有气泡,滴定后气泡消失
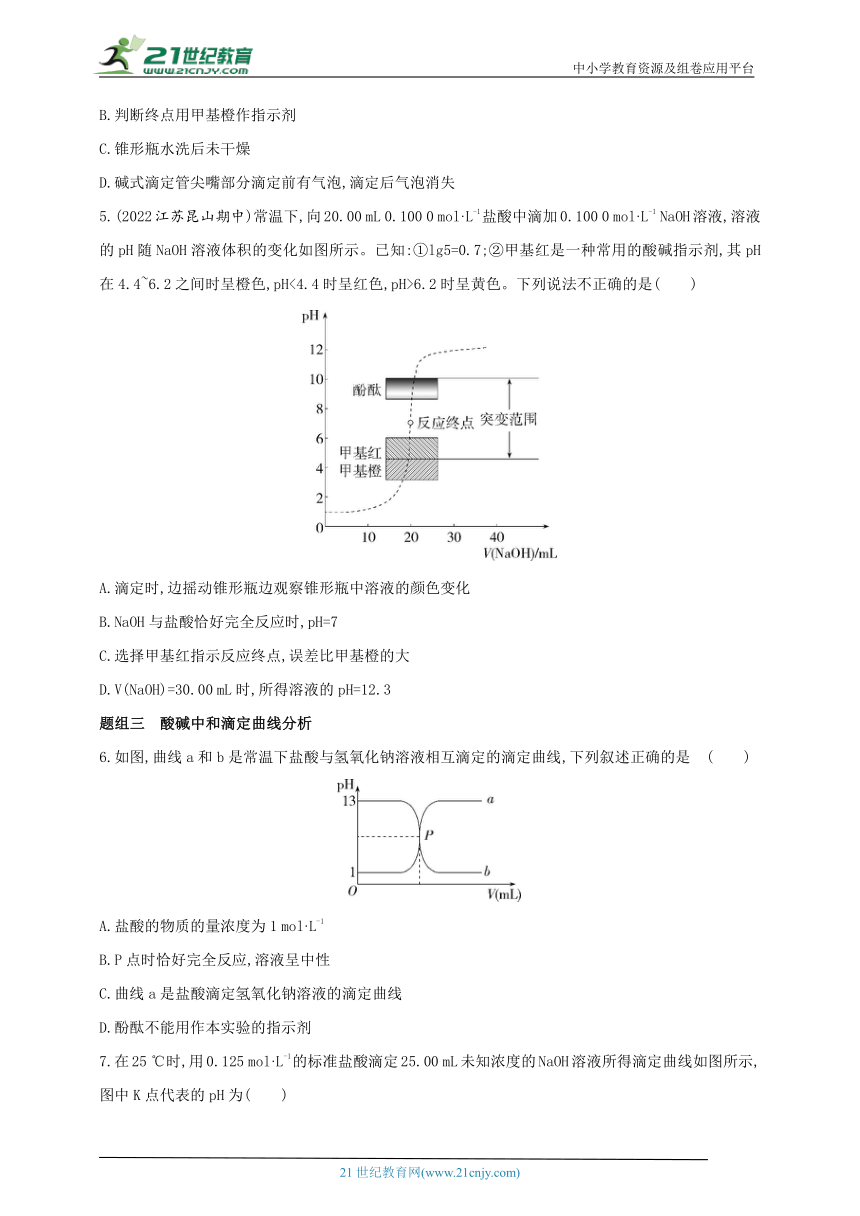
5.(2022江苏昆山期中)常温下,向20.00 mL 0.100 0 mol·L-1盐酸中滴加0.100 0 mol·L-1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。已知:①lg5=0.7;②甲基红是一种常用的酸碱指示剂,其pH在4.4~6.2之间时呈橙色,pH<4.4时呈红色,pH>6.2时呈黄色。下列说法不正确的是( )
A.滴定时,边摇动锥形瓶边观察锥形瓶中溶液的颜色变化
B.NaOH与盐酸恰好完全反应时,pH=7
C.选择甲基红指示反应终点,误差比甲基橙的大
D.V(NaOH)=30.00 mL时,所得溶液的pH=12.3
题组三 酸碱中和滴定曲线分析
6.如图,曲线a和b是常温下盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是 ( )
A.盐酸的物质的量浓度为1 mol·L-1
B.P点时恰好完全反应,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
D.酚酞不能用作本实验的指示剂
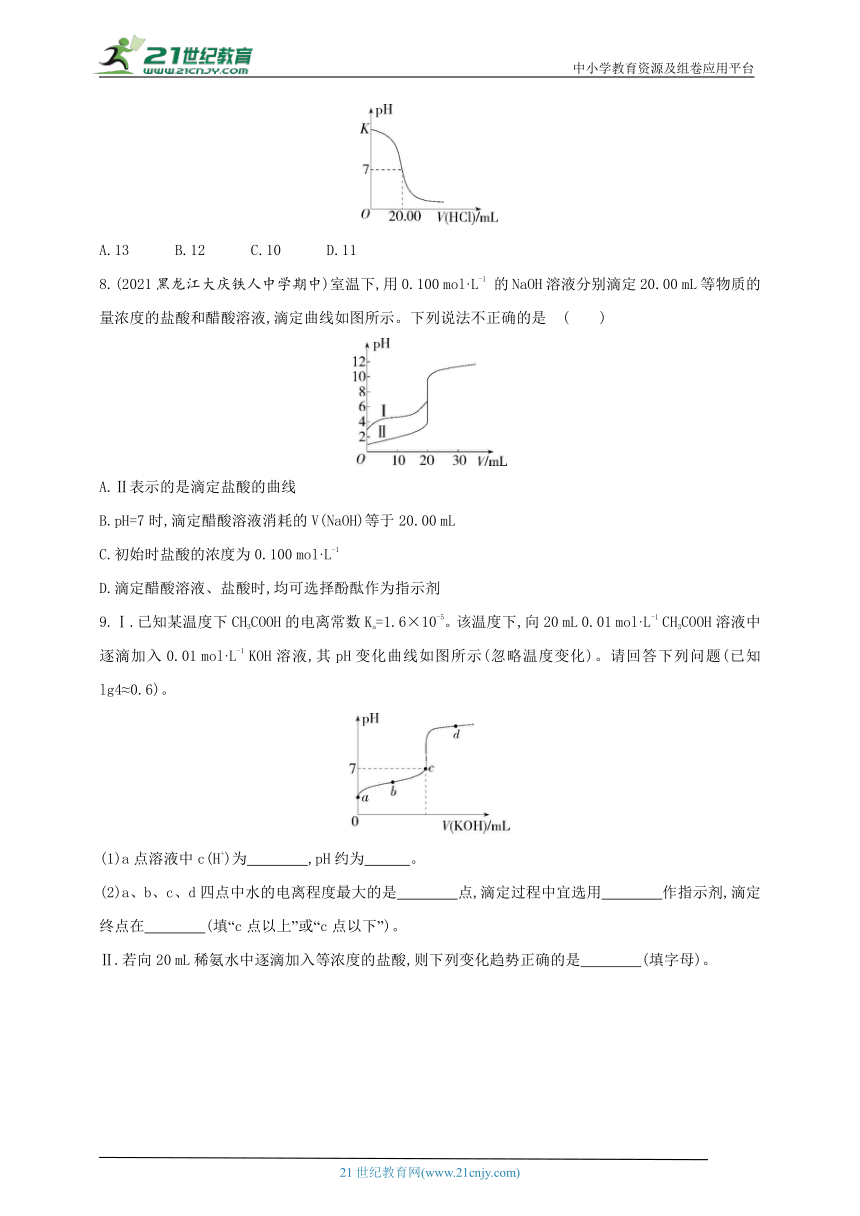
7.在25 ℃时,用0.125 mol·L-1的标准盐酸滴定25.00 mL未知浓度的NaOH溶液所得滴定曲线如图所示,图中K点代表的pH为( )
A.13 B.12 C.10 D.11
8.(2021黑龙江大庆铁人中学期中)室温下,用0.100 mol·L-1 的NaOH溶液分别滴定20.00 mL等物质的量浓度的盐酸和醋酸溶液,滴定曲线如图所示。下列说法不正确的是 ( )
A.Ⅱ表示的是滴定盐酸的曲线
B.pH=7时,滴定醋酸溶液消耗的V(NaOH)等于20.00 mL
C.初始时盐酸的浓度为0.100 mol·L-1
D.滴定醋酸溶液、盐酸时,均可选择酚酞作为指示剂
9.Ⅰ.已知某温度下CH3COOH的电离常数Ka=1.6×10-5。该温度下,向20 mL 0.01 mol·L-1 CH3COOH溶液中逐滴加入0.01 mol·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列问题(已知lg4≈0.6)。
(1)a点溶液中c(H+)为 ,pH约为 。
(2)a、b、c、d四点中水的电离程度最大的是 点,滴定过程中宜选用 作指示剂,滴定终点在 (填“c点以上”或“c点以下”)。
Ⅱ.若向20 mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是 (填字母)。
能力提升练
题组 中和滴定实验及其误差分析
1.(2021河南郑州二中月考)下列有关仪器使用方法或实验操作正确的是( )
A.洗净的锥形瓶和容量瓶必须放进烘干箱中烘干才能开始实验
B.用容量瓶配溶液时,若加水超过刻度线,应立即用滴管吸出多余液体
C.酸式滴定管装标准溶液前,必须先用该溶液润洗
D.酸碱中和滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差
2.(2021江苏启东期中)用0.50 mol·L-1 NaOH标准液10.00 mL,将未知浓度的盐酸20.00 mL恰好滴定至终点,下列说法正确的是 ( )
A.若滴定完毕,滴定管尖嘴悬有一滴标准液,则所测的盐酸浓度偏大
B.用量筒量取上述盐酸
C.若选用酚酞作为指示剂,终点时,液体恰好褪色
D.盐酸的浓度为1.00 mol·L-1
3.(2021山东聊城期中)某学生欲用0.100 0 mol·L-1的氢氧化钠溶液滴定未知浓度的盐酸,以酚酞作为指示剂。请回答下列问题:
(1)排出酸式滴定管中的气泡应采用如图所示操作中的 ,然后小心操作使尖嘴部分充满酸液。
(2)用标准的氢氧化钠溶液滴定待测的盐酸时,眼睛注视 。
(3)下列操作中可能使所测盐酸的浓度偏低的是 。
A.碱式滴定管在滴定前有气泡,滴定后气泡消失
B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥
C.量取一定体积的待测液最后读数时滴定管尖嘴处悬挂一滴溶液
D.读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数
(4)若第一次滴定开始和结束时,碱式滴定管中的液面如图所示。
第二、三、四次滴定消耗的NaOH溶液的体积分别为26.30 mL、26.08 mL、26.12 mL,每次滴定准确量取盐酸25.00 mL,则该盐酸的物质的量浓度c(HCl)= 。
(5)请简述滴定终点的判定方法: 。
4.(2022安徽六安舒城育才学校月考)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度,在实验室中进行如下实验:
①配制100 mL 0.10 mol/L NaOH标准溶液。
②取20.00 mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验 编号 NaOH溶 液的浓度 (mol/L) 滴定完成时, NaOH溶液滴 入的体积(mL) 待测盐 酸的体 积(mL)
1 0.10 22.62 20.00
2 0.10 22.72 20.00
3 0.10 22.80 20.00
请完成下列填空:
(1)滴定达到终点的现象是 ,此时锥形瓶内溶液的pH范围为 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)。
(3)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.滴定终点读数时俯视
B.酸式滴定管水洗后未用待测盐酸润洗
C.滴定前滴定管液面在0刻度以下
D.称量前NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分滴定前有气泡,滴定后消失
5.(2021湖南长郡中学期中)已知某烧碱样品中含有NaCl杂质,为测定该样品中NaOH的质量分数,进行如下实验:
①称量1.00 g样品溶于水,配成250 mL溶液;
②用碱式滴定管准确量取25.00 mL所配溶液于锥形瓶中,滴加2~3滴 作为指示剂;
③用0.100 0 mol·L-1的标准盐酸滴定并重复三次,每次实验数据记录如下:
滴定 序号 待测液 体积/mL 酸式滴定管读数/mL
滴定前 滴定后
1 25.00 0.50 20.60
2 25.00 6.00 26.00
3 25.00 2.10 21.00
4 25.00 1.10 21.00
请回答下列问题:
(1)配制该溶液所需要的主要玻璃仪器为烧杯、玻璃棒、 、 。
(2)实验步骤②中,横线上填的指示剂是 。
(3)判断达到滴定终点时的现象为 。
(4)若出现下列情况,导致测定结果偏高的是 (填序号)。
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎使瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管中在滴定前有气泡,滴定后气泡消失
e.滴定前仰视读数,滴定后俯视读数
f.酸式滴定管在使用前没有用标准液润洗
(5)通过计算可知该烧碱样品的纯度为 。
答案全解全析
基础过关练
1.A 滴定前应排出滴定管尖嘴部分的气泡,否则可能导致标准溶液的体积偏大,所测结果偏高,A项正确;在滴定时左手操作滴定管,右手不停地摇动锥形瓶,B项错误;下端连有橡胶管的滴定管为碱式滴定管,酸式滴定管下端有旋塞,C项错误;滴定过程中两眼应注视锥形瓶中溶液颜色的变化,D项错误。
2.B 甲基橙变色的pH范围是3.1~4.4,在盐酸滴定NaOH溶液的实验中,如果以甲基橙为指示剂,甲基橙指示剂在NaOH溶液中为黄色,滴定到终点时突变为橙色。
3.A 滴入NaOH溶液前,H2SO4溶液的pH=0,c(H+)=1 mol·L-1,则c(H2SO4)=×c(H+)=×1 mol·L-1=0.5 mol·L-1;当加入NaOH溶液体积为40 mL时,溶液的pH=7,表明H2SO4和NaOH刚好完全反应,NaOH和H2SO4以2∶1反应,n(NaOH)=2 mol·L-1×0.040 L=0.080 mol,n(H2SO4)= 0.040 mol,V(H2SO4)=0.040 mol÷0.5 mol·L-1=0.08 L=80 mL,反应后溶液的总体积为80 mL+40 mL=120 mL。
4.D 终点读数时俯视,读取所用NaOH标准溶液的体积偏小,所测盐酸的浓度偏低,A不符合题意;判断终点用甲基橙作指示剂,虽然甲基橙的变色范围不在7附近,但误差很小,可以忽略不计,B不符合题意;锥形瓶水洗后未干燥,不影响HCl的物质的量,对测定结果不产生影响,C不符合题意;碱式滴定管尖嘴部分滴定前有气泡,滴定后气泡消失,则读取NaOH溶液的体积偏大,所测盐酸的浓度偏高,D符合题意。
5.C 滴定实验中,眼睛要注视锥形瓶中溶液颜色的变化,因为要根据颜色变化判断是否还要继续滴定,A正确;NaOH与HCl完全反应生成NaCl,溶液显中性,则两者恰好完全反应时,pH=7,B正确;由图示知,甲基红的变色范围更接近于中性,而甲基橙是在酸性条件下变色,所以选择甲基红作指示剂,误差更小些,C错误;V(NaOH)=30.00 mL时,碱过量,c(OH-)= mol·L-1=0.02 mol·L-1,c(H+)= mol·L-1= 5×10-13 mol·L-1,pH=-lg(5×10-13)=13-lg5=13-0.7=12.3,D正确。
6.B 由题图可知,盐酸与氢氧化钠溶液的浓度相等,都是0.1 mol·L-1, A项错误;P点时盐酸与氢氧化钠溶液的体积相等,恰好完全反应,溶液呈中性,B项正确;曲线a对应的溶液起点的pH等于1,故曲线a是氢氧化钠溶液滴定盐酸的滴定曲线,C项错误;强酸和强碱的中和滴定,达到终点时溶液呈中性,可选用酚酞作为指示剂,D项错误。
7.A 由图示可知,在V(HCl)=20.00 mL时,pH=7,HCl与NaOH恰好完全反应,由c(HCl)·V(HCl)=c(NaOH)·V(NaOH),知c(NaOH)== =0.1 mol·L-1,c(OH-)=0.1 mol·L-1,c(H+)=10-13 mol·L-1, pH=13。
8.B 醋酸是弱电解质,HCl是强电解质,相同浓度的醋酸溶液和HCl溶液,醋酸溶液的pH大于盐酸,所以Ⅰ表示滴定醋酸溶液的曲线,Ⅱ表示滴定盐酸的曲线,A项正确;pH=7时,溶液呈中性,醋酸钠溶液呈碱性,要使溶液呈中性,则醋酸溶液的体积稍大于NaOH溶液的体积,滴定醋酸溶液消耗的V(NaOH)小于20.00 mL,B项错误;由题图可知消耗20.00 mL NaOH溶液时,NaOH与HCl恰好完全反应,则初始时盐酸的浓度为0.10 mol·L-1,C项正确;滴定醋酸溶液、盐酸时,均可选择酚酞作为指示剂,D项正确。
9.答案 Ⅰ.(1)4×10-4 mol·L-1 3.4
(2)c 酚酞 c点以上
Ⅱ.B
解析 Ⅰ.(1)由Ka=得c(H+)≈ mol·L-1= 4×10-4 mol·L-1。(2)a点是醋酸溶液,b点是醋酸和少量CH3COOK的混合溶液,c点是CH3COOK和少量醋酸的混合溶液,d点是CH3COOK和KOH的混合溶液,酸、碱均能抑制水的电离,CH3COOK水解促进水的电离,所以c点溶液中水的电离程度最大。由于醋酸和KOH恰好完全反应时溶液呈碱性,故应选酚酞作为指示剂,滴定终点应在c点以上。Ⅱ.由于稀氨水显碱性,首先排除选项A和C;稀氨水和盐酸恰好反应时溶液显酸性,排除选项D。
能力提升练
1.C 锥形瓶、容量瓶中有少量的蒸馏水,不影响实验,A项错误;用容量瓶配溶液时,若加水超过刻度线,此次配制失败,需重新配制,B项错误;酸式滴定管在盛放标准液之前,应该先用标准液润洗,C项正确;酸碱中和滴定实验中锥形瓶不能用待测液润洗,否则会导致锥形瓶中待测液的溶质的物质的量偏大,使测定结果偏高,D项错误。
2.A 滴定管尖嘴悬有一滴标准液,导致消耗的V(NaOH)偏大,则所测的盐酸浓度偏大,A项正确;量筒的精确度最小为0.1 mL,B项错误;NaOH溶液滴定盐酸,选用酚酞作为指示剂,终点时,溶液由无色变为浅红色,且30 s内不褪色,C项错误;用0.50 mol·L-1 NaOH标准液10.00 mL将未知浓度的盐酸20.00 mL恰好滴定至终点,则c(HCl)===0.25 mol·L-1,D项错误。
3.答案 (1)②
(2)锥形瓶中溶液颜色的变化
(3)CD
(4)0.104 4 mol·L-1
(5)当滴入最后半滴NaOH溶液后,溶液由无色变为浅红色,且半分钟内不褪色
解析 (2)滴定时,两眼注视锥形瓶中溶液颜色的变化,以便准确判断终点。(3)碱式滴定管在滴定前有气泡,滴定后气泡消失,导致消耗的标准液体积偏大,测定结果偏高,A项错误;滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥,对HCl的物质的量没有影响,不影响滴定结果,B项错误;量取一定体积的待测液最后读数时滴定管尖嘴处悬挂一滴溶液,导致待测液的体积偏小,消耗标准液的体积偏小,测定结果偏低,C项正确;读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数,导致标准液体积偏小,测定结果偏低,D项正确。(4)根据题图中的刻度可知,滴定前读数为0.00 mL,滴定后读数为26.10 mL,所以第一次滴定时NaOH标准溶液的体积为26.10 mL,第二次数据舍去,第一、三、四次滴定消耗NaOH溶液的平均体积为26.10 mL,由HCl~NaOH可知,c(HCl)===0.104 4 mol·L-1。(5)NaOH溶液滴定盐酸,以酚酞作为指示剂,滴定终点的判定方法为滴入最后半滴NaOH溶液后,溶液由无色变为浅红色,且半分钟内不褪色。
4.答案 (1)当最后半滴NaOH溶液滴入时,溶液由无色变为浅红色,且半分钟内不褪色 8.2~10.0 (2)0.11 mol/L (3)DE
解析 (1)滴定达到终点的现象是当最后半滴NaOH溶液滴入时,溶液由无色变为浅红色,且半分钟内不褪色。(2)平均消耗氢氧化钠溶液22.71 mL,可计算出该盐酸的浓度为≈0.11 mol/L。(3)A项,终点读数偏小,氢氧化钠溶液体积偏小,测定结果偏低;B项,盐酸被稀释,消耗氢氧化钠溶液体积减小,测定结果偏低;C项,不影响测定结果;D项,氢氧化钠溶液中和能力减弱,消耗氢氧化钠溶液体积增大,测定结果偏高;E项,氢氧化钠溶液体积偏大,测定结果偏高。
5.答案 (1)250 mL容量瓶 胶头滴管 (2)酚酞或甲基橙 (3)滴入最后半滴盐酸后,锥形瓶中溶液的颜色由红色变为无色且半分钟内不恢复原色(或滴入最后半滴盐酸后,锥形瓶中溶液的颜色由黄色变为橙色且半分钟内不恢复原色) (4)cdf (5)80%
解析 (1)配制一定物质的量浓度的250 mL溶液,用到的主要玻璃仪器为烧杯、玻璃棒、250 mL容量瓶、胶头滴管。(2)强酸滴定强碱用酚酞或甲基橙作指示剂。(3)滴定时,若用酚酞作指示剂,则滴入最后半滴盐酸后,锥形瓶中溶液的颜色由红色变为无色且半分钟内不恢复原色,可说明达到滴定终点。若用甲基橙作指示剂,滴入最后半滴盐酸后,锥形瓶中溶液的颜色由黄色变为橙色且半分钟内不恢复原色,可说明达到滴定终点。(4)滴定前用蒸馏水冲洗锥形瓶,待测液中溶质的物质的量不变,所用标准液的体积不变,则测定结果不变,故a项错误;在振荡锥形瓶时不慎使瓶内溶液溅出,会导致所用标准液的体积偏小,则测定结果偏低,故b项错误;若在滴定过程中不慎将数滴酸液滴在锥形瓶外,会导致所用标准液的体积偏大,则测定结果偏高,故c项正确;酸式滴定管中在滴定前有气泡,滴定后气泡消失,造成所用标准液的体积偏大,则测定结果偏高,故d项正确;滴定前仰视读数,滴定后俯视读数,会导致消耗标准液的体积偏小,则测定结果偏低,故e项错误;酸式滴定管在使用前没有用标准液润洗,则标准液被蒸馏水稀释,会导致所用标准液的体积偏大,则测定结果偏高,故f项正确。(5)用0.100 0 mol·L-1的标准盐酸滴定4次,消耗盐酸的平均体积为(20.10+20.00+19.90)/3 mL=20.00 mL(第3次数据偏差太大,舍去),由关系式HCl~NaOH可知,n(NaOH)=0.100 0 mol·L-1×0.02 L=0.002 mol,则该烧碱样品的纯度为×100%=80%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024苏教版新教材高中化学选择性必修1
第2课时 酸碱中和滴定
基础过关练
题组一 酸碱中和滴定实验
1.(2021山西朔州怀仁期中)中和滴定实验中,下列有关叙述正确的是( )
A.滴定前应排出滴定管尖嘴部分的气泡
B.在进行滴定时左手操作锥形瓶,右手操作滴定管
C.下端连有橡胶管的滴定管为酸式滴定管
D.滴定过程中两眼应注视滴定管内液面的变化
2.(2021重庆万州第三中学期中)在盐酸滴定NaOH溶液的实验中,以甲基橙为指示剂,滴到终点时的颜色变化是( )
A.由黄色变红色 B.由黄色变橙色
C.由橙色变红色 D.由红色变橙色
3.常温下,用2 mol·L-1 NaOH溶液中和某浓度的硫酸溶液时,溶液的pH和所加NaOH溶液的体积关系如图所示,则原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )
A.0.5 mol·L-1、120 mL
B.0.5 mol·L-1、80 mL
C.0.8 mol·L-1、90 mL
D.1.0 mol·L-1、60 mL
题组二 酸碱中和滴定误差分析
4.中和滴定实验中,用NaOH标准溶液滴定稀盐酸时,下列操作(其他操作正确)会造成测定的盐酸浓度偏高的是( )
A.滴定终点读数时俯视
B.判断终点用甲基橙作指示剂
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分滴定前有气泡,滴定后气泡消失
5.(2022江苏昆山期中)常温下,向20.00 mL 0.100 0 mol·L-1盐酸中滴加0.100 0 mol·L-1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。已知:①lg5=0.7;②甲基红是一种常用的酸碱指示剂,其pH在4.4~6.2之间时呈橙色,pH<4.4时呈红色,pH>6.2时呈黄色。下列说法不正确的是( )
A.滴定时,边摇动锥形瓶边观察锥形瓶中溶液的颜色变化
B.NaOH与盐酸恰好完全反应时,pH=7
C.选择甲基红指示反应终点,误差比甲基橙的大
D.V(NaOH)=30.00 mL时,所得溶液的pH=12.3
题组三 酸碱中和滴定曲线分析
6.如图,曲线a和b是常温下盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是 ( )
A.盐酸的物质的量浓度为1 mol·L-1
B.P点时恰好完全反应,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
D.酚酞不能用作本实验的指示剂
7.在25 ℃时,用0.125 mol·L-1的标准盐酸滴定25.00 mL未知浓度的NaOH溶液所得滴定曲线如图所示,图中K点代表的pH为( )
A.13 B.12 C.10 D.11
8.(2021黑龙江大庆铁人中学期中)室温下,用0.100 mol·L-1 的NaOH溶液分别滴定20.00 mL等物质的量浓度的盐酸和醋酸溶液,滴定曲线如图所示。下列说法不正确的是 ( )
A.Ⅱ表示的是滴定盐酸的曲线
B.pH=7时,滴定醋酸溶液消耗的V(NaOH)等于20.00 mL
C.初始时盐酸的浓度为0.100 mol·L-1
D.滴定醋酸溶液、盐酸时,均可选择酚酞作为指示剂
9.Ⅰ.已知某温度下CH3COOH的电离常数Ka=1.6×10-5。该温度下,向20 mL 0.01 mol·L-1 CH3COOH溶液中逐滴加入0.01 mol·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列问题(已知lg4≈0.6)。
(1)a点溶液中c(H+)为 ,pH约为 。
(2)a、b、c、d四点中水的电离程度最大的是 点,滴定过程中宜选用 作指示剂,滴定终点在 (填“c点以上”或“c点以下”)。
Ⅱ.若向20 mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是 (填字母)。
能力提升练
题组 中和滴定实验及其误差分析
1.(2021河南郑州二中月考)下列有关仪器使用方法或实验操作正确的是( )
A.洗净的锥形瓶和容量瓶必须放进烘干箱中烘干才能开始实验
B.用容量瓶配溶液时,若加水超过刻度线,应立即用滴管吸出多余液体
C.酸式滴定管装标准溶液前,必须先用该溶液润洗
D.酸碱中和滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差
2.(2021江苏启东期中)用0.50 mol·L-1 NaOH标准液10.00 mL,将未知浓度的盐酸20.00 mL恰好滴定至终点,下列说法正确的是 ( )
A.若滴定完毕,滴定管尖嘴悬有一滴标准液,则所测的盐酸浓度偏大
B.用量筒量取上述盐酸
C.若选用酚酞作为指示剂,终点时,液体恰好褪色
D.盐酸的浓度为1.00 mol·L-1
3.(2021山东聊城期中)某学生欲用0.100 0 mol·L-1的氢氧化钠溶液滴定未知浓度的盐酸,以酚酞作为指示剂。请回答下列问题:
(1)排出酸式滴定管中的气泡应采用如图所示操作中的 ,然后小心操作使尖嘴部分充满酸液。
(2)用标准的氢氧化钠溶液滴定待测的盐酸时,眼睛注视 。
(3)下列操作中可能使所测盐酸的浓度偏低的是 。
A.碱式滴定管在滴定前有气泡,滴定后气泡消失
B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥
C.量取一定体积的待测液最后读数时滴定管尖嘴处悬挂一滴溶液
D.读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数
(4)若第一次滴定开始和结束时,碱式滴定管中的液面如图所示。
第二、三、四次滴定消耗的NaOH溶液的体积分别为26.30 mL、26.08 mL、26.12 mL,每次滴定准确量取盐酸25.00 mL,则该盐酸的物质的量浓度c(HCl)= 。
(5)请简述滴定终点的判定方法: 。
4.(2022安徽六安舒城育才学校月考)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度,在实验室中进行如下实验:
①配制100 mL 0.10 mol/L NaOH标准溶液。
②取20.00 mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验 编号 NaOH溶 液的浓度 (mol/L) 滴定完成时, NaOH溶液滴 入的体积(mL) 待测盐 酸的体 积(mL)
1 0.10 22.62 20.00
2 0.10 22.72 20.00
3 0.10 22.80 20.00
请完成下列填空:
(1)滴定达到终点的现象是 ,此时锥形瓶内溶液的pH范围为 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)。
(3)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.滴定终点读数时俯视
B.酸式滴定管水洗后未用待测盐酸润洗
C.滴定前滴定管液面在0刻度以下
D.称量前NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分滴定前有气泡,滴定后消失
5.(2021湖南长郡中学期中)已知某烧碱样品中含有NaCl杂质,为测定该样品中NaOH的质量分数,进行如下实验:
①称量1.00 g样品溶于水,配成250 mL溶液;
②用碱式滴定管准确量取25.00 mL所配溶液于锥形瓶中,滴加2~3滴 作为指示剂;
③用0.100 0 mol·L-1的标准盐酸滴定并重复三次,每次实验数据记录如下:
滴定 序号 待测液 体积/mL 酸式滴定管读数/mL
滴定前 滴定后
1 25.00 0.50 20.60
2 25.00 6.00 26.00
3 25.00 2.10 21.00
4 25.00 1.10 21.00
请回答下列问题:
(1)配制该溶液所需要的主要玻璃仪器为烧杯、玻璃棒、 、 。
(2)实验步骤②中,横线上填的指示剂是 。
(3)判断达到滴定终点时的现象为 。
(4)若出现下列情况,导致测定结果偏高的是 (填序号)。
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎使瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管中在滴定前有气泡,滴定后气泡消失
e.滴定前仰视读数,滴定后俯视读数
f.酸式滴定管在使用前没有用标准液润洗
(5)通过计算可知该烧碱样品的纯度为 。
答案全解全析
基础过关练
1.A 滴定前应排出滴定管尖嘴部分的气泡,否则可能导致标准溶液的体积偏大,所测结果偏高,A项正确;在滴定时左手操作滴定管,右手不停地摇动锥形瓶,B项错误;下端连有橡胶管的滴定管为碱式滴定管,酸式滴定管下端有旋塞,C项错误;滴定过程中两眼应注视锥形瓶中溶液颜色的变化,D项错误。
2.B 甲基橙变色的pH范围是3.1~4.4,在盐酸滴定NaOH溶液的实验中,如果以甲基橙为指示剂,甲基橙指示剂在NaOH溶液中为黄色,滴定到终点时突变为橙色。
3.A 滴入NaOH溶液前,H2SO4溶液的pH=0,c(H+)=1 mol·L-1,则c(H2SO4)=×c(H+)=×1 mol·L-1=0.5 mol·L-1;当加入NaOH溶液体积为40 mL时,溶液的pH=7,表明H2SO4和NaOH刚好完全反应,NaOH和H2SO4以2∶1反应,n(NaOH)=2 mol·L-1×0.040 L=0.080 mol,n(H2SO4)= 0.040 mol,V(H2SO4)=0.040 mol÷0.5 mol·L-1=0.08 L=80 mL,反应后溶液的总体积为80 mL+40 mL=120 mL。
4.D 终点读数时俯视,读取所用NaOH标准溶液的体积偏小,所测盐酸的浓度偏低,A不符合题意;判断终点用甲基橙作指示剂,虽然甲基橙的变色范围不在7附近,但误差很小,可以忽略不计,B不符合题意;锥形瓶水洗后未干燥,不影响HCl的物质的量,对测定结果不产生影响,C不符合题意;碱式滴定管尖嘴部分滴定前有气泡,滴定后气泡消失,则读取NaOH溶液的体积偏大,所测盐酸的浓度偏高,D符合题意。
5.C 滴定实验中,眼睛要注视锥形瓶中溶液颜色的变化,因为要根据颜色变化判断是否还要继续滴定,A正确;NaOH与HCl完全反应生成NaCl,溶液显中性,则两者恰好完全反应时,pH=7,B正确;由图示知,甲基红的变色范围更接近于中性,而甲基橙是在酸性条件下变色,所以选择甲基红作指示剂,误差更小些,C错误;V(NaOH)=30.00 mL时,碱过量,c(OH-)= mol·L-1=0.02 mol·L-1,c(H+)= mol·L-1= 5×10-13 mol·L-1,pH=-lg(5×10-13)=13-lg5=13-0.7=12.3,D正确。
6.B 由题图可知,盐酸与氢氧化钠溶液的浓度相等,都是0.1 mol·L-1, A项错误;P点时盐酸与氢氧化钠溶液的体积相等,恰好完全反应,溶液呈中性,B项正确;曲线a对应的溶液起点的pH等于1,故曲线a是氢氧化钠溶液滴定盐酸的滴定曲线,C项错误;强酸和强碱的中和滴定,达到终点时溶液呈中性,可选用酚酞作为指示剂,D项错误。
7.A 由图示可知,在V(HCl)=20.00 mL时,pH=7,HCl与NaOH恰好完全反应,由c(HCl)·V(HCl)=c(NaOH)·V(NaOH),知c(NaOH)== =0.1 mol·L-1,c(OH-)=0.1 mol·L-1,c(H+)=10-13 mol·L-1, pH=13。
8.B 醋酸是弱电解质,HCl是强电解质,相同浓度的醋酸溶液和HCl溶液,醋酸溶液的pH大于盐酸,所以Ⅰ表示滴定醋酸溶液的曲线,Ⅱ表示滴定盐酸的曲线,A项正确;pH=7时,溶液呈中性,醋酸钠溶液呈碱性,要使溶液呈中性,则醋酸溶液的体积稍大于NaOH溶液的体积,滴定醋酸溶液消耗的V(NaOH)小于20.00 mL,B项错误;由题图可知消耗20.00 mL NaOH溶液时,NaOH与HCl恰好完全反应,则初始时盐酸的浓度为0.10 mol·L-1,C项正确;滴定醋酸溶液、盐酸时,均可选择酚酞作为指示剂,D项正确。
9.答案 Ⅰ.(1)4×10-4 mol·L-1 3.4
(2)c 酚酞 c点以上
Ⅱ.B
解析 Ⅰ.(1)由Ka=得c(H+)≈ mol·L-1= 4×10-4 mol·L-1。(2)a点是醋酸溶液,b点是醋酸和少量CH3COOK的混合溶液,c点是CH3COOK和少量醋酸的混合溶液,d点是CH3COOK和KOH的混合溶液,酸、碱均能抑制水的电离,CH3COOK水解促进水的电离,所以c点溶液中水的电离程度最大。由于醋酸和KOH恰好完全反应时溶液呈碱性,故应选酚酞作为指示剂,滴定终点应在c点以上。Ⅱ.由于稀氨水显碱性,首先排除选项A和C;稀氨水和盐酸恰好反应时溶液显酸性,排除选项D。
能力提升练
1.C 锥形瓶、容量瓶中有少量的蒸馏水,不影响实验,A项错误;用容量瓶配溶液时,若加水超过刻度线,此次配制失败,需重新配制,B项错误;酸式滴定管在盛放标准液之前,应该先用标准液润洗,C项正确;酸碱中和滴定实验中锥形瓶不能用待测液润洗,否则会导致锥形瓶中待测液的溶质的物质的量偏大,使测定结果偏高,D项错误。
2.A 滴定管尖嘴悬有一滴标准液,导致消耗的V(NaOH)偏大,则所测的盐酸浓度偏大,A项正确;量筒的精确度最小为0.1 mL,B项错误;NaOH溶液滴定盐酸,选用酚酞作为指示剂,终点时,溶液由无色变为浅红色,且30 s内不褪色,C项错误;用0.50 mol·L-1 NaOH标准液10.00 mL将未知浓度的盐酸20.00 mL恰好滴定至终点,则c(HCl)===0.25 mol·L-1,D项错误。
3.答案 (1)②
(2)锥形瓶中溶液颜色的变化
(3)CD
(4)0.104 4 mol·L-1
(5)当滴入最后半滴NaOH溶液后,溶液由无色变为浅红色,且半分钟内不褪色
解析 (2)滴定时,两眼注视锥形瓶中溶液颜色的变化,以便准确判断终点。(3)碱式滴定管在滴定前有气泡,滴定后气泡消失,导致消耗的标准液体积偏大,测定结果偏高,A项错误;滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥,对HCl的物质的量没有影响,不影响滴定结果,B项错误;量取一定体积的待测液最后读数时滴定管尖嘴处悬挂一滴溶液,导致待测液的体积偏小,消耗标准液的体积偏小,测定结果偏低,C项正确;读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数,导致标准液体积偏小,测定结果偏低,D项正确。(4)根据题图中的刻度可知,滴定前读数为0.00 mL,滴定后读数为26.10 mL,所以第一次滴定时NaOH标准溶液的体积为26.10 mL,第二次数据舍去,第一、三、四次滴定消耗NaOH溶液的平均体积为26.10 mL,由HCl~NaOH可知,c(HCl)===0.104 4 mol·L-1。(5)NaOH溶液滴定盐酸,以酚酞作为指示剂,滴定终点的判定方法为滴入最后半滴NaOH溶液后,溶液由无色变为浅红色,且半分钟内不褪色。
4.答案 (1)当最后半滴NaOH溶液滴入时,溶液由无色变为浅红色,且半分钟内不褪色 8.2~10.0 (2)0.11 mol/L (3)DE
解析 (1)滴定达到终点的现象是当最后半滴NaOH溶液滴入时,溶液由无色变为浅红色,且半分钟内不褪色。(2)平均消耗氢氧化钠溶液22.71 mL,可计算出该盐酸的浓度为≈0.11 mol/L。(3)A项,终点读数偏小,氢氧化钠溶液体积偏小,测定结果偏低;B项,盐酸被稀释,消耗氢氧化钠溶液体积减小,测定结果偏低;C项,不影响测定结果;D项,氢氧化钠溶液中和能力减弱,消耗氢氧化钠溶液体积增大,测定结果偏高;E项,氢氧化钠溶液体积偏大,测定结果偏高。
5.答案 (1)250 mL容量瓶 胶头滴管 (2)酚酞或甲基橙 (3)滴入最后半滴盐酸后,锥形瓶中溶液的颜色由红色变为无色且半分钟内不恢复原色(或滴入最后半滴盐酸后,锥形瓶中溶液的颜色由黄色变为橙色且半分钟内不恢复原色) (4)cdf (5)80%
解析 (1)配制一定物质的量浓度的250 mL溶液,用到的主要玻璃仪器为烧杯、玻璃棒、250 mL容量瓶、胶头滴管。(2)强酸滴定强碱用酚酞或甲基橙作指示剂。(3)滴定时,若用酚酞作指示剂,则滴入最后半滴盐酸后,锥形瓶中溶液的颜色由红色变为无色且半分钟内不恢复原色,可说明达到滴定终点。若用甲基橙作指示剂,滴入最后半滴盐酸后,锥形瓶中溶液的颜色由黄色变为橙色且半分钟内不恢复原色,可说明达到滴定终点。(4)滴定前用蒸馏水冲洗锥形瓶,待测液中溶质的物质的量不变,所用标准液的体积不变,则测定结果不变,故a项错误;在振荡锥形瓶时不慎使瓶内溶液溅出,会导致所用标准液的体积偏小,则测定结果偏低,故b项错误;若在滴定过程中不慎将数滴酸液滴在锥形瓶外,会导致所用标准液的体积偏大,则测定结果偏高,故c项正确;酸式滴定管中在滴定前有气泡,滴定后气泡消失,造成所用标准液的体积偏大,则测定结果偏高,故d项正确;滴定前仰视读数,滴定后俯视读数,会导致消耗标准液的体积偏小,则测定结果偏低,故e项错误;酸式滴定管在使用前没有用标准液润洗,则标准液被蒸馏水稀释,会导致所用标准液的体积偏大,则测定结果偏高,故f项正确。(5)用0.100 0 mol·L-1的标准盐酸滴定4次,消耗盐酸的平均体积为(20.10+20.00+19.90)/3 mL=20.00 mL(第3次数据偏差太大,舍去),由关系式HCl~NaOH可知,n(NaOH)=0.100 0 mol·L-1×0.02 L=0.002 mol,则该烧碱样品的纯度为×100%=80%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
