2024苏教版新教材高中化学选择性必修1同步练习--第三单元 金属的腐蚀与防护(含解析)
文档属性
| 名称 | 2024苏教版新教材高中化学选择性必修1同步练习--第三单元 金属的腐蚀与防护(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 633.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-08 19:31:58 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
2024苏教版新教材高中化学选择性必修1
第三单元 金属的腐蚀与防护
基础过关练
题组一 金属的腐蚀
1.铜板上的铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法不正确的是( )
A.正极的电极反应为2H++2e- H2↑
B.此过程中还涉及的反应:4Fe(OH)2+2H2O+O2 4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe流向Cu
2.(2021河北张家口第一中学期中)食品包装中常见的脱氧剂组成为还原铁粉、氯化钠、炭粉等,其脱氧过程与电化学知识相关。下列分析正确的是( )
A.脱氧过程是吸热反应,可降低温度,延长食品保质期
B.脱氧过程中炭作为原电池正极,电极反应为4H++O2+4e- 2H2O
C.含有0.56 g铁粉的脱氧剂,理论上最多能吸收氧气168 mL(标准状况)
D.该过程实现了电能到化学能的转化
题组二 金属的防护
3.(2021河北唐山第十一中学期中)生活和生产中人们采用多种方法防止金属腐蚀,其中保护轮船外壳的常用方法是( )
A.涂保护层
B.改变金属结构
C.牺牲阳极的阴极保护法
D.外加电流的阴极保护法
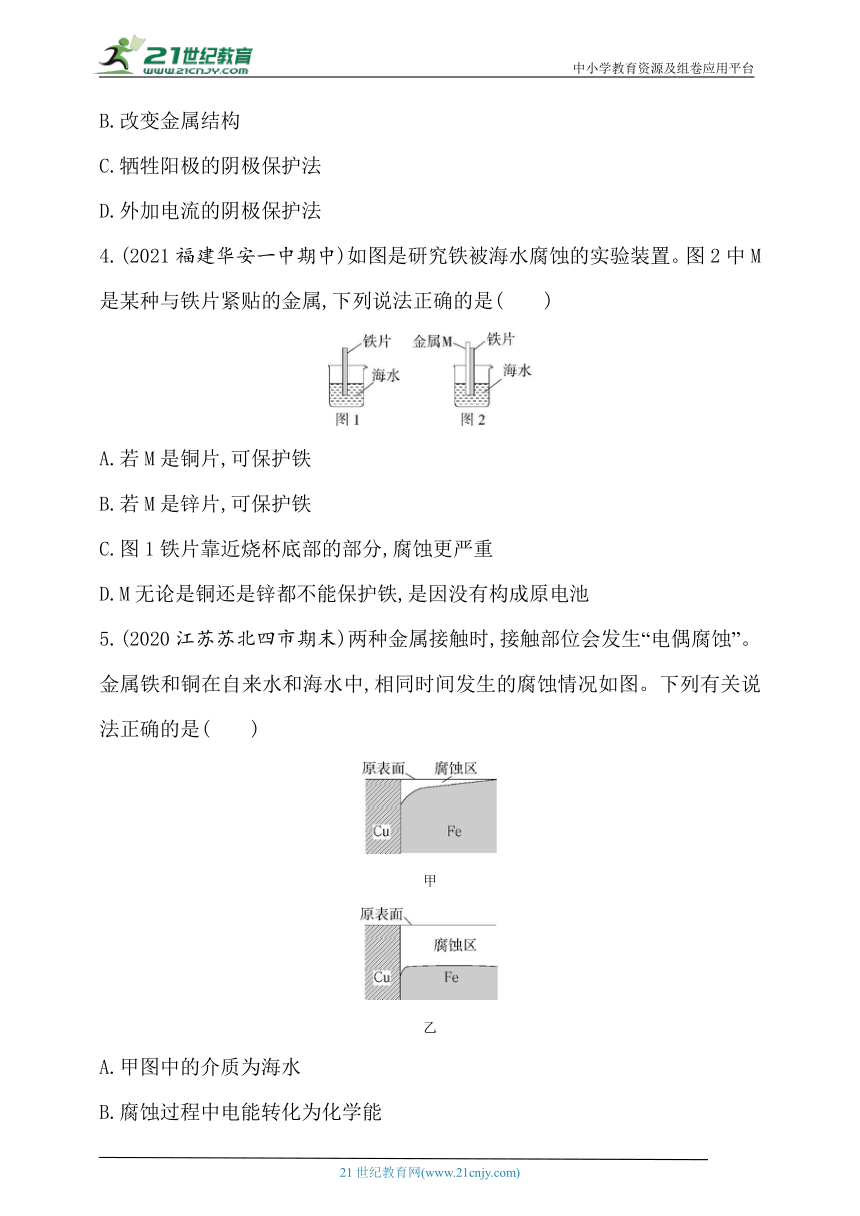
4.(2021福建华安一中期中)如图是研究铁被海水腐蚀的实验装置。图2中M是某种与铁片紧贴的金属,下列说法正确的是( )
A.若M是铜片,可保护铁
B.若M是锌片,可保护铁
C.图1铁片靠近烧杯底部的部分,腐蚀更严重
D.M无论是铜还是锌都不能保护铁,是因没有构成原电池
5.(2020江苏苏北四市期末)两种金属接触时,接触部位会发生“电偶腐蚀”。金属铁和铜在自来水和海水中,相同时间发生的腐蚀情况如图。下列有关说法正确的是( )
甲
乙
A.甲图中的介质为海水
B.腐蚀过程中电能转化为化学能
C.铁电极反应式为Fe-3e- Fe3+
D.若在金属Fe的表面涂油漆,可以减慢铁的腐蚀
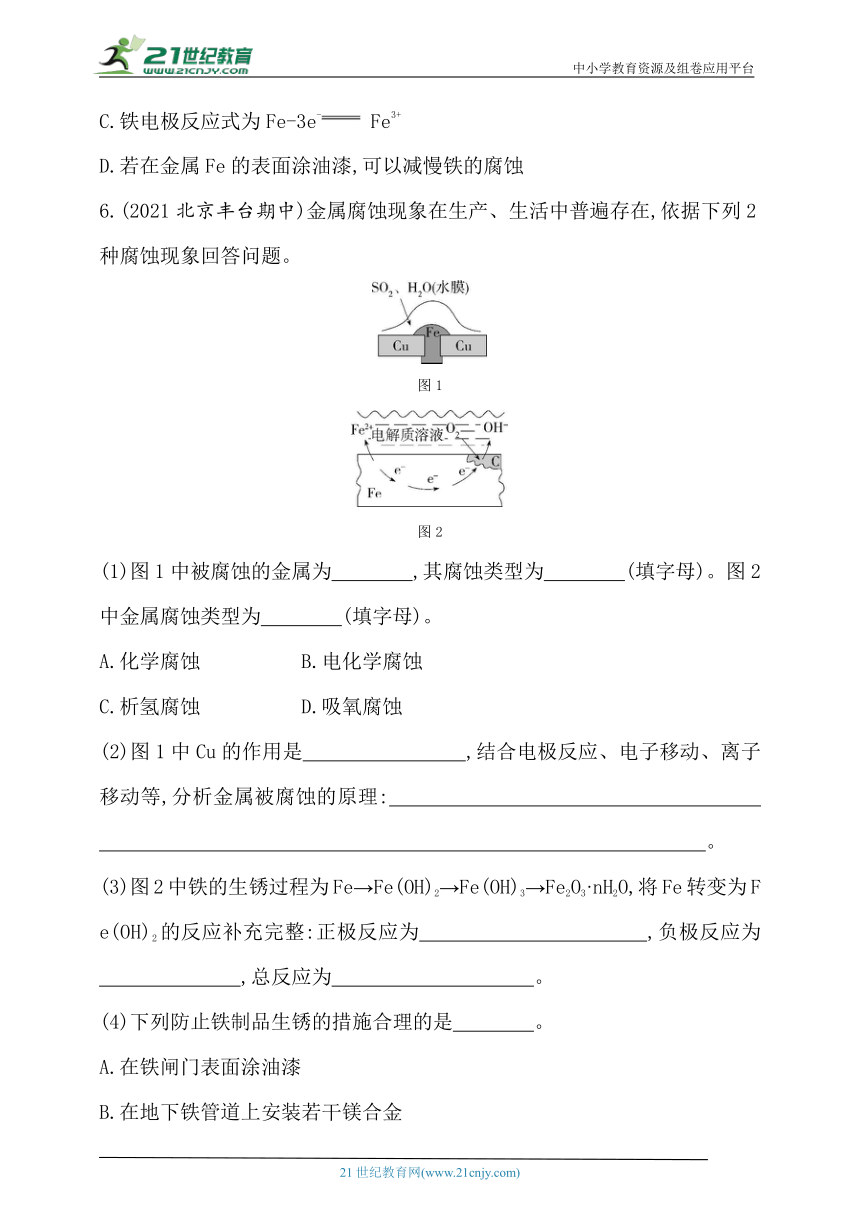
6.(2021北京丰台期中)金属腐蚀现象在生产、生活中普遍存在,依据下列2种腐蚀现象回答问题。
图1
图2
(1)图1中被腐蚀的金属为 ,其腐蚀类型为 (填字母)。图2中金属腐蚀类型为 (填字母)。
A.化学腐蚀 B.电化学腐蚀
C.析氢腐蚀 D.吸氧腐蚀
(2)图1中Cu的作用是 ,结合电极反应、电子移动、离子移动等,分析金属被腐蚀的原理: 。
(3)图2中铁的生锈过程为Fe→Fe(OH)2→Fe(OH)3→Fe2O3·nH2O,将Fe转变为Fe(OH)2的反应补充完整:正极反应为 ,负极反应为 ,总反应为 。
(4)下列防止铁制品生锈的措施合理的是 。
A.在铁闸门表面涂油漆
B.在地下铁管道上安装若干镁合金
C.将铁罐与浓硫酸等强氧化剂接触,使之钝化
题组三 金属腐蚀快慢的比较
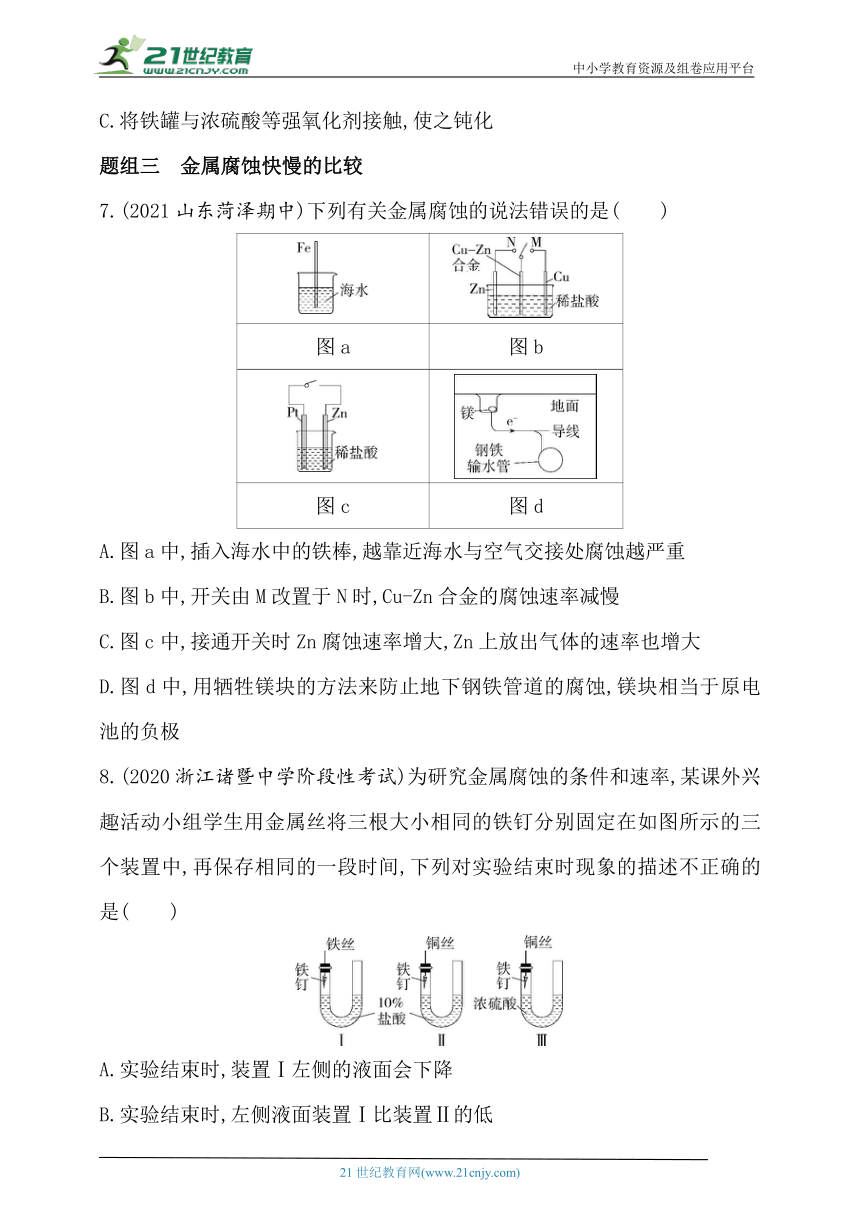
7.(2021山东菏泽期中)下列有关金属腐蚀的说法错误的是( )
图a 图b
图c 图d
A.图a中,插入海水中的铁棒,越靠近海水与空气交接处腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减慢
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的负极
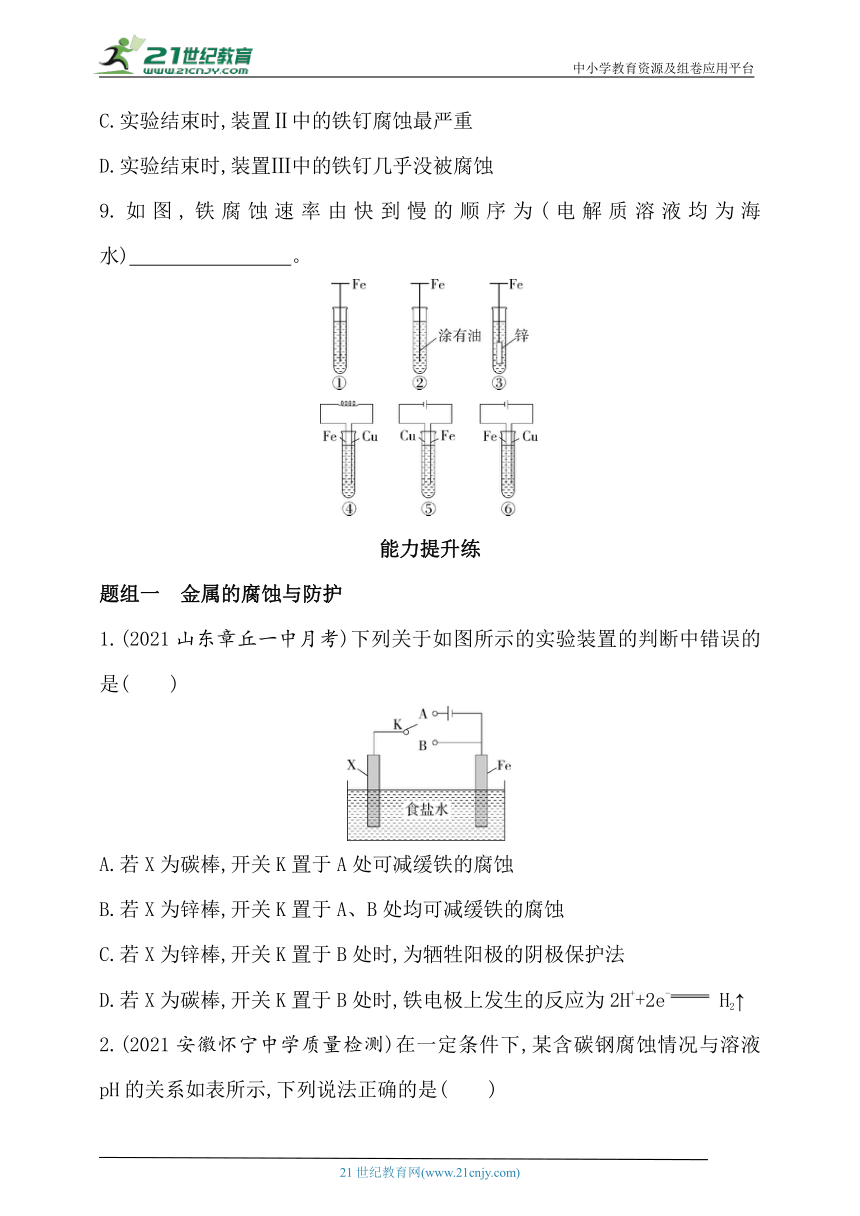
8.(2020浙江诸暨中学阶段性考试)为研究金属腐蚀的条件和速率,某课外兴趣活动小组学生用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,再保存相同的一段时间,下列对实验结束时现象的描述不正确的是( )
A.实验结束时,装置Ⅰ左侧的液面会下降
B.实验结束时,左侧液面装置Ⅰ比装置Ⅱ的低
C.实验结束时,装置Ⅱ中的铁钉腐蚀最严重
D.实验结束时,装置Ⅲ中的铁钉几乎没被腐蚀
9.如图,铁腐蚀速率由快到慢的顺序为(电解质溶液均为海水) 。
能力提升练
题组一 金属的腐蚀与防护
1.(2021山东章丘一中月考)下列关于如图所示的实验装置的判断中错误的是( )
A.若X为碳棒,开关K置于A处可减缓铁的腐蚀
B.若X为锌棒,开关K置于A、B处均可减缓铁的腐蚀
C.若X为锌棒,开关K置于B处时,为牺牲阳极的阴极保护法
D.若X为碳棒,开关K置于B处时,铁电极上发生的反应为2H++2e- H2↑
2.(2021安徽怀宁中学质量检测)在一定条件下,某含碳钢腐蚀情况与溶液pH的关系如表所示,下列说法正确的是( )
pH 2 4 6 6.5 8 13.5 14
腐蚀 快慢 较快 慢 较快
主要 产物 Fe2+ Fe3O4 Fe2O3 Fe
A.当pH<6.5时,碳钢主要发生化学腐蚀
B.当pH<4和pH>13.5时,碳钢主要发生析氢腐蚀
C.pH越大,碳钢的腐蚀速率越慢
D.pH=14时,负极反应为4OH-+Fe-3e- Fe+2H2O
3.(2021江苏如皋中学阶段性检测)下列说法正确的是( )
A.钢铁锈蚀时,Fe失去电子成为Fe3+
B.铅蓄电池(如图)在放电过程中,负极质量减小,正极质量增大
C.将海水中钢铁闸门与电源的负极相连,可防止闸门被腐蚀
D.铅蓄电池和碱性锌锰电池都属于二次电池
题组二 金属腐蚀与防护相关实验探究
4.(2021福建厦门第一中学月考)下列根据实验操作及现象进行的分析和推断中,不正确的是( )
操作
现象
一段时间后:①铁钉裸露在外的附近区域变红; ②……
A.NaCl的琼脂水溶液作为离子迁移的通路
B.①中变红是因为发生反应2H2O+2e- H2↑+2OH-
C.②中可观察到铁钉裸露在外的附近区域变蓝,铜丝附近区域变红
D.①和②中发生的氧化反应均可表示为M-2e- M2+(M代表锌或铁)
5.将两根铁钉分别缠绕铜丝和镁条,放入滴有混合溶液的容器中,如图所示,下列叙述不正确的是( )
A.a中铜丝附近有气泡产生
B.a中铁钉附近出现蓝色沉淀
C.b中铁钉附近呈现红色
D.b中发生吸氧腐蚀
6.(2021北京首都师范大学附属中学期中)某小组同学进行铁的电化学腐蚀原理的探究实验。
装置
分别进行 的操作 ⅰ.连好装置一段时间后,烧杯中滴加酚酞溶液 ⅱ.连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液
现象 铁片表面产生蓝色沉淀
(1)小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。
①实验ⅰ中的现象是 。
②用化学用语解释实验ⅰ中的现象: 。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ⅱ中现象不能证明铁发生了电化学腐蚀,理由是 。
②进行实验,在实验几分钟后记录实验现象,具体如下。
实验 装置
滴管 内试剂 0.5 mol·L-1 K3[Fe(CN)6] 溶液
试管 内试剂 ⅲ.蒸 馏水 ⅳ.1.0 mol· L-1 NaCl溶液 ⅴ.0.5 mol· L-1 Na2SO4 溶液
实验 现象 无明显 变化 铁片表面产 生大量蓝色 沉淀 无明显变化
a.以上实验表明:在 条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b.为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验ⅲ,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是 。
(3)有同学认为上述实验仍不严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验ⅱ结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是 (填字母)。
实验 试剂 现象
A 酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2) 产生蓝色沉淀
B 酸洗后的铁片、K3[Fe(CN)6]和NaCl混合溶液(未除O2) 产生蓝色沉淀
C 铁片、K3[Fe(CN)6]和NaCl混合溶液(已除O2) 产生蓝色沉淀
D 铁片、K3[Fe(CN)6]和盐酸混合溶液(已除O2) 产生蓝色沉淀
答案全解全析
基础过关练
1.A 题图表示吸氧腐蚀,其中铁作为负极,电极反应为2Fe-4e- 2Fe2+,铜作为正极,电极反应为O2+2H2O+4e- 4OH-,形成Fe(OH)2后,还发生反应4Fe(OH)2+O2+2H2O 4Fe(OH)3,A项错误。
2.C 脱氧过程为放热反应,A项错误;炭作为正极,氧气在正极上得电子发生还原反应,电极反应为2H2O+O2+4e- 4OH-,B项错误; 0.56 g铁粉的物质的量为0.01 mol,Fe~Fe2O3~O2,故理论上最多能吸收氧气×0.01 mol×22.4 L/mol=0.168 L=168 mL,C项正确;原电池将化学能转化为电能,D项错误。
3.C 保护轮船外壳的常用方法是船壳上镶一些活泼金属如锌块,锌块作为负极,与船体、电解质溶液(海水)构成原电池,船体作为原电池的正极,被保护,该方法利用的是牺牲阳极的阴极保护法,C项正确。
4.B 若M是铜片,铜片、铁片与海水构成原电池,铁是负极,铁被腐蚀,故A错误;若M是锌片,锌片、铁片与海水构成原电池,锌是负极,锌被腐蚀,铁被保护,故B正确、D错误;图1铁片靠近水面的部分,接触的氧气更多,腐蚀更严重,故C错误。
5.D 铁和铜接触时,遇到电解质溶液会形成原电池,且形成的原电池中铁作为负极,铜作为正极,电解质溶液为海水时的腐蚀速率大于自来水作电解质溶液时的腐蚀速率,因此甲图中的介质为自来水,乙图中的介质是海水,A项错误;腐蚀过程中化学能转化为电能,B项错误;形成的原电池中铁作为负极,失去电子,电极反应式为Fe-2e- Fe2+,C项错误;在金属Fe的表面涂油漆,可以减慢铁的腐蚀,D项正确。
6.答案 (1)铁(或Fe) BC BD
(2)作为正极材料,导电 铜作为正极,氢离子在内电路中移向正极,得到电子,生成氢气;铁作为负极,失去电子,电子通过外电路从负极移向正极,金属铁被腐蚀生成Fe2+
(3)O2+4e-+2H2O 4OH- 2Fe-4e- 2Fe2+ 2Fe+O2+2H2O 2Fe(OH)2
(4)ABC
解析 (1)图1中二氧化硫的水溶液作为电解质溶液,酸性较强,与铁、铜形成原电池,腐蚀类型为析氢腐蚀;图2中电解质溶液显碱性,所发生电化学腐蚀类型为吸氧腐蚀。(3)图2中发生吸氧腐蚀,正极反应为氧气得电子,反应式为O2+4e-+2H2O 4OH-,在负极铁失电子,电极反应式为2Fe-4e- 2Fe2+,总反应为2Fe+O2+2H2O 2Fe(OH)2。 (4)在铁表面涂油漆、在地下铁管道上安装若干镁合金,将铁罐与浓硫酸等强氧化剂接触使之钝化均可防止铁制品生锈。
7.C 图a中,铁棒中含有铁和碳,铁、碳和海水构成了原电池,铁作负极失电子而容易被腐蚀,海水中氧的含量较少,所以越靠近海水与空气交接处腐蚀越严重,A正确;图b中,开关由M改置于N时,合金作正极,锌作负极,所以合金的腐蚀速率减慢,B正确;图c中,接通开关时,Zn作负极,腐蚀速率增大,但氢离子在铂上放电生成氢气,C错误;图d中,Mg的活泼性比Fe强,构成原电池时,Mg作负极,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,D正确。
8.B 盐酸易挥发,装置Ⅰ中铁钉发生化学腐蚀,生成H2,使左侧液面下降,A项正确;装置Ⅱ中,铁钉与铜丝连接,由于Fe比Cu活泼,Fe、Cu与挥发的盐酸形成原电池,Fe作负极,发生析氢腐蚀,放出更多的H2,使左侧液面下降得更多,即左侧液面装置Ⅱ比装置Ⅰ低,B项错误;装置Ⅲ中浓硫酸是难挥发性酸,而且浓硫酸具有吸水性,干燥的空气中铁不易被腐蚀,所以装置Ⅲ中的铁钉几乎没有被腐蚀,D项正确;根据以上分析可知,装置Ⅱ中的铁钉腐蚀最严重,C项正确。
9.答案 ⑤>④>①>②>③>⑥
解析 ①②可发生化学腐蚀;③④都构成原电池,但③中铁为正极受到保护,④中铁为负极被氧化;⑤⑥都构成电解池,⑤中铁与电源的正极相连,作为阳极,氧化速率加快,⑥中铁与电源的负极相连,作为阴极,受到保护。综上分析,铁腐蚀速率的快慢顺序为⑤>④>①>②>③>⑥。
能力提升练
1.D 若X为碳棒,开关K置于A处,Fe作电解池的阴极,属外加电流的阴极保护法,可减缓铁的腐蚀,故A项正确;若X为锌棒,开关K置于A处,Fe作电解池的阴极,属外加电流的阴极保护法,开关K置于B处,Fe作原电池的正极,属牺牲阳极的阴极保护法,均可减缓铁的腐蚀,故B、C项正确;若X为碳棒,开关K置于B处,Fe作原电池的负极,电极反应为Fe-2e- Fe2+,故D项错误。
2.D 当pH<4时,碳钢主要发生析氢腐蚀,A不正确;当pH>13.5,碳钢主要发生吸氧腐蚀,B不正确;从表中信息可以得出,pH在6~8之间时,碳钢的腐蚀速率慢,但pH>13.5时,碳钢的腐蚀速率较快,C不正确;pH=14时,在负极,Fe失电子的产物与OH-反应生成Fe和水,电极反应式为4OH-+Fe-3e- Fe+2H2O,D正确。
3.C 钢铁锈蚀时,Fe失去电子生成Fe2+,A项错误;铅蓄电池在放电过程中,负极Pb失电子后与电解质溶液中的S结合生成PbSO4,质量增大,B项错误;将海水中钢铁闸门与电源的负极相连,此时钢铁闸门作为阴极,可阻止钢铁闸门中的铁失电子,从而防止闸门被腐蚀,C项正确;碱性锌锰电池属于一次电池,D项错误。
4.B 原电池的形成条件之一是形成闭合回路,①和②实验中,NaCl的琼脂水溶液的作用是形成闭合回路,即NaCl的琼脂水溶液作为离子迁移的通路,A项正确;中性或碱性条件下,Zn、Fe与电解质溶液形成原电池,Zn比Fe活泼,Zn作为负极,Fe作为正极,正极的电极反应为2H2O+O2+4e- 4OH-,B项错误;②中NaCl溶液、Cu、Fe形成原电池,Fe比Cu活泼,Fe作为负极,Cu作为正极,负极反应式为Fe-2e- Fe2+,正极反应式为2H2O+O2+4e- 4OH-,所以铁钉裸露在外的附近区域生成蓝色铁氰化亚铁沉淀,铜丝附近区域酚酞遇到碱变红,C项正确;①中Zn和②中Fe均生成+2价的阳离子(Zn2+或Fe2+),发生氧化反应,所以Zn、Fe发生的氧化反应可表示为M-2e- M2+(M代表Zn或Fe),D项正确。
5.C a中Cu作为正极,电解质溶液显酸性,正极的电极反应式为2H++2e- H2↑,所以a中铜丝附近有气泡产生,A项正确;a中Fe电极的电极反应式为Fe-2e- Fe2+,Fe2+和K3[Fe(CN)6]反应生成蓝色沉淀,所以a中铁钉附近出现蓝色沉淀,B项正确;b中Fe作为正极被保护,Fe不参加反应,没有铁离子生成,所以铁钉附近不呈现红色,C项错误;b中发生吸氧腐蚀,D项正确。
6.答案 (1)①碳棒附近溶液变红 ②O2+4e-+2H2O 4OH-
(2)①K3[Fe(CN)6]将Fe氧化为Fe2+,会干扰由于电化学腐蚀生成的Fe2+的检验 ②a.Cl-存在 b.破坏铁片表面的氧化膜
(3)AC
解析 (1)①实验ⅰ中,碳棒为正极,正极上发生O2得电子生成OH-的反应,碳棒附近溶液变红。②正极上氧气得电子与水反应生成氢氧根离子,电极反应式为O2+4e-+2H2O 4OH-。(2)①K3[Fe(CN)6]具有氧化性,能将Fe氧化为Fe2+,影响实验结果。②a.对比实验ⅳ和ⅴ,溶液中的Na+、S对铁的腐蚀无影响,Cl-使K3[Fe(CN)6]溶液易与Fe反应;b.用稀硫酸酸洗后,铁片表面的氧化膜被破坏,再进行实验ⅲ,铁片表面产生蓝色沉淀,则Cl-的作用与稀硫酸相同,也是破坏铁片表面的氧化膜。(3)已除O2的铁片不能发生吸氧腐蚀,只能发生铁片、K3[Fe(CN)6]溶液的反应,从而表明K3[Fe(CN)6]能与铁作用生成Fe2+,A符合题意;酸洗后的铁片、K3[Fe(CN)6]和NaCl混合溶液(未除O2),同时满足两个反应发生的条件,既可能是K3[Fe(CN)6]与铁作用生成Fe2+,也可能是铁片发生了吸氧腐蚀,B不符合题意;铁片、K3[Fe(CN)6]和NaCl混合溶液(已除O2),不能发生吸氧腐蚀,只能是Cl-破坏铁片表面的氧化膜,然后K3[Fe(CN)6]与铁作用生成Fe2+,C符合题意;铁片、K3[Fe(CN)6]和盐酸混合溶液(已除O2)反应产生蓝色沉淀,可能是铁片与盐酸直接反应生成Fe2+,也可能是K3[Fe(CN)6]与铁作用生成Fe2+,D不符合题意。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024苏教版新教材高中化学选择性必修1
第三单元 金属的腐蚀与防护
基础过关练
题组一 金属的腐蚀
1.铜板上的铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法不正确的是( )
A.正极的电极反应为2H++2e- H2↑
B.此过程中还涉及的反应:4Fe(OH)2+2H2O+O2 4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe流向Cu
2.(2021河北张家口第一中学期中)食品包装中常见的脱氧剂组成为还原铁粉、氯化钠、炭粉等,其脱氧过程与电化学知识相关。下列分析正确的是( )
A.脱氧过程是吸热反应,可降低温度,延长食品保质期
B.脱氧过程中炭作为原电池正极,电极反应为4H++O2+4e- 2H2O
C.含有0.56 g铁粉的脱氧剂,理论上最多能吸收氧气168 mL(标准状况)
D.该过程实现了电能到化学能的转化
题组二 金属的防护
3.(2021河北唐山第十一中学期中)生活和生产中人们采用多种方法防止金属腐蚀,其中保护轮船外壳的常用方法是( )
A.涂保护层
B.改变金属结构
C.牺牲阳极的阴极保护法
D.外加电流的阴极保护法
4.(2021福建华安一中期中)如图是研究铁被海水腐蚀的实验装置。图2中M是某种与铁片紧贴的金属,下列说法正确的是( )
A.若M是铜片,可保护铁
B.若M是锌片,可保护铁
C.图1铁片靠近烧杯底部的部分,腐蚀更严重
D.M无论是铜还是锌都不能保护铁,是因没有构成原电池
5.(2020江苏苏北四市期末)两种金属接触时,接触部位会发生“电偶腐蚀”。金属铁和铜在自来水和海水中,相同时间发生的腐蚀情况如图。下列有关说法正确的是( )
甲
乙
A.甲图中的介质为海水
B.腐蚀过程中电能转化为化学能
C.铁电极反应式为Fe-3e- Fe3+
D.若在金属Fe的表面涂油漆,可以减慢铁的腐蚀
6.(2021北京丰台期中)金属腐蚀现象在生产、生活中普遍存在,依据下列2种腐蚀现象回答问题。
图1
图2
(1)图1中被腐蚀的金属为 ,其腐蚀类型为 (填字母)。图2中金属腐蚀类型为 (填字母)。
A.化学腐蚀 B.电化学腐蚀
C.析氢腐蚀 D.吸氧腐蚀
(2)图1中Cu的作用是 ,结合电极反应、电子移动、离子移动等,分析金属被腐蚀的原理: 。
(3)图2中铁的生锈过程为Fe→Fe(OH)2→Fe(OH)3→Fe2O3·nH2O,将Fe转变为Fe(OH)2的反应补充完整:正极反应为 ,负极反应为 ,总反应为 。
(4)下列防止铁制品生锈的措施合理的是 。
A.在铁闸门表面涂油漆
B.在地下铁管道上安装若干镁合金
C.将铁罐与浓硫酸等强氧化剂接触,使之钝化
题组三 金属腐蚀快慢的比较
7.(2021山东菏泽期中)下列有关金属腐蚀的说法错误的是( )
图a 图b
图c 图d
A.图a中,插入海水中的铁棒,越靠近海水与空气交接处腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减慢
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的负极
8.(2020浙江诸暨中学阶段性考试)为研究金属腐蚀的条件和速率,某课外兴趣活动小组学生用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,再保存相同的一段时间,下列对实验结束时现象的描述不正确的是( )
A.实验结束时,装置Ⅰ左侧的液面会下降
B.实验结束时,左侧液面装置Ⅰ比装置Ⅱ的低
C.实验结束时,装置Ⅱ中的铁钉腐蚀最严重
D.实验结束时,装置Ⅲ中的铁钉几乎没被腐蚀
9.如图,铁腐蚀速率由快到慢的顺序为(电解质溶液均为海水) 。
能力提升练
题组一 金属的腐蚀与防护
1.(2021山东章丘一中月考)下列关于如图所示的实验装置的判断中错误的是( )
A.若X为碳棒,开关K置于A处可减缓铁的腐蚀
B.若X为锌棒,开关K置于A、B处均可减缓铁的腐蚀
C.若X为锌棒,开关K置于B处时,为牺牲阳极的阴极保护法
D.若X为碳棒,开关K置于B处时,铁电极上发生的反应为2H++2e- H2↑
2.(2021安徽怀宁中学质量检测)在一定条件下,某含碳钢腐蚀情况与溶液pH的关系如表所示,下列说法正确的是( )
pH 2 4 6 6.5 8 13.5 14
腐蚀 快慢 较快 慢 较快
主要 产物 Fe2+ Fe3O4 Fe2O3 Fe
A.当pH<6.5时,碳钢主要发生化学腐蚀
B.当pH<4和pH>13.5时,碳钢主要发生析氢腐蚀
C.pH越大,碳钢的腐蚀速率越慢
D.pH=14时,负极反应为4OH-+Fe-3e- Fe+2H2O
3.(2021江苏如皋中学阶段性检测)下列说法正确的是( )
A.钢铁锈蚀时,Fe失去电子成为Fe3+
B.铅蓄电池(如图)在放电过程中,负极质量减小,正极质量增大
C.将海水中钢铁闸门与电源的负极相连,可防止闸门被腐蚀
D.铅蓄电池和碱性锌锰电池都属于二次电池
题组二 金属腐蚀与防护相关实验探究
4.(2021福建厦门第一中学月考)下列根据实验操作及现象进行的分析和推断中,不正确的是( )
操作
现象
一段时间后:①铁钉裸露在外的附近区域变红; ②……
A.NaCl的琼脂水溶液作为离子迁移的通路
B.①中变红是因为发生反应2H2O+2e- H2↑+2OH-
C.②中可观察到铁钉裸露在外的附近区域变蓝,铜丝附近区域变红
D.①和②中发生的氧化反应均可表示为M-2e- M2+(M代表锌或铁)
5.将两根铁钉分别缠绕铜丝和镁条,放入滴有混合溶液的容器中,如图所示,下列叙述不正确的是( )
A.a中铜丝附近有气泡产生
B.a中铁钉附近出现蓝色沉淀
C.b中铁钉附近呈现红色
D.b中发生吸氧腐蚀
6.(2021北京首都师范大学附属中学期中)某小组同学进行铁的电化学腐蚀原理的探究实验。
装置
分别进行 的操作 ⅰ.连好装置一段时间后,烧杯中滴加酚酞溶液 ⅱ.连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液
现象 铁片表面产生蓝色沉淀
(1)小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。
①实验ⅰ中的现象是 。
②用化学用语解释实验ⅰ中的现象: 。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ⅱ中现象不能证明铁发生了电化学腐蚀,理由是 。
②进行实验,在实验几分钟后记录实验现象,具体如下。
实验 装置
滴管 内试剂 0.5 mol·L-1 K3[Fe(CN)6] 溶液
试管 内试剂 ⅲ.蒸 馏水 ⅳ.1.0 mol· L-1 NaCl溶液 ⅴ.0.5 mol· L-1 Na2SO4 溶液
实验 现象 无明显 变化 铁片表面产 生大量蓝色 沉淀 无明显变化
a.以上实验表明:在 条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b.为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验ⅲ,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是 。
(3)有同学认为上述实验仍不严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验ⅱ结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是 (填字母)。
实验 试剂 现象
A 酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2) 产生蓝色沉淀
B 酸洗后的铁片、K3[Fe(CN)6]和NaCl混合溶液(未除O2) 产生蓝色沉淀
C 铁片、K3[Fe(CN)6]和NaCl混合溶液(已除O2) 产生蓝色沉淀
D 铁片、K3[Fe(CN)6]和盐酸混合溶液(已除O2) 产生蓝色沉淀
答案全解全析
基础过关练
1.A 题图表示吸氧腐蚀,其中铁作为负极,电极反应为2Fe-4e- 2Fe2+,铜作为正极,电极反应为O2+2H2O+4e- 4OH-,形成Fe(OH)2后,还发生反应4Fe(OH)2+O2+2H2O 4Fe(OH)3,A项错误。
2.C 脱氧过程为放热反应,A项错误;炭作为正极,氧气在正极上得电子发生还原反应,电极反应为2H2O+O2+4e- 4OH-,B项错误; 0.56 g铁粉的物质的量为0.01 mol,Fe~Fe2O3~O2,故理论上最多能吸收氧气×0.01 mol×22.4 L/mol=0.168 L=168 mL,C项正确;原电池将化学能转化为电能,D项错误。
3.C 保护轮船外壳的常用方法是船壳上镶一些活泼金属如锌块,锌块作为负极,与船体、电解质溶液(海水)构成原电池,船体作为原电池的正极,被保护,该方法利用的是牺牲阳极的阴极保护法,C项正确。
4.B 若M是铜片,铜片、铁片与海水构成原电池,铁是负极,铁被腐蚀,故A错误;若M是锌片,锌片、铁片与海水构成原电池,锌是负极,锌被腐蚀,铁被保护,故B正确、D错误;图1铁片靠近水面的部分,接触的氧气更多,腐蚀更严重,故C错误。
5.D 铁和铜接触时,遇到电解质溶液会形成原电池,且形成的原电池中铁作为负极,铜作为正极,电解质溶液为海水时的腐蚀速率大于自来水作电解质溶液时的腐蚀速率,因此甲图中的介质为自来水,乙图中的介质是海水,A项错误;腐蚀过程中化学能转化为电能,B项错误;形成的原电池中铁作为负极,失去电子,电极反应式为Fe-2e- Fe2+,C项错误;在金属Fe的表面涂油漆,可以减慢铁的腐蚀,D项正确。
6.答案 (1)铁(或Fe) BC BD
(2)作为正极材料,导电 铜作为正极,氢离子在内电路中移向正极,得到电子,生成氢气;铁作为负极,失去电子,电子通过外电路从负极移向正极,金属铁被腐蚀生成Fe2+
(3)O2+4e-+2H2O 4OH- 2Fe-4e- 2Fe2+ 2Fe+O2+2H2O 2Fe(OH)2
(4)ABC
解析 (1)图1中二氧化硫的水溶液作为电解质溶液,酸性较强,与铁、铜形成原电池,腐蚀类型为析氢腐蚀;图2中电解质溶液显碱性,所发生电化学腐蚀类型为吸氧腐蚀。(3)图2中发生吸氧腐蚀,正极反应为氧气得电子,反应式为O2+4e-+2H2O 4OH-,在负极铁失电子,电极反应式为2Fe-4e- 2Fe2+,总反应为2Fe+O2+2H2O 2Fe(OH)2。 (4)在铁表面涂油漆、在地下铁管道上安装若干镁合金,将铁罐与浓硫酸等强氧化剂接触使之钝化均可防止铁制品生锈。
7.C 图a中,铁棒中含有铁和碳,铁、碳和海水构成了原电池,铁作负极失电子而容易被腐蚀,海水中氧的含量较少,所以越靠近海水与空气交接处腐蚀越严重,A正确;图b中,开关由M改置于N时,合金作正极,锌作负极,所以合金的腐蚀速率减慢,B正确;图c中,接通开关时,Zn作负极,腐蚀速率增大,但氢离子在铂上放电生成氢气,C错误;图d中,Mg的活泼性比Fe强,构成原电池时,Mg作负极,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,D正确。
8.B 盐酸易挥发,装置Ⅰ中铁钉发生化学腐蚀,生成H2,使左侧液面下降,A项正确;装置Ⅱ中,铁钉与铜丝连接,由于Fe比Cu活泼,Fe、Cu与挥发的盐酸形成原电池,Fe作负极,发生析氢腐蚀,放出更多的H2,使左侧液面下降得更多,即左侧液面装置Ⅱ比装置Ⅰ低,B项错误;装置Ⅲ中浓硫酸是难挥发性酸,而且浓硫酸具有吸水性,干燥的空气中铁不易被腐蚀,所以装置Ⅲ中的铁钉几乎没有被腐蚀,D项正确;根据以上分析可知,装置Ⅱ中的铁钉腐蚀最严重,C项正确。
9.答案 ⑤>④>①>②>③>⑥
解析 ①②可发生化学腐蚀;③④都构成原电池,但③中铁为正极受到保护,④中铁为负极被氧化;⑤⑥都构成电解池,⑤中铁与电源的正极相连,作为阳极,氧化速率加快,⑥中铁与电源的负极相连,作为阴极,受到保护。综上分析,铁腐蚀速率的快慢顺序为⑤>④>①>②>③>⑥。
能力提升练
1.D 若X为碳棒,开关K置于A处,Fe作电解池的阴极,属外加电流的阴极保护法,可减缓铁的腐蚀,故A项正确;若X为锌棒,开关K置于A处,Fe作电解池的阴极,属外加电流的阴极保护法,开关K置于B处,Fe作原电池的正极,属牺牲阳极的阴极保护法,均可减缓铁的腐蚀,故B、C项正确;若X为碳棒,开关K置于B处,Fe作原电池的负极,电极反应为Fe-2e- Fe2+,故D项错误。
2.D 当pH<4时,碳钢主要发生析氢腐蚀,A不正确;当pH>13.5,碳钢主要发生吸氧腐蚀,B不正确;从表中信息可以得出,pH在6~8之间时,碳钢的腐蚀速率慢,但pH>13.5时,碳钢的腐蚀速率较快,C不正确;pH=14时,在负极,Fe失电子的产物与OH-反应生成Fe和水,电极反应式为4OH-+Fe-3e- Fe+2H2O,D正确。
3.C 钢铁锈蚀时,Fe失去电子生成Fe2+,A项错误;铅蓄电池在放电过程中,负极Pb失电子后与电解质溶液中的S结合生成PbSO4,质量增大,B项错误;将海水中钢铁闸门与电源的负极相连,此时钢铁闸门作为阴极,可阻止钢铁闸门中的铁失电子,从而防止闸门被腐蚀,C项正确;碱性锌锰电池属于一次电池,D项错误。
4.B 原电池的形成条件之一是形成闭合回路,①和②实验中,NaCl的琼脂水溶液的作用是形成闭合回路,即NaCl的琼脂水溶液作为离子迁移的通路,A项正确;中性或碱性条件下,Zn、Fe与电解质溶液形成原电池,Zn比Fe活泼,Zn作为负极,Fe作为正极,正极的电极反应为2H2O+O2+4e- 4OH-,B项错误;②中NaCl溶液、Cu、Fe形成原电池,Fe比Cu活泼,Fe作为负极,Cu作为正极,负极反应式为Fe-2e- Fe2+,正极反应式为2H2O+O2+4e- 4OH-,所以铁钉裸露在外的附近区域生成蓝色铁氰化亚铁沉淀,铜丝附近区域酚酞遇到碱变红,C项正确;①中Zn和②中Fe均生成+2价的阳离子(Zn2+或Fe2+),发生氧化反应,所以Zn、Fe发生的氧化反应可表示为M-2e- M2+(M代表Zn或Fe),D项正确。
5.C a中Cu作为正极,电解质溶液显酸性,正极的电极反应式为2H++2e- H2↑,所以a中铜丝附近有气泡产生,A项正确;a中Fe电极的电极反应式为Fe-2e- Fe2+,Fe2+和K3[Fe(CN)6]反应生成蓝色沉淀,所以a中铁钉附近出现蓝色沉淀,B项正确;b中Fe作为正极被保护,Fe不参加反应,没有铁离子生成,所以铁钉附近不呈现红色,C项错误;b中发生吸氧腐蚀,D项正确。
6.答案 (1)①碳棒附近溶液变红 ②O2+4e-+2H2O 4OH-
(2)①K3[Fe(CN)6]将Fe氧化为Fe2+,会干扰由于电化学腐蚀生成的Fe2+的检验 ②a.Cl-存在 b.破坏铁片表面的氧化膜
(3)AC
解析 (1)①实验ⅰ中,碳棒为正极,正极上发生O2得电子生成OH-的反应,碳棒附近溶液变红。②正极上氧气得电子与水反应生成氢氧根离子,电极反应式为O2+4e-+2H2O 4OH-。(2)①K3[Fe(CN)6]具有氧化性,能将Fe氧化为Fe2+,影响实验结果。②a.对比实验ⅳ和ⅴ,溶液中的Na+、S对铁的腐蚀无影响,Cl-使K3[Fe(CN)6]溶液易与Fe反应;b.用稀硫酸酸洗后,铁片表面的氧化膜被破坏,再进行实验ⅲ,铁片表面产生蓝色沉淀,则Cl-的作用与稀硫酸相同,也是破坏铁片表面的氧化膜。(3)已除O2的铁片不能发生吸氧腐蚀,只能发生铁片、K3[Fe(CN)6]溶液的反应,从而表明K3[Fe(CN)6]能与铁作用生成Fe2+,A符合题意;酸洗后的铁片、K3[Fe(CN)6]和NaCl混合溶液(未除O2),同时满足两个反应发生的条件,既可能是K3[Fe(CN)6]与铁作用生成Fe2+,也可能是铁片发生了吸氧腐蚀,B不符合题意;铁片、K3[Fe(CN)6]和NaCl混合溶液(已除O2),不能发生吸氧腐蚀,只能是Cl-破坏铁片表面的氧化膜,然后K3[Fe(CN)6]与铁作用生成Fe2+,C符合题意;铁片、K3[Fe(CN)6]和盐酸混合溶液(已除O2)反应产生蓝色沉淀,可能是铁片与盐酸直接反应生成Fe2+,也可能是K3[Fe(CN)6]与铁作用生成Fe2+,D不符合题意。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
