第三单元 物质构成的奥秘 2023-2024学年人教版九年级化学上册单元复习知识归纳+题型总结(含解析)
文档属性
| 名称 | 第三单元 物质构成的奥秘 2023-2024学年人教版九年级化学上册单元复习知识归纳+题型总结(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-07 17:37:40 | ||
图片预览




文档简介
第三单元 物质构成的奥秘
【题型归纳目录】
题型一:分子、原子和离子的认识
题型二:分子、原子有关的探究实验
题型三:粒子的结构示意图
题型四:元素
题型五:化学符号意义及用语
题型六:元素周期表
考点1:分子、原子和离子
1.构成物质的微粒有分子、原子、离子等。
2.分子(由原子构成)
(1)定义:保持由分子构成的物质的化学性质的最小微粒。
(2)性质:①体积、质量都很小;
② 总是在不断地运动,温度越高,分子运动速率越快,如花香四溢、酒精挥发等;
③ 分子间有间隔,一般情况下,气体物质分子间的间隔相对较大,固体和液体。如天然气加压后贮存在钢瓶中;
解释生活现象:气体体积容易压缩,固体和液体较难被压缩。
④ 同种分子化学性质相同,不同种分子化学性质不同。
(3)分子运动现象的实验探究
① 实验装置(如图)
② 实验现象:过一段时间,烧杯A中的溶液变红。
③ 解释:烧杯B中浓氨水有挥发性,氨分子运动到烧杯A中与水反应生成氨水,氨水显碱性,使酚酞溶液变红。
④ 实验结论:分子总在不断地做无规则运动。
3.原子定义:化学变化中的最小微粒,在化学变化中不可再分。
4.离子
(1)定义:带电的原子或原子团。
(2)阳离子:带正电的原子或原子团;核内质子数>核外电子数,如Ca2+、N等。
阴离子:带负电的原子或原子团;核内质子数<核外电子数,如C、Cl-等。
5.离子符号:在元素符号(或原子团)的右上角用“+”或“-”表示离子的正负电性,数值在前,正负号在后。数字为1时,可忽略不写。
意义:如3Mg2+,“3”表示3个镁离子,
“2”表示1个镁离子带2个单位正电荷。
6.分子与原子的区别和联系
分子 原子
基本性质 1.体积小、质量小;2.不断做无规则运动;3.微粒之间有间隔
定义 保持化学性质的最小粒子 化学变化中的最小粒子
本质区别 化学变化中分子可分,原子不可分
联系 分子可以分成原子,原子可以互相结合成分子
7.微观角度认识物质的组成和变化实质
以分子为例 宏观 微观
纯净物 一种物质组成 如:氧气 同种分子构成 氧气中只含有氧分子一种分子
混合物 两种或两种以上的物质组成 如:空气 不同种分子构成 空气中含有氧气分子、氮气分子、二氧化碳分子等
物理变化 没有新物质生成的变化 如:水的三态变化 分子本身不改变,只是分子间隔改变 水分子不改变,不同状态下的水转化只是水分子间隔的改变
化学变化 有新物质生成的变化 如:过氧化氢分解 分子破裂成原子,原子重新组合成新分子 过氧化氢分子破裂成氢原子和氧原子,氢原子和氧原子重新组合成水分子,氧原子重新组合成氧分子
考点2:原子的结构
1.原子的结构
原子
总结:① 原子内部不是实心体,很多是“空”的;
② 并不是所有的原子中都含有中子(如:氢原子中没有中子);
③ 原子不显电性:质子数=核电荷数=核外电子数;
④ 原子的质量主要集中在原子核上,原子的相对原子质量(取整数时)≈ 质子数+中子数;
⑤ 相对原子质量的单位为1,一般不写也不读。
2.原子结构示意图(以氧原子为例):小圈表示原子核,圈内的数字表示质子数,弧线表示电子层,弧线上的数字表示电子数,最外层电子数决定元素的化学性质。
考点3:元素与元素周期表
1.元素定义:具有相同核电荷数(即质子数)的一类原子的总称。
【特别提醒】(1)元素是宏观概念,只论种类,不讲个数;(2)核电荷数(即质子数)决定元素的种类;(3)日常生活中的“加碘盐”“高钙牛奶”等中的“碘”“钙”指的是元素。
2.地壳中含量较多的前四位元素分别是O、Si、Al、Fe。人体中含量最多的元素是O,人体中含量最多的金属元素是Ca。
3.元素的分类
金属元素 原子的最外层电子数<4,易失电子,化学性质活泼
非金属元素 原子的最外层电子数>4,易得电子,化学性质活泼;原子的最外层电子数若等于4,则不易得也不易失电子,化学性质较稳定
稀有气体元素 原子的最外层有8个电子(He有2个),结构稳定,性质稳定
4.元素符号
(1)书写:由一个字母表示的元素符号要大写,由两个字母表示的元素符号,第一个字母一定要大写,第二个字母要小写。
(2)意义:宏观上,可表示:①一种元素,如K表示钾元素;②由原子构成的物质:微观上,可表示该元素的一个原子,如O表示一个氧原子。
5.元素周期表
(1)按元素原子核电荷数递增的顺序,由小到大排列(即原子序数),每一横行叫一个周期,每一纵行叫一个 族(第8、9、10三纵行为一族)。
(2)元素周期表中的信息(如图:以氧元素为例)
(3)元素周期表的规律
① 原子序数=核电荷数=质子数=核外电子数。
② 同周期的原子电子层数相同,一般最外层电子数从左到右依次递增。
③ 同主族的原子最外层电子数相同,化学性质相似,一般电子数从上到下依次递增。
6.元素符号的意义
宏观:表示一种元素;表示某些由原子构成的物质。
(2)微观:表示该元素的一个原子。
例如:H:表示氢元素,一个氢原子;
Fe:表示铁元素,一个铁原子,铁这种物质。
(3)数字+元素符号,只表示微观意义:几个原子。
例如:5O:表示5个氧原子; 3Ne:3个氖原子。
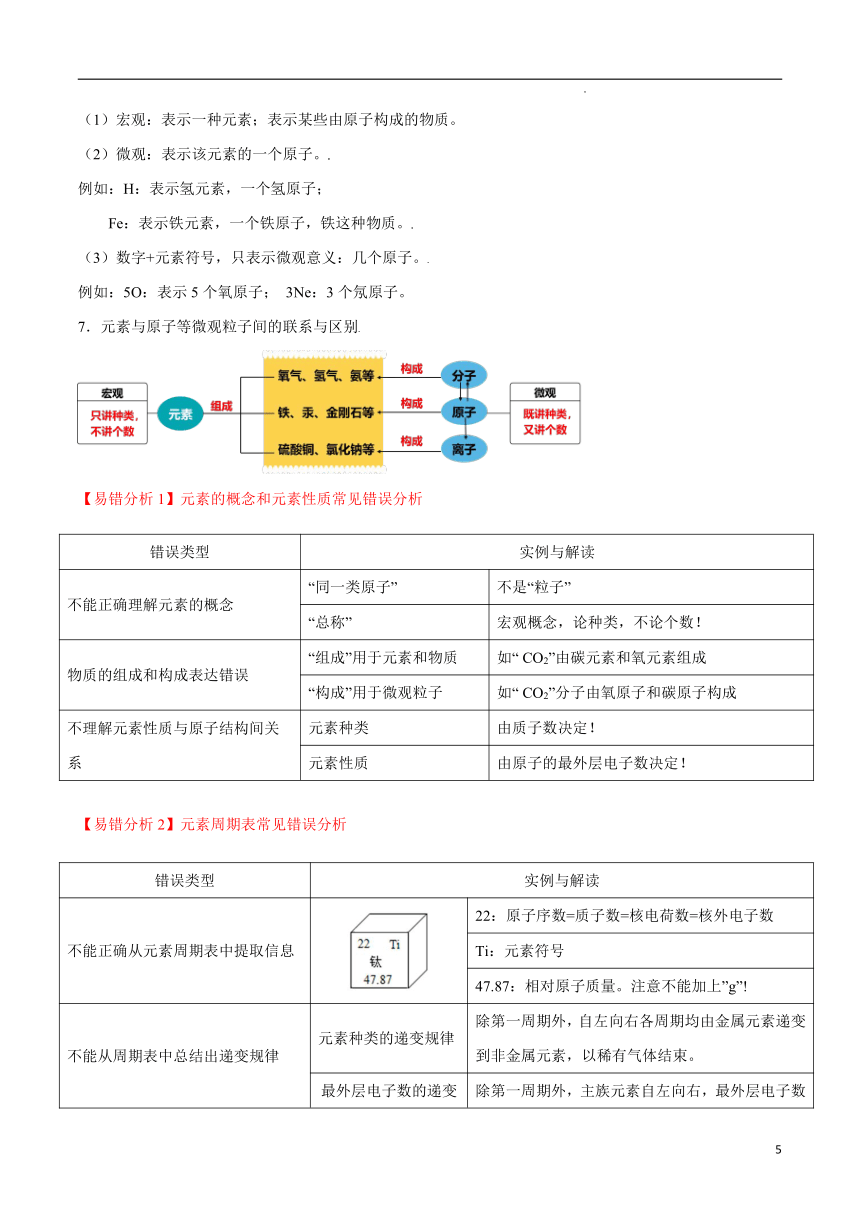
7.元素与原子等微观粒子间的联系与区别
【易错分析1】元素的概念和元素性质常见错误分析
错误类型 实例与解读
不能正确理解元素的概念 “同一类原子” 不是“粒子”
“总称” 宏观概念,论种类,不论个数!
物质的组成和构成表达错误 “组成”用于元素和物质 如“ CO2”由碳元素和氧元素组成
“构成”用于微观粒子 如“ CO2”分子由氧原子和碳原子构成
不理解元素性质与原子结构间关系 元素种类 由质子数决定!
元素性质 由原子的最外层电子数决定!
【易错分析2】元素周期表常见错误分析
错误类型 实例与解读
不能正确从元素周期表中提取信息 22:原子序数=质子数=核电荷数=核外电子数
Ti:元素符号
47.87:相对原子质量。注意不能加上”g”!
不能从周期表中总结出递变规律 元素种类的递变规律 除第一周期外,自左向右各周期均由金属元素递变到非金属元素,以稀有气体结束。
最外层电子数的递变规律 除第一周期外,主族元素自左向右,最外层电子数均由1递变到8.
化合价递变规律 主族元素最高正价由+1递变到+7(O、F除外),非金属元素最低负价由-4递变到-1。
不能区分氧化物和含氧化合物 氧化物 两种元素组成的化合物,其中一种元素为氧元素。
含氧化合物 含有氧元素的化合物
题型一:分子、原子和离子的认识
【例1】(物质的构成)下列物质是由分子构成的是( )
A.氢氧化钾 B.铝 C.金刚石 D.甲烷
【变式1-1】(微粒观点解释现象)六月的校园,百花盛开,香远益清,阵阵花香,沁人心脾。花香四溢的现象说明( )
A.分子的质量很小 B.分子在不停地运动
C.分子是由原子构成的 D.分子之间有一定的间隔
【变式1-2】(分子原子的认识)随着科技的进步,我们可通过扫描隧道显微镜获得苯分子的图像。观察下图,有关苯分子的表述错误的是( )
A.它在不断运动 B.它体积很小 C.分子间有间隔 D.它真实存在
【变式1-3】(原子结构)有①分子②原子③中子④电子⑤质子等粒子,其中:
(1)能直接构成物质的粒子是 ,
(2)构成分子的粒子是 ;
(3)构成原子核的粒子是 ,构成原子的粒子是原子核和 ;
(4)带正电荷的粒子是 ,带负电荷的粒子是 ,不显电性的粒子是 .
【变式1-4】(离子)下列物质由阴、阳离子构成的是 ( )
A.铜 B.二氧化碳 C.氯化钠 D.金刚石(碳)
【变式1-5】下列关于微观粒子的说法错误的是( )
A.离子之间存在着相互作用,分子间没有相互作用
B.分子、原子、离子都是构成物质的基本粒子
C.在化学反应中,原子核是不变的,发生改变的只是原子核外的电子
D.原子由居于原子中心、带正电荷的原子核和核外带负电荷的电子构成,原子不显电性
题型二:分子、原子有关的探究实验
【例2】如图所示,将中间的玻璃片抽走,使两瓶口密合在一起,观察到甲中两瓶气体的颜色很快趋于一致,而乙中需很长时间才能达到相同效果(已知氢气与黄绿色的氯气在该实验中不反应)。下列说法错误的是( )
A.保持氢气化学性质的最小粒子是氢分子
B.该实验说明分子在不停地运动
C.该实验说明此条件下氯气的密度比氢气大
D.该实验证明在化学变化中,分子可以再分,原子不可再分
【变式】小明学习了分子的性质后做了如下实验:
(1)教材实验(如图1所示):该实验可以观察到的实验现象是________;实验结论是________。
(2)改进实验:先在一支试管中装一半红墨水,再在液面上注满酒精(缓缓注入),加盖密封后静置,30日后再观察,现象如图2所示。小明做的实验还可以说明的分子性质是__________。
(3)如果继续完成图3实验操作,对比实验2可以得出的结论是_________。
题型三:粒子的结构示意图
【例3】2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子( )
A.含有2个质子 B.核电荷数为1
C.相对原子质量为4 D.质子数和中子数相等
【变式3-1】下图是某粒子的结构示意图,下列有关该粒子的叙述中,错误的是( )
A. 该粒子原子核内有17个质子 B. 该粒子呈电中性
C. 该粒子属于非金属元素 D. 该粒子易形成阳离子
【变式3-2】下列粒子结构示意图中,表示阴离子的是( )
A. B. C. D.
【变式3-3】下列关于Fe、Fe2+、Fe3+的说法中,正确的是( )
A. 它们的核外电子数不同 B. 它们的质子数和中子数都不同
C. 它们的质量完全相同 D. 它们的性质完全相同
【变式3-4】“”和“”分别表示不同元素的原子,其中表示单质的是( )
A. B.
C. D.
【变式3-5】根据以下几种粒子的结构示意图,回答下列问题:
(1)具有相对稳定结构的粒子是_______________________(填字母序号,下同)。
(2)具有相似化学性质的原子是_______________________。
(3)D粒子在化学反应中容易___________(填“失去”或“得到”)电子。
题型四:元素
【例4】C919客机部分机身采用了铝锂合金,铝元素与锂元素的本质区别是( )
A. 相对原子质量不同 B. 中子数不同
C. 最外层电子数不同 D. 质子数不同
【变式4-1】下列有关分子、原子、离子、元素的说法中,正确的是( )
A. 原子都是由质子、中子、核外电子构成的
B. 同种元素的原子核内质子数和中子数一定相等
C. 氯化钠由氯离子和钠离子构成
D. 保持水的化学性质的最小粒子是氢原子和氧原子
【变式4-2】元素符号书写正确的是( )
A. 氮 N B. 氮 Ne
C. 氖 N D. 氖NE
【变式4-3】地壳中的元素分布如图,其中区域②代表的元素是( )
A. 氧 B. 硅 C. 铝 D. 铁
【变式4-4】奶制品、豆类、虾皮等食物中含钙丰富,这里的“钙”是指( )
A.钙元素 B.钙原子 C.钙离子 D.钙单质
题型五:化学符号意义及用语
【例5】下列符号中既表示一种元素,又表示一种原子,还可表示一种物质的是( )
A. Cu B. N C. H D. O
【变式5-1】下列符号既能表示一种元素,又能表示一个原子的是( )
A.O2 B.Mg2+ C.H D.2N2
【变式5-2】下列符号中既表示一种元素,又表示一种原子,还可表示一种物质的是( )
A.O B.N C.H2 D.Cu
【变式5-3】用化学用语填空。
(1)氮原子________;
(2)镁元素________;
(3)钠离子________。
(4)7个硫原子________。
题型六:元素周期表
【例6】钛和钛合金被认为是21世纪的重要金属材料。下图是钛元素在元素周期表中的部分信息,下列说法正确的是( )
A.钛原子的电子数为22 B.钛为非金属元素
C.钛原子的中子数为22 D.钛原子的相对原子质量为47.87g
【变式6-1】用锶制成的原子钟精准度极高,常用于卫星的精准计时。下图是锶元素在元素周期表中的信息,下列说法中不正确的是( )
A. 锶的相对原子质量是87.62
B. 锶是金属元素
C. 锶原子在化学反应中易得到电子
D. 锶的元素符号为Sr
【变式6-2】我国著名科学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕
等近十种元素的相对原子质量,为相对原子质量测定作出了卓越贡献。关于钢元素在元素周期表中的部分
信息及原了结构示意图如图所示。下列说法正确的是( )
A.铟元素属于非金属元素 B.铟元素的相对原子质量是114.8g
C.铟原子的质子数为49 D.铟的原子结构示意图中X=18
【变式6-3】元素周期表是学习和研究化学的重要工具。如图是元素周期表的部分信息:
认真分析信息,回答下列问题:
(1)地壳中含量最多的元素的原子序数是 ;
(2)仔细分析上表规律,可以推知:表中的符号X= ;
(3)结构示意图为所表示的离子符号是 ;
(4)写出一个由8、14号两种元素组成的化合物的化学式 ;
(5)这个同期表的发现和制作者是 。
A.张青莲 B.汤姆生 C.门捷列夫 D.诺贝尔
【变式6-4】元素周期表是学习和研究化学的重要工具,它的内容十分丰富。下表是元素周期表的部分内容,请认真分析并回答后面的问题:
(1)请从上表中查出地壳中含量最多的金属元素的相对原子质量为 。
(2)表中不同种元素最本质的区别是 (填序号)。
A.相对原子质量不同 B.质子数不同 C.中子数不同
(3)元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律,如:
(填字母序号)。
A.从左到右,各元素原子的电子层数相同
B.从左到右,各元素原子的原子序数依次增加
C.从左到右,各元素原子的最外层电子数相同
(4)元素周期表中,原子序数为12的镁元素的原子结构示意图如图,该原子在化学反应中易 (填“得到”或“失去”)电子。说明元素的化学性质与原子的 关系密切。
【变式6-5】如图是几种元素的粒子结构示意图及元素周期表的一部分。
(1)2021年2月27日,嫦娥五号采集的月壤样品在中国国家博物馆正式展出。月壤中存在着大量的氦-3(氦-3是含有2个质子和1个中子的氦原子),其原子结构示意图为图甲中的________(填序号)。
(2)硒是人体必需微量元素,具有防癌、抗癌作用,其原子结构示意图如图甲中的E,该元素处于元素周期表中第________周期,它与图乙中________(填元素名称)的化学性质相似。
【变式6-6】下图1为元素周期表的一部分,图2为几种粒子结构示意图,据图回答问题:
(1)图1中氩的相对原子质量是__________,硫元素的原子序数为__________;
(2)X元素名称__________;
(3)图2中与硫元素化学性质相似的是__________(填字母序号,下同);
(4)图2所示粒子共表示__________种元素,其中具有相对稳定结构的原子是__________。
第三单元 物质构成的奥秘
【题型归纳目录】
题型一:分子、原子和离子的认识
题型二:分子、原子有关的探究实验
题型三:粒子的结构示意图
题型四:元素
题型五:化学符号意义及用语
题型六:元素周期表
考点1:分子、原子和离子
1.构成物质的微粒有分子、原子、离子等。
2.分子(由原子构成)
(1)定义:保持由分子构成的物质的化学性质的最小微粒。
(2)性质:①体积、质量都很小;
② 总是在不断地运动,温度越高,分子运动速率越快,如花香四溢、酒精挥发等;
③ 分子间有间隔,一般情况下,气体物质分子间的间隔相对较大,固体和液体。如天然气加压后贮存在钢瓶中;
解释生活现象:气体体积容易压缩,固体和液体较难被压缩。
④ 同种分子化学性质相同,不同种分子化学性质不同。
(3)分子运动现象的实验探究
① 实验装置(如图)
② 实验现象:过一段时间,烧杯A中的溶液变红。
③ 解释:烧杯B中浓氨水有挥发性,氨分子运动到烧杯A中与水反应生成氨水,氨水显碱性,使酚酞溶液变红。
④ 实验结论:分子总在不断地做无规则运动。
3.原子定义:化学变化中的最小微粒,在化学变化中不可再分。
4.离子
(1)定义:带电的原子或原子团。
(2)阳离子:带正电的原子或原子团;核内质子数>核外电子数,如Ca2+、N等。
阴离子:带负电的原子或原子团;核内质子数<核外电子数,如C、Cl-等。
5.离子符号:在元素符号(或原子团)的右上角用“+”或“-”表示离子的正负电性,数值在前,正负号在后。数字为1时,可忽略不写。
意义:如3Mg2+,“3”表示3个镁离子,
“2”表示1个镁离子带2个单位正电荷。
6.分子与原子的区别和联系
分子 原子
基本性质 1.体积小、质量小;2.不断做无规则运动;3.微粒之间有间隔
定义 保持化学性质的最小粒子 化学变化中的最小粒子
本质区别 化学变化中分子可分,原子不可分
联系 分子可以分成原子,原子可以互相结合成分子
7.微观角度认识物质的组成和变化实质
以分子为例 宏观 微观
纯净物 一种物质组成 如:氧气 同种分子构成 氧气中只含有氧分子一种分子
混合物 两种或两种以上的物质组成 如:空气 不同种分子构成 空气中含有氧气分子、氮气分子、二氧化碳分子等
物理变化 没有新物质生成的变化 如:水的三态变化 分子本身不改变,只是分子间隔改变 水分子不改变,不同状态下的水转化只是水分子间隔的改变
化学变化 有新物质生成的变化 如:过氧化氢分解 分子破裂成原子,原子重新组合成新分子 过氧化氢分子破裂成氢原子和氧原子,氢原子和氧原子重新组合成水分子,氧原子重新组合成氧分子
考点2:原子的结构
1.原子的结构
原子
总结:① 原子内部不是实心体,很多是“空”的;
② 并不是所有的原子中都含有中子(如:氢原子中没有中子);
③ 原子不显电性:质子数=核电荷数=核外电子数;
④ 原子的质量主要集中在原子核上,原子的相对原子质量(取整数时)≈ 质子数+中子数;
⑤ 相对原子质量的单位为1,一般不写也不读。
2.原子结构示意图(以氧原子为例):小圈表示原子核,圈内的数字表示质子数,弧线表示电子层,弧线上的数字表示电子数,最外层电子数决定元素的化学性质。
考点3:元素与元素周期表
1.元素定义:具有相同核电荷数(即质子数)的一类原子的总称。
【特别提醒】(1)元素是宏观概念,只论种类,不讲个数;(2)核电荷数(即质子数)决定元素的种类;(3)日常生活中的“加碘盐”“高钙牛奶”等中的“碘”“钙”指的是元素。
2.地壳中含量较多的前四位元素分别是O、Si、Al、Fe。人体中含量最多的元素是O,人体中含量最多的金属元素是Ca。
3.元素的分类
金属元素 原子的最外层电子数<4,易失电子,化学性质活泼
非金属元素 原子的最外层电子数>4,易得电子,化学性质活泼;原子的最外层电子数若等于4,则不易得也不易失电子,化学性质较稳定
稀有气体元素 原子的最外层有8个电子(He有2个),结构稳定,性质稳定
4.元素符号
(1)书写:由一个字母表示的元素符号要大写,由两个字母表示的元素符号,第一个字母一定要大写,第二个字母要小写。
(2)意义:宏观上,可表示:①一种元素,如K表示钾元素;②由原子构成的物质:微观上,可表示该元素的一个原子,如O表示一个氧原子。
5.元素周期表
(1)按元素原子核电荷数递增的顺序,由小到大排列(即原子序数),每一横行叫一个周期,每一纵行叫一个 族(第8、9、10三纵行为一族)。
(2)元素周期表中的信息(如图:以氧元素为例)
(3)元素周期表的规律
① 原子序数=核电荷数=质子数=核外电子数。
② 同周期的原子电子层数相同,一般最外层电子数从左到右依次递增。
③ 同主族的原子最外层电子数相同,化学性质相似,一般电子数从上到下依次递增。
6.元素符号的意义
宏观:表示一种元素;表示某些由原子构成的物质。
(2)微观:表示该元素的一个原子。
例如:H:表示氢元素,一个氢原子;
Fe:表示铁元素,一个铁原子,铁这种物质。
(3)数字+元素符号,只表示微观意义:几个原子。
例如:5O:表示5个氧原子; 3Ne:3个氖原子。
7.元素与原子等微观粒子间的联系与区别
【易错分析1】元素的概念和元素性质常见错误分析
错误类型 实例与解读
不能正确理解元素的概念 “同一类原子” 不是“粒子”
“总称” 宏观概念,论种类,不论个数!
物质的组成和构成表达错误 “组成”用于元素和物质 如“ CO2”由碳元素和氧元素组成
“构成”用于微观粒子 如“ CO2”分子由氧原子和碳原子构成
不理解元素性质与原子结构间关系 元素种类 由质子数决定!
元素性质 由原子的最外层电子数决定!
【易错分析2】元素周期表常见错误分析
错误类型 实例与解读
不能正确从元素周期表中提取信息 22:原子序数=质子数=核电荷数=核外电子数
Ti:元素符号
47.87:相对原子质量。注意不能加上”g”!
不能从周期表中总结出递变规律 元素种类的递变规律 除第一周期外,自左向右各周期均由金属元素递变到非金属元素,以稀有气体结束。
最外层电子数的递变规律 除第一周期外,主族元素自左向右,最外层电子数均由1递变到8.
化合价递变规律 主族元素最高正价由+1递变到+7(O、F除外),非金属元素最低负价由-4递变到-1。
不能区分氧化物和含氧化合物 氧化物 两种元素组成的化合物,其中一种元素为氧元素。
含氧化合物 含有氧元素的化合物
题型一:分子、原子和离子的认识
【例1】(物质的构成)下列物质是由分子构成的是( )
A.氢氧化钾 B.铝 C.金刚石 D.甲烷
【答案】D
【解析】分子、原子或离子都可以构成物质,大多数固态非金属单质、金属和稀有气体是由原子直接构成的,气态的非金属单质和由非金属元素组成的化合物是由分子构成的,一般含有金属元素和非金属元素的化合物是由离子构成的。
A、氢氧化钾是由钾离子和氢氧根离子构成的,不符合题意;
B、铝是由铝原子构成的,不符合题意;
C、金刚石由碳原子构成的,不符合题意;
D、甲烷由甲烷分子构成的,符合题意;
故选D。
【变式1-1】(微粒观点解释现象)六月的校园,百花盛开,香远益清,阵阵花香,沁人心脾。花香四溢的现象说明( )
A.分子的质量很小 B.分子在不停地运动
C.分子是由原子构成的 D.分子之间有一定的间隔
【答案】B
【解析】
A、花香四溢不能说明分子质量很小,此说法错误。
B、花香四溢的现象说明分子在不断运动,花的香味分子运动到空气中,进入人们的鼻孔,使人感觉到了香味,说明分子的不断运动。此项正确。
C、花香四溢是香味分子的一种性质,不能说明分子是由原子构成的,此说法错误。
D、能嗅到花香是分子运动的结果,和分子间的间隔没有太大关系,此说法错误。
故选:B。
【变式1-2】(分子原子的认识)随着科技的进步,我们可通过扫描隧道显微镜获得苯分子的图像。观察下图,有关苯分子的表述错误的是( )
A.它在不断运动 B.它体积很小 C.分子间有间隔 D.它真实存在
【答案】A
【解析】通过扫描隧道显微镜获得苯分子的图像,苯分子肉眼不可见,通过扫描隧道显微镜才能发现,说明它的体积很小,通过图像可以看出,分子之间存在间隔,能通过扫描隧道显微镜获得苯分子的图像,说明它真实存在,不能说明它在不断运动。
故选A。
【变式1-3】(原子结构)有①分子②原子③中子④电子⑤质子等粒子,其中:
(1)能直接构成物质的粒子是 ,
(2)构成分子的粒子是 ;
(3)构成原子核的粒子是 ,构成原子的粒子是原子核和 ;
(4)带正电荷的粒子是 ,带负电荷的粒子是 ,不显电性的粒子是 .
【解答】解:(1)分子、原子、离子都是构成物质的基本微粒,可知可以直接构成物质的粒子是分子、原
子和离子,故填:①②;
(2)分子是由原子构成的,故填:②;
(3)构成原子核的粒子是质子和中子;构成原子的粒子是原子核和核外电子;故填:③⑤;④;
(4)已知质子带正电,电子带负电,分子、原子、中子不显电性的粒子.故填:⑤;④;①②③.
【变式1-4】(离子)下列物质由阴、阳离子构成的是 ( )
A.铜 B.二氧化碳 C.氯化钠 D.金刚石(碳)
【答案】C
【解析】阴、阳离子构成的物质应是离子化合物,铜是由铜原子构成的;二氧化碳是由二氧化碳分子构成的;氯化钠是由钠离子和氯离子构成的; 金刚石(碳) 是由碳原子构成的。
故选C。
【变式1-5】下列关于微观粒子的说法错误的是( )
A.离子之间存在着相互作用,分子间没有相互作用
B.分子、原子、离子都是构成物质的基本粒子
C.在化学反应中,原子核是不变的,发生改变的只是原子核外的电子
D.原子由居于原子中心、带正电荷的原子核和核外带负电荷的电子构成,原子不显电性
【答案】 A
【解析】A、离子之间存在着相互作用,分子间也有相互作用,符合题意;
B、分子、原子、离子都是构成物质的基本粒子,不符合题意;
C、在化学反应中,分子可分,原子不能再分,原子核是不变的,发生改变的只是原子核外的电子,不符合题意;
D、原子由居于原子中心、带正电荷的原子核和核外带负电荷的电子构成,原子不显电性,不符合题意。
故答案为:A。
题型二:分子、原子有关的探究实验
【例2】如图所示,将中间的玻璃片抽走,使两瓶口密合在一起,观察到甲中两瓶气体的颜色很快趋于一致,而乙中需很长时间才能达到相同效果(已知氢气与黄绿色的氯气在该实验中不反应)。下列说法错误的是( )
A.保持氢气化学性质的最小粒子是氢分子
B.该实验说明分子在不停地运动
C.该实验说明此条件下氯气的密度比氢气大
D.该实验证明在化学变化中,分子可以再分,原子不可再分
【答案】D
【解析】A、氢气由氢分子构成,故保持氢气化学性质的最小粒子是氢分子,不符合题意;
B、将中间的玻璃片抽走,使两瓶口密合在一起,一段时间后,两瓶中的气体颜色很快趋于一致,故该实验说明分子在不停地运动,不符合题意;
C、将中间的玻璃片抽走,使两瓶口密合在一起,观察到甲中两瓶气体的颜色很快趋于一致,而乙中需很长时间才能达到相同效果,说明此条件下氯气的密度比氢气大,不符合题意;
D、该实验是物理变化,无法证明在化学变化中,分子可以再分,原子不可再分,符合题意。
故选D。
【变式】小明学习了分子的性质后做了如下实验:
(1)教材实验(如图1所示):该实验可以观察到的实验现象是________;实验结论是________。
(2)改进实验:先在一支试管中装一半红墨水,再在液面上注满酒精(缓缓注入),加盖密封后静置,30日后再观察,现象如图2所示。小明做的实验还可以说明的分子性质是__________。
(3)如果继续完成图3实验操作,对比实验2可以得出的结论是_________。
【答案】(1) B烧杯中溶液变红,A烧杯中溶液不变红 分子在不断运动
(2)分子之间有间隔 (3)温度越高,分子运动越剧烈
【解析】(1)浓氨水具有挥发性,挥发出的氨气在不断运动,溶解到B烧杯中能形成氨水,氨水能使酚酞溶液变红,则实验现象是B烧杯溶液变红,A烧杯中溶液不变红,实验结论是分子在不断运动。
(2)图2中溶液混合后体积变小,说明分子之间有间隔。
(3)图2和图3相比,温度变大,则溶液混匀更快,说明温度越高,分子运动越剧烈。
题型三:粒子的结构示意图
【例3】2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子( )
A.含有2个质子 B.核电荷数为1
C.相对原子质量为4 D.质子数和中子数相等
【答案】B
【解析】
A、根据图示可知,氚原子含有1个质子,故错误;
B、核电荷数=质子数,据图可知氚原子含有1个质子,因此核电荷数为1,故正确;
C、相对原子质量≈质子数+中子数,据图可知氚原子含有1个质子、2个中子,因此相对原子质量=3,故错误;
D、据图可知氚原子含有1个质子、2个中子,因此质子数和中子数不相等,故错误;
故选:B。
【变式3-1】下图是某粒子的结构示意图,下列有关该粒子的叙述中,错误的是( )
A. 该粒子原子核内有17个质子 B. 该粒子呈电中性
C. 该粒子属于非金属元素 D. 该粒子易形成阳离子
【答案】 D
【解析】A. 该粒子圆圈里的数子不是原子的质子数,所以原子核内有17个质子,故正确,不符合题意;
B. 该粒子质子数=核外电子数,粒子呈电中性,故正确,不符合题意;
C. 该粒子质子数是17 ,为氯元素,属于非金属元素,故正确,不符合题意;
D. 该粒子最外层电子数大于4,容易得到电子,易形成阴离子,故错误,符合题意;
故答案为:D。
【变式3-2】下列粒子结构示意图中,表示阴离子的是( )
A. B. C. D.
【答案】 A
【解析】A. 质子数=9>核外电子数=10,为阴离子,故符合题意;
B. 质子数=10,核外电子数=10,质子数=核外电子数,为原子,故不符合题意;
C. 质子数=11,核外电子数=10,质子数>核外电子数,为阳离子,故不符合题意;
D. 质子数=13>核外电子数=10,质子数>核外电子数,为阳离子,故不符合题意;
故答案为:A。
【变式3-3】下列关于Fe、Fe2+、Fe3+的说法中,正确的是( )
A. 它们的核外电子数不同 B. 它们的质子数和中子数都不同
C. 它们的质量完全相同 D. 它们的性质完全相同
【答案】 A
【解析】A. 铁原子失去2个电子形成亚铁离子,失去3个电子形成铁离子,则它们的核外电子数不同,故符合题意;
B. 铁原子失去2个电子形成亚铁离子,失去3个电子形成铁离子,核内质子数和中子数不变,它们的质子数和中子数都相同,故不符合题意;
C. 铁原子失去2个电子形成亚铁离子,失去3个电子形成铁离子,尽管电子的质量很小,但它们的质量不相同,故不符合题意;
D. 铁原子失去2个电子形成亚铁离子,失去3个电子形成铁离子,它们的最外层电子数不同,它们的性质不完全相同,故不符合题意。
故答案为:A。
【变式3-4】“”和“”分别表示不同元素的原子,其中表示单质的是( )
A. B.
C. D.
【答案】D
【解析】
【分析】物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成,纯净物是由一种物质组成。纯净物又分为单质和化合物。由同种元素组成的纯净物叫单质;由两种或两种以上的元素组成的纯净物叫化合物。
A、图A中只有一种分子,是不同种元素组成的纯净物,属于化合物,不符合题意;
B、图B中有两种单质分子和一种化合物分子,属于混合物,不符合题意;
C、图C中有两种化合物分子,属于混合物,不符合题意;
D、图D中只有一种分子,是由同种元素组成的纯净物,属于单质,符合题意。
故选D。
【变式3-5】根据以下几种粒子的结构示意图,回答下列问题:
(1)具有相对稳定结构的粒子是_______________________(填字母序号,下同)。
(2)具有相似化学性质的原子是_______________________。
(3)D粒子在化学反应中容易___________(填“失去”或“得到”)电子。
【答案】(1)A和B (2)C和E (3)失去
【解析】(1)只有一层,最外层是2个电子,含有多个电子层,最外层有8个电子称为相对稳定结构,由粒子的结构示意图可知,具有相对稳定结构的粒子是A和B,故填:A和B;
(2)元素的化学性质与其原子的核外电子排布,特别是最外层电子的数目有关,由粒子的结构示意图可知,具有相似化学性质的原子是C和E,因为它们原子的最外层电子数相同,故填:C和E;
(3)D粒子的最外层电子数为2,小于4,在化学反应中容易失去电子,故填:失去。
题型四:元素
【例4】C919客机部分机身采用了铝锂合金,铝元素与锂元素的本质区别是( )
A. 相对原子质量不同 B. 中子数不同
C. 最外层电子数不同 D. 质子数不同
【答案】 D
【解析】具有相同质子数的一类原子总称为元素,铝元素与锂元素的本质区别是质子数不同,
故答案为:D。
【变式4-1】下列有关分子、原子、离子、元素的说法中,正确的是( )
A. 原子都是由质子、中子、核外电子构成的
B. 同种元素的原子核内质子数和中子数一定相等
C. 氯化钠由氯离子和钠离子构成
D. 保持水的化学性质的最小粒子是氢原子和氧原子
【答案】 C
【解析】A.氢原子的原子核中没有中子,故不符合题意;
B.同种元素的原子核内质子数和中子数不一定相等,如氢原子核中有1个质子,没有中子,故不符合题意;
C.氯化钠由氯离子和钠离子构成,故符合题意;
D.水由水分子构成,保持水化学性质的最小粒子是水分子,故不符合题意。
故答案为:C。
【变式4-2】元素符号书写正确的是( )
A. 氮 N B. 氮 Ne
C. 氖 N D. 氖NE
【答案】 A
【解析】A、如果元素符号中只有一个字母,该字母大写,如果元素符号中有两个字母,第一个字母大写,第二个字母小写,氮的元素符号为N,此选项符合题意;
B、氮的元素符号为N,此选项不符合题意;
C、氖的元素符号为Ne,此选项不符合题意;
D、氖的元素符号为Ne,此选项不符合题意。
故答案为:A。
【变式4-3】地壳中的元素分布如图,其中区域②代表的元素是( )
A. 氧 B. 硅 C. 铝 D. 铁
【答案】 B
【解析】地壳中元素由多到少顺序为氧、硅、铝、铁,所以区域② 代表硅元素;
故答案为:B。
【变式4-4】奶制品、豆类、虾皮等食物中含钙丰富,这里的“钙”是指( )
A.钙元素 B.钙原子 C.钙离子 D.钙单质
【答案】 A
【解析】食品、药品、营养品、矿泉水等物质中的“钙、镁、钾、钠”等不是以单质、分子、原子等形式存在,而是指元素,通常用元素及其所占质量(质量分数)来描述;故奶、奶制品、豆类、虾皮等食物中含钙丰富,是日常饮食中钙的较好来源.这里的钙是指钙元素,与具体形态无关;
故答案为:A。
题型五:化学符号意义及用语
【例5】下列符号中既表示一种元素,又表示一种原子,还可表示一种物质的是( )
A. Cu B. N C. H D. O
【答案】 A
【解析】A. Cu 可表示铜元素、一个铜原子和铜这种物质,符合题意;
B.N不能表示氮气这种物质,不符合题意;
C.H不能表示物质,不符合题意;
D.O不能表示物质,不符合题意;
故答案为:A
【变式5-1】下列符号既能表示一种元素,又能表示一个原子的是( )
A.O2 B.Mg2+ C.H D.2N2
【答案】C。
【解析】
A.这是氧气的化学式,不能表示氧元素,也不能表示一个氧原子,故错误;
B.这是镁离子的符号,不能表示镁元素,也不能表示一个镁原子,故错误;
C.这是氢元素的元素符号,可以表示氢元素,还可以表示1个氢原子,故正确;
D.这个化学符号只能表示2个氮分子,不能表示一种元素,也不能表示一个原子,故错误。
故选:C。
【变式5-2】下列符号中既表示一种元素,又表示一种原子,还可表示一种物质的是( )
A.O B.N C.H2 D.Cu
【答案】D
【解析】解:A、O,表示氧元素和一个氧原子,故选项错误;
B、N,表示氮元素和一个氮原子,故选项错误;
C、H2,不能表示一种元素和一个原子,故选项错误;
D、Cu,表示铜元素,又表示一个铜原子,还可表示铜这种物质,故选项正确;
【变式5-3】用化学用语填空。
(1)氮原子________;
(2)镁元素________;
(3)钠离子________。
(4)7个硫原子________。
【答案】 (1)N(2)Mg(3)Na+(4)7S
【解析】(1)由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,氮原子可表示为N,故填:N;
(2)根据元素符号的书写方法,第一个字母要大写,第二个字母要小写,镁元素符号为:Mg,故填:Mg;
(3)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字,故钠离子可表示为Na+ , 故填:Na+;
(4)由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故7个硫原子可表示为7S,故填:7S。
题型六:元素周期表
【例6】钛和钛合金被认为是21世纪的重要金属材料。下图是钛元素在元素周期表中的部分信息,下列说法正确的是( )
A.钛原子的电子数为22 B.钛为非金属元素
C.钛原子的中子数为22 D.钛原子的相对原子质量为47.87g
【答案】A
【解析】
A、根据图示信息可知,钛原子内质子数、原子序数、核电荷数、电子数均为22,符合题意;
B、根据图示信息可知钛元素名称偏旁为金字旁,故属于金属元素,不符合题意;
C、根据图示信息可知钛原子中子数为48-22=26,不符合题意;
D、相对原子质量单位为“1”,通常省略不写,而不是“g”,不符合题意。
故选A。
【变式6-1】用锶制成的原子钟精准度极高,常用于卫星的精准计时。下图是锶元素在元素周期表中的信息,下列说法中不正确的是( )
A. 锶的相对原子质量是87.62
B. 锶是金属元素
C. 锶原子在化学反应中易得到电子
D. 锶的元素符号为Sr
【答案】C
【解析】
A、由元素周期表中的一格可知,汉子下方的数字表示相对原子质量,即锶的相对原子质量是87.62,故A正确,不符合题意;
B、锶是金属元素,故B正确,不符合题意;
C、锶原子是金属元素的原子,在化学反应中易失去电子,故C错误,不符合题意;
D、由元素周期表中的一格可知,右上角的表示元素符号,故锶的元素符号为Sr,故D正确,不符合题意;
故选C。
【变式6-2】我国著名科学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕
等近十种元素的相对原子质量,为相对原子质量测定作出了卓越贡献。关于钢元素在元素周期表中的部分
信息及原了结构示意图如图所示。下列说法正确的是( )
A.铟元素属于非金属元素 B.铟元素的相对原子质量是114.8g
C.铟原子的质子数为49 D.铟的原子结构示意图中X=18
【答案】C
【解析】
A、铟元素的元素名称为“钅”字旁,属于金属元素,选项错误,不符合题意;
B、元素周期表中的一格可知:汉字下面的数字表示相对原子质量。铟元素的相对原子质量是114.8,选项错误,不符合题意;
C、根据原子结构示意图可知铟原子的原子核内有49个质子,选项正确,符合题意;
D、铟的原子结构示意图中X是第二层的电子,根据原子核外电子排列规律:第一层最多排2个电子,第二层最多排8个电子可知x=8,选项错误,不符合题意。
故选C。
【变式6-3】元素周期表是学习和研究化学的重要工具。如图是元素周期表的部分信息:
认真分析信息,回答下列问题:
(1)地壳中含量最多的元素的原子序数是 ;
(2)仔细分析上表规律,可以推知:表中的符号X= ;
(3)结构示意图为所表示的离子符号是 ;
(4)写出一个由8、14号两种元素组成的化合物的化学式 ;
(5)这个同期表的发现和制作者是 。
A.张青莲 B.汤姆生 C.门捷列夫 D.诺贝尔
【答案】
(1)8;
(2)17;
(3)Ca2+;
(4)SiO2;
(5)C。
【解析】(1)地壳中含量最多的元素是氧元素,其原子序数是8,故填:8;
(2)表中的符号X等于17,故填:17;
(3)结构示意图为所表示的离子是钙离子,其符号是Ca2+,故填:Ca2+;
(4)由8、14号两种元素组成的化合物是二氧化硅,其化学式为 SiO2,故填:SiO2;
(5)元素同期表的发现和制作者是门捷列夫,故填:C。
【变式6-4】元素周期表是学习和研究化学的重要工具,它的内容十分丰富。下表是元素周期表的部分内容,请认真分析并回答后面的问题:
(1)请从上表中查出地壳中含量最多的金属元素的相对原子质量为 。
(2)表中不同种元素最本质的区别是 (填序号)。
A.相对原子质量不同 B.质子数不同 C.中子数不同
(3)元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律,如:
(填字母序号)。
A.从左到右,各元素原子的电子层数相同
B.从左到右,各元素原子的原子序数依次增加
C.从左到右,各元素原子的最外层电子数相同
(4)元素周期表中,原子序数为12的镁元素的原子结构示意图如图,该原子在化学反应中易 (填“得到”或“失去”)电子。说明元素的化学性质与原子的 关系密切。
【答案】(1)26.98; (2)B; (3)AB; (4)失去; 最外层电子数。
【解析】(1)先弄清地壳中含量最多的金属元素为铝元素;再根据元素周期表的内容,查知其相对原子质量为26.98;
(2)根据元素的概念,可知表中不同种元素最本质的区别是质子数不同;
(3)元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律:A.从左到右,各元素原子的电子层数相同;B.从左到右,各元素原子的原子序数依次增加;
(4)元素周期表中,原子序数为12的镁元素的原子结构示意图如上图,该原子在化学反应中易失去电子,说明元素的化学性质与原子的最外层电子数关系密切。
故答案为:(1)26.98; (2)B; (3)AB; (4)失去; 最外层电子数。
【变式6-5】如图是几种元素的粒子结构示意图及元素周期表的一部分。
(1)2021年2月27日,嫦娥五号采集的月壤样品在中国国家博物馆正式展出。月壤中存在着大量的氦-3(氦-3是含有2个质子和1个中子的氦原子),其原子结构示意图为图甲中的________(填序号)。
(2)硒是人体必需微量元素,具有防癌、抗癌作用,其原子结构示意图如图甲中的E,该元素处于元素周期表中第________周期,它与图乙中________(填元素名称)的化学性质相似。
【答案】 (1)A(2)四;氧
【解析】(1)氦-3是含有2个质子和1个中子的氦原子,在原子中,质子数=核外电子数=2,故其原子结构示意图为图甲中的A;
(2)由原子结构示意图可知,其原子核外有4个电子层,位于第四周期;
硒与氧的最外层电子数相同,都是6,化学性质相似,故填:氧。
【变式6-6】下图1为元素周期表的一部分,图2为几种粒子结构示意图,据图回答问题:
(1)图1中氩的相对原子质量是__________,硫元素的原子序数为__________;
(2)X元素名称__________;
(3)图2中与硫元素化学性质相似的是__________(填字母序号,下同);
(4)图2所示粒子共表示__________种元素,其中具有相对稳定结构的原子是__________。
【答案】(1) 39.95 16 (2)氯元素 (3)A (4) 三 D
【解析】(1)以氩的单元格为例:18—表示原子序数,Ar—表示元素符号,氩—表示元素名称,39.95—表示相对原子质量;所以氩的相对原子质量是39.95;由硫的单元格可知硫元素的原子序数为16;
(2)由元素周期表可知:X为第17号元素,是氯元素;
(3)最外层电子数相同的原子,化学性质相似,硫元素的最外层电子数为6,所以与硫元素化学性质相似的是A;
(4)元素种类由质子数决定,所以共有三种元素;当原子只有一个电子层时,最外层电子数为2是稳定结构,当第二层或第三层为最外层时,最外层电子数为8是稳定结构,具有相对稳定结构的原子是D。
(北京)股份有限公司
【题型归纳目录】
题型一:分子、原子和离子的认识
题型二:分子、原子有关的探究实验
题型三:粒子的结构示意图
题型四:元素
题型五:化学符号意义及用语
题型六:元素周期表
考点1:分子、原子和离子
1.构成物质的微粒有分子、原子、离子等。
2.分子(由原子构成)
(1)定义:保持由分子构成的物质的化学性质的最小微粒。
(2)性质:①体积、质量都很小;
② 总是在不断地运动,温度越高,分子运动速率越快,如花香四溢、酒精挥发等;
③ 分子间有间隔,一般情况下,气体物质分子间的间隔相对较大,固体和液体。如天然气加压后贮存在钢瓶中;
解释生活现象:气体体积容易压缩,固体和液体较难被压缩。
④ 同种分子化学性质相同,不同种分子化学性质不同。
(3)分子运动现象的实验探究
① 实验装置(如图)
② 实验现象:过一段时间,烧杯A中的溶液变红。
③ 解释:烧杯B中浓氨水有挥发性,氨分子运动到烧杯A中与水反应生成氨水,氨水显碱性,使酚酞溶液变红。
④ 实验结论:分子总在不断地做无规则运动。
3.原子定义:化学变化中的最小微粒,在化学变化中不可再分。
4.离子
(1)定义:带电的原子或原子团。
(2)阳离子:带正电的原子或原子团;核内质子数>核外电子数,如Ca2+、N等。
阴离子:带负电的原子或原子团;核内质子数<核外电子数,如C、Cl-等。
5.离子符号:在元素符号(或原子团)的右上角用“+”或“-”表示离子的正负电性,数值在前,正负号在后。数字为1时,可忽略不写。
意义:如3Mg2+,“3”表示3个镁离子,
“2”表示1个镁离子带2个单位正电荷。
6.分子与原子的区别和联系
分子 原子
基本性质 1.体积小、质量小;2.不断做无规则运动;3.微粒之间有间隔
定义 保持化学性质的最小粒子 化学变化中的最小粒子
本质区别 化学变化中分子可分,原子不可分
联系 分子可以分成原子,原子可以互相结合成分子
7.微观角度认识物质的组成和变化实质
以分子为例 宏观 微观
纯净物 一种物质组成 如:氧气 同种分子构成 氧气中只含有氧分子一种分子
混合物 两种或两种以上的物质组成 如:空气 不同种分子构成 空气中含有氧气分子、氮气分子、二氧化碳分子等
物理变化 没有新物质生成的变化 如:水的三态变化 分子本身不改变,只是分子间隔改变 水分子不改变,不同状态下的水转化只是水分子间隔的改变
化学变化 有新物质生成的变化 如:过氧化氢分解 分子破裂成原子,原子重新组合成新分子 过氧化氢分子破裂成氢原子和氧原子,氢原子和氧原子重新组合成水分子,氧原子重新组合成氧分子
考点2:原子的结构
1.原子的结构
原子
总结:① 原子内部不是实心体,很多是“空”的;
② 并不是所有的原子中都含有中子(如:氢原子中没有中子);
③ 原子不显电性:质子数=核电荷数=核外电子数;
④ 原子的质量主要集中在原子核上,原子的相对原子质量(取整数时)≈ 质子数+中子数;
⑤ 相对原子质量的单位为1,一般不写也不读。
2.原子结构示意图(以氧原子为例):小圈表示原子核,圈内的数字表示质子数,弧线表示电子层,弧线上的数字表示电子数,最外层电子数决定元素的化学性质。
考点3:元素与元素周期表
1.元素定义:具有相同核电荷数(即质子数)的一类原子的总称。
【特别提醒】(1)元素是宏观概念,只论种类,不讲个数;(2)核电荷数(即质子数)决定元素的种类;(3)日常生活中的“加碘盐”“高钙牛奶”等中的“碘”“钙”指的是元素。
2.地壳中含量较多的前四位元素分别是O、Si、Al、Fe。人体中含量最多的元素是O,人体中含量最多的金属元素是Ca。
3.元素的分类
金属元素 原子的最外层电子数<4,易失电子,化学性质活泼
非金属元素 原子的最外层电子数>4,易得电子,化学性质活泼;原子的最外层电子数若等于4,则不易得也不易失电子,化学性质较稳定
稀有气体元素 原子的最外层有8个电子(He有2个),结构稳定,性质稳定
4.元素符号
(1)书写:由一个字母表示的元素符号要大写,由两个字母表示的元素符号,第一个字母一定要大写,第二个字母要小写。
(2)意义:宏观上,可表示:①一种元素,如K表示钾元素;②由原子构成的物质:微观上,可表示该元素的一个原子,如O表示一个氧原子。
5.元素周期表
(1)按元素原子核电荷数递增的顺序,由小到大排列(即原子序数),每一横行叫一个周期,每一纵行叫一个 族(第8、9、10三纵行为一族)。
(2)元素周期表中的信息(如图:以氧元素为例)
(3)元素周期表的规律
① 原子序数=核电荷数=质子数=核外电子数。
② 同周期的原子电子层数相同,一般最外层电子数从左到右依次递增。
③ 同主族的原子最外层电子数相同,化学性质相似,一般电子数从上到下依次递增。
6.元素符号的意义
宏观:表示一种元素;表示某些由原子构成的物质。
(2)微观:表示该元素的一个原子。
例如:H:表示氢元素,一个氢原子;
Fe:表示铁元素,一个铁原子,铁这种物质。
(3)数字+元素符号,只表示微观意义:几个原子。
例如:5O:表示5个氧原子; 3Ne:3个氖原子。
7.元素与原子等微观粒子间的联系与区别
【易错分析1】元素的概念和元素性质常见错误分析
错误类型 实例与解读
不能正确理解元素的概念 “同一类原子” 不是“粒子”
“总称” 宏观概念,论种类,不论个数!
物质的组成和构成表达错误 “组成”用于元素和物质 如“ CO2”由碳元素和氧元素组成
“构成”用于微观粒子 如“ CO2”分子由氧原子和碳原子构成
不理解元素性质与原子结构间关系 元素种类 由质子数决定!
元素性质 由原子的最外层电子数决定!
【易错分析2】元素周期表常见错误分析
错误类型 实例与解读
不能正确从元素周期表中提取信息 22:原子序数=质子数=核电荷数=核外电子数
Ti:元素符号
47.87:相对原子质量。注意不能加上”g”!
不能从周期表中总结出递变规律 元素种类的递变规律 除第一周期外,自左向右各周期均由金属元素递变到非金属元素,以稀有气体结束。
最外层电子数的递变规律 除第一周期外,主族元素自左向右,最外层电子数均由1递变到8.
化合价递变规律 主族元素最高正价由+1递变到+7(O、F除外),非金属元素最低负价由-4递变到-1。
不能区分氧化物和含氧化合物 氧化物 两种元素组成的化合物,其中一种元素为氧元素。
含氧化合物 含有氧元素的化合物
题型一:分子、原子和离子的认识
【例1】(物质的构成)下列物质是由分子构成的是( )
A.氢氧化钾 B.铝 C.金刚石 D.甲烷
【变式1-1】(微粒观点解释现象)六月的校园,百花盛开,香远益清,阵阵花香,沁人心脾。花香四溢的现象说明( )
A.分子的质量很小 B.分子在不停地运动
C.分子是由原子构成的 D.分子之间有一定的间隔
【变式1-2】(分子原子的认识)随着科技的进步,我们可通过扫描隧道显微镜获得苯分子的图像。观察下图,有关苯分子的表述错误的是( )
A.它在不断运动 B.它体积很小 C.分子间有间隔 D.它真实存在
【变式1-3】(原子结构)有①分子②原子③中子④电子⑤质子等粒子,其中:
(1)能直接构成物质的粒子是 ,
(2)构成分子的粒子是 ;
(3)构成原子核的粒子是 ,构成原子的粒子是原子核和 ;
(4)带正电荷的粒子是 ,带负电荷的粒子是 ,不显电性的粒子是 .
【变式1-4】(离子)下列物质由阴、阳离子构成的是 ( )
A.铜 B.二氧化碳 C.氯化钠 D.金刚石(碳)
【变式1-5】下列关于微观粒子的说法错误的是( )
A.离子之间存在着相互作用,分子间没有相互作用
B.分子、原子、离子都是构成物质的基本粒子
C.在化学反应中,原子核是不变的,发生改变的只是原子核外的电子
D.原子由居于原子中心、带正电荷的原子核和核外带负电荷的电子构成,原子不显电性
题型二:分子、原子有关的探究实验
【例2】如图所示,将中间的玻璃片抽走,使两瓶口密合在一起,观察到甲中两瓶气体的颜色很快趋于一致,而乙中需很长时间才能达到相同效果(已知氢气与黄绿色的氯气在该实验中不反应)。下列说法错误的是( )
A.保持氢气化学性质的最小粒子是氢分子
B.该实验说明分子在不停地运动
C.该实验说明此条件下氯气的密度比氢气大
D.该实验证明在化学变化中,分子可以再分,原子不可再分
【变式】小明学习了分子的性质后做了如下实验:
(1)教材实验(如图1所示):该实验可以观察到的实验现象是________;实验结论是________。
(2)改进实验:先在一支试管中装一半红墨水,再在液面上注满酒精(缓缓注入),加盖密封后静置,30日后再观察,现象如图2所示。小明做的实验还可以说明的分子性质是__________。
(3)如果继续完成图3实验操作,对比实验2可以得出的结论是_________。
题型三:粒子的结构示意图
【例3】2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子( )
A.含有2个质子 B.核电荷数为1
C.相对原子质量为4 D.质子数和中子数相等
【变式3-1】下图是某粒子的结构示意图,下列有关该粒子的叙述中,错误的是( )
A. 该粒子原子核内有17个质子 B. 该粒子呈电中性
C. 该粒子属于非金属元素 D. 该粒子易形成阳离子
【变式3-2】下列粒子结构示意图中,表示阴离子的是( )
A. B. C. D.
【变式3-3】下列关于Fe、Fe2+、Fe3+的说法中,正确的是( )
A. 它们的核外电子数不同 B. 它们的质子数和中子数都不同
C. 它们的质量完全相同 D. 它们的性质完全相同
【变式3-4】“”和“”分别表示不同元素的原子,其中表示单质的是( )
A. B.
C. D.
【变式3-5】根据以下几种粒子的结构示意图,回答下列问题:
(1)具有相对稳定结构的粒子是_______________________(填字母序号,下同)。
(2)具有相似化学性质的原子是_______________________。
(3)D粒子在化学反应中容易___________(填“失去”或“得到”)电子。
题型四:元素
【例4】C919客机部分机身采用了铝锂合金,铝元素与锂元素的本质区别是( )
A. 相对原子质量不同 B. 中子数不同
C. 最外层电子数不同 D. 质子数不同
【变式4-1】下列有关分子、原子、离子、元素的说法中,正确的是( )
A. 原子都是由质子、中子、核外电子构成的
B. 同种元素的原子核内质子数和中子数一定相等
C. 氯化钠由氯离子和钠离子构成
D. 保持水的化学性质的最小粒子是氢原子和氧原子
【变式4-2】元素符号书写正确的是( )
A. 氮 N B. 氮 Ne
C. 氖 N D. 氖NE
【变式4-3】地壳中的元素分布如图,其中区域②代表的元素是( )
A. 氧 B. 硅 C. 铝 D. 铁
【变式4-4】奶制品、豆类、虾皮等食物中含钙丰富,这里的“钙”是指( )
A.钙元素 B.钙原子 C.钙离子 D.钙单质
题型五:化学符号意义及用语
【例5】下列符号中既表示一种元素,又表示一种原子,还可表示一种物质的是( )
A. Cu B. N C. H D. O
【变式5-1】下列符号既能表示一种元素,又能表示一个原子的是( )
A.O2 B.Mg2+ C.H D.2N2
【变式5-2】下列符号中既表示一种元素,又表示一种原子,还可表示一种物质的是( )
A.O B.N C.H2 D.Cu
【变式5-3】用化学用语填空。
(1)氮原子________;
(2)镁元素________;
(3)钠离子________。
(4)7个硫原子________。
题型六:元素周期表
【例6】钛和钛合金被认为是21世纪的重要金属材料。下图是钛元素在元素周期表中的部分信息,下列说法正确的是( )
A.钛原子的电子数为22 B.钛为非金属元素
C.钛原子的中子数为22 D.钛原子的相对原子质量为47.87g
【变式6-1】用锶制成的原子钟精准度极高,常用于卫星的精准计时。下图是锶元素在元素周期表中的信息,下列说法中不正确的是( )
A. 锶的相对原子质量是87.62
B. 锶是金属元素
C. 锶原子在化学反应中易得到电子
D. 锶的元素符号为Sr
【变式6-2】我国著名科学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕
等近十种元素的相对原子质量,为相对原子质量测定作出了卓越贡献。关于钢元素在元素周期表中的部分
信息及原了结构示意图如图所示。下列说法正确的是( )
A.铟元素属于非金属元素 B.铟元素的相对原子质量是114.8g
C.铟原子的质子数为49 D.铟的原子结构示意图中X=18
【变式6-3】元素周期表是学习和研究化学的重要工具。如图是元素周期表的部分信息:
认真分析信息,回答下列问题:
(1)地壳中含量最多的元素的原子序数是 ;
(2)仔细分析上表规律,可以推知:表中的符号X= ;
(3)结构示意图为所表示的离子符号是 ;
(4)写出一个由8、14号两种元素组成的化合物的化学式 ;
(5)这个同期表的发现和制作者是 。
A.张青莲 B.汤姆生 C.门捷列夫 D.诺贝尔
【变式6-4】元素周期表是学习和研究化学的重要工具,它的内容十分丰富。下表是元素周期表的部分内容,请认真分析并回答后面的问题:
(1)请从上表中查出地壳中含量最多的金属元素的相对原子质量为 。
(2)表中不同种元素最本质的区别是 (填序号)。
A.相对原子质量不同 B.质子数不同 C.中子数不同
(3)元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律,如:
(填字母序号)。
A.从左到右,各元素原子的电子层数相同
B.从左到右,各元素原子的原子序数依次增加
C.从左到右,各元素原子的最外层电子数相同
(4)元素周期表中,原子序数为12的镁元素的原子结构示意图如图,该原子在化学反应中易 (填“得到”或“失去”)电子。说明元素的化学性质与原子的 关系密切。
【变式6-5】如图是几种元素的粒子结构示意图及元素周期表的一部分。
(1)2021年2月27日,嫦娥五号采集的月壤样品在中国国家博物馆正式展出。月壤中存在着大量的氦-3(氦-3是含有2个质子和1个中子的氦原子),其原子结构示意图为图甲中的________(填序号)。
(2)硒是人体必需微量元素,具有防癌、抗癌作用,其原子结构示意图如图甲中的E,该元素处于元素周期表中第________周期,它与图乙中________(填元素名称)的化学性质相似。
【变式6-6】下图1为元素周期表的一部分,图2为几种粒子结构示意图,据图回答问题:
(1)图1中氩的相对原子质量是__________,硫元素的原子序数为__________;
(2)X元素名称__________;
(3)图2中与硫元素化学性质相似的是__________(填字母序号,下同);
(4)图2所示粒子共表示__________种元素,其中具有相对稳定结构的原子是__________。
第三单元 物质构成的奥秘
【题型归纳目录】
题型一:分子、原子和离子的认识
题型二:分子、原子有关的探究实验
题型三:粒子的结构示意图
题型四:元素
题型五:化学符号意义及用语
题型六:元素周期表
考点1:分子、原子和离子
1.构成物质的微粒有分子、原子、离子等。
2.分子(由原子构成)
(1)定义:保持由分子构成的物质的化学性质的最小微粒。
(2)性质:①体积、质量都很小;
② 总是在不断地运动,温度越高,分子运动速率越快,如花香四溢、酒精挥发等;
③ 分子间有间隔,一般情况下,气体物质分子间的间隔相对较大,固体和液体。如天然气加压后贮存在钢瓶中;
解释生活现象:气体体积容易压缩,固体和液体较难被压缩。
④ 同种分子化学性质相同,不同种分子化学性质不同。
(3)分子运动现象的实验探究
① 实验装置(如图)
② 实验现象:过一段时间,烧杯A中的溶液变红。
③ 解释:烧杯B中浓氨水有挥发性,氨分子运动到烧杯A中与水反应生成氨水,氨水显碱性,使酚酞溶液变红。
④ 实验结论:分子总在不断地做无规则运动。
3.原子定义:化学变化中的最小微粒,在化学变化中不可再分。
4.离子
(1)定义:带电的原子或原子团。
(2)阳离子:带正电的原子或原子团;核内质子数>核外电子数,如Ca2+、N等。
阴离子:带负电的原子或原子团;核内质子数<核外电子数,如C、Cl-等。
5.离子符号:在元素符号(或原子团)的右上角用“+”或“-”表示离子的正负电性,数值在前,正负号在后。数字为1时,可忽略不写。
意义:如3Mg2+,“3”表示3个镁离子,
“2”表示1个镁离子带2个单位正电荷。
6.分子与原子的区别和联系
分子 原子
基本性质 1.体积小、质量小;2.不断做无规则运动;3.微粒之间有间隔
定义 保持化学性质的最小粒子 化学变化中的最小粒子
本质区别 化学变化中分子可分,原子不可分
联系 分子可以分成原子,原子可以互相结合成分子
7.微观角度认识物质的组成和变化实质
以分子为例 宏观 微观
纯净物 一种物质组成 如:氧气 同种分子构成 氧气中只含有氧分子一种分子
混合物 两种或两种以上的物质组成 如:空气 不同种分子构成 空气中含有氧气分子、氮气分子、二氧化碳分子等
物理变化 没有新物质生成的变化 如:水的三态变化 分子本身不改变,只是分子间隔改变 水分子不改变,不同状态下的水转化只是水分子间隔的改变
化学变化 有新物质生成的变化 如:过氧化氢分解 分子破裂成原子,原子重新组合成新分子 过氧化氢分子破裂成氢原子和氧原子,氢原子和氧原子重新组合成水分子,氧原子重新组合成氧分子
考点2:原子的结构
1.原子的结构
原子
总结:① 原子内部不是实心体,很多是“空”的;
② 并不是所有的原子中都含有中子(如:氢原子中没有中子);
③ 原子不显电性:质子数=核电荷数=核外电子数;
④ 原子的质量主要集中在原子核上,原子的相对原子质量(取整数时)≈ 质子数+中子数;
⑤ 相对原子质量的单位为1,一般不写也不读。
2.原子结构示意图(以氧原子为例):小圈表示原子核,圈内的数字表示质子数,弧线表示电子层,弧线上的数字表示电子数,最外层电子数决定元素的化学性质。
考点3:元素与元素周期表
1.元素定义:具有相同核电荷数(即质子数)的一类原子的总称。
【特别提醒】(1)元素是宏观概念,只论种类,不讲个数;(2)核电荷数(即质子数)决定元素的种类;(3)日常生活中的“加碘盐”“高钙牛奶”等中的“碘”“钙”指的是元素。
2.地壳中含量较多的前四位元素分别是O、Si、Al、Fe。人体中含量最多的元素是O,人体中含量最多的金属元素是Ca。
3.元素的分类
金属元素 原子的最外层电子数<4,易失电子,化学性质活泼
非金属元素 原子的最外层电子数>4,易得电子,化学性质活泼;原子的最外层电子数若等于4,则不易得也不易失电子,化学性质较稳定
稀有气体元素 原子的最外层有8个电子(He有2个),结构稳定,性质稳定
4.元素符号
(1)书写:由一个字母表示的元素符号要大写,由两个字母表示的元素符号,第一个字母一定要大写,第二个字母要小写。
(2)意义:宏观上,可表示:①一种元素,如K表示钾元素;②由原子构成的物质:微观上,可表示该元素的一个原子,如O表示一个氧原子。
5.元素周期表
(1)按元素原子核电荷数递增的顺序,由小到大排列(即原子序数),每一横行叫一个周期,每一纵行叫一个 族(第8、9、10三纵行为一族)。
(2)元素周期表中的信息(如图:以氧元素为例)
(3)元素周期表的规律
① 原子序数=核电荷数=质子数=核外电子数。
② 同周期的原子电子层数相同,一般最外层电子数从左到右依次递增。
③ 同主族的原子最外层电子数相同,化学性质相似,一般电子数从上到下依次递增。
6.元素符号的意义
宏观:表示一种元素;表示某些由原子构成的物质。
(2)微观:表示该元素的一个原子。
例如:H:表示氢元素,一个氢原子;
Fe:表示铁元素,一个铁原子,铁这种物质。
(3)数字+元素符号,只表示微观意义:几个原子。
例如:5O:表示5个氧原子; 3Ne:3个氖原子。
7.元素与原子等微观粒子间的联系与区别
【易错分析1】元素的概念和元素性质常见错误分析
错误类型 实例与解读
不能正确理解元素的概念 “同一类原子” 不是“粒子”
“总称” 宏观概念,论种类,不论个数!
物质的组成和构成表达错误 “组成”用于元素和物质 如“ CO2”由碳元素和氧元素组成
“构成”用于微观粒子 如“ CO2”分子由氧原子和碳原子构成
不理解元素性质与原子结构间关系 元素种类 由质子数决定!
元素性质 由原子的最外层电子数决定!
【易错分析2】元素周期表常见错误分析
错误类型 实例与解读
不能正确从元素周期表中提取信息 22:原子序数=质子数=核电荷数=核外电子数
Ti:元素符号
47.87:相对原子质量。注意不能加上”g”!
不能从周期表中总结出递变规律 元素种类的递变规律 除第一周期外,自左向右各周期均由金属元素递变到非金属元素,以稀有气体结束。
最外层电子数的递变规律 除第一周期外,主族元素自左向右,最外层电子数均由1递变到8.
化合价递变规律 主族元素最高正价由+1递变到+7(O、F除外),非金属元素最低负价由-4递变到-1。
不能区分氧化物和含氧化合物 氧化物 两种元素组成的化合物,其中一种元素为氧元素。
含氧化合物 含有氧元素的化合物
题型一:分子、原子和离子的认识
【例1】(物质的构成)下列物质是由分子构成的是( )
A.氢氧化钾 B.铝 C.金刚石 D.甲烷
【答案】D
【解析】分子、原子或离子都可以构成物质,大多数固态非金属单质、金属和稀有气体是由原子直接构成的,气态的非金属单质和由非金属元素组成的化合物是由分子构成的,一般含有金属元素和非金属元素的化合物是由离子构成的。
A、氢氧化钾是由钾离子和氢氧根离子构成的,不符合题意;
B、铝是由铝原子构成的,不符合题意;
C、金刚石由碳原子构成的,不符合题意;
D、甲烷由甲烷分子构成的,符合题意;
故选D。
【变式1-1】(微粒观点解释现象)六月的校园,百花盛开,香远益清,阵阵花香,沁人心脾。花香四溢的现象说明( )
A.分子的质量很小 B.分子在不停地运动
C.分子是由原子构成的 D.分子之间有一定的间隔
【答案】B
【解析】
A、花香四溢不能说明分子质量很小,此说法错误。
B、花香四溢的现象说明分子在不断运动,花的香味分子运动到空气中,进入人们的鼻孔,使人感觉到了香味,说明分子的不断运动。此项正确。
C、花香四溢是香味分子的一种性质,不能说明分子是由原子构成的,此说法错误。
D、能嗅到花香是分子运动的结果,和分子间的间隔没有太大关系,此说法错误。
故选:B。
【变式1-2】(分子原子的认识)随着科技的进步,我们可通过扫描隧道显微镜获得苯分子的图像。观察下图,有关苯分子的表述错误的是( )
A.它在不断运动 B.它体积很小 C.分子间有间隔 D.它真实存在
【答案】A
【解析】通过扫描隧道显微镜获得苯分子的图像,苯分子肉眼不可见,通过扫描隧道显微镜才能发现,说明它的体积很小,通过图像可以看出,分子之间存在间隔,能通过扫描隧道显微镜获得苯分子的图像,说明它真实存在,不能说明它在不断运动。
故选A。
【变式1-3】(原子结构)有①分子②原子③中子④电子⑤质子等粒子,其中:
(1)能直接构成物质的粒子是 ,
(2)构成分子的粒子是 ;
(3)构成原子核的粒子是 ,构成原子的粒子是原子核和 ;
(4)带正电荷的粒子是 ,带负电荷的粒子是 ,不显电性的粒子是 .
【解答】解:(1)分子、原子、离子都是构成物质的基本微粒,可知可以直接构成物质的粒子是分子、原
子和离子,故填:①②;
(2)分子是由原子构成的,故填:②;
(3)构成原子核的粒子是质子和中子;构成原子的粒子是原子核和核外电子;故填:③⑤;④;
(4)已知质子带正电,电子带负电,分子、原子、中子不显电性的粒子.故填:⑤;④;①②③.
【变式1-4】(离子)下列物质由阴、阳离子构成的是 ( )
A.铜 B.二氧化碳 C.氯化钠 D.金刚石(碳)
【答案】C
【解析】阴、阳离子构成的物质应是离子化合物,铜是由铜原子构成的;二氧化碳是由二氧化碳分子构成的;氯化钠是由钠离子和氯离子构成的; 金刚石(碳) 是由碳原子构成的。
故选C。
【变式1-5】下列关于微观粒子的说法错误的是( )
A.离子之间存在着相互作用,分子间没有相互作用
B.分子、原子、离子都是构成物质的基本粒子
C.在化学反应中,原子核是不变的,发生改变的只是原子核外的电子
D.原子由居于原子中心、带正电荷的原子核和核外带负电荷的电子构成,原子不显电性
【答案】 A
【解析】A、离子之间存在着相互作用,分子间也有相互作用,符合题意;
B、分子、原子、离子都是构成物质的基本粒子,不符合题意;
C、在化学反应中,分子可分,原子不能再分,原子核是不变的,发生改变的只是原子核外的电子,不符合题意;
D、原子由居于原子中心、带正电荷的原子核和核外带负电荷的电子构成,原子不显电性,不符合题意。
故答案为:A。
题型二:分子、原子有关的探究实验
【例2】如图所示,将中间的玻璃片抽走,使两瓶口密合在一起,观察到甲中两瓶气体的颜色很快趋于一致,而乙中需很长时间才能达到相同效果(已知氢气与黄绿色的氯气在该实验中不反应)。下列说法错误的是( )
A.保持氢气化学性质的最小粒子是氢分子
B.该实验说明分子在不停地运动
C.该实验说明此条件下氯气的密度比氢气大
D.该实验证明在化学变化中,分子可以再分,原子不可再分
【答案】D
【解析】A、氢气由氢分子构成,故保持氢气化学性质的最小粒子是氢分子,不符合题意;
B、将中间的玻璃片抽走,使两瓶口密合在一起,一段时间后,两瓶中的气体颜色很快趋于一致,故该实验说明分子在不停地运动,不符合题意;
C、将中间的玻璃片抽走,使两瓶口密合在一起,观察到甲中两瓶气体的颜色很快趋于一致,而乙中需很长时间才能达到相同效果,说明此条件下氯气的密度比氢气大,不符合题意;
D、该实验是物理变化,无法证明在化学变化中,分子可以再分,原子不可再分,符合题意。
故选D。
【变式】小明学习了分子的性质后做了如下实验:
(1)教材实验(如图1所示):该实验可以观察到的实验现象是________;实验结论是________。
(2)改进实验:先在一支试管中装一半红墨水,再在液面上注满酒精(缓缓注入),加盖密封后静置,30日后再观察,现象如图2所示。小明做的实验还可以说明的分子性质是__________。
(3)如果继续完成图3实验操作,对比实验2可以得出的结论是_________。
【答案】(1) B烧杯中溶液变红,A烧杯中溶液不变红 分子在不断运动
(2)分子之间有间隔 (3)温度越高,分子运动越剧烈
【解析】(1)浓氨水具有挥发性,挥发出的氨气在不断运动,溶解到B烧杯中能形成氨水,氨水能使酚酞溶液变红,则实验现象是B烧杯溶液变红,A烧杯中溶液不变红,实验结论是分子在不断运动。
(2)图2中溶液混合后体积变小,说明分子之间有间隔。
(3)图2和图3相比,温度变大,则溶液混匀更快,说明温度越高,分子运动越剧烈。
题型三:粒子的结构示意图
【例3】2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子( )
A.含有2个质子 B.核电荷数为1
C.相对原子质量为4 D.质子数和中子数相等
【答案】B
【解析】
A、根据图示可知,氚原子含有1个质子,故错误;
B、核电荷数=质子数,据图可知氚原子含有1个质子,因此核电荷数为1,故正确;
C、相对原子质量≈质子数+中子数,据图可知氚原子含有1个质子、2个中子,因此相对原子质量=3,故错误;
D、据图可知氚原子含有1个质子、2个中子,因此质子数和中子数不相等,故错误;
故选:B。
【变式3-1】下图是某粒子的结构示意图,下列有关该粒子的叙述中,错误的是( )
A. 该粒子原子核内有17个质子 B. 该粒子呈电中性
C. 该粒子属于非金属元素 D. 该粒子易形成阳离子
【答案】 D
【解析】A. 该粒子圆圈里的数子不是原子的质子数,所以原子核内有17个质子,故正确,不符合题意;
B. 该粒子质子数=核外电子数,粒子呈电中性,故正确,不符合题意;
C. 该粒子质子数是17 ,为氯元素,属于非金属元素,故正确,不符合题意;
D. 该粒子最外层电子数大于4,容易得到电子,易形成阴离子,故错误,符合题意;
故答案为:D。
【变式3-2】下列粒子结构示意图中,表示阴离子的是( )
A. B. C. D.
【答案】 A
【解析】A. 质子数=9>核外电子数=10,为阴离子,故符合题意;
B. 质子数=10,核外电子数=10,质子数=核外电子数,为原子,故不符合题意;
C. 质子数=11,核外电子数=10,质子数>核外电子数,为阳离子,故不符合题意;
D. 质子数=13>核外电子数=10,质子数>核外电子数,为阳离子,故不符合题意;
故答案为:A。
【变式3-3】下列关于Fe、Fe2+、Fe3+的说法中,正确的是( )
A. 它们的核外电子数不同 B. 它们的质子数和中子数都不同
C. 它们的质量完全相同 D. 它们的性质完全相同
【答案】 A
【解析】A. 铁原子失去2个电子形成亚铁离子,失去3个电子形成铁离子,则它们的核外电子数不同,故符合题意;
B. 铁原子失去2个电子形成亚铁离子,失去3个电子形成铁离子,核内质子数和中子数不变,它们的质子数和中子数都相同,故不符合题意;
C. 铁原子失去2个电子形成亚铁离子,失去3个电子形成铁离子,尽管电子的质量很小,但它们的质量不相同,故不符合题意;
D. 铁原子失去2个电子形成亚铁离子,失去3个电子形成铁离子,它们的最外层电子数不同,它们的性质不完全相同,故不符合题意。
故答案为:A。
【变式3-4】“”和“”分别表示不同元素的原子,其中表示单质的是( )
A. B.
C. D.
【答案】D
【解析】
【分析】物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成,纯净物是由一种物质组成。纯净物又分为单质和化合物。由同种元素组成的纯净物叫单质;由两种或两种以上的元素组成的纯净物叫化合物。
A、图A中只有一种分子,是不同种元素组成的纯净物,属于化合物,不符合题意;
B、图B中有两种单质分子和一种化合物分子,属于混合物,不符合题意;
C、图C中有两种化合物分子,属于混合物,不符合题意;
D、图D中只有一种分子,是由同种元素组成的纯净物,属于单质,符合题意。
故选D。
【变式3-5】根据以下几种粒子的结构示意图,回答下列问题:
(1)具有相对稳定结构的粒子是_______________________(填字母序号,下同)。
(2)具有相似化学性质的原子是_______________________。
(3)D粒子在化学反应中容易___________(填“失去”或“得到”)电子。
【答案】(1)A和B (2)C和E (3)失去
【解析】(1)只有一层,最外层是2个电子,含有多个电子层,最外层有8个电子称为相对稳定结构,由粒子的结构示意图可知,具有相对稳定结构的粒子是A和B,故填:A和B;
(2)元素的化学性质与其原子的核外电子排布,特别是最外层电子的数目有关,由粒子的结构示意图可知,具有相似化学性质的原子是C和E,因为它们原子的最外层电子数相同,故填:C和E;
(3)D粒子的最外层电子数为2,小于4,在化学反应中容易失去电子,故填:失去。
题型四:元素
【例4】C919客机部分机身采用了铝锂合金,铝元素与锂元素的本质区别是( )
A. 相对原子质量不同 B. 中子数不同
C. 最外层电子数不同 D. 质子数不同
【答案】 D
【解析】具有相同质子数的一类原子总称为元素,铝元素与锂元素的本质区别是质子数不同,
故答案为:D。
【变式4-1】下列有关分子、原子、离子、元素的说法中,正确的是( )
A. 原子都是由质子、中子、核外电子构成的
B. 同种元素的原子核内质子数和中子数一定相等
C. 氯化钠由氯离子和钠离子构成
D. 保持水的化学性质的最小粒子是氢原子和氧原子
【答案】 C
【解析】A.氢原子的原子核中没有中子,故不符合题意;
B.同种元素的原子核内质子数和中子数不一定相等,如氢原子核中有1个质子,没有中子,故不符合题意;
C.氯化钠由氯离子和钠离子构成,故符合题意;
D.水由水分子构成,保持水化学性质的最小粒子是水分子,故不符合题意。
故答案为:C。
【变式4-2】元素符号书写正确的是( )
A. 氮 N B. 氮 Ne
C. 氖 N D. 氖NE
【答案】 A
【解析】A、如果元素符号中只有一个字母,该字母大写,如果元素符号中有两个字母,第一个字母大写,第二个字母小写,氮的元素符号为N,此选项符合题意;
B、氮的元素符号为N,此选项不符合题意;
C、氖的元素符号为Ne,此选项不符合题意;
D、氖的元素符号为Ne,此选项不符合题意。
故答案为:A。
【变式4-3】地壳中的元素分布如图,其中区域②代表的元素是( )
A. 氧 B. 硅 C. 铝 D. 铁
【答案】 B
【解析】地壳中元素由多到少顺序为氧、硅、铝、铁,所以区域② 代表硅元素;
故答案为:B。
【变式4-4】奶制品、豆类、虾皮等食物中含钙丰富,这里的“钙”是指( )
A.钙元素 B.钙原子 C.钙离子 D.钙单质
【答案】 A
【解析】食品、药品、营养品、矿泉水等物质中的“钙、镁、钾、钠”等不是以单质、分子、原子等形式存在,而是指元素,通常用元素及其所占质量(质量分数)来描述;故奶、奶制品、豆类、虾皮等食物中含钙丰富,是日常饮食中钙的较好来源.这里的钙是指钙元素,与具体形态无关;
故答案为:A。
题型五:化学符号意义及用语
【例5】下列符号中既表示一种元素,又表示一种原子,还可表示一种物质的是( )
A. Cu B. N C. H D. O
【答案】 A
【解析】A. Cu 可表示铜元素、一个铜原子和铜这种物质,符合题意;
B.N不能表示氮气这种物质,不符合题意;
C.H不能表示物质,不符合题意;
D.O不能表示物质,不符合题意;
故答案为:A
【变式5-1】下列符号既能表示一种元素,又能表示一个原子的是( )
A.O2 B.Mg2+ C.H D.2N2
【答案】C。
【解析】
A.这是氧气的化学式,不能表示氧元素,也不能表示一个氧原子,故错误;
B.这是镁离子的符号,不能表示镁元素,也不能表示一个镁原子,故错误;
C.这是氢元素的元素符号,可以表示氢元素,还可以表示1个氢原子,故正确;
D.这个化学符号只能表示2个氮分子,不能表示一种元素,也不能表示一个原子,故错误。
故选:C。
【变式5-2】下列符号中既表示一种元素,又表示一种原子,还可表示一种物质的是( )
A.O B.N C.H2 D.Cu
【答案】D
【解析】解:A、O,表示氧元素和一个氧原子,故选项错误;
B、N,表示氮元素和一个氮原子,故选项错误;
C、H2,不能表示一种元素和一个原子,故选项错误;
D、Cu,表示铜元素,又表示一个铜原子,还可表示铜这种物质,故选项正确;
【变式5-3】用化学用语填空。
(1)氮原子________;
(2)镁元素________;
(3)钠离子________。
(4)7个硫原子________。
【答案】 (1)N(2)Mg(3)Na+(4)7S
【解析】(1)由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,氮原子可表示为N,故填:N;
(2)根据元素符号的书写方法,第一个字母要大写,第二个字母要小写,镁元素符号为:Mg,故填:Mg;
(3)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字,故钠离子可表示为Na+ , 故填:Na+;
(4)由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故7个硫原子可表示为7S,故填:7S。
题型六:元素周期表
【例6】钛和钛合金被认为是21世纪的重要金属材料。下图是钛元素在元素周期表中的部分信息,下列说法正确的是( )
A.钛原子的电子数为22 B.钛为非金属元素
C.钛原子的中子数为22 D.钛原子的相对原子质量为47.87g
【答案】A
【解析】
A、根据图示信息可知,钛原子内质子数、原子序数、核电荷数、电子数均为22,符合题意;
B、根据图示信息可知钛元素名称偏旁为金字旁,故属于金属元素,不符合题意;
C、根据图示信息可知钛原子中子数为48-22=26,不符合题意;
D、相对原子质量单位为“1”,通常省略不写,而不是“g”,不符合题意。
故选A。
【变式6-1】用锶制成的原子钟精准度极高,常用于卫星的精准计时。下图是锶元素在元素周期表中的信息,下列说法中不正确的是( )
A. 锶的相对原子质量是87.62
B. 锶是金属元素
C. 锶原子在化学反应中易得到电子
D. 锶的元素符号为Sr
【答案】C
【解析】
A、由元素周期表中的一格可知,汉子下方的数字表示相对原子质量,即锶的相对原子质量是87.62,故A正确,不符合题意;
B、锶是金属元素,故B正确,不符合题意;
C、锶原子是金属元素的原子,在化学反应中易失去电子,故C错误,不符合题意;
D、由元素周期表中的一格可知,右上角的表示元素符号,故锶的元素符号为Sr,故D正确,不符合题意;
故选C。
【变式6-2】我国著名科学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕
等近十种元素的相对原子质量,为相对原子质量测定作出了卓越贡献。关于钢元素在元素周期表中的部分
信息及原了结构示意图如图所示。下列说法正确的是( )
A.铟元素属于非金属元素 B.铟元素的相对原子质量是114.8g
C.铟原子的质子数为49 D.铟的原子结构示意图中X=18
【答案】C
【解析】
A、铟元素的元素名称为“钅”字旁,属于金属元素,选项错误,不符合题意;
B、元素周期表中的一格可知:汉字下面的数字表示相对原子质量。铟元素的相对原子质量是114.8,选项错误,不符合题意;
C、根据原子结构示意图可知铟原子的原子核内有49个质子,选项正确,符合题意;
D、铟的原子结构示意图中X是第二层的电子,根据原子核外电子排列规律:第一层最多排2个电子,第二层最多排8个电子可知x=8,选项错误,不符合题意。
故选C。
【变式6-3】元素周期表是学习和研究化学的重要工具。如图是元素周期表的部分信息:
认真分析信息,回答下列问题:
(1)地壳中含量最多的元素的原子序数是 ;
(2)仔细分析上表规律,可以推知:表中的符号X= ;
(3)结构示意图为所表示的离子符号是 ;
(4)写出一个由8、14号两种元素组成的化合物的化学式 ;
(5)这个同期表的发现和制作者是 。
A.张青莲 B.汤姆生 C.门捷列夫 D.诺贝尔
【答案】
(1)8;
(2)17;
(3)Ca2+;
(4)SiO2;
(5)C。
【解析】(1)地壳中含量最多的元素是氧元素,其原子序数是8,故填:8;
(2)表中的符号X等于17,故填:17;
(3)结构示意图为所表示的离子是钙离子,其符号是Ca2+,故填:Ca2+;
(4)由8、14号两种元素组成的化合物是二氧化硅,其化学式为 SiO2,故填:SiO2;
(5)元素同期表的发现和制作者是门捷列夫,故填:C。
【变式6-4】元素周期表是学习和研究化学的重要工具,它的内容十分丰富。下表是元素周期表的部分内容,请认真分析并回答后面的问题:
(1)请从上表中查出地壳中含量最多的金属元素的相对原子质量为 。
(2)表中不同种元素最本质的区别是 (填序号)。
A.相对原子质量不同 B.质子数不同 C.中子数不同
(3)元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律,如:
(填字母序号)。
A.从左到右,各元素原子的电子层数相同
B.从左到右,各元素原子的原子序数依次增加
C.从左到右,各元素原子的最外层电子数相同
(4)元素周期表中,原子序数为12的镁元素的原子结构示意图如图,该原子在化学反应中易 (填“得到”或“失去”)电子。说明元素的化学性质与原子的 关系密切。
【答案】(1)26.98; (2)B; (3)AB; (4)失去; 最外层电子数。
【解析】(1)先弄清地壳中含量最多的金属元素为铝元素;再根据元素周期表的内容,查知其相对原子质量为26.98;
(2)根据元素的概念,可知表中不同种元素最本质的区别是质子数不同;
(3)元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律:A.从左到右,各元素原子的电子层数相同;B.从左到右,各元素原子的原子序数依次增加;
(4)元素周期表中,原子序数为12的镁元素的原子结构示意图如上图,该原子在化学反应中易失去电子,说明元素的化学性质与原子的最外层电子数关系密切。
故答案为:(1)26.98; (2)B; (3)AB; (4)失去; 最外层电子数。
【变式6-5】如图是几种元素的粒子结构示意图及元素周期表的一部分。
(1)2021年2月27日,嫦娥五号采集的月壤样品在中国国家博物馆正式展出。月壤中存在着大量的氦-3(氦-3是含有2个质子和1个中子的氦原子),其原子结构示意图为图甲中的________(填序号)。
(2)硒是人体必需微量元素,具有防癌、抗癌作用,其原子结构示意图如图甲中的E,该元素处于元素周期表中第________周期,它与图乙中________(填元素名称)的化学性质相似。
【答案】 (1)A(2)四;氧
【解析】(1)氦-3是含有2个质子和1个中子的氦原子,在原子中,质子数=核外电子数=2,故其原子结构示意图为图甲中的A;
(2)由原子结构示意图可知,其原子核外有4个电子层,位于第四周期;
硒与氧的最外层电子数相同,都是6,化学性质相似,故填:氧。
【变式6-6】下图1为元素周期表的一部分,图2为几种粒子结构示意图,据图回答问题:
(1)图1中氩的相对原子质量是__________,硫元素的原子序数为__________;
(2)X元素名称__________;
(3)图2中与硫元素化学性质相似的是__________(填字母序号,下同);
(4)图2所示粒子共表示__________种元素,其中具有相对稳定结构的原子是__________。
【答案】(1) 39.95 16 (2)氯元素 (3)A (4) 三 D
【解析】(1)以氩的单元格为例:18—表示原子序数,Ar—表示元素符号,氩—表示元素名称,39.95—表示相对原子质量;所以氩的相对原子质量是39.95;由硫的单元格可知硫元素的原子序数为16;
(2)由元素周期表可知:X为第17号元素,是氯元素;
(3)最外层电子数相同的原子,化学性质相似,硫元素的最外层电子数为6,所以与硫元素化学性质相似的是A;
(4)元素种类由质子数决定,所以共有三种元素;当原子只有一个电子层时,最外层电子数为2是稳定结构,当第二层或第三层为最外层时,最外层电子数为8是稳定结构,具有相对稳定结构的原子是D。
(北京)股份有限公司
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
