2.1.2影响化学反应速率的因素课件(共26张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.1.2影响化学反应速率的因素课件(共26张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 16.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-07 20:10:13 | ||
图片预览




文档简介
(共26张PPT)
第二章 化学反应速率与化学平衡
第一节 化学反应速率
第2课时 影响化学反应速率的因素
提出问题
影响化学反应速率的因素有哪些?
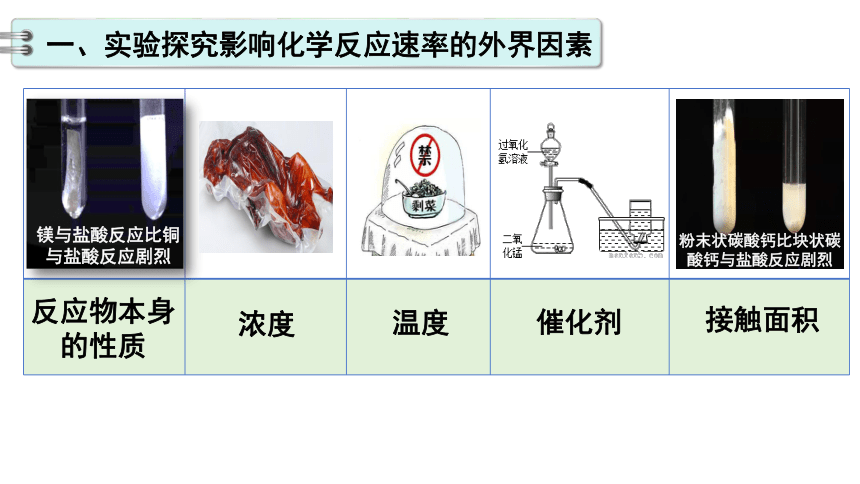
一、实验探究影响化学反应速率的外界因素
镁与盐酸反应比铜与盐酸反应剧烈
粉末状碳酸钙比块状碳酸钙与盐酸反应剧烈
反应物本身
的性质
浓度
温度
催化剂
接触面积
动手时间
如何定性比较化学反应的快慢?
颜色变化快慢
产生气泡快慢
产生浑浊快慢
固体减少快慢
1.定性研究影响化学反应速率的因素
一、实验探究影响化学反应速率的外界因素
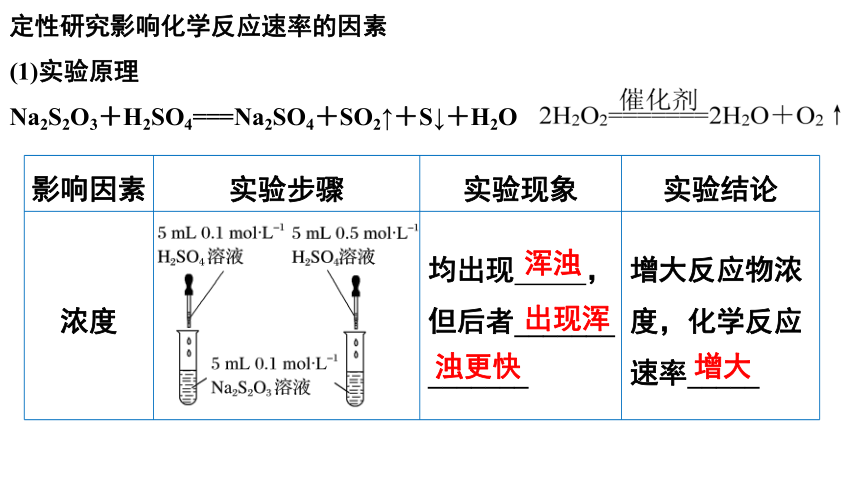
定性研究影响化学反应速率的因素
(1)实验原理
Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O
影响因素 实验步骤 实验现象 实验结论
浓度 均出现 ,但后者_______ _______ 增大反应物浓度,化学反应速率_____
浑浊
出现浑
浊更快
增大
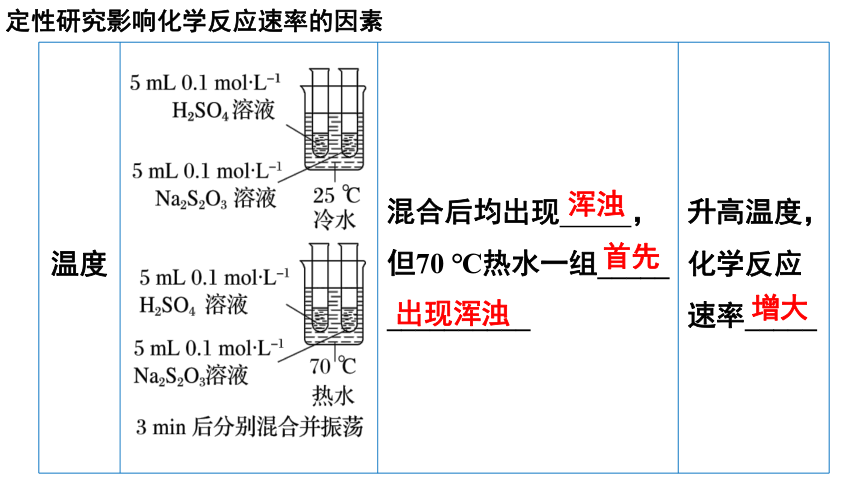
温度 混合后均出现 ,但70 ℃热水一组_____ __________ 升高温度,化学反应速率_____
浑浊
首先
出现浑浊
增大
定性研究影响化学反应速率的因素
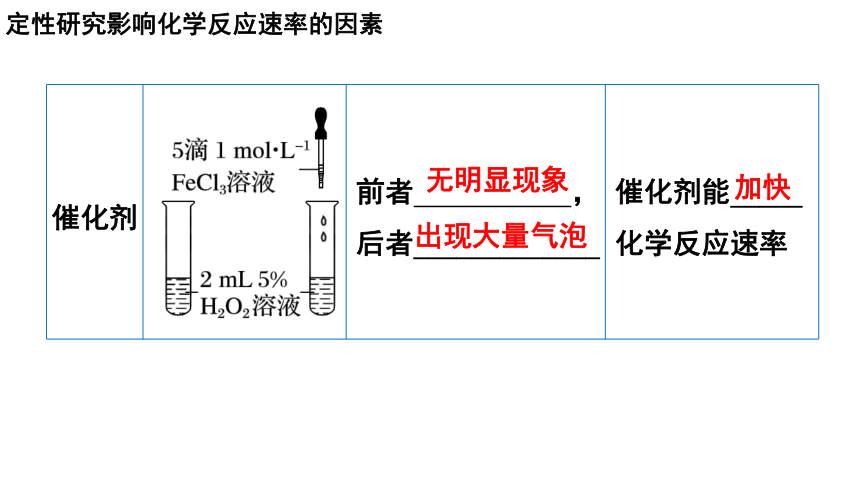
催化剂 前者 ,后者_____________ 催化剂能_____
化学反应速率
无明显现象
出现大量气泡
加快
定性研究影响化学反应速率的因素
定量研究影响化学反应速率的因素
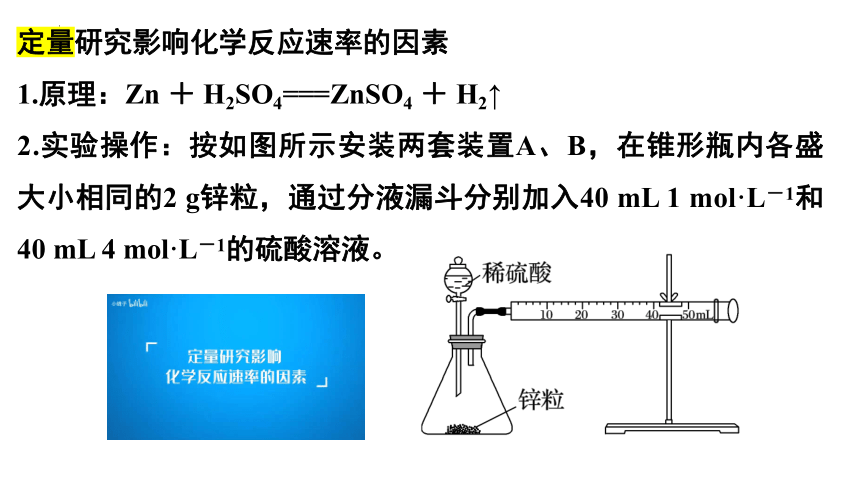
1.原理:Zn + H2SO4===ZnSO4 + H2↑
2.实验操作:按如图所示安装两套装置A、B,在锥形瓶内各盛大小相同的2 g锌粒,通过分液漏斗分别加入40 mL 1 mol·L-1和40 mL 4 mol·L-1的硫酸溶液。
3.实验记录及结论(记录收集10 mL H2所用的时间)
加入试剂 反应时间(填“长” 或“短”) 反应速率(填“快” 或“慢”) 结论
1 mol·L-1 H2SO4溶液 _____ _____ 增大反应物浓度,化学反应速率______
4 mol·L-1 H2SO4溶液 _____ _____
增大
长
短
慢
快
定量研究影响化学反应速率的因素
4.实验拓展探究
在用上述实验测定锌与硫酸反应的速率时:
(1)为确保测定的准确性,应注意哪些事项?________________________________________________________________________________________________。
(2)用上述装置测定化学反应速率时,操作、药品无误,结果测定速率偏大,从装置缺陷的角度分析可能的原因是______________________ 。
忽视加入稀硫酸排出气体的体积
锌的颗粒(即比表面积)大小基本相同;稀硫酸要迅速加入;装置气密性良好,且计时要迅速准确
(3)除了测定氢气的体积外,你还能设计哪些方案测定锌与稀硫酸
反应的速率?
_______________________________________________
_______________________________________________
________________________________________________
在恒容反应装置中,测定一段时间内压强的变化;
测定一段时间内H+的浓度变化;
测定一段时间内锌粒的质量变化等。
(1)任何化学反应都可以通过反应现象判断化学反应的快慢
(2)测定化学反应速率,可以用比色的方法测定溶液颜色的深浅
进行比较
正误判断
×
(3)可用装置 测定过氧化氢分解的化学反应速率
√
×
(4)锌与H2SO4反应,H2SO4的浓度越大,产生H2的速率越快
×
大本P19
浓度
二、外界因素对化学反应速率的影响
增大反应物的浓度,化学反应速率加快
减小反应物的浓度,化学反应速率减慢
1.适用于气体或溶液参与的反应;
2.实际参加反应的离子浓度的变化,
才会引起反应速率的改变。
1.适用于有气体参与的反应;
2.通过浓度对反应速率的影 响实现速率改变。
压强
减小压强,引起气体反应物浓度减小,化学反应速率减慢
增大压强,引起气体反应物浓度增大,化学反应速率加快
二、外界因素对化学反应速率的影响
恒容时
总压增大,各物质浓度不变,反应速率不变
反应速率加快
→
总压增大
→
浓度增大
充入气体反应物
→
充入惰性气体
→
反应速率减慢
恒压时
充入惰性气体
→
体积增大
→
各反应物浓度减小
→
注意:
压强只有影响到反应物浓度时,才会影响化学反应速率
2.对于反应:N2(g)+3H2(g) 2NH3(g)
(1)恒温恒容条件下,向反应体系中充入氮气,反应速率______
(填“增大”“减小”或“不变”,下同),原因是______________________________________________。
(2)恒温恒容条件下,向反应体系中充入氦气,反应速率________,原因是__________________________________________________________。
(3)恒温恒压条件下,向反应体系中充入氦气,反应速率________,原因是
________________________________________________。
增大
增大反应物的浓度,化学反应速率增大
不变
恒容条件下,充入氦气,
反应物和生成物的浓度不变,化学反应速率不变
减小
压强不变,充入氦气,容积增大,
反应物和生成物的浓度减小,化学反应速率减小
大本P22
温度
升高温度,化学反应(正反应、逆反应、放热反应、吸热反应)速率加快
降低温度,化学反应速率速率减慢
二、外界因素对化学反应速率的影响
同等程度影响正、
逆反应速率
催化剂
逆催化剂减慢
化学反应速率
正催化剂加快
化学反应速率
二、外界因素对化学反应速率的影响
其他因素
影响反应速率的因素是多方面的
接触面积
溶剂的性质
光
超声波
磁场
二、外界因素对化学反应速率的影响
影响因素 规律
内因 反应物本 身的性质 反应物的化学性质越活泼,化学反应速率越快;反之化学反应速率越慢
外因 浓度 增大反应物的浓度,化学反应速率增大;减小反应物的浓度,化学反应速率减小
温度 升高温度,化学反应速率增大;
降低温度,化学反应速率减小
催化剂 一般地,使用催化剂能极大地加快反应速率
固体的 表面积 增大固体反应物的表面积,化学反应速率加快
其他 光照、溶剂、形成原电池等,也能影响化学反应速率
控制变量探究实验题的思维流程
明确影响实验探究结果的因素可能有哪些
确定变量
根据实验目的,只变化一种因素,看这种因素与探究的问题之间存在怎样的关系;同样的方法确定另一种因素的影响结果。
定多变一
选择数据(设置实验)要有效,且变量统一,否则无法做出正确判断。
数据有效
模型建构
2.控制变量法是化学实验的常用方法之一。某化学兴趣小组为探究外界条件对化学反应速率的影响,设计以下四组实验。
深度思考
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
回答下列问题:
(1)V1=____,V2=____。
5
10
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
深度思考
(2)设计实验方案①和②的目的是:___________________________________。
探究Na2S2O3的浓度对化学反应速率的影响
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
深度思考
(3)设计实验方案②和④的目的是:____________________________。
探究温度对化学反应速率的影响
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
深度思考
(4)各实验方案中均需加入一定体积的水的原因:________________________________。
各实验方案中混合液的体积均相等
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
深度思考
第二章 化学反应速率与化学平衡
第一节 化学反应速率
第2课时 影响化学反应速率的因素
提出问题
影响化学反应速率的因素有哪些?
一、实验探究影响化学反应速率的外界因素
镁与盐酸反应比铜与盐酸反应剧烈
粉末状碳酸钙比块状碳酸钙与盐酸反应剧烈
反应物本身
的性质
浓度
温度
催化剂
接触面积
动手时间
如何定性比较化学反应的快慢?
颜色变化快慢
产生气泡快慢
产生浑浊快慢
固体减少快慢
1.定性研究影响化学反应速率的因素
一、实验探究影响化学反应速率的外界因素
定性研究影响化学反应速率的因素
(1)实验原理
Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O
影响因素 实验步骤 实验现象 实验结论
浓度 均出现 ,但后者_______ _______ 增大反应物浓度,化学反应速率_____
浑浊
出现浑
浊更快
增大
温度 混合后均出现 ,但70 ℃热水一组_____ __________ 升高温度,化学反应速率_____
浑浊
首先
出现浑浊
增大
定性研究影响化学反应速率的因素
催化剂 前者 ,后者_____________ 催化剂能_____
化学反应速率
无明显现象
出现大量气泡
加快
定性研究影响化学反应速率的因素
定量研究影响化学反应速率的因素
1.原理:Zn + H2SO4===ZnSO4 + H2↑
2.实验操作:按如图所示安装两套装置A、B,在锥形瓶内各盛大小相同的2 g锌粒,通过分液漏斗分别加入40 mL 1 mol·L-1和40 mL 4 mol·L-1的硫酸溶液。
3.实验记录及结论(记录收集10 mL H2所用的时间)
加入试剂 反应时间(填“长” 或“短”) 反应速率(填“快” 或“慢”) 结论
1 mol·L-1 H2SO4溶液 _____ _____ 增大反应物浓度,化学反应速率______
4 mol·L-1 H2SO4溶液 _____ _____
增大
长
短
慢
快
定量研究影响化学反应速率的因素
4.实验拓展探究
在用上述实验测定锌与硫酸反应的速率时:
(1)为确保测定的准确性,应注意哪些事项?________________________________________________________________________________________________。
(2)用上述装置测定化学反应速率时,操作、药品无误,结果测定速率偏大,从装置缺陷的角度分析可能的原因是______________________ 。
忽视加入稀硫酸排出气体的体积
锌的颗粒(即比表面积)大小基本相同;稀硫酸要迅速加入;装置气密性良好,且计时要迅速准确
(3)除了测定氢气的体积外,你还能设计哪些方案测定锌与稀硫酸
反应的速率?
_______________________________________________
_______________________________________________
________________________________________________
在恒容反应装置中,测定一段时间内压强的变化;
测定一段时间内H+的浓度变化;
测定一段时间内锌粒的质量变化等。
(1)任何化学反应都可以通过反应现象判断化学反应的快慢
(2)测定化学反应速率,可以用比色的方法测定溶液颜色的深浅
进行比较
正误判断
×
(3)可用装置 测定过氧化氢分解的化学反应速率
√
×
(4)锌与H2SO4反应,H2SO4的浓度越大,产生H2的速率越快
×
大本P19
浓度
二、外界因素对化学反应速率的影响
增大反应物的浓度,化学反应速率加快
减小反应物的浓度,化学反应速率减慢
1.适用于气体或溶液参与的反应;
2.实际参加反应的离子浓度的变化,
才会引起反应速率的改变。
1.适用于有气体参与的反应;
2.通过浓度对反应速率的影 响实现速率改变。
压强
减小压强,引起气体反应物浓度减小,化学反应速率减慢
增大压强,引起气体反应物浓度增大,化学反应速率加快
二、外界因素对化学反应速率的影响
恒容时
总压增大,各物质浓度不变,反应速率不变
反应速率加快
→
总压增大
→
浓度增大
充入气体反应物
→
充入惰性气体
→
反应速率减慢
恒压时
充入惰性气体
→
体积增大
→
各反应物浓度减小
→
注意:
压强只有影响到反应物浓度时,才会影响化学反应速率
2.对于反应:N2(g)+3H2(g) 2NH3(g)
(1)恒温恒容条件下,向反应体系中充入氮气,反应速率______
(填“增大”“减小”或“不变”,下同),原因是______________________________________________。
(2)恒温恒容条件下,向反应体系中充入氦气,反应速率________,原因是__________________________________________________________。
(3)恒温恒压条件下,向反应体系中充入氦气,反应速率________,原因是
________________________________________________。
增大
增大反应物的浓度,化学反应速率增大
不变
恒容条件下,充入氦气,
反应物和生成物的浓度不变,化学反应速率不变
减小
压强不变,充入氦气,容积增大,
反应物和生成物的浓度减小,化学反应速率减小
大本P22
温度
升高温度,化学反应(正反应、逆反应、放热反应、吸热反应)速率加快
降低温度,化学反应速率速率减慢
二、外界因素对化学反应速率的影响
同等程度影响正、
逆反应速率
催化剂
逆催化剂减慢
化学反应速率
正催化剂加快
化学反应速率
二、外界因素对化学反应速率的影响
其他因素
影响反应速率的因素是多方面的
接触面积
溶剂的性质
光
超声波
磁场
二、外界因素对化学反应速率的影响
影响因素 规律
内因 反应物本 身的性质 反应物的化学性质越活泼,化学反应速率越快;反之化学反应速率越慢
外因 浓度 增大反应物的浓度,化学反应速率增大;减小反应物的浓度,化学反应速率减小
温度 升高温度,化学反应速率增大;
降低温度,化学反应速率减小
催化剂 一般地,使用催化剂能极大地加快反应速率
固体的 表面积 增大固体反应物的表面积,化学反应速率加快
其他 光照、溶剂、形成原电池等,也能影响化学反应速率
控制变量探究实验题的思维流程
明确影响实验探究结果的因素可能有哪些
确定变量
根据实验目的,只变化一种因素,看这种因素与探究的问题之间存在怎样的关系;同样的方法确定另一种因素的影响结果。
定多变一
选择数据(设置实验)要有效,且变量统一,否则无法做出正确判断。
数据有效
模型建构
2.控制变量法是化学实验的常用方法之一。某化学兴趣小组为探究外界条件对化学反应速率的影响,设计以下四组实验。
深度思考
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
回答下列问题:
(1)V1=____,V2=____。
5
10
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
深度思考
(2)设计实验方案①和②的目的是:___________________________________。
探究Na2S2O3的浓度对化学反应速率的影响
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
深度思考
(3)设计实验方案②和④的目的是:____________________________。
探究温度对化学反应速率的影响
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
深度思考
(4)各实验方案中均需加入一定体积的水的原因:________________________________。
各实验方案中混合液的体积均相等
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
深度思考
