化学人教版(2019)必修第一册2.2.3氯气的实验室制备(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.2.3氯气的实验室制备(共26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 13.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-08 09:07:55 | ||
图片预览







文档简介
(共26张PPT)
第二节
氯及其化合物
第3课时
氯气的实验室制法
第二章
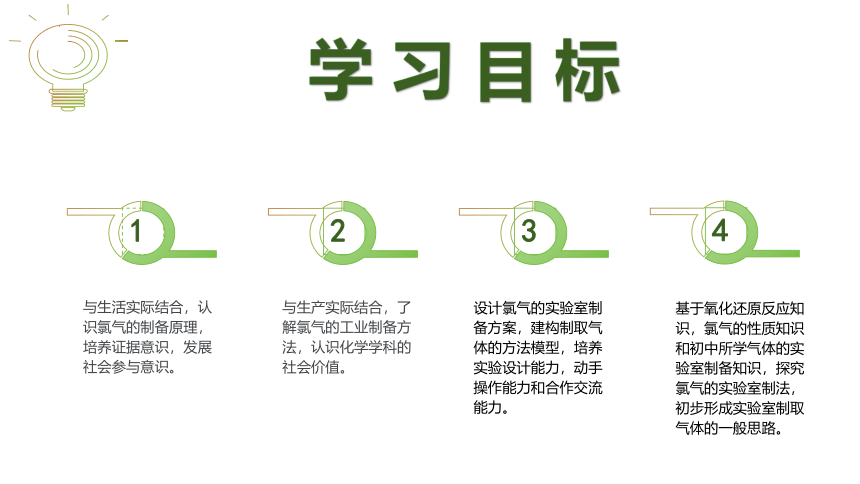
学 习 目 标
与生产实际结合,了解氯气的工业制备方法,认识化学学科的社会价值。
设计氯气的实验室制备方案,建构制取气体的方法模型,培养实验设计能力,动手操作能力和合作交流能力。
基于氧化还原反应知识,氯气的性质知识和初中所学气体的实验室制备知识,探究氯气的实验室制法,初步形成实验室制取气体的一般思路。
与生活实际结合,认识氯气的制备原理,培养证据意识,发展社会参与意识。
3
2
1
4
01
教 学 重 点
氯气的实验室制法
制取气体方法模型的构建
教 学 难 点
01
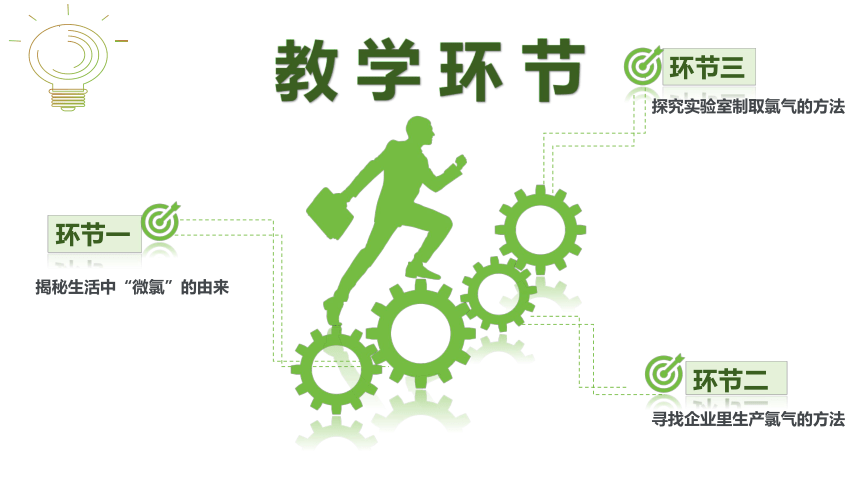
教 学 环 节
4
环节三
环节一
环节二
揭秘生活中“微氯”的由来
寻找企业里生产氯气的方法
探究实验室制取氯气的方法
环节一:揭秘生活中“微氯”的由来
一般我们在养鱼的时候,新缸都会进行七天的养水才会把鱼放进去养,这是为什么呢?
环节一:揭秘生活中“微氯”的由来
氯气在水中衍生出来的氯化物,可以综合称为余氯,它们与氯气(Cl )一样都具备漂白及杀菌效果,因此,我们可以把余氯(Cl )以及次氯酸(HClO)及次氯酸根(ClO-)等三种物质合称为余氯。
直接饮用自来水烧的开水也不是健康的选择,对自来水进行再净化是关键
自来水
自来水与净水比较
环节一:揭秘生活中“微氯”的由来
自来水中有大量的有害菌群和对鱼产生毒性的氯,养水是为了增加水中的有益菌群,营造一个比较完好的微生物生态系统。
除氯最好的方法是爆氧曝晒
1.晒水挥发法
2.硫代硫酸钠
3.加热法
4.使用净水设备
5.活性炭吸收法
我国有严格的标准,其中出厂水标准为大于0.3mg/L,末梢水为大于0.05mg/L.
环节二:寻找企业里生产氯气的方法
我国氯碱行业市场龙头企业分别为中泰化学和新疆天业
工业上用电解饱和氯化钠溶液的方法来制取氢氧化钠、氯气,并以它们为原材料生产一系列化工产品,简称为氯碱工业。
氯碱工业
氯碱工业中,电解饱和食盐水除了得到产品烧碱、
氯气,还有一种气态物质,请分析是什么物质?
NaCl+H2O
NaOH+Cl2 +
+1 -1 +1 -2 +1 -2 +1 0
失去2e-,化合价升高
某一个元素应该得到电子,化合价降低
氯碱工业制备氯气的方法:Cl- 被氧化成Cl2
环节二:寻找企业里生产氯气的方法
环节二:寻找企业里生产氯气的方法
氯碱工业是以盐和电为原料生产烧碱、氯气、氢气的基础原材料工业,经过浓度调节、蒸发、冷冻液化、燃烧合成等阶段最终制成。
氯碱是国民经济的重要基本化工原料之一,主要用于轻工、化工、纺织、医药、冶金、石油等行业。
氯
碱
工
业
环节三:探究实验室制取氯气的方法
【回顾】
初中实验室制取O2,CO2的原理,选择合适的仪器:
E F G H I
制取O2:
制取CO2:
AC
AF
AH
BC
BF
BH
BF
BH
环节三:探究实验室制取氯气的方法
气体的实验室制取装置
考虑反应物的状态和反应条件
考虑气体的密度和溶解性
发生装置
收集装置
环节三:探究实验室制取氯气的方法
卡尔·威尔海姆·舍勒(1742—1786)
瑞典著名化学家
“氧、氯、锰、氟、盐酸、氨、氢氟酸、砷酸、钨酸、钼酸、草酸、柠檬酸、酒石酸、没食子酸、焦性没食子酸、苹果酸、硫酸亚铁……”
1774年,舍勒用盐酸和软锰矿(主要成分为二氧化锰)一起加热时,从烧瓶中放出一股刺鼻的、呛得人咳嗽不止的黄绿色气体,吸入后会感到“肺部极为难受”。
舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一:
环节三:探究实验室制取氯气的方法
MnO2
黑色无定形粉末或黑色斜方晶体
二氧化锰是两性氧化物,遇还原剂时,表现为氧化性;遇强氧化剂时,还表现为还原性
用作H2O2和KClO3分解制氧气时的催化剂
与单质铝粉发生铝热反应,制得锰
用作颜料、黄色玻璃
热的浓盐酸反应制取氯气
熔融苛性钾(氢氧化钾)在空气中反应制取锰酸钾
高锰酸钾分解反应中,二氧化锰作为高锰酸钾的自催化剂
环节三:探究实验室制取氯气的方法
+1 -1 +4 -2 +2 -1 0 +1 -2
失去2e-,化合价升高
得到2e-,化合价降低
氧化性:
还原性:
MnO2 > Cl2
HCl > MnCl2
实验室制取氯气的原理:
环节三:探究实验室制取氯气的方法
实验室制取氯气的离子反应方程式:
氧化性:
还原性:
MnO2 > Cl2
Cl- > Mn2+
环节三:探究实验室制取氯气的方法
NaOH溶液的作用是什么?
氯气有毒,用NaOH溶液吸收多余的氯气。
这样装置制取的氯气纯净吗?
不纯净,氯气中存在水蒸气(H2O)和氯化氢(HCl)。
如何除去呢?
环节三:探究实验室制取氯气的方法
由于1体积水可溶解约2体积的氯气,故可以用排饱和食盐水法收集氯气以减少氯气的溶解。
除水蒸气通常用浓硫酸
洗气
尾气处理
环节三:探究实验室制取氯气的方法
【改进实验】
【注意】
1.可以用稀盐酸代替浓盐酸吗?
3.为什么要加热,温度过高会怎么样?
2.浓盐酸体现了什么性质?
观察颜色,或湿润的淀粉KI试纸
——湿润的淀粉KI试纸遇到氯气会变蓝
不可以,因为与浓盐酸相比,稀盐酸的还原性较弱,不能被MnO2还原成Cl2。
还原性和酸性
4.如何检验氯气已满?
加快反应速率;温度过高导致浓HCl挥发性增强,Cl2中混有HCl杂质。
可以有其他物质代替MnO2吗?
环节三:探究实验室制取氯气的方法
1.高锰酸钾制取氯气:
2.重铬酸钾制取氯气:
3.重铬酸钾制取氯气:
环节三:探究实验室制取氯气的方法
实验室制取气体装置的连接顺序:
发生装置→除杂装置→收集装置→尾气处理装置
实验室制备气体的思路:
第一步:明确原理,写方程式
第二步:确定药品状态,反应条件,选发生装置
第三步:分析是否有杂质,选择合适的除杂装置
第四步:选择收集装置,考虑是否需要尾气处理
环节三:小结
氯气的实验室制法
一、实验室:
二、工业上:
制取原理→发生装置→除杂装置→收集装置→尾气处理装置
环节三:课堂测试
1.下列有关描述对应的离子方程式书写正确的是
A.钠加入到稀盐酸中:
B.炉甘石(主要成分为 )与稀硫酸反应:
C.用稀盐酸去除试管中附着的铁锈(主要成分为 ):
D.实验室制备氯气:
C
2.实验室用氯酸钾与浓盐酸制备氯气的反应方程式的原理 (浓) ,则用该法制备的氯气的氯元素的近似平均相对原子质量为
A.36.0 B.36.7 C.35.3 D.35.5
C
环节三:课堂测试
3. 是一种化工原料,可以制备多种物质,如下图所示。下列说法正确的是
A.氯化钠溶液通电后,发生反应的离子方程式为
B.氢气在氯气中剧烈燃烧,发出黄色火焰,瓶口有白雾出现
C. 与 反应生成以 为有效成分的漂白粉,该反应中,氯气是氧化剂, 是还原剂
D.使用漂白粉浸泡衣物时,可大量加入盐酸,增强漂白效果
A
第二节
氯及其化合物
第3课时
氯气的实验室制法
第二章
学 习 目 标
与生产实际结合,了解氯气的工业制备方法,认识化学学科的社会价值。
设计氯气的实验室制备方案,建构制取气体的方法模型,培养实验设计能力,动手操作能力和合作交流能力。
基于氧化还原反应知识,氯气的性质知识和初中所学气体的实验室制备知识,探究氯气的实验室制法,初步形成实验室制取气体的一般思路。
与生活实际结合,认识氯气的制备原理,培养证据意识,发展社会参与意识。
3
2
1
4
01
教 学 重 点
氯气的实验室制法
制取气体方法模型的构建
教 学 难 点
01
教 学 环 节
4
环节三
环节一
环节二
揭秘生活中“微氯”的由来
寻找企业里生产氯气的方法
探究实验室制取氯气的方法
环节一:揭秘生活中“微氯”的由来
一般我们在养鱼的时候,新缸都会进行七天的养水才会把鱼放进去养,这是为什么呢?
环节一:揭秘生活中“微氯”的由来
氯气在水中衍生出来的氯化物,可以综合称为余氯,它们与氯气(Cl )一样都具备漂白及杀菌效果,因此,我们可以把余氯(Cl )以及次氯酸(HClO)及次氯酸根(ClO-)等三种物质合称为余氯。
直接饮用自来水烧的开水也不是健康的选择,对自来水进行再净化是关键
自来水
自来水与净水比较
环节一:揭秘生活中“微氯”的由来
自来水中有大量的有害菌群和对鱼产生毒性的氯,养水是为了增加水中的有益菌群,营造一个比较完好的微生物生态系统。
除氯最好的方法是爆氧曝晒
1.晒水挥发法
2.硫代硫酸钠
3.加热法
4.使用净水设备
5.活性炭吸收法
我国有严格的标准,其中出厂水标准为大于0.3mg/L,末梢水为大于0.05mg/L.
环节二:寻找企业里生产氯气的方法
我国氯碱行业市场龙头企业分别为中泰化学和新疆天业
工业上用电解饱和氯化钠溶液的方法来制取氢氧化钠、氯气,并以它们为原材料生产一系列化工产品,简称为氯碱工业。
氯碱工业
氯碱工业中,电解饱和食盐水除了得到产品烧碱、
氯气,还有一种气态物质,请分析是什么物质?
NaCl+H2O
NaOH+Cl2 +
+1 -1 +1 -2 +1 -2 +1 0
失去2e-,化合价升高
某一个元素应该得到电子,化合价降低
氯碱工业制备氯气的方法:Cl- 被氧化成Cl2
环节二:寻找企业里生产氯气的方法
环节二:寻找企业里生产氯气的方法
氯碱工业是以盐和电为原料生产烧碱、氯气、氢气的基础原材料工业,经过浓度调节、蒸发、冷冻液化、燃烧合成等阶段最终制成。
氯碱是国民经济的重要基本化工原料之一,主要用于轻工、化工、纺织、医药、冶金、石油等行业。
氯
碱
工
业
环节三:探究实验室制取氯气的方法
【回顾】
初中实验室制取O2,CO2的原理,选择合适的仪器:
E F G H I
制取O2:
制取CO2:
AC
AF
AH
BC
BF
BH
BF
BH
环节三:探究实验室制取氯气的方法
气体的实验室制取装置
考虑反应物的状态和反应条件
考虑气体的密度和溶解性
发生装置
收集装置
环节三:探究实验室制取氯气的方法
卡尔·威尔海姆·舍勒(1742—1786)
瑞典著名化学家
“氧、氯、锰、氟、盐酸、氨、氢氟酸、砷酸、钨酸、钼酸、草酸、柠檬酸、酒石酸、没食子酸、焦性没食子酸、苹果酸、硫酸亚铁……”
1774年,舍勒用盐酸和软锰矿(主要成分为二氧化锰)一起加热时,从烧瓶中放出一股刺鼻的、呛得人咳嗽不止的黄绿色气体,吸入后会感到“肺部极为难受”。
舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一:
环节三:探究实验室制取氯气的方法
MnO2
黑色无定形粉末或黑色斜方晶体
二氧化锰是两性氧化物,遇还原剂时,表现为氧化性;遇强氧化剂时,还表现为还原性
用作H2O2和KClO3分解制氧气时的催化剂
与单质铝粉发生铝热反应,制得锰
用作颜料、黄色玻璃
热的浓盐酸反应制取氯气
熔融苛性钾(氢氧化钾)在空气中反应制取锰酸钾
高锰酸钾分解反应中,二氧化锰作为高锰酸钾的自催化剂
环节三:探究实验室制取氯气的方法
+1 -1 +4 -2 +2 -1 0 +1 -2
失去2e-,化合价升高
得到2e-,化合价降低
氧化性:
还原性:
MnO2 > Cl2
HCl > MnCl2
实验室制取氯气的原理:
环节三:探究实验室制取氯气的方法
实验室制取氯气的离子反应方程式:
氧化性:
还原性:
MnO2 > Cl2
Cl- > Mn2+
环节三:探究实验室制取氯气的方法
NaOH溶液的作用是什么?
氯气有毒,用NaOH溶液吸收多余的氯气。
这样装置制取的氯气纯净吗?
不纯净,氯气中存在水蒸气(H2O)和氯化氢(HCl)。
如何除去呢?
环节三:探究实验室制取氯气的方法
由于1体积水可溶解约2体积的氯气,故可以用排饱和食盐水法收集氯气以减少氯气的溶解。
除水蒸气通常用浓硫酸
洗气
尾气处理
环节三:探究实验室制取氯气的方法
【改进实验】
【注意】
1.可以用稀盐酸代替浓盐酸吗?
3.为什么要加热,温度过高会怎么样?
2.浓盐酸体现了什么性质?
观察颜色,或湿润的淀粉KI试纸
——湿润的淀粉KI试纸遇到氯气会变蓝
不可以,因为与浓盐酸相比,稀盐酸的还原性较弱,不能被MnO2还原成Cl2。
还原性和酸性
4.如何检验氯气已满?
加快反应速率;温度过高导致浓HCl挥发性增强,Cl2中混有HCl杂质。
可以有其他物质代替MnO2吗?
环节三:探究实验室制取氯气的方法
1.高锰酸钾制取氯气:
2.重铬酸钾制取氯气:
3.重铬酸钾制取氯气:
环节三:探究实验室制取氯气的方法
实验室制取气体装置的连接顺序:
发生装置→除杂装置→收集装置→尾气处理装置
实验室制备气体的思路:
第一步:明确原理,写方程式
第二步:确定药品状态,反应条件,选发生装置
第三步:分析是否有杂质,选择合适的除杂装置
第四步:选择收集装置,考虑是否需要尾气处理
环节三:小结
氯气的实验室制法
一、实验室:
二、工业上:
制取原理→发生装置→除杂装置→收集装置→尾气处理装置
环节三:课堂测试
1.下列有关描述对应的离子方程式书写正确的是
A.钠加入到稀盐酸中:
B.炉甘石(主要成分为 )与稀硫酸反应:
C.用稀盐酸去除试管中附着的铁锈(主要成分为 ):
D.实验室制备氯气:
C
2.实验室用氯酸钾与浓盐酸制备氯气的反应方程式的原理 (浓) ,则用该法制备的氯气的氯元素的近似平均相对原子质量为
A.36.0 B.36.7 C.35.3 D.35.5
C
环节三:课堂测试
3. 是一种化工原料,可以制备多种物质,如下图所示。下列说法正确的是
A.氯化钠溶液通电后,发生反应的离子方程式为
B.氢气在氯气中剧烈燃烧,发出黄色火焰,瓶口有白雾出现
C. 与 反应生成以 为有效成分的漂白粉,该反应中,氯气是氧化剂, 是还原剂
D.使用漂白粉浸泡衣物时,可大量加入盐酸,增强漂白效果
A
