2023—2024学年上学期高二化学鲁科版(2019)选择性必修一第1章 化学反应与能量转化 章末练习(含答案)
文档属性
| 名称 | 2023—2024学年上学期高二化学鲁科版(2019)选择性必修一第1章 化学反应与能量转化 章末练习(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 970.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-08 09:13:52 | ||
图片预览




文档简介
2023—2024学年上学期高二化学鲁科版(2019)选择性必修一第1章 化学反应与能量转化 章末练习含答案
鲁科版(2019)第1章 化学反应与能量转化
一、选择题。(18题)
1、下列关于能量变化的说法正确的是( )
A.相同质量的水和冰相比较,冰的能量高
B.化学反应过程中能量的变化只有吸热和放热两种表现形式
C.化学反应既遵循质量守恒,也遵循能量守恒
D.需要加热才能发生的反应一定是吸热反应
2、a、b、c、d均大于0,下列表示物质摩尔燃烧焓的热化学方程式的是( )
A.
B.
C.
D.
3、我国科学家开发出了一种锌—一氧化氮电池系统,该电池具有同的合成氨和对外供电的功能,其工作原理如图所示,下列说法中错误的是( )
A.电极电势:电极电极
B.电极的反应式为
C.电池工作一段时间后,正极区溶液的减小
D.电子流向:电极→负载电极
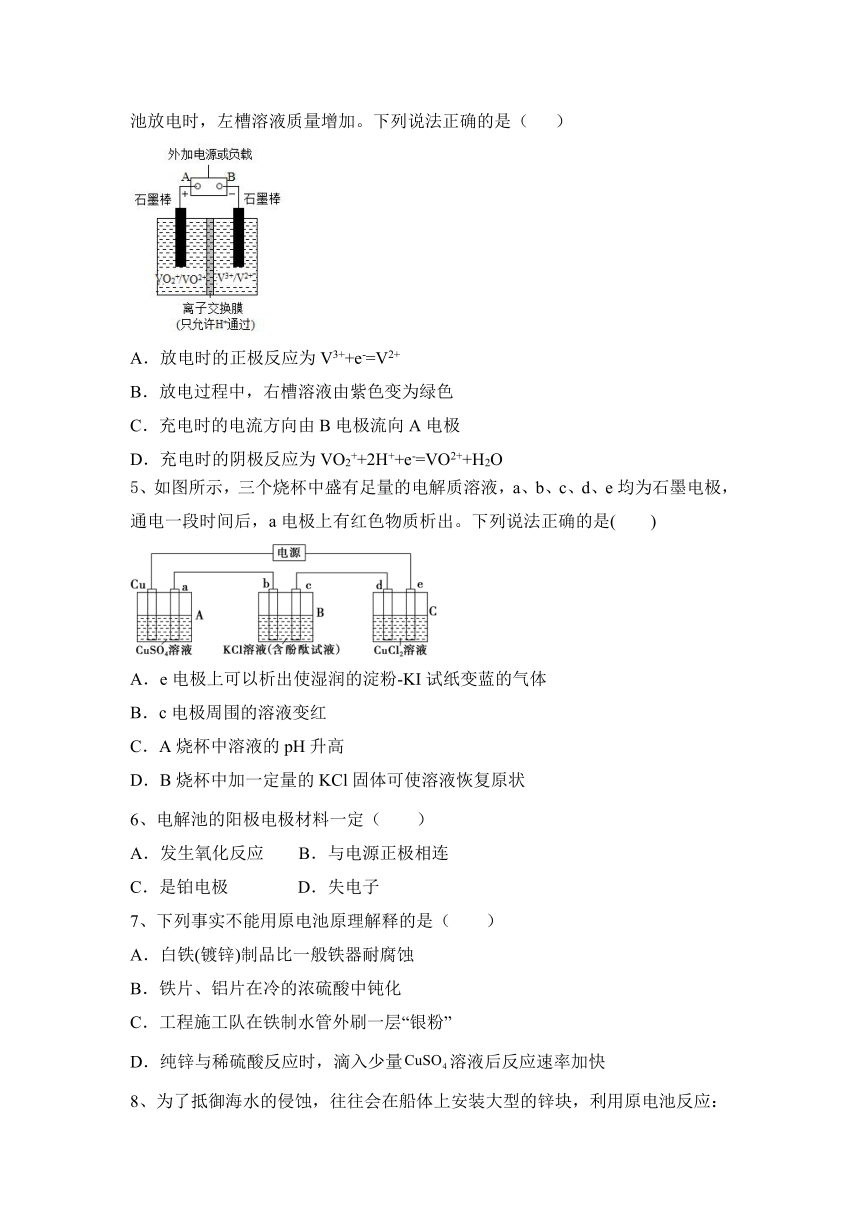
4、全钒液流储能电池一次性充电后,续航能力可达1000 km,而充电时间只需3~5 min,被誉为“完美电池”,其原理如图所示(已知V2+呈紫色,V3+呈绿色)。电池放电时,左槽溶液质量增加。下列说法正确的是( )
A.放电时的正极反应为V3++e-=V2+
B.放电过程中,右槽溶液由紫色变为绿色
C.充电时的电流方向由B电极流向A电极
D.充电时的阴极反应为VO2++2H++e-=VO2++H2O
5、如图所示,三个烧杯中盛有足量的电解质溶液,a、b、c、d、e均为石墨电极,通电一段时间后,a电极上有红色物质析出。下列说法正确的是( )
A.e电极上可以析出使湿润的淀粉 KI试纸变蓝的气体
B.c电极周围的溶液变红
C.A烧杯中溶液的pH升高
D.B烧杯中加一定量的KCl固体可使溶液恢复原状
6、电解池的阳极电极材料一定( )
A.发生氧化反应 B.与电源正极相连
C.是铂电极 D.失电子
7、下列事实不能用原电池原理解释的是( )
A.白铁(镀锌)制品比一般铁器耐腐蚀
B.铁片、铝片在冷的浓硫酸中钝化
C.工程施工队在铁制水管外刷一层“银粉”
D.纯锌与稀硫酸反应时,滴入少量溶液后反应速率加快
8、为了抵御海水的侵蚀,往往会在船体上安装大型的锌块,利用原电池反应:2Zn+2H2O+O2 = 2Zn(OH)2,下列说法正确的是( )
A.锌块作为原电池的负极,发生还原反应而被腐蚀
B.海水中的电解质如NaCl起到了导电的作用
C.正极的电极反应式为:Zn - 2e-=Zn2+
D.实际应用中,需用锌块覆满船体,完全隔绝海水以防止钢铁被腐蚀
9、已知某化学反应A2(g)+2B2(g)═2AB2(g)(AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中不正确的是( )
A.该反应的反应物的总焓小于反应产物的总焓
B.断裂4molA-B键要吸收E2kJ能量
C.该反应的△H=(E1-E2)kJ/mol
D.该反应中反应物的键能总和小于生成物的键能总和
10、某同学设计了如图所示的盐桥式原电池,下列说法正确的是( )
A.X若为Fe、Y可以为Na2SO4溶液
B.X若为Cu、Y可以为AgNO3溶液
C.电子由X电极经盐桥流向Ag电极
D.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
11、下列过程需要通电才能进行的是( )
①电离 ②电解 ③电镀 ④电化学腐蚀
A.②③ B.①② C.②④ D.全部
12、用电渗析法可将含硝酸钠的废水再生为硝酸和氢氧化钠,其装置如图所示。下列叙述不正确的( )
A.膜a、膜c分别是阴离子交换膜、阳离子交换膜
B.阳极室、阴极室的产品分别是氢氧化钠、硝酸
C.阳极的电极反应式为2H2O-4e—=4H++O2↑
D.该装置工作时,电路中每转移0.2 mol 电子,两极共生成气体3.36L(标准状况)
13、已知:①
②
③
则反应的等于( )
A. B.
C. D.
14、(双选)某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )
A.a为O2,b为CH4 B.向负极移动
C.此电池在常温时也能工作 D.正极的电极反应式为2CO2+O2+4e-=2
15、某溶液中含有Cu2+、Fe2+、Mg2+、Cl-、NO3-,用石墨作电极进行电解时,肯定得不到的产物是( )
A.Cl2 B.Mg C.Cu D.H2
16、下列有关金属腐蚀的说法中正确的是( )
A.钢铁闸门接在电源的负极上,此方法称为牺牲阳极的阴极保护法
B.电化学腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程
C.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈
D.金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生
17、键能是气态基态原子形成1 mol化学键释放的最低能量。根据图中的能量关系,可求得C-H键的键能为( )
A.377 kJ/mol B.414 kJ/mol C.235 kJ/mol D.197 kJ/mol
18、中科院某课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料获得能量。下列说法中正确的是( )
A.a极为正极
B.随着反应不断进行,负极区的pH不断增大
C.b极电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
D.消耗0.01mol葡萄糖,电路中转移0.02mol电子
二、填空题。(3题)
19、某兴趣小组为研究原电池原理,设计如图甲乙两个原电池装置。
(1)如图甲,a和b用导线连接,Cu电极的电极反应式为:________,溶液中SO移向______(填“Cu”或“Fe”)极。
(2)如图乙所示的原电池装置中,负极材料是_____。正极上能够观察到的现象是_______________。 负极的电极反应式是_________________。原电池工作一段时间后,若消耗负极5.4g,则放出气体______mol。
20、金属腐蚀现象在生产生活中普遍存在,依据下列2种腐蚀现象回答下列问题:
(1)图1,被腐蚀的金属为____,其腐蚀类型属于____(填字母)。图2,金属腐蚀类型属于____(填字母)。
A.化学腐蚀 B.电化学腐蚀 C.析氢腐蚀 D.吸氧腐蚀
(2)图1中Cu的作用是______,结合电极反应、电子移动、离子移动等,分析金属被腐蚀的原理______。
(3)图2中铁的生锈过程:Fe→Fe(OH)2→Fe(OH)3→Fe2O3·nH2O,将Fe转变为Fe(OH)2的反应补充完整:正极反应为_______,负极反应为______,总反应为
___ _ 。
(4)下列防止铁制品生锈的措施合理的是__________。
A.在铁闸门表面涂油漆
B.在地下铁管道上安装若干镁合金
C.将铁罐与浓硫酸等强氧化剂接触,使之发生钝化
21、如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中。请回答:
(1)金属腐蚀主要分为________腐蚀和________腐蚀两种。
(2)铁被腐蚀的速率由快到慢的顺序是________(填序号)。
(3)请你为以下钢铁制品选择适当的防锈方法。
A.健身器材__________________________________________;
B.自行车的链条、齿轮________________________________;
C.海水中的轮船______________________________________。
四、原理综合题。
22、)(1)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的摩尔燃烧焓△H1= - 2220 kJ/mol,正丁烷的摩尔燃烧焓△H2= -2878 kJ/ mol;异丁烷的摩尔燃烧焓△H3= -2869.6 kJ/mol。
①下列有关说法不正确的是_______________ (填标号)。
A 奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B 异丁烷分子中的碳氢键比正丁烷的多
C 正丁烷比异丁烷稳定
②已知1 mol H2燃烧生成液态水放出的热量是285. 8 kJ,现有6 mol由氢气和丙烷组成的混合气体,完全燃烧时放出的热量是3649 kJ,则该混合气体中氢气和丙烷的体积比为____ 。
(2)利用氢气可以制取工业原料乙酸。已知:
Ⅰ.CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH=-870.3 kJ·mol-1
Ⅱ.C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
Ⅲ.H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
①相同质量的CH3COOH、C、H2完全燃烧时,放出热量最多的是______________。
②利用上述信息计算反应:2C(s)+2H2(g)+O2(g)===CH3COOH(l) ΔH=_________ kJ·mol-1。
(3)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应 A:4HCl+O22Cl2+2H2O
已知:ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.
写出此条件下反应A的热化学方程式是_______________________________。
2023—2024学年上学期高二化学鲁科版(2019)选择性必修一第1章 化学反应与能量转化 章末练习含答案
鲁科版(2019)第1章 化学反应与能量转化
一、选择题。(18题)
1、下列关于能量变化的说法正确的是( )
A.相同质量的水和冰相比较,冰的能量高
B.化学反应过程中能量的变化只有吸热和放热两种表现形式
C.化学反应既遵循质量守恒,也遵循能量守恒
D.需要加热才能发生的反应一定是吸热反应
【答案】C
2、a、b、c、d均大于0,下列表示物质摩尔燃烧焓的热化学方程式的是( )
A.
B.
C.
D.
【答案】B
3、我国科学家开发出了一种锌—一氧化氮电池系统,该电池具有同的合成氨和对外供电的功能,其工作原理如图所示,下列说法中错误的是( )
A.电极电势:电极电极
B.电极的反应式为
C.电池工作一段时间后,正极区溶液的减小
D.电子流向:电极→负载电极
【答案】C
4、全钒液流储能电池一次性充电后,续航能力可达1000 km,而充电时间只需3~5 min,被誉为“完美电池”,其原理如图所示(已知V2+呈紫色,V3+呈绿色)。电池放电时,左槽溶液质量增加。下列说法正确的是( )
A.放电时的正极反应为V3++e-=V2+
B.放电过程中,右槽溶液由紫色变为绿色
C.充电时的电流方向由B电极流向A电极
D.充电时的阴极反应为VO2++2H++e-=VO2++H2O
【答案】B
5、如图所示,三个烧杯中盛有足量的电解质溶液,a、b、c、d、e均为石墨电极,通电一段时间后,a电极上有红色物质析出。下列说法正确的是( )
A.e电极上可以析出使湿润的淀粉 KI试纸变蓝的气体
B.c电极周围的溶液变红
C.A烧杯中溶液的pH升高
D.B烧杯中加一定量的KCl固体可使溶液恢复原状
【答案】B
6、电解池的阳极电极材料一定( )
A.发生氧化反应 B.与电源正极相连
C.是铂电极 D.失电子
【答案】B
7、下列事实不能用原电池原理解释的是( )
A.白铁(镀锌)制品比一般铁器耐腐蚀
B.铁片、铝片在冷的浓硫酸中钝化
C.工程施工队在铁制水管外刷一层“银粉”
D.纯锌与稀硫酸反应时,滴入少量溶液后反应速率加快
【答案】B
8、为了抵御海水的侵蚀,往往会在船体上安装大型的锌块,利用原电池反应:2Zn+2H2O+O2 = 2Zn(OH)2,下列说法正确的是( )
A.锌块作为原电池的负极,发生还原反应而被腐蚀
B.海水中的电解质如NaCl起到了导电的作用
C.正极的电极反应式为:Zn - 2e-=Zn2+
D.实际应用中,需用锌块覆满船体,完全隔绝海水以防止钢铁被腐蚀
【答案】B
9、已知某化学反应A2(g)+2B2(g)═2AB2(g)(AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中不正确的是( )
A.该反应的反应物的总焓小于反应产物的总焓
B.断裂4molA-B键要吸收E2kJ能量
C.该反应的△H=(E1-E2)kJ/mol
D.该反应中反应物的键能总和小于生成物的键能总和
【答案】D
10、某同学设计了如图所示的盐桥式原电池,下列说法正确的是( )
A.X若为Fe、Y可以为Na2SO4溶液
B.X若为Cu、Y可以为AgNO3溶液
C.电子由X电极经盐桥流向Ag电极
D.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
【答案】B
11、下列过程需要通电才能进行的是( )
①电离 ②电解 ③电镀 ④电化学腐蚀
A.②③ B.①② C.②④ D.全部
【答案】A
12、用电渗析法可将含硝酸钠的废水再生为硝酸和氢氧化钠,其装置如图所示。下列叙述不正确的( )
A.膜a、膜c分别是阴离子交换膜、阳离子交换膜
B.阳极室、阴极室的产品分别是氢氧化钠、硝酸
C.阳极的电极反应式为2H2O-4e—=4H++O2↑
D.该装置工作时,电路中每转移0.2 mol 电子,两极共生成气体3.36L(标准状况)
【答案】B
13、已知:①
②
③
则反应的等于( )
A. B.
C. D.
【答案】B
14、(双选)某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )
A.a为O2,b为CH4 B.向负极移动
C.此电池在常温时也能工作 D.正极的电极反应式为2CO2+O2+4e-=2
【答案】BD
15、某溶液中含有Cu2+、Fe2+、Mg2+、Cl-、NO3-,用石墨作电极进行电解时,肯定得不到的产物是( )
A.Cl2 B.Mg C.Cu D.H2
【答案】B
16、下列有关金属腐蚀的说法中正确的是( )
A.钢铁闸门接在电源的负极上,此方法称为牺牲阳极的阴极保护法
B.电化学腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程
C.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈
D.金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生
【答案】D
17、键能是气态基态原子形成1 mol化学键释放的最低能量。根据图中的能量关系,可求得C-H键的键能为( )
A.377 kJ/mol B.414 kJ/mol C.235 kJ/mol D.197 kJ/mol
【答案】B
18、中科院某课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料获得能量。下列说法中正确的是( )
A.a极为正极
B.随着反应不断进行,负极区的pH不断增大
C.b极电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
D.消耗0.01mol葡萄糖,电路中转移0.02mol电子
【答案】D
二、填空题。(3题)
19、某兴趣小组为研究原电池原理,设计如图甲乙两个原电池装置。
(1)如图甲,a和b用导线连接,Cu电极的电极反应式为:________,溶液中SO移向______(填“Cu”或“Fe”)极。
(2)如图乙所示的原电池装置中,负极材料是_____。正极上能够观察到的现象是_______________。 负极的电极反应式是_________________。原电池工作一段时间后,若消耗负极5.4g,则放出气体______mol。
【答案】2H++2e-=H2↑ Fe Al 产生气泡
Al-3e- +4OH-=AlO+ 2H2O 0.3
20、金属腐蚀现象在生产生活中普遍存在,依据下列2种腐蚀现象回答下列问题:
(1)图1,被腐蚀的金属为____,其腐蚀类型属于____(填字母)。图2,金属腐蚀类型属于____(填字母)。
A.化学腐蚀 B.电化学腐蚀 C.析氢腐蚀 D.吸氧腐蚀
(2)图1中Cu的作用是______,结合电极反应、电子移动、离子移动等,分析金属被腐蚀的原理______。
(3)图2中铁的生锈过程:Fe→Fe(OH)2→Fe(OH)3→Fe2O3·nH2O,将Fe转变为Fe(OH)2的反应补充完整:正极反应为_______,负极反应为______,总反应为
___ _ 。
(4)下列防止铁制品生锈的措施合理的是__________。
A.在铁闸门表面涂油漆
B.在地下铁管道上安装若干镁合金
C.将铁罐与浓硫酸等强氧化剂接触,使之发生钝化
【答案】铁或Fe BC BD 做正极材料,导电 铜做正极,氢离子在内电路移向正极,得到电子,生成氢气;铁做负极,在外电路失去电子,电子从负极移向正极,金属铁被腐蚀成亚铁离子。 O2+4e-+2H2O=4OH- 2Fe-4e-=2Fe2+ 2Fe+O2+2H2O=2Fe(OH)2 ABC
21、如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中。请回答:
(1)金属腐蚀主要分为________腐蚀和________腐蚀两种。
(2)铁被腐蚀的速率由快到慢的顺序是________(填序号)。
(3)请你为以下钢铁制品选择适当的防锈方法。
A.健身器材__________________________________________;
B.自行车的链条、齿轮________________________________;
C.海水中的轮船______________________________________。
【答案】(1)化学 电化学 (2)①>③>②
(3)涂油漆 涂油脂 焊接锌块
四、原理综合题。
22、)(1)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的摩尔燃烧焓△H1= - 2220 kJ/mol,正丁烷的摩尔燃烧焓△H2= -2878 kJ/ mol;异丁烷的摩尔燃烧焓△H3= -2869.6 kJ/mol。
①下列有关说法不正确的是_______________ (填标号)。
A 奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B 异丁烷分子中的碳氢键比正丁烷的多
C 正丁烷比异丁烷稳定
②已知1 mol H2燃烧生成液态水放出的热量是285. 8 kJ,现有6 mol由氢气和丙烷组成的混合气体,完全燃烧时放出的热量是3649 kJ,则该混合气体中氢气和丙烷的体积比为____ 。
(2)利用氢气可以制取工业原料乙酸。已知:
Ⅰ.CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH=-870.3 kJ·mol-1
Ⅱ.C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
Ⅲ.H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
①相同质量的CH3COOH、C、H2完全燃烧时,放出热量最多的是______________。
②利用上述信息计算反应:2C(s)+2H2(g)+O2(g)===CH3COOH(l) ΔH=_________ kJ·mol-1。
(3)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应 A:4HCl+O22Cl2+2H2O
已知:ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.
写出此条件下反应A的热化学方程式是_______________________________。
【答案】(1)BC 5:1 (2)H2 -488.3
(3)4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH=-115.6kJ/mol
鲁科版(2019)第1章 化学反应与能量转化
一、选择题。(18题)
1、下列关于能量变化的说法正确的是( )
A.相同质量的水和冰相比较,冰的能量高
B.化学反应过程中能量的变化只有吸热和放热两种表现形式
C.化学反应既遵循质量守恒,也遵循能量守恒
D.需要加热才能发生的反应一定是吸热反应
2、a、b、c、d均大于0,下列表示物质摩尔燃烧焓的热化学方程式的是( )
A.
B.
C.
D.
3、我国科学家开发出了一种锌—一氧化氮电池系统,该电池具有同的合成氨和对外供电的功能,其工作原理如图所示,下列说法中错误的是( )
A.电极电势:电极电极
B.电极的反应式为
C.电池工作一段时间后,正极区溶液的减小
D.电子流向:电极→负载电极
4、全钒液流储能电池一次性充电后,续航能力可达1000 km,而充电时间只需3~5 min,被誉为“完美电池”,其原理如图所示(已知V2+呈紫色,V3+呈绿色)。电池放电时,左槽溶液质量增加。下列说法正确的是( )
A.放电时的正极反应为V3++e-=V2+
B.放电过程中,右槽溶液由紫色变为绿色
C.充电时的电流方向由B电极流向A电极
D.充电时的阴极反应为VO2++2H++e-=VO2++H2O
5、如图所示,三个烧杯中盛有足量的电解质溶液,a、b、c、d、e均为石墨电极,通电一段时间后,a电极上有红色物质析出。下列说法正确的是( )
A.e电极上可以析出使湿润的淀粉 KI试纸变蓝的气体
B.c电极周围的溶液变红
C.A烧杯中溶液的pH升高
D.B烧杯中加一定量的KCl固体可使溶液恢复原状
6、电解池的阳极电极材料一定( )
A.发生氧化反应 B.与电源正极相连
C.是铂电极 D.失电子
7、下列事实不能用原电池原理解释的是( )
A.白铁(镀锌)制品比一般铁器耐腐蚀
B.铁片、铝片在冷的浓硫酸中钝化
C.工程施工队在铁制水管外刷一层“银粉”
D.纯锌与稀硫酸反应时,滴入少量溶液后反应速率加快
8、为了抵御海水的侵蚀,往往会在船体上安装大型的锌块,利用原电池反应:2Zn+2H2O+O2 = 2Zn(OH)2,下列说法正确的是( )
A.锌块作为原电池的负极,发生还原反应而被腐蚀
B.海水中的电解质如NaCl起到了导电的作用
C.正极的电极反应式为:Zn - 2e-=Zn2+
D.实际应用中,需用锌块覆满船体,完全隔绝海水以防止钢铁被腐蚀
9、已知某化学反应A2(g)+2B2(g)═2AB2(g)(AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中不正确的是( )
A.该反应的反应物的总焓小于反应产物的总焓
B.断裂4molA-B键要吸收E2kJ能量
C.该反应的△H=(E1-E2)kJ/mol
D.该反应中反应物的键能总和小于生成物的键能总和
10、某同学设计了如图所示的盐桥式原电池,下列说法正确的是( )
A.X若为Fe、Y可以为Na2SO4溶液
B.X若为Cu、Y可以为AgNO3溶液
C.电子由X电极经盐桥流向Ag电极
D.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
11、下列过程需要通电才能进行的是( )
①电离 ②电解 ③电镀 ④电化学腐蚀
A.②③ B.①② C.②④ D.全部
12、用电渗析法可将含硝酸钠的废水再生为硝酸和氢氧化钠,其装置如图所示。下列叙述不正确的( )
A.膜a、膜c分别是阴离子交换膜、阳离子交换膜
B.阳极室、阴极室的产品分别是氢氧化钠、硝酸
C.阳极的电极反应式为2H2O-4e—=4H++O2↑
D.该装置工作时,电路中每转移0.2 mol 电子,两极共生成气体3.36L(标准状况)
13、已知:①
②
③
则反应的等于( )
A. B.
C. D.
14、(双选)某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )
A.a为O2,b为CH4 B.向负极移动
C.此电池在常温时也能工作 D.正极的电极反应式为2CO2+O2+4e-=2
15、某溶液中含有Cu2+、Fe2+、Mg2+、Cl-、NO3-,用石墨作电极进行电解时,肯定得不到的产物是( )
A.Cl2 B.Mg C.Cu D.H2
16、下列有关金属腐蚀的说法中正确的是( )
A.钢铁闸门接在电源的负极上,此方法称为牺牲阳极的阴极保护法
B.电化学腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程
C.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈
D.金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生
17、键能是气态基态原子形成1 mol化学键释放的最低能量。根据图中的能量关系,可求得C-H键的键能为( )
A.377 kJ/mol B.414 kJ/mol C.235 kJ/mol D.197 kJ/mol
18、中科院某课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料获得能量。下列说法中正确的是( )
A.a极为正极
B.随着反应不断进行,负极区的pH不断增大
C.b极电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
D.消耗0.01mol葡萄糖,电路中转移0.02mol电子
二、填空题。(3题)
19、某兴趣小组为研究原电池原理,设计如图甲乙两个原电池装置。
(1)如图甲,a和b用导线连接,Cu电极的电极反应式为:________,溶液中SO移向______(填“Cu”或“Fe”)极。
(2)如图乙所示的原电池装置中,负极材料是_____。正极上能够观察到的现象是_______________。 负极的电极反应式是_________________。原电池工作一段时间后,若消耗负极5.4g,则放出气体______mol。
20、金属腐蚀现象在生产生活中普遍存在,依据下列2种腐蚀现象回答下列问题:
(1)图1,被腐蚀的金属为____,其腐蚀类型属于____(填字母)。图2,金属腐蚀类型属于____(填字母)。
A.化学腐蚀 B.电化学腐蚀 C.析氢腐蚀 D.吸氧腐蚀
(2)图1中Cu的作用是______,结合电极反应、电子移动、离子移动等,分析金属被腐蚀的原理______。
(3)图2中铁的生锈过程:Fe→Fe(OH)2→Fe(OH)3→Fe2O3·nH2O,将Fe转变为Fe(OH)2的反应补充完整:正极反应为_______,负极反应为______,总反应为
___ _ 。
(4)下列防止铁制品生锈的措施合理的是__________。
A.在铁闸门表面涂油漆
B.在地下铁管道上安装若干镁合金
C.将铁罐与浓硫酸等强氧化剂接触,使之发生钝化
21、如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中。请回答:
(1)金属腐蚀主要分为________腐蚀和________腐蚀两种。
(2)铁被腐蚀的速率由快到慢的顺序是________(填序号)。
(3)请你为以下钢铁制品选择适当的防锈方法。
A.健身器材__________________________________________;
B.自行车的链条、齿轮________________________________;
C.海水中的轮船______________________________________。
四、原理综合题。
22、)(1)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的摩尔燃烧焓△H1= - 2220 kJ/mol,正丁烷的摩尔燃烧焓△H2= -2878 kJ/ mol;异丁烷的摩尔燃烧焓△H3= -2869.6 kJ/mol。
①下列有关说法不正确的是_______________ (填标号)。
A 奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B 异丁烷分子中的碳氢键比正丁烷的多
C 正丁烷比异丁烷稳定
②已知1 mol H2燃烧生成液态水放出的热量是285. 8 kJ,现有6 mol由氢气和丙烷组成的混合气体,完全燃烧时放出的热量是3649 kJ,则该混合气体中氢气和丙烷的体积比为____ 。
(2)利用氢气可以制取工业原料乙酸。已知:
Ⅰ.CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH=-870.3 kJ·mol-1
Ⅱ.C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
Ⅲ.H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
①相同质量的CH3COOH、C、H2完全燃烧时,放出热量最多的是______________。
②利用上述信息计算反应:2C(s)+2H2(g)+O2(g)===CH3COOH(l) ΔH=_________ kJ·mol-1。
(3)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应 A:4HCl+O22Cl2+2H2O
已知:ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.
写出此条件下反应A的热化学方程式是_______________________________。
2023—2024学年上学期高二化学鲁科版(2019)选择性必修一第1章 化学反应与能量转化 章末练习含答案
鲁科版(2019)第1章 化学反应与能量转化
一、选择题。(18题)
1、下列关于能量变化的说法正确的是( )
A.相同质量的水和冰相比较,冰的能量高
B.化学反应过程中能量的变化只有吸热和放热两种表现形式
C.化学反应既遵循质量守恒,也遵循能量守恒
D.需要加热才能发生的反应一定是吸热反应
【答案】C
2、a、b、c、d均大于0,下列表示物质摩尔燃烧焓的热化学方程式的是( )
A.
B.
C.
D.
【答案】B
3、我国科学家开发出了一种锌—一氧化氮电池系统,该电池具有同的合成氨和对外供电的功能,其工作原理如图所示,下列说法中错误的是( )
A.电极电势:电极电极
B.电极的反应式为
C.电池工作一段时间后,正极区溶液的减小
D.电子流向:电极→负载电极
【答案】C
4、全钒液流储能电池一次性充电后,续航能力可达1000 km,而充电时间只需3~5 min,被誉为“完美电池”,其原理如图所示(已知V2+呈紫色,V3+呈绿色)。电池放电时,左槽溶液质量增加。下列说法正确的是( )
A.放电时的正极反应为V3++e-=V2+
B.放电过程中,右槽溶液由紫色变为绿色
C.充电时的电流方向由B电极流向A电极
D.充电时的阴极反应为VO2++2H++e-=VO2++H2O
【答案】B
5、如图所示,三个烧杯中盛有足量的电解质溶液,a、b、c、d、e均为石墨电极,通电一段时间后,a电极上有红色物质析出。下列说法正确的是( )
A.e电极上可以析出使湿润的淀粉 KI试纸变蓝的气体
B.c电极周围的溶液变红
C.A烧杯中溶液的pH升高
D.B烧杯中加一定量的KCl固体可使溶液恢复原状
【答案】B
6、电解池的阳极电极材料一定( )
A.发生氧化反应 B.与电源正极相连
C.是铂电极 D.失电子
【答案】B
7、下列事实不能用原电池原理解释的是( )
A.白铁(镀锌)制品比一般铁器耐腐蚀
B.铁片、铝片在冷的浓硫酸中钝化
C.工程施工队在铁制水管外刷一层“银粉”
D.纯锌与稀硫酸反应时,滴入少量溶液后反应速率加快
【答案】B
8、为了抵御海水的侵蚀,往往会在船体上安装大型的锌块,利用原电池反应:2Zn+2H2O+O2 = 2Zn(OH)2,下列说法正确的是( )
A.锌块作为原电池的负极,发生还原反应而被腐蚀
B.海水中的电解质如NaCl起到了导电的作用
C.正极的电极反应式为:Zn - 2e-=Zn2+
D.实际应用中,需用锌块覆满船体,完全隔绝海水以防止钢铁被腐蚀
【答案】B
9、已知某化学反应A2(g)+2B2(g)═2AB2(g)(AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中不正确的是( )
A.该反应的反应物的总焓小于反应产物的总焓
B.断裂4molA-B键要吸收E2kJ能量
C.该反应的△H=(E1-E2)kJ/mol
D.该反应中反应物的键能总和小于生成物的键能总和
【答案】D
10、某同学设计了如图所示的盐桥式原电池,下列说法正确的是( )
A.X若为Fe、Y可以为Na2SO4溶液
B.X若为Cu、Y可以为AgNO3溶液
C.电子由X电极经盐桥流向Ag电极
D.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
【答案】B
11、下列过程需要通电才能进行的是( )
①电离 ②电解 ③电镀 ④电化学腐蚀
A.②③ B.①② C.②④ D.全部
【答案】A
12、用电渗析法可将含硝酸钠的废水再生为硝酸和氢氧化钠,其装置如图所示。下列叙述不正确的( )
A.膜a、膜c分别是阴离子交换膜、阳离子交换膜
B.阳极室、阴极室的产品分别是氢氧化钠、硝酸
C.阳极的电极反应式为2H2O-4e—=4H++O2↑
D.该装置工作时,电路中每转移0.2 mol 电子,两极共生成气体3.36L(标准状况)
【答案】B
13、已知:①
②
③
则反应的等于( )
A. B.
C. D.
【答案】B
14、(双选)某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )
A.a为O2,b为CH4 B.向负极移动
C.此电池在常温时也能工作 D.正极的电极反应式为2CO2+O2+4e-=2
【答案】BD
15、某溶液中含有Cu2+、Fe2+、Mg2+、Cl-、NO3-,用石墨作电极进行电解时,肯定得不到的产物是( )
A.Cl2 B.Mg C.Cu D.H2
【答案】B
16、下列有关金属腐蚀的说法中正确的是( )
A.钢铁闸门接在电源的负极上,此方法称为牺牲阳极的阴极保护法
B.电化学腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程
C.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈
D.金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生
【答案】D
17、键能是气态基态原子形成1 mol化学键释放的最低能量。根据图中的能量关系,可求得C-H键的键能为( )
A.377 kJ/mol B.414 kJ/mol C.235 kJ/mol D.197 kJ/mol
【答案】B
18、中科院某课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料获得能量。下列说法中正确的是( )
A.a极为正极
B.随着反应不断进行,负极区的pH不断增大
C.b极电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
D.消耗0.01mol葡萄糖,电路中转移0.02mol电子
【答案】D
二、填空题。(3题)
19、某兴趣小组为研究原电池原理,设计如图甲乙两个原电池装置。
(1)如图甲,a和b用导线连接,Cu电极的电极反应式为:________,溶液中SO移向______(填“Cu”或“Fe”)极。
(2)如图乙所示的原电池装置中,负极材料是_____。正极上能够观察到的现象是_______________。 负极的电极反应式是_________________。原电池工作一段时间后,若消耗负极5.4g,则放出气体______mol。
【答案】2H++2e-=H2↑ Fe Al 产生气泡
Al-3e- +4OH-=AlO+ 2H2O 0.3
20、金属腐蚀现象在生产生活中普遍存在,依据下列2种腐蚀现象回答下列问题:
(1)图1,被腐蚀的金属为____,其腐蚀类型属于____(填字母)。图2,金属腐蚀类型属于____(填字母)。
A.化学腐蚀 B.电化学腐蚀 C.析氢腐蚀 D.吸氧腐蚀
(2)图1中Cu的作用是______,结合电极反应、电子移动、离子移动等,分析金属被腐蚀的原理______。
(3)图2中铁的生锈过程:Fe→Fe(OH)2→Fe(OH)3→Fe2O3·nH2O,将Fe转变为Fe(OH)2的反应补充完整:正极反应为_______,负极反应为______,总反应为
___ _ 。
(4)下列防止铁制品生锈的措施合理的是__________。
A.在铁闸门表面涂油漆
B.在地下铁管道上安装若干镁合金
C.将铁罐与浓硫酸等强氧化剂接触,使之发生钝化
【答案】铁或Fe BC BD 做正极材料,导电 铜做正极,氢离子在内电路移向正极,得到电子,生成氢气;铁做负极,在外电路失去电子,电子从负极移向正极,金属铁被腐蚀成亚铁离子。 O2+4e-+2H2O=4OH- 2Fe-4e-=2Fe2+ 2Fe+O2+2H2O=2Fe(OH)2 ABC
21、如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中。请回答:
(1)金属腐蚀主要分为________腐蚀和________腐蚀两种。
(2)铁被腐蚀的速率由快到慢的顺序是________(填序号)。
(3)请你为以下钢铁制品选择适当的防锈方法。
A.健身器材__________________________________________;
B.自行车的链条、齿轮________________________________;
C.海水中的轮船______________________________________。
【答案】(1)化学 电化学 (2)①>③>②
(3)涂油漆 涂油脂 焊接锌块
四、原理综合题。
22、)(1)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的摩尔燃烧焓△H1= - 2220 kJ/mol,正丁烷的摩尔燃烧焓△H2= -2878 kJ/ mol;异丁烷的摩尔燃烧焓△H3= -2869.6 kJ/mol。
①下列有关说法不正确的是_______________ (填标号)。
A 奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B 异丁烷分子中的碳氢键比正丁烷的多
C 正丁烷比异丁烷稳定
②已知1 mol H2燃烧生成液态水放出的热量是285. 8 kJ,现有6 mol由氢气和丙烷组成的混合气体,完全燃烧时放出的热量是3649 kJ,则该混合气体中氢气和丙烷的体积比为____ 。
(2)利用氢气可以制取工业原料乙酸。已知:
Ⅰ.CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH=-870.3 kJ·mol-1
Ⅱ.C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
Ⅲ.H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
①相同质量的CH3COOH、C、H2完全燃烧时,放出热量最多的是______________。
②利用上述信息计算反应:2C(s)+2H2(g)+O2(g)===CH3COOH(l) ΔH=_________ kJ·mol-1。
(3)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应 A:4HCl+O22Cl2+2H2O
已知:ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.
写出此条件下反应A的热化学方程式是_______________________________。
【答案】(1)BC 5:1 (2)H2 -488.3
(3)4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH=-115.6kJ/mol
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
