1.1化学反应的热效应同步练习(含解析)2023-2024学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.1化学反应的热效应同步练习(含解析)2023-2024学年高二化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 940.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-08 00:00:00 | ||
图片预览




文档简介
1.1化学反应的热效应同步练习
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.已知铝在空气中会生成一层致密的氧化膜(),该氧化膜可与稀盐酸发生反应:。实验小组将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,结果如图。下列说法不正确的是
A.反应过程中有热量放出 B.0~50s,发生稀盐酸与的反应
C.50s时,溶液中溶质为 D.100~140s,压强减小是因为温度降低
2.已知I.碳碳双键加氢时总要放出热量,并且放出的热量与碳碳双键的数目大致成正比;
II.1,3-环己二烯( )脱氢生成苯是放热反应。相同温度和压强下,关于反应的,下列判断正确的是
① ②
③ ④
A., B.
C., D.
3.一定条件下已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量;②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量;③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量。则1mol H2和1mol Cl2完全反应放出的热量是
A.183kJ B.248kJ C.679kJ D.862kJ
4.在25℃、101KPa的条件下,下列热化学方程式书写正确的是
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g);ΔH=-1367.0kJ·mol-1(燃烧热)
B.2NO2=O2+2NO;ΔH=+116.2kJ·mol-1
C.S(s)+O2(g)=SO2(g);ΔH=+296.8kJ·mol-1
D.H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l)ΔH=-57.3kJ·mol-1
5.已知:1mol (g)和1mol (g)生成2mol HF(g)的反应热,下列说法正确的是
A.1mol (g)与1mol (g)反应生成2mol HF(l)放出的热量小于5466kJ
B.在相同条件下,1mol (g)与1mol (g)的能量总和大于2mol HF(g)的能量
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用上图来表示
6.已知:①,其反应过程与能量变化如图所示。
②
断开共价键所需能量 460 500 176
下列说法正确的是
A.晶体硅光伏发电是将化学能转化为电能 B.二氧化硅的稳定性弱于硅的稳定性
C. D.
7.一定温度下,的氯化、溴化反应势能图及产物选择性如下图所示,下列叙述正确的是
A.稳定性:
B.(表示键能)
C.的溴化反应达到平衡时,升高温度,可以提高产物中溴丙烷的比例
D.以为原料合成丙醇时,应该选用氯化反应,然后再水解
8.雷诺舞梅甘娜(Megane)使用了与生物燃料(生物乙醇和生物柴油)兼容的引擎。乙醇燃料是一种清洁的能源燃料,298K时,燃烧a g乙醇(液态)生成气体和液态,放出热量为Q,经测定a g乙醇与足量钠反应能生成 5.6L(标准状况),则乙醇燃烧的热化学方程式表示正确的是
A.
B.
C.
D.
9.根据下图所示的过程中的能量变化情况,判断下列说法正确的是
A.H2(g)转化为氢原子是一个放热过程
B.1mol H2和1mol Cl2的总能量比2mol HCl的总能量低
C.1个HCl(g)分子中的化学键断裂时需要吸收431kJ能量
D.1mol H2(g)和1mol Cl2(g)反应生成2mol HCl(g)的反应热ΔH=-183 kJ·mol-1
10.下列有关图像的描述错误的是(已知图像中a、b均大于0)
A.图甲中反应为放热反应,
B.图乙表征金刚石转化为石墨过程中的能量变化,石墨比金刚石稳定
C.图丙中断开反应物中化学键所需能量低于形成生成物中化学键所释放能量,所示反应的热化学方程式为N2(g)+O2(g)=2NO(g) ΔH =+bKJ/mol
D.图丁是2A(g)B(g)的能量变化示意图,则2A(g)B(l)
11.下列依据热化学方程式得出的结论正确的是
A.已知:正丁烷异丁烷,则正丁烷比异丁烷稳定
B.已知:,则的标准燃烧热
C.已知:;,则
D.已知:,则稀和稀完全反应生成时,放出热量
12.下列有关化学反应与能量变化的说法不正确的是
A.化学反应热效应数值与参加反应的物质多少有关
B.101KPa时,1g氢气完全燃烧生成液态水时所放出的热量称为氢气的燃烧热
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.化学反应过程中的能量变化除了热能外,也可以是光能、电能等
13.某同学利用如图所示装置探究溶液与稀盐酸反应的热效应,进行了三次实验,数据如表所示。忽略溶解、逸出时的能量变化,逸出的的质量也忽略不计,混合溶液的密度视为,若反应后混合溶液的比热容,下列说法正确的是
实验序号 稀盐酸 反应后最高温度/℃
体积/mL 反应前温度/℃ 体积/mL 反应前温度/℃
1 50 19.1 60 19.1 19.8
2 50 19.1 60 19.3 19.9
3 50 19.2 60 19.2 21.7
A.用铜质的搅拌器会使所测偏小
B.分批加入盐酸会使实验结果更准确
C.测量溶液的温度后可直接测盐酸温度
D.
14.是一种重要的化工原料,可用乙烷()在高温条件下与水蒸气反应制得。已知:
① ;
② ;
③ 。
下列由和水蒸气在高温下反应得到和CO的热化学方程式正确的是
A.
B.
C.
D.
15.已知丙烯(,气态)的燃烧热,环丙烷(,气态)的燃烧热,下列热化学方程式或叙述正确的是
A.(g)+O2(g)=3CO2(g)+3H2O(g)
B.(g)+3O2(g)=3CO(g)+3H2O(l)
C.丙烯比环丙烷稳定
D. (g)(g)
二、实验题
16.用溶液与溶液在如图所示的装置中进行反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的重要仪器为 。
(2)已知:中和后生成的溶液的比热容c为4.18J/(g ℃),溶液的密度均为,某学习小组三次实验测得温度平均升高3.4℃。写出该反应表示中和热的热化学方程式: 。
(3)实验中若用溶液跟溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”);若用醋酸代替溶液进行上述实验,测得反应放出的热量 (填“变大”“变小”或“无影响”)。
(4)中和热测定实验中,下列操作能保证实验准确性的是 (填字母)。
a.为节省时间,只做一次实验
b.两烧杯夹层间碎纸条没有填满
c.记录混合液的最高温度作为终止温度
d.用铁制容器代替烧杯进行实验
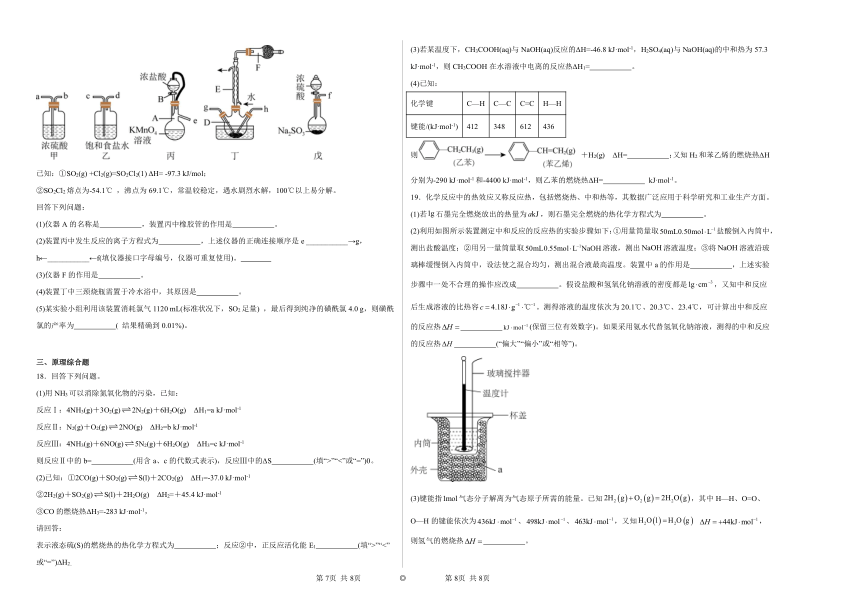
17.磺酰氯( SO2Cl2 )可用于制造锂电池正极活性物质。实验室可利用SO2和Cl2在活性炭催化下反应制取少量SO2Cl2,装置如图(部分夹持装置已省略)。
已知:①SO2(g) +Cl2(g)=SO2Cl2(1) ΔH= -97.3 kJ/mol;
②SO2Cl2熔点为-54.1℃ ,沸点为69.1℃,常温较稳定,遇水剧烈水解,100℃以上易分解。
回答下列问题:
(1)仪器A的名称是 ,装置丙中橡胶管的作用是 。
(2)装置丙中发生反应的离子方程式为 ,上述仪器的正确连接顺序是e ___________→g,h←___________←f(填仪器接口字母编号,仪器可重复使用)。
(3)仪器F的作用是 。
(4)装置丁中三颈烧瓶需置于冷水浴中,其原因是 。
(5)某实验小组利用该装置消耗氯气1120 mL(标准状况下,SO2足量) ,最后得到纯净的磺酰氯4.0 g,则磺酰氯的产率为 ( 结果精确到0.01%)。
三、原理综合题
18.回答下列问题。
(1)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g)2N2(g)+6H2O(g) ΔH1=a kJ·mol-1
反应Ⅱ:N2(g)+O2(g)2NO(g) ΔH2=b kJ·mol-1
反应Ⅲ:4NH3(g)+6NO(g)5N2(g)+6H2O(g) ΔH3=c kJ·mol-1
则反应Ⅱ中的b= (用含a、c的代数式表示),反应Ⅲ中的ΔS (填“>”“<”或“=”)0。
(2)已知:①2CO(g)+SO2(g)S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
②2H2(g)+SO2(g)S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
③CO的燃烧热ΔH3=-283 kJ·mol-1,
请回答:
表示液态硫(S)的燃烧热的热化学方程式为 ;反应②中,正反应活化能E1 (填“>”“<”或“=”)ΔH2。
(3)若某温度下,CH3COOH(aq)与NaOH(aq)反应的ΔH=-46.8 kJ·mol-1,H2SO4(aq)与NaOH(aq)的中和热为57.3 kJ·mol-1,则CH3COOH在水溶液中电离的反应热ΔH1= 。
(4)已知:
化学键 C—H C—C C=C H—H
键能/(kJ·mol-1) 412 348 612 436
则 +H2(g) ΔH= ;又知H2和苯乙烯的燃烧热ΔH分别为-290 kJ·mol-1和-4400 kJ·mol-1,则乙苯的燃烧热ΔH= kJ·mol-1。
19.化学反应中的热效应又称反应热,包括燃烧热、中和热等,其数据广泛应用于科学研究和工业生产方面。
(1)若石墨完全燃烧放出的热量为,则石墨完全燃烧的热化学方程式为 。
(2)利用如图所示装置测定中和反应的反应热的实验步骤如下:①用量筒量取盐酸倒入内筒中,测出盐酸温度;②用另一量筒量取溶液,测出溶液温度;③将溶液沿玻璃棒缓慢倒入内筒中,设法使之混合均匀,测出混合液最高温度。装置中a的作用是 ,上述实验步骤中一处不合理的操作应改成 。假设盐酸和氢氧化钠溶液的密度都是,又知中和反应后生成溶液的比热容。测得溶液的温度依次为20.1℃、20.3℃、23.4℃,可计算出中和反应的反应热 (保留三位有效数字)。如果采用氨水代替氢氧化钠溶液,测得的中和反应的反应热 (“偏大”“偏小”或“相等”)。
(3)键能指气态分子解离为气态原子所需的能量。已知,其中H—H、O=O、O—H的键能依次为、、,又知 ,则氢气的燃烧热 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.由图示可知,反应的过程中温度升高,反应过程中有热量放出,故A正确;
B.氧化铝覆盖在铝的表面,由图示可知,0~50s,压强未增大,无气体产生,则发生稀盐酸与的反应,故B正确;
C.50s时,盐酸未反应完,溶液中溶质为、HCl,故C错误;
D.100~140s,反应停止了,压强减小是因为温度降低,故D正确;
答案选C。
2.C
【详解】A.反应①和②都是和氢气加成,是放热反应,所以ΔH1<0,ΔH2<0,故A错误;
B.将反应①和②相加不能得到反应③,所以ΔH3≠ΔH1+ΔH2,故B错误;
C.反应①和②都是放热反应,ΔH<0,根据已知,加氢放出的热量与碳碳双键的数目大致成正比,所以ΔH1>ΔH2;反应④是1,3-环己二烯脱氢生成苯的逆反应,是吸热反应,所以ΔH4>0,所以ΔH2<ΔH4,故C正确;
D.由已知方程式可知,ΔH3=ΔH2+ΔH4,故D错误;
答案选C。
3.A
【详解】1mol H2和1mol Cl2完全反应生成2mol HCl的焓变,等于反应物的总键能减去生成物的总键能,即 H=436kJ/mol +243kJ/mol -2×431kJ/mol =-183kJ/mol,所以1mol H2和1mol Cl2完全反应放出的热量是183kJ,故选A。
4.D
【详解】A.燃烧热要求产物中水为液态,A错误;
B.热化学方程式中,应该注明反应物和生成物的聚集状态,B错误;
C.该反应为放热反应,反应热为负值,C错误;
D.该选项为正确的热化学方程式,D正确;
故选D。
5.B
【详解】A.1mol (g)与1mol (g)反应生成2mol HF(l)放出的热量大于546.6kJ,选项A错误;
B.该反应为放热反应,在相同条件下,1mol (g)与1mol (g)的能量总和大于2mol HF(g)的能量,选项B正确;
C.该反应为放热反应,故反应的逆反应是吸热反应,选项C错误;
D.图像表示,是吸热反应,选项D错误;
答案选B。
6.C
【详解】A.晶体硅光伏发电是将太阳能转化为电能,故A不符合题意;
B.根据化学键的键能判断,断裂1mol二氧化硅中的Si-O键需要的能量为4×460kJ=1840kJ,断裂1mol晶体硅中的Si-Si键需要的能量为2×176=354kJ,所以二氧化硅稳定性大于硅的稳定性,故B不符合题意;
C.,故C符合题意;
D.根据图中可知,,故D不符合题意;
故选:C
7.B
【详解】A.由于能量越低越稳定,由图可知,更稳定,选项A错误;
B.由图可知,①,,根据盖斯定律②-①得到,同时,由键能数据可知,,选项B正确;
C.由于,所以升高温度,平衡正向移动,故可以提高产物中溴丙烷的比例,选项C错误;
D.由图可知,溴化反应的产率为,明显高于氯化反应的,故以为原料合成丙醇时,应该选用澳化反应,然后再水解,选项D错误;
答案选B。
8.D
【详解】a g乙醇与足量钠反应能生成 5.6L(标准状况气体物质的量为0.25mol),根据,说明a g乙醇物质的量为0.5mol,根据298K时,燃烧a g乙醇(液态)生成气体和液态,放出热量为Q,则1mol乙醇(液态)生成气体和液态,放出热量为2Q,其热化学方程式 ,故D正确。
综上所述,答案为D。
9.D
【分析】由图中信息可知,氢气与氯气反应生成氯化氢气体的热化学方程式为H2(g)+Cl2(g)=2HCl(g) ΔH=436 kJ·mol-1+243kJ·mol-1-431kJ·mol-1×2=-183 kJ·mol-1。
【详解】A.H2(g)转化为氢原子时,需要断裂共价键,所以该过程是一个吸热过程,A不正确;
B.氢气与氯气反应生成氯化氢气体的热化学方程式为H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1,则1mol H2和1mol Cl2的总能量比2mol HCl的总能量高,B不正确;
C.图中信息显示,1molHCl(g)分子中的化学键断裂时需要吸收431kJ能量,则1个HCl(g)分子中的化学键断裂时需要吸收kJ能量,C不正确;
D.由热化学方程式H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1可知,1mol H2(g)和1mol Cl2(g)反应生成2mol HCl(g)的反应热ΔH=-183 kJ·mol-1,D正确;
故选D。
10.C
【详解】A.ΔH=正反应活化能-逆反应活化能=(Ek-Ek′)kJ mol-1,故A正确;
B.由图可知,金刚石的能量高于石墨,则石墨比金刚石稳定,故B正确;
C.由图可知,该反应为吸热反应,反应的热化学方程式为N2(g)+O2(g)=2NO(g)ΔH=+bkJ mol-1,故C错误;
D.等量B(g)能量高于B(l),则2A(g) B(l)ΔH<-akJ mol-1,故D正确;
故选:C。
11.C
【详解】A.该反应为放热反应,E(正丁烷)>E(异丁烷)。能量越低,物质越稳定,稳定性:异丁烷>正丁烷,A项错误;
B.燃烧热指1mol燃料与O2完全反应生成CO2与H2O(l),而该反应中生成的气态水H2O,所以1478.8kJ/mol不是燃烧热,B项错误;
C.这两个反应均是放热反应,S(g)完全燃烧时放热更多,ΔH的比较带符号比较,反应放出的热量越多ΔH越小,故 ΔH1>ΔH2,C项正确;
D.Ba(OH)2与H2SO4完全反应除了中和以外,还包含了Ba2+与硫酸根沉淀放出的热量,所有放出的热量比57.3更多,D项错误;
故选:C。
12.B
【详解】A.一个化学反应,热化学方程式可以写无数个,但焓变与化学计量数的比值是定值,参加反应的物质的量不同,热效应的数值不同,所以化学反应热效应数值与参加反应的物质多少有关,A正确;
B.101KPa时,1g氢气完全燃烧生成液态水时所放出的热量称为氢气的热值,1mol氢气完全燃烧生成液态水时所放出的热量称为氢气的燃烧热,B不正确;
C.应用盖斯定律,将已知热化学方程式调整化学计量数后进行相加减,可计算某些难以直接测量的反应的焓变,C正确;
D.能量通常表现为热能、电能、光能等,化学反应过程中除了产生热能外,也可以产生光能、电能等,D正确;
故选B。
13.D
【详解】A.铜会散热,用铜质的搅拌器会使所测的热量偏小,偏大,A错误;
B. 要确保热量不散失,故应一次性迅速加入盐酸,B错误;
C.测量溶液的温度后若直接测盐酸温度,碳酸钠和盐酸反应会导致热量散失,会使所测的热量偏小,偏大,C错误;
D. 3次实验温度差分别为0.7℃、0.7℃、2.5℃,第三次数据偏差大舍去,取平均温差为0.7℃,从数据知,盐酸略过量,生成0.015mol的二氧化碳,则放出热量, 则得 ,D正确;
答案选D。
14.C
【详解】根据盖斯定律,由③-①×-②×2可得C2H6(g)+2H2O(g)=2CO(g)+5H2(g) ΔH=-1258 kJ·mol-1-(-484 kJ·mol-1)×-2×(-283.0 kJ·mol-1)=+518kJ·mol-1。
故答案选C。
15.C
【详解】A.丙烯(,气态)的燃烧热,应该是生成液态水,故A错误;
B.环丙烷(,气态)的燃烧热,则热化学方程式为(g)+O2(g)=3CO2(g)+3H2O(l) ,故B错误;
C.丙烯(,气态)的燃烧热,环丙烷(,气态)的燃烧热,则环丙烷放出的热量多,丙烯能量低,根据能量越低稳定,因此丙烯比环丙烷稳定,故C正确;
D.根据C选项环丙烷放出的热量多,说明丙烯能量低,即(g)(g) ,故D错误。
综上所述,答案为C。
16.(1)温度计
(2)
(3) 不相等 相等 变小
(4)c
【分析】中和热是在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时所释放的热量;中和热测定实验中一定注意使用稀的强酸强碱反应,并注意实验进行要迅速、保温效果要好,尽可能减少热量损失。
【详解】(1)根据量热计的构造可知,该装置缺少的仪器是温度计;
(2)中和热是在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时所释放的热量;反应放出的热量Q=3.4℃×4.18J/(g·℃)×1g/cm3×100mL=1.421kJ,,故热化学方程式为: ;
(3)反应放出的热量和所用酸以及碱的量有关,若用溶液跟溶液反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热为稀的强酸和强碱溶液反应生成1mol水时放出的热量,与酸碱的用量无关,因此中和热相等;醋酸为弱酸,电离会吸热,故若用醋酸代替溶液进行上述实验,测得反应放出的热量变小;
(4)a.为节省时间,只做一次实验,会造成实验误差大,应重复几次,以减少实验误差,a错误;
b.两烧杯夹层间碎纸条没有填满,保温效果不好,实验误差大,b错误;
c.最高温度为恰好反应时的温度,记录混合液的最高温度作为终止温度,可减少实验误差,提高实验准确性,c正确;
d.铁的导热性好,用铁制容器代替烧杯进行实验,热量散失多,实验误差大,d错误;
答案选c。
17.(1) 蒸馏烧瓶 平衡分液漏斗内外压强,便于液体顺利流下
(2) 2+10Cl-+16H+=2Mn2++5Cl2↑+8H2O e→c→d→a→b→g,h←b←a←f
(3)吸收未反应的Cl2、SO2,同时防止空气中的水蒸气进入冷凝管内
(4)制备SO2Cl2的反应为放热反应,温度过高易气化且易分解
(5)59.26%
【分析】丙装置制备氯气,戊装置制备二氧化硫,二氧化硫与氯气在丁中反应生成SO2Cl2,丁中活性炭可能起催化剂作用,SO2Cl2遇水发生剧烈的水解反应,甲为干燥二氧化硫装置,乙是饱和食盐水,降低氯气溶解度,甲也可干燥氯气,SO2Cl2沸点低、易挥发,B为冷凝管,使挥发的产物SO2Cl2冷凝回流,碱石灰吸收未反应的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止进入C中导致磺酰氯水解。
【详解】(1)根据仪器的构造可知,仪器A的名称是蒸馏烧瓶,当分液漏斗上部压强大于烧瓶内压强时,分液漏斗内液体才能顺利流下,所以橡皮管起到平衡气压,使液体顺利流下的作用,装置丙中橡胶管的作用是平衡气压,使液体顺利滴下,故答案为:蒸馏烧瓶;平衡气压,使液体顺利滴下;
(2)装置丙中高锰酸钾与浓盐酸反应生成氯化锰、氯化钾、氯气和水,发生反应的离子反应方程式为2+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,实验装置的顺序是氯气制备装置→除杂装置→干燥装置→反应装置←干燥装置←二氧化硫制备装置,上述仪器正确的连接顺序是e→c→d→a→b→g,h←b←a←f,故答案为:2+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;c→d→a→b;b←a;
(3)仪器F装有碱石灰成分是CaO和NaOH混合物,其作用是吸收SO2、Cl2,防止污染空气,同时防止水蒸气进同意使磺酰氯水解;
(4)因为制备SO2Cl2的反应为放热反应,SO2Cl2沸点低,温度过高易气化且易分解,故装置丁中三颈烧瓶置于冷水浴中,故答案为:制备SO2Cl2的反应为放热反应,SO2Cl2沸点低,温度过高易气化且易分解;
(5)标准状况1120mL氯气物质的量为,二氧化硫过量,根据反应SO2(g)+Cl2(g)=SO2Cl2,可知理论上生成0.05mol SO2Cl2,质量为m=nM=0.05mol×135g/mol=6.75g,则磺酰氯的产率为,故答案为:59.26%。
18.(1) >
(2) S(l)+O2(g)=SO2(g)ΔH=-529 kJ·mol-1 >
(3)+10.5 kJ·mol-1
(4) +124 kJ·mol-1 -4 566
【详解】(1)根据盖斯定律,由(反应Ⅰ-反应Ⅲ)÷3,得N2(g)+O2(g)2NO(g) ΔH2=kJ·mol-1.反应Ⅲ中生成物气体的物质的量大于反应物的,所以反应Ⅲ是熵增反应,ΔS>0。
(2)由已知信息③可得CO(g)+O2(g)=CO2(g) ΔH3=-283 kJ·mol-1,将该热化学方程式及已知信息①中热化学方程式依次编号为a、b,根据盖斯定律,由a×2-b得:S(l)+O2(g)=SO2(g) ΔH=(-283 kJ·mol-1)×2+37.0 kJ·mol-1=-529 kJ·mol-1;设E2为逆反应的活化能,则E1-E2=ΔH2>0,所以E1>ΔH2。
(3)醋酸和NaOH的中和反应(反应热ΔH),可以分为CH3COOH的电离(反应热ΔH1)、H+和OH-的中和(反应热ΔH2)两步,故ΔH1=ΔH-ΔH2=-46.8 kJ·mol-1-(-57.3 kJ·mol-1)=+10.5 kJ·mol-1;
(4)反应热=反应物总键能-生成物总键能,由有机物的结构可知,乙苯催化脱氢反应的反应热等于—CH2CH3的总键能与—CH=CH2、H2的总键能之差,故乙苯催化脱氢反应的ΔH=(5×412+348-3×412-612-436) kJ·mol-1=+124 kJ·mol-1,根据盖斯定律,乙苯的燃烧热ΔH=-290 kJ·mol-1+(-4 400 kJ·mol-1)+(+124 kJ·mol-1)=-4 566 kJ·mol-1。
19.(1)C(石墨,s)
(2) 隔热,减少热量损失 将溶液迅速倒入内筒中 偏大
(3)
【详解】(1)1g石墨完全燃烧生成CO2时放出热量为akJ,1moC完全燃烧放热12akJ,热化学方程式为C(石墨,s) ;
(2)装置中a为保温装置,作用是隔热,减少热量损失;反应时为了减少热量损失,需要迅速使酸碱混合反应,上述实验步骤中不合理的操作应为③,改成将溶液迅速倒入内筒中;平均温度值为 ,50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液的总质量m=100mL×1g/cm3=100g,c=4.18J/(g ℃),生成0.025mol的水放出热量Q=cm△T=4.18J/(g ℃)×100g×3.2℃=1337.6J=1.3376kJ,则该实验测得的中和热△H=;如果采用氨水代替氢氧化钠溶液,由于一水合氨的电离吸热,测得的中和反应的反应热偏大。
(3)氢气燃烧生成液态水的热化学方程式为2×+-4×-2×()=-570kJ/mol,氢气的燃烧热为1moL氢气完全燃烧生成液态水放出的热量,则氢气的燃烧热。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.已知铝在空气中会生成一层致密的氧化膜(),该氧化膜可与稀盐酸发生反应:。实验小组将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,结果如图。下列说法不正确的是
A.反应过程中有热量放出 B.0~50s,发生稀盐酸与的反应
C.50s时,溶液中溶质为 D.100~140s,压强减小是因为温度降低
2.已知I.碳碳双键加氢时总要放出热量,并且放出的热量与碳碳双键的数目大致成正比;
II.1,3-环己二烯( )脱氢生成苯是放热反应。相同温度和压强下,关于反应的,下列判断正确的是
① ②
③ ④
A., B.
C., D.
3.一定条件下已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量;②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量;③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量。则1mol H2和1mol Cl2完全反应放出的热量是
A.183kJ B.248kJ C.679kJ D.862kJ
4.在25℃、101KPa的条件下,下列热化学方程式书写正确的是
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g);ΔH=-1367.0kJ·mol-1(燃烧热)
B.2NO2=O2+2NO;ΔH=+116.2kJ·mol-1
C.S(s)+O2(g)=SO2(g);ΔH=+296.8kJ·mol-1
D.H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l)ΔH=-57.3kJ·mol-1
5.已知:1mol (g)和1mol (g)生成2mol HF(g)的反应热,下列说法正确的是
A.1mol (g)与1mol (g)反应生成2mol HF(l)放出的热量小于5466kJ
B.在相同条件下,1mol (g)与1mol (g)的能量总和大于2mol HF(g)的能量
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用上图来表示
6.已知:①,其反应过程与能量变化如图所示。
②
断开共价键所需能量 460 500 176
下列说法正确的是
A.晶体硅光伏发电是将化学能转化为电能 B.二氧化硅的稳定性弱于硅的稳定性
C. D.
7.一定温度下,的氯化、溴化反应势能图及产物选择性如下图所示,下列叙述正确的是
A.稳定性:
B.(表示键能)
C.的溴化反应达到平衡时,升高温度,可以提高产物中溴丙烷的比例
D.以为原料合成丙醇时,应该选用氯化反应,然后再水解
8.雷诺舞梅甘娜(Megane)使用了与生物燃料(生物乙醇和生物柴油)兼容的引擎。乙醇燃料是一种清洁的能源燃料,298K时,燃烧a g乙醇(液态)生成气体和液态,放出热量为Q,经测定a g乙醇与足量钠反应能生成 5.6L(标准状况),则乙醇燃烧的热化学方程式表示正确的是
A.
B.
C.
D.
9.根据下图所示的过程中的能量变化情况,判断下列说法正确的是
A.H2(g)转化为氢原子是一个放热过程
B.1mol H2和1mol Cl2的总能量比2mol HCl的总能量低
C.1个HCl(g)分子中的化学键断裂时需要吸收431kJ能量
D.1mol H2(g)和1mol Cl2(g)反应生成2mol HCl(g)的反应热ΔH=-183 kJ·mol-1
10.下列有关图像的描述错误的是(已知图像中a、b均大于0)
A.图甲中反应为放热反应,
B.图乙表征金刚石转化为石墨过程中的能量变化,石墨比金刚石稳定
C.图丙中断开反应物中化学键所需能量低于形成生成物中化学键所释放能量,所示反应的热化学方程式为N2(g)+O2(g)=2NO(g) ΔH =+bKJ/mol
D.图丁是2A(g)B(g)的能量变化示意图,则2A(g)B(l)
11.下列依据热化学方程式得出的结论正确的是
A.已知:正丁烷异丁烷,则正丁烷比异丁烷稳定
B.已知:,则的标准燃烧热
C.已知:;,则
D.已知:,则稀和稀完全反应生成时,放出热量
12.下列有关化学反应与能量变化的说法不正确的是
A.化学反应热效应数值与参加反应的物质多少有关
B.101KPa时,1g氢气完全燃烧生成液态水时所放出的热量称为氢气的燃烧热
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.化学反应过程中的能量变化除了热能外,也可以是光能、电能等
13.某同学利用如图所示装置探究溶液与稀盐酸反应的热效应,进行了三次实验,数据如表所示。忽略溶解、逸出时的能量变化,逸出的的质量也忽略不计,混合溶液的密度视为,若反应后混合溶液的比热容,下列说法正确的是
实验序号 稀盐酸 反应后最高温度/℃
体积/mL 反应前温度/℃ 体积/mL 反应前温度/℃
1 50 19.1 60 19.1 19.8
2 50 19.1 60 19.3 19.9
3 50 19.2 60 19.2 21.7
A.用铜质的搅拌器会使所测偏小
B.分批加入盐酸会使实验结果更准确
C.测量溶液的温度后可直接测盐酸温度
D.
14.是一种重要的化工原料,可用乙烷()在高温条件下与水蒸气反应制得。已知:
① ;
② ;
③ 。
下列由和水蒸气在高温下反应得到和CO的热化学方程式正确的是
A.
B.
C.
D.
15.已知丙烯(,气态)的燃烧热,环丙烷(,气态)的燃烧热,下列热化学方程式或叙述正确的是
A.(g)+O2(g)=3CO2(g)+3H2O(g)
B.(g)+3O2(g)=3CO(g)+3H2O(l)
C.丙烯比环丙烷稳定
D. (g)(g)
二、实验题
16.用溶液与溶液在如图所示的装置中进行反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的重要仪器为 。
(2)已知:中和后生成的溶液的比热容c为4.18J/(g ℃),溶液的密度均为,某学习小组三次实验测得温度平均升高3.4℃。写出该反应表示中和热的热化学方程式: 。
(3)实验中若用溶液跟溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”);若用醋酸代替溶液进行上述实验,测得反应放出的热量 (填“变大”“变小”或“无影响”)。
(4)中和热测定实验中,下列操作能保证实验准确性的是 (填字母)。
a.为节省时间,只做一次实验
b.两烧杯夹层间碎纸条没有填满
c.记录混合液的最高温度作为终止温度
d.用铁制容器代替烧杯进行实验
17.磺酰氯( SO2Cl2 )可用于制造锂电池正极活性物质。实验室可利用SO2和Cl2在活性炭催化下反应制取少量SO2Cl2,装置如图(部分夹持装置已省略)。
已知:①SO2(g) +Cl2(g)=SO2Cl2(1) ΔH= -97.3 kJ/mol;
②SO2Cl2熔点为-54.1℃ ,沸点为69.1℃,常温较稳定,遇水剧烈水解,100℃以上易分解。
回答下列问题:
(1)仪器A的名称是 ,装置丙中橡胶管的作用是 。
(2)装置丙中发生反应的离子方程式为 ,上述仪器的正确连接顺序是e ___________→g,h←___________←f(填仪器接口字母编号,仪器可重复使用)。
(3)仪器F的作用是 。
(4)装置丁中三颈烧瓶需置于冷水浴中,其原因是 。
(5)某实验小组利用该装置消耗氯气1120 mL(标准状况下,SO2足量) ,最后得到纯净的磺酰氯4.0 g,则磺酰氯的产率为 ( 结果精确到0.01%)。
三、原理综合题
18.回答下列问题。
(1)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g)2N2(g)+6H2O(g) ΔH1=a kJ·mol-1
反应Ⅱ:N2(g)+O2(g)2NO(g) ΔH2=b kJ·mol-1
反应Ⅲ:4NH3(g)+6NO(g)5N2(g)+6H2O(g) ΔH3=c kJ·mol-1
则反应Ⅱ中的b= (用含a、c的代数式表示),反应Ⅲ中的ΔS (填“>”“<”或“=”)0。
(2)已知:①2CO(g)+SO2(g)S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
②2H2(g)+SO2(g)S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
③CO的燃烧热ΔH3=-283 kJ·mol-1,
请回答:
表示液态硫(S)的燃烧热的热化学方程式为 ;反应②中,正反应活化能E1 (填“>”“<”或“=”)ΔH2。
(3)若某温度下,CH3COOH(aq)与NaOH(aq)反应的ΔH=-46.8 kJ·mol-1,H2SO4(aq)与NaOH(aq)的中和热为57.3 kJ·mol-1,则CH3COOH在水溶液中电离的反应热ΔH1= 。
(4)已知:
化学键 C—H C—C C=C H—H
键能/(kJ·mol-1) 412 348 612 436
则 +H2(g) ΔH= ;又知H2和苯乙烯的燃烧热ΔH分别为-290 kJ·mol-1和-4400 kJ·mol-1,则乙苯的燃烧热ΔH= kJ·mol-1。
19.化学反应中的热效应又称反应热,包括燃烧热、中和热等,其数据广泛应用于科学研究和工业生产方面。
(1)若石墨完全燃烧放出的热量为,则石墨完全燃烧的热化学方程式为 。
(2)利用如图所示装置测定中和反应的反应热的实验步骤如下:①用量筒量取盐酸倒入内筒中,测出盐酸温度;②用另一量筒量取溶液,测出溶液温度;③将溶液沿玻璃棒缓慢倒入内筒中,设法使之混合均匀,测出混合液最高温度。装置中a的作用是 ,上述实验步骤中一处不合理的操作应改成 。假设盐酸和氢氧化钠溶液的密度都是,又知中和反应后生成溶液的比热容。测得溶液的温度依次为20.1℃、20.3℃、23.4℃,可计算出中和反应的反应热 (保留三位有效数字)。如果采用氨水代替氢氧化钠溶液,测得的中和反应的反应热 (“偏大”“偏小”或“相等”)。
(3)键能指气态分子解离为气态原子所需的能量。已知,其中H—H、O=O、O—H的键能依次为、、,又知 ,则氢气的燃烧热 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.由图示可知,反应的过程中温度升高,反应过程中有热量放出,故A正确;
B.氧化铝覆盖在铝的表面,由图示可知,0~50s,压强未增大,无气体产生,则发生稀盐酸与的反应,故B正确;
C.50s时,盐酸未反应完,溶液中溶质为、HCl,故C错误;
D.100~140s,反应停止了,压强减小是因为温度降低,故D正确;
答案选C。
2.C
【详解】A.反应①和②都是和氢气加成,是放热反应,所以ΔH1<0,ΔH2<0,故A错误;
B.将反应①和②相加不能得到反应③,所以ΔH3≠ΔH1+ΔH2,故B错误;
C.反应①和②都是放热反应,ΔH<0,根据已知,加氢放出的热量与碳碳双键的数目大致成正比,所以ΔH1>ΔH2;反应④是1,3-环己二烯脱氢生成苯的逆反应,是吸热反应,所以ΔH4>0,所以ΔH2<ΔH4,故C正确;
D.由已知方程式可知,ΔH3=ΔH2+ΔH4,故D错误;
答案选C。
3.A
【详解】1mol H2和1mol Cl2完全反应生成2mol HCl的焓变,等于反应物的总键能减去生成物的总键能,即 H=436kJ/mol +243kJ/mol -2×431kJ/mol =-183kJ/mol,所以1mol H2和1mol Cl2完全反应放出的热量是183kJ,故选A。
4.D
【详解】A.燃烧热要求产物中水为液态,A错误;
B.热化学方程式中,应该注明反应物和生成物的聚集状态,B错误;
C.该反应为放热反应,反应热为负值,C错误;
D.该选项为正确的热化学方程式,D正确;
故选D。
5.B
【详解】A.1mol (g)与1mol (g)反应生成2mol HF(l)放出的热量大于546.6kJ,选项A错误;
B.该反应为放热反应,在相同条件下,1mol (g)与1mol (g)的能量总和大于2mol HF(g)的能量,选项B正确;
C.该反应为放热反应,故反应的逆反应是吸热反应,选项C错误;
D.图像表示,是吸热反应,选项D错误;
答案选B。
6.C
【详解】A.晶体硅光伏发电是将太阳能转化为电能,故A不符合题意;
B.根据化学键的键能判断,断裂1mol二氧化硅中的Si-O键需要的能量为4×460kJ=1840kJ,断裂1mol晶体硅中的Si-Si键需要的能量为2×176=354kJ,所以二氧化硅稳定性大于硅的稳定性,故B不符合题意;
C.,故C符合题意;
D.根据图中可知,,故D不符合题意;
故选:C
7.B
【详解】A.由于能量越低越稳定,由图可知,更稳定,选项A错误;
B.由图可知,①,,根据盖斯定律②-①得到,同时,由键能数据可知,,选项B正确;
C.由于,所以升高温度,平衡正向移动,故可以提高产物中溴丙烷的比例,选项C错误;
D.由图可知,溴化反应的产率为,明显高于氯化反应的,故以为原料合成丙醇时,应该选用澳化反应,然后再水解,选项D错误;
答案选B。
8.D
【详解】a g乙醇与足量钠反应能生成 5.6L(标准状况气体物质的量为0.25mol),根据,说明a g乙醇物质的量为0.5mol,根据298K时,燃烧a g乙醇(液态)生成气体和液态,放出热量为Q,则1mol乙醇(液态)生成气体和液态,放出热量为2Q,其热化学方程式 ,故D正确。
综上所述,答案为D。
9.D
【分析】由图中信息可知,氢气与氯气反应生成氯化氢气体的热化学方程式为H2(g)+Cl2(g)=2HCl(g) ΔH=436 kJ·mol-1+243kJ·mol-1-431kJ·mol-1×2=-183 kJ·mol-1。
【详解】A.H2(g)转化为氢原子时,需要断裂共价键,所以该过程是一个吸热过程,A不正确;
B.氢气与氯气反应生成氯化氢气体的热化学方程式为H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1,则1mol H2和1mol Cl2的总能量比2mol HCl的总能量高,B不正确;
C.图中信息显示,1molHCl(g)分子中的化学键断裂时需要吸收431kJ能量,则1个HCl(g)分子中的化学键断裂时需要吸收kJ能量,C不正确;
D.由热化学方程式H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1可知,1mol H2(g)和1mol Cl2(g)反应生成2mol HCl(g)的反应热ΔH=-183 kJ·mol-1,D正确;
故选D。
10.C
【详解】A.ΔH=正反应活化能-逆反应活化能=(Ek-Ek′)kJ mol-1,故A正确;
B.由图可知,金刚石的能量高于石墨,则石墨比金刚石稳定,故B正确;
C.由图可知,该反应为吸热反应,反应的热化学方程式为N2(g)+O2(g)=2NO(g)ΔH=+bkJ mol-1,故C错误;
D.等量B(g)能量高于B(l),则2A(g) B(l)ΔH<-akJ mol-1,故D正确;
故选:C。
11.C
【详解】A.该反应为放热反应,E(正丁烷)>E(异丁烷)。能量越低,物质越稳定,稳定性:异丁烷>正丁烷,A项错误;
B.燃烧热指1mol燃料与O2完全反应生成CO2与H2O(l),而该反应中生成的气态水H2O,所以1478.8kJ/mol不是燃烧热,B项错误;
C.这两个反应均是放热反应,S(g)完全燃烧时放热更多,ΔH的比较带符号比较,反应放出的热量越多ΔH越小,故 ΔH1>ΔH2,C项正确;
D.Ba(OH)2与H2SO4完全反应除了中和以外,还包含了Ba2+与硫酸根沉淀放出的热量,所有放出的热量比57.3更多,D项错误;
故选:C。
12.B
【详解】A.一个化学反应,热化学方程式可以写无数个,但焓变与化学计量数的比值是定值,参加反应的物质的量不同,热效应的数值不同,所以化学反应热效应数值与参加反应的物质多少有关,A正确;
B.101KPa时,1g氢气完全燃烧生成液态水时所放出的热量称为氢气的热值,1mol氢气完全燃烧生成液态水时所放出的热量称为氢气的燃烧热,B不正确;
C.应用盖斯定律,将已知热化学方程式调整化学计量数后进行相加减,可计算某些难以直接测量的反应的焓变,C正确;
D.能量通常表现为热能、电能、光能等,化学反应过程中除了产生热能外,也可以产生光能、电能等,D正确;
故选B。
13.D
【详解】A.铜会散热,用铜质的搅拌器会使所测的热量偏小,偏大,A错误;
B. 要确保热量不散失,故应一次性迅速加入盐酸,B错误;
C.测量溶液的温度后若直接测盐酸温度,碳酸钠和盐酸反应会导致热量散失,会使所测的热量偏小,偏大,C错误;
D. 3次实验温度差分别为0.7℃、0.7℃、2.5℃,第三次数据偏差大舍去,取平均温差为0.7℃,从数据知,盐酸略过量,生成0.015mol的二氧化碳,则放出热量, 则得 ,D正确;
答案选D。
14.C
【详解】根据盖斯定律,由③-①×-②×2可得C2H6(g)+2H2O(g)=2CO(g)+5H2(g) ΔH=-1258 kJ·mol-1-(-484 kJ·mol-1)×-2×(-283.0 kJ·mol-1)=+518kJ·mol-1。
故答案选C。
15.C
【详解】A.丙烯(,气态)的燃烧热,应该是生成液态水,故A错误;
B.环丙烷(,气态)的燃烧热,则热化学方程式为(g)+O2(g)=3CO2(g)+3H2O(l) ,故B错误;
C.丙烯(,气态)的燃烧热,环丙烷(,气态)的燃烧热,则环丙烷放出的热量多,丙烯能量低,根据能量越低稳定,因此丙烯比环丙烷稳定,故C正确;
D.根据C选项环丙烷放出的热量多,说明丙烯能量低,即(g)(g) ,故D错误。
综上所述,答案为C。
16.(1)温度计
(2)
(3) 不相等 相等 变小
(4)c
【分析】中和热是在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时所释放的热量;中和热测定实验中一定注意使用稀的强酸强碱反应,并注意实验进行要迅速、保温效果要好,尽可能减少热量损失。
【详解】(1)根据量热计的构造可知,该装置缺少的仪器是温度计;
(2)中和热是在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时所释放的热量;反应放出的热量Q=3.4℃×4.18J/(g·℃)×1g/cm3×100mL=1.421kJ,,故热化学方程式为: ;
(3)反应放出的热量和所用酸以及碱的量有关,若用溶液跟溶液反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热为稀的强酸和强碱溶液反应生成1mol水时放出的热量,与酸碱的用量无关,因此中和热相等;醋酸为弱酸,电离会吸热,故若用醋酸代替溶液进行上述实验,测得反应放出的热量变小;
(4)a.为节省时间,只做一次实验,会造成实验误差大,应重复几次,以减少实验误差,a错误;
b.两烧杯夹层间碎纸条没有填满,保温效果不好,实验误差大,b错误;
c.最高温度为恰好反应时的温度,记录混合液的最高温度作为终止温度,可减少实验误差,提高实验准确性,c正确;
d.铁的导热性好,用铁制容器代替烧杯进行实验,热量散失多,实验误差大,d错误;
答案选c。
17.(1) 蒸馏烧瓶 平衡分液漏斗内外压强,便于液体顺利流下
(2) 2+10Cl-+16H+=2Mn2++5Cl2↑+8H2O e→c→d→a→b→g,h←b←a←f
(3)吸收未反应的Cl2、SO2,同时防止空气中的水蒸气进入冷凝管内
(4)制备SO2Cl2的反应为放热反应,温度过高易气化且易分解
(5)59.26%
【分析】丙装置制备氯气,戊装置制备二氧化硫,二氧化硫与氯气在丁中反应生成SO2Cl2,丁中活性炭可能起催化剂作用,SO2Cl2遇水发生剧烈的水解反应,甲为干燥二氧化硫装置,乙是饱和食盐水,降低氯气溶解度,甲也可干燥氯气,SO2Cl2沸点低、易挥发,B为冷凝管,使挥发的产物SO2Cl2冷凝回流,碱石灰吸收未反应的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止进入C中导致磺酰氯水解。
【详解】(1)根据仪器的构造可知,仪器A的名称是蒸馏烧瓶,当分液漏斗上部压强大于烧瓶内压强时,分液漏斗内液体才能顺利流下,所以橡皮管起到平衡气压,使液体顺利流下的作用,装置丙中橡胶管的作用是平衡气压,使液体顺利滴下,故答案为:蒸馏烧瓶;平衡气压,使液体顺利滴下;
(2)装置丙中高锰酸钾与浓盐酸反应生成氯化锰、氯化钾、氯气和水,发生反应的离子反应方程式为2+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,实验装置的顺序是氯气制备装置→除杂装置→干燥装置→反应装置←干燥装置←二氧化硫制备装置,上述仪器正确的连接顺序是e→c→d→a→b→g,h←b←a←f,故答案为:2+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;c→d→a→b;b←a;
(3)仪器F装有碱石灰成分是CaO和NaOH混合物,其作用是吸收SO2、Cl2,防止污染空气,同时防止水蒸气进同意使磺酰氯水解;
(4)因为制备SO2Cl2的反应为放热反应,SO2Cl2沸点低,温度过高易气化且易分解,故装置丁中三颈烧瓶置于冷水浴中,故答案为:制备SO2Cl2的反应为放热反应,SO2Cl2沸点低,温度过高易气化且易分解;
(5)标准状况1120mL氯气物质的量为,二氧化硫过量,根据反应SO2(g)+Cl2(g)=SO2Cl2,可知理论上生成0.05mol SO2Cl2,质量为m=nM=0.05mol×135g/mol=6.75g,则磺酰氯的产率为,故答案为:59.26%。
18.(1) >
(2) S(l)+O2(g)=SO2(g)ΔH=-529 kJ·mol-1 >
(3)+10.5 kJ·mol-1
(4) +124 kJ·mol-1 -4 566
【详解】(1)根据盖斯定律,由(反应Ⅰ-反应Ⅲ)÷3,得N2(g)+O2(g)2NO(g) ΔH2=kJ·mol-1.反应Ⅲ中生成物气体的物质的量大于反应物的,所以反应Ⅲ是熵增反应,ΔS>0。
(2)由已知信息③可得CO(g)+O2(g)=CO2(g) ΔH3=-283 kJ·mol-1,将该热化学方程式及已知信息①中热化学方程式依次编号为a、b,根据盖斯定律,由a×2-b得:S(l)+O2(g)=SO2(g) ΔH=(-283 kJ·mol-1)×2+37.0 kJ·mol-1=-529 kJ·mol-1;设E2为逆反应的活化能,则E1-E2=ΔH2>0,所以E1>ΔH2。
(3)醋酸和NaOH的中和反应(反应热ΔH),可以分为CH3COOH的电离(反应热ΔH1)、H+和OH-的中和(反应热ΔH2)两步,故ΔH1=ΔH-ΔH2=-46.8 kJ·mol-1-(-57.3 kJ·mol-1)=+10.5 kJ·mol-1;
(4)反应热=反应物总键能-生成物总键能,由有机物的结构可知,乙苯催化脱氢反应的反应热等于—CH2CH3的总键能与—CH=CH2、H2的总键能之差,故乙苯催化脱氢反应的ΔH=(5×412+348-3×412-612-436) kJ·mol-1=+124 kJ·mol-1,根据盖斯定律,乙苯的燃烧热ΔH=-290 kJ·mol-1+(-4 400 kJ·mol-1)+(+124 kJ·mol-1)=-4 566 kJ·mol-1。
19.(1)C(石墨,s)
(2) 隔热,减少热量损失 将溶液迅速倒入内筒中 偏大
(3)
【详解】(1)1g石墨完全燃烧生成CO2时放出热量为akJ,1moC完全燃烧放热12akJ,热化学方程式为C(石墨,s) ;
(2)装置中a为保温装置,作用是隔热,减少热量损失;反应时为了减少热量损失,需要迅速使酸碱混合反应,上述实验步骤中不合理的操作应为③,改成将溶液迅速倒入内筒中;平均温度值为 ,50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液的总质量m=100mL×1g/cm3=100g,c=4.18J/(g ℃),生成0.025mol的水放出热量Q=cm△T=4.18J/(g ℃)×100g×3.2℃=1337.6J=1.3376kJ,则该实验测得的中和热△H=;如果采用氨水代替氢氧化钠溶液,由于一水合氨的电离吸热,测得的中和反应的反应热偏大。
(3)氢气燃烧生成液态水的热化学方程式为2×+-4×-2×()=-570kJ/mol,氢气的燃烧热为1moL氢气完全燃烧生成液态水放出的热量,则氢气的燃烧热。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
