鲁科版 高中化学 选择性必修1 3.3沉淀溶解平衡同步练习(含答案)
文档属性
| 名称 | 鲁科版 高中化学 选择性必修1 3.3沉淀溶解平衡同步练习(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-08 19:47:57 | ||
图片预览





文档简介
中小学教育资源及组卷应用平台
3.3沉淀溶解平衡同步练习-鲁科版高中化学选择性必修1
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.侯德榜先生为我国的制碱工业做出了突出贡献,其制碱原理为NH3+NaCl+CO2+H2O=NaHCO3↓+NH4Cl。实验室模拟原理流程如下:
下列说法错误的是
A.先通入NH3的目的是造成碱性环境利于CO2的吸收
B.操作①为过滤、操作②为灼烧
C.该模拟流程应用了溶解性和热稳定性:Na2CO3>NaHCO3
D.蒸发母液可得到纯净的NH4Cl
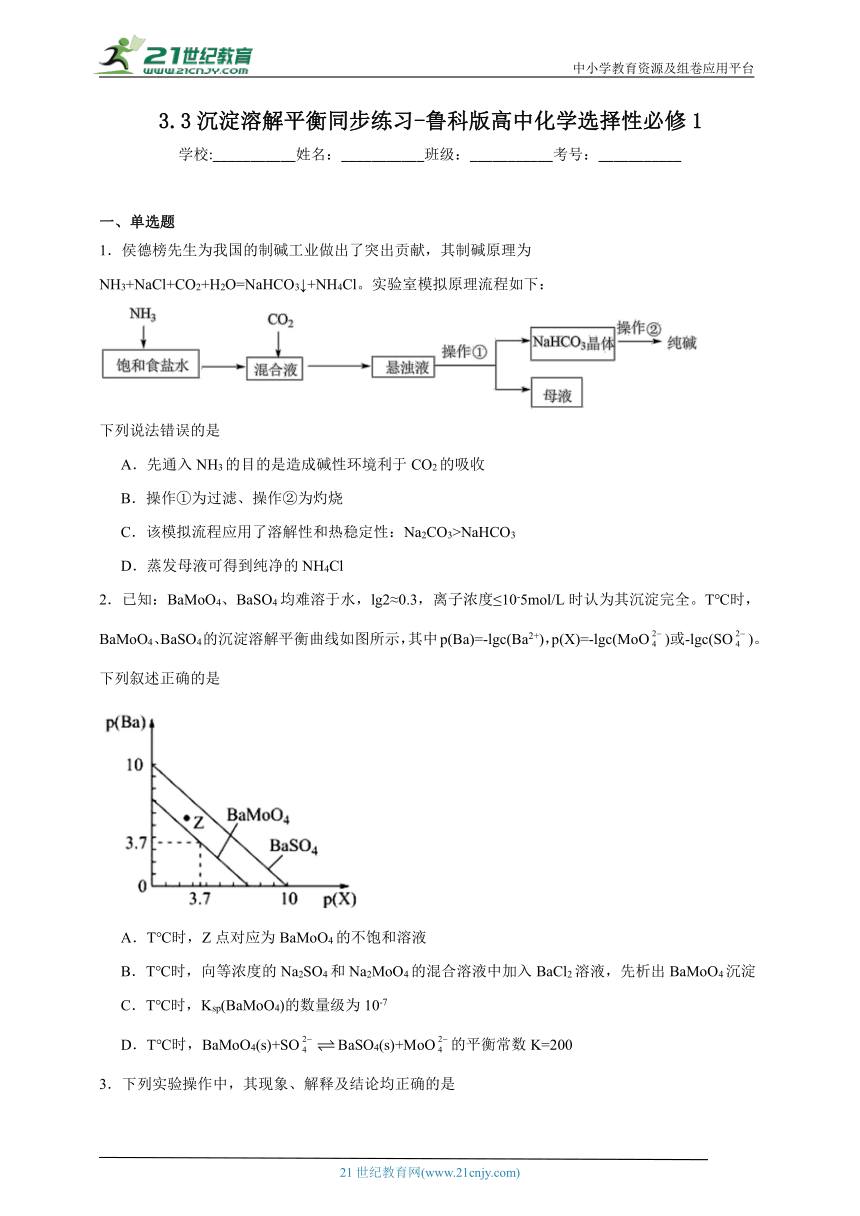
2.已知:BaMoO4、BaSO4均难溶于水,lg2≈0.3,离子浓度≤10-5mol/L时认为其沉淀完全。T℃时,BaMoO4、BaSO4的沉淀溶解平衡曲线如图所示,其中p(Ba)=-lgc(Ba2+),p(X)=-lgc(MoO)或-lgc(SO)。下列叙述正确的是
A.T℃时,Z点对应为BaMoO4的不饱和溶液
B.T℃时,向等浓度的Na2SO4和Na2MoO4的混合溶液中加入BaCl2溶液,先析出BaMoO4沉淀
C.T℃时,Ksp(BaMoO4)的数量级为10-7
D.T℃时,BaMoO4(s)+SOBaSO4(s)+MoO的平衡常数K=200
3.下列实验操作中,其现象、解释及结论均正确的是
序号 实验操作 实验现象 解释或结论
A 取少量Fe与水蒸气高温反应的固体产物于试管中,加足量的稀硫酸溶解,再滴入硫氰化钾溶液 溶液未出现血红色 反应后的固体产物没有+3的铁
B 向含有ZnS的悬浊液中滴入少量的CuSO4溶液 出现黑色沉淀 Ksp(CuS)<Ksp(ZnS)
C 加热乙醇与浓H2SO4的混合溶液,将产生的气体直接通入酸性高锰酸钾溶液中 溶液紫色褪去 产生的气体一定是乙烯
D 向BaCl2溶液中通入SO2和X气体 产生白色沉淀 气体X一定具有强氧化性
A.A B.B C.C D.D
4.下列说法正确的是
A.含有AgCl和AgI固体的悬浊液中c(Ag+)>c(Cl-)=c(I-)
B.25 ℃时Cu(OH)2在水中的溶解度大于在Cu(NO3)2溶液中的溶解度
C.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
D.25 ℃,AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
5.某温度下,FeS的水溶液中存在平衡FeS(s)Fe2+(aq)+S2-(aq),其沉淀溶解平衡曲线如图所示。下列说法正确的是
A.可以通过升温实现由c点变到a点 B.d点可能有沉淀生成
C.a点对应的Ksp大于b点对应的Ksp D.该温度下,Ksp(FeS)=2.0×10-18
6.NA为阿伏加德罗常数的值,下列叙述正确的是
A.1L1mol·L-1溴化铵水溶液中NH与H+离子数之和大于NA
B.标准状况下,1.12LHF中含有氢原子数为0.05NA
C.常温下,Ksp(AgCl)=1.8×10-10,则AgCl饱和溶液中Ag+数目为×10-5NA
D.电解饱和食盐水时(惰性电极),阴阳两极产生气体总质量为73g时转移电子数为NA
7.根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 结论
A 常温下,测得溶液和溶液的分别为1.3和1.0 氮元素的非金属性强于碳元素
B 向较浓的溶液中滴入少量酸性溶液,观察溶液紫色是否褪去 证明有还原性
C 用计测定相同浓度的溶液和溶液的,前者的小于后者的 的酸性弱于
D 向2mL溶液中加1mL溶液,产生白色沉淀;再加入1mL溶液,产生红褐色沉淀。 沉淀转化为沉淀
A.A B.B C.C D.D
8.室温下,向10mL浓度均为0.1mol/L的CuCl2、FeC12和ZnCl2溶液中分别滴加等浓度的Na2S溶液,滴加过程中pc[pc=-1gc(M2+),M2+为Cu2+或Fe2+或Zn2+]与Na2S溶液体积的关系如图所示。已知:Ksp(CuS)A.m=8.6
B.a点的CuCl2溶液中:c(H+)=c(OH-)+2c[Cu(OH)2]
C.a→d→g的过程中,水的电离程度经历由大到小后又增大的过程
D.将足量ZnCl2晶体加入0.1mol/L的Na2S溶液中,c(Zn2+)最大可达到10-24.4mol·L-1
9.化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+FeS(s)CuS(s)+Fe2+(aq)下列有关叙述中正确的是
①FeS的Ksp大于CuS的Ksp
②该反应平衡常数K=
③溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Fe2+)保持不变
④达到平衡时c(Fe2+)=c(Cu2+)
A.②③ B.①③④ C.①② D.②③④
10.室温下,通过下列实验探究NaHCO3溶液的性质
实验 实验操作和现象
1 用pH试纸测得0.1mol·L-1NaHCO3溶液的pH约为8
2 向0.1mol·L-1NaHCO3溶液中加入过量0.1mol·L-1Ba(OH)2溶液,产生白色沉淀
3 向0.1mol·L-1NaHCO3溶液中加入等体积0.1mol·L-1NaOH溶液
4 向浓NaHCO3溶液中加入浓Al2(SO4)3溶液,有气体和沉淀生成
下列说法不正确的是
A.实验1的溶液中存在c(Na+)>c(H2CO3)>c()
B.实验2所得上层清液中存在c(Ba2+)·c()=Ksp(BaCO3)
C.实验3反应后的溶液中存在c(Na+)D.实验4中发生反应的离子方程式为:Al3++3=Al(OH)3↓+3CO2↑
二、填空题
判断正误
11.pH<7的溶液,可能呈酸性。
12.当溶液中的c(H+)或c(OH-)较小时,用pH表示其酸碱性更为方便。
13.把pH试纸直接插入待测溶液中,测其pH。
14.等浓度的醋酸和盐酸与Zn反应时生成H2的速率:醋酸>盐酸。
15.中和等体积、等pH的盐酸和醋酸所用NaOH的物质的量:醋酸>盐酸。
16.中和等浓度等体积的盐酸和醋酸所用NaOH的物质的量:盐酸>醋酸。
17.加水稀释两种相同pH的酸,pH变化大的一定是强酸。
18.含有CH3COOH与CH3COONa的混合液一定呈酸性。
19.在相同温度下,pH相等的氨水和NaOH溶液,n(OH-)相等。
20.体积相等、pH值相等的CH3COOH和盐酸与Zn反应,开始时盐酸放出H2快。
21.pH=12的氨水和pH=2的盐酸等体积混合,混合液的pH<7。
22.pH=2的盐酸、pH=2的醋酸中由水电离出的c(H+)均为10-12mol·L-1。
23.向10mLpH=11的氨水中,加入10mLpH=3的H2SO4溶液,混合液pH=7。
24.1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11。
25.测得0.1mol·L-1的一元酸HA溶液pH=3.0,则HA一定为弱电解质。
26.25℃时,将0.1mol·L-1的NaOH溶液加水稀释100倍,所得溶液的pH=11.0。
27.25℃时,将0.1mol·L-1的HA溶液加水稀释至pH=4.0,所得溶液c(OH-)=1×10-10mol·L-1。
28.0.1mol·L-1的HA溶液与0.1mol·L-1的NaOH溶液等体积混合,所得溶液pH一定等于7.0。
29.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的pH<7。
30.向10mL0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,将减小。
31.将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>b>c。
32.pH=11和pH=13的NaOH溶液等体积混合后,溶液中的c(H+)=mol·L-1。
33.pH=12的NaOH溶液中,c(H+)=10-12mol·L-1,将溶液稀释为原体积的10倍后c(H+)=mol·L-1=10-13mol·L-1。
34.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,因生成的CH3COONa水解,所以由水电离出的c(H+)>10-7mol·L-1。
35.已知某分散系中存在:M(OH)2(s) M2+(aq)+2OH-(aq),K=a,c(M2+)=bmol·L-1时,溶液的pH等于14+lg()。
36.二硫化钼(MoS2,其中Mo的化合价为+4)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如下:
钼酸钠晶体(Na2MoO4 2H2O)是一种无公害型冷却水系统金属缓蚀剂,可以由MoS2制备。在制备过程中需加入Ba(OH)2固体除去,若溶液中c(MoO)=0.4mol/L,c(SO)=0.05mol/L,常温下,当BaMoO4即将开始沉淀时,的去除率为 [忽略溶液体积变化。已知:259℃,Ksp(BaMoO4)=4.0×10 8,Ksp(BaSO4)=1.1×10 10]
37.连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
①写出H2N2O2在水溶液中的电离方程式: 。
②c点时溶液中各离子浓度由大到小的顺序为 。
③b点时溶液中c(H2N2O2) c(N2O22-)。(填“>”“<”或“=”,下同)
④a点时溶液中c(Na+) c(HN2O)+c(N2O22-)。
(2)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中= 。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
(3)有时我们将NaHCO3溶液中的平衡表示为:2HCO3-H2CO3+CO32-;为了证明该平衡存在,你认为应向NaHCO3溶液中加入下列哪种试剂合理 (填序号)
A.适当浓度的盐酸
B.适当浓度Ba(OH)2溶液
C.适当浓度BaCl2溶液
38.工业上以菱锰矿(主要成分是MnCO3,还含有Fe2+、Ni2+等)为原料制备电解锰的工艺流程如图所示。
溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子 Ni2+ Mn2+ Fe3+ Fe2+
开始沉淀时(c=0.01mol L-1)的pH 7.2 8.3 2.2 7.5
沉淀完全时(c=1.0×10-5mol L-1)的pH 8.7 9.8 3.2 9.0
加入氨水的目的是为除去杂质,根据流程图及表中数据,pH应调控在 范围内。常温下,Ksp[Fe(OH)3]=4.0×10-38,当pH=4时,溶液中c(Fe3+)= 。
39.牙齿表面由一层硬的组成为Ca5(PO4)3OH的难溶物质保护着,它在唾液中存在下列平衡:Ca5(PO4)3OH(s)5Ca2+(aq)+3PO(aq)+OH-(aq)。
(1)进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。
(2)已知Ca5(PO4)3F的溶解度比Ca5(PO4)3OH更小,请用离子方程式表示使用含氟牙膏防止龋齿的原因: 。
40.锂离子电池的广泛应用同样也要求处理电池废料以节约资源、保护环境。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(由Al箔、LiFePO4活性材料、少量不溶于酸碱的导电剂组成)中的资源,部分流程如图:
若滤液②中c(Li+)=4mol·L-1加入等体积的Na2CO3后,沉淀中的Li元素占原Li元素总量的95.5%,计算滤液③中c()= 。[Ksp(Li2CO3)=1.62×10-3]。
41.完成下列问题
(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol/L的MgCl2和CaCl2混合溶液中逐滴加入Na3P04,先生成 沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c= mol/L。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
①毒重石用盐酸浸取前需充分研磨,目的是 。
②加入NH3·H2O调节PH=8可除去 (填离子符号),滤渣II中含 (填化学式)。加入H2C2O4时应避免过量,原因是 。
Ca2+ Mg2+ Fe3+
开始沉淀时的pH 11.9 9.1 1.9
完全沉淀时的pH 13.9 11.1 3.7
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL0.01mol/LNa2SO4溶液,下列叙述正确的是
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀.溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
42.如图所示,横轴为溶液的pH,纵轴为Zn2+或ZnO22-物质的量浓度的对数。回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为 。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp= 。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液pH的范围是 。
43.酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1)氨水是中学常见的碱溶液
① 下列事实可证明NH3·H2O是弱碱的是 (填字母序号)。
A.常温下,0. 1 mol·L-1氨水pH为11
B.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
C.常温下,0. 1mol·L-1氯化铵溶液的pH为5
D.铵盐受热易分解
② 下列方法中,可以使氨水电离程度增大的是 (填字母序号)。
A.加入少量氯化铁固体 B.通入氨气
C.加入少量氯化铵固体 D.加水稀释
(2)盐酸和醋酸是中学常见酸
用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
① 滴定醋酸的曲线是 (填“Ⅰ”或“Ⅱ”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③ V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)常温下将0.2mol/L HCl溶液与0.2mol/L氨水溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,求混合溶液中下列算式的精确计算结果(填具体数字):c(H+)﹣c(NH3﹒H2O)= mol/L.
(4)铵盐和氯化银是中学常见盐
①0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液相比较 (填溶质的化学式)溶液中NH的浓度更大,其原因是
②含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:
AgCl(s)Ag+(aq)+Cl-(aq)
在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:
①100 mL蒸馏水
②100 mL 0.3 mol·L-1AgNO3溶液
③100 mL 0.1 mol·L-1 MgCl2溶液
充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为 (填序号)。
44.用相关化学反应原理解释下列问题。
(1)请用离子方程式表示热纯碱溶液除油污原理 。
(2)请解释不能通过水溶液的离子反应制备,其原因是 。
(3)氯碱工业原理 。
(4)难溶物ZnS作沉淀剂除去废水中,写出该过程的离子方程式 。
(5)将0.3mol的气态高能燃料乙硼烷()在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为 。
三、实验题
45.滴定实验是化学学科中最重要的定量实验之一、常见的滴定实验有酸碱中和滴定、氧化还原应滴定、沉淀滴定等等。
(1)酸碱中和滴定—用0.1000mol·L-1 HCl标准溶液测定某NaOH溶液的物质的量浓度(用酚酞作指示剂),请回答下列问题:
①若某学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为 ;
②该学生做了三组平行实验,数据记录如下:实验序号待测NaOH溶液的体积/mL 0.1000mol·L-1HCl溶液的体积/mL滴定前刻度 滴定后刻度
1 25.00 0.00 25.02
2 25.00 1.56 31.30
3 25.00 0.22 25.20
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (小数点后保留四位);
(2)氧化还原滴定——葡萄酒中抗氧化剂残留量的测定葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
注:实验中加入盐酸的目的:将Na2S2O5全部转化成SO2。
①滴定时,I2溶液应装在 (“酸”或“碱”)式滴定管中,滴定终点时滴定现象是 。
②实验消耗标准I2溶液25.00mL,所测样品中抗氧化剂的残留量(以游离SO2计算)为 g/L。
③上述滴定过程中的原理为 (用离子方程式表示),下列情形会造成测定结果偏高的 。
A. 滴定持续时间稍长,溶液中部分HI被空气氧化
B. 滴定前平视,滴定后俯视
C. 盛装标准I2溶液的滴定管用蒸馏水洗净后,未润洗
D. 滴定前滴定管尖嘴有气泡,滴定后气泡消失
(3)沉淀滴定——滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是___________(填选项字母)。
难溶物 AgCl AgBr AgCN Ag2CrO4 AgSCN
颜色 白 浅黄 白 砖红 白
Ksp 1.77×10-10 5.35×10-13 1.21×10-16 1.12×10-12 1.0×10-12
A.NaCl B.NaBr C.NaCN D.Na2CrO4
46.铅和锰是工业生产中的重要金属,利用软锰矿(主要成分)和方铅矿(主要成分PbS,含少量)协同浸出制取铅、锰氧化物是重要的化工方法。
已知:
(1)在搅拌条件下将方铅矿、软锰矿和盐酸混合溶液进行混合,反应生成和S。写出该过程中主要发生的化学方程式 。
(2)研究表明加入氯化钠对体系中Pb、Mn、Fe元素的浸出率有影响,结果如图所示。随着氯化钠浓度的增大,铁元素的浸出率下降的原因是 。
(3)在浸出结束后加入NaOH溶液调节pH除铁。已知:,。若、起始浓度分别为1mol/L和0.8mol/L,加入等体积NaOH溶液后pH为3.0,则此时 。
(4)氯化铅配合物与硫酸溶液反应生成。利用与溶液进一步反应制取。将所得固体样品进行X—射线衍射分析,结果如图所示。固体样品中出现杂质的原因是 。
(5)利用除去、后的溶液制备。在弱碱性氨水溶液中,采用充氧氧化制备得到,写出该离子反应方程式 。
(6)加热烘干过程中常常混有杂质,现对样品中的含量进行测定。取样品22.19g加入足量浓盐酸并加热,得到标准状况下2.24L氯气。(和在加热时均能和浓盐酸反应生成)计算样品中的质量分数为 。(写出计算过程)
47.室温下,某小组同学对溶液的性质进行如下探究:
实验I
(1)甲同学测定溶液,用化学用语表示原因 。
(2)乙同学观察试管中的现象:对比试管和,发现试管中红色更深,由此该同学得出的结论是 ;试管中的现象是 。
(3)小组同学依据上述实验现象,得出试管a中发生反应的离子方程式为 。
实验Ⅱ
(4)实验Ⅱ开始前小组同学查阅了相关资料,并对实验现象进行了预测
资料i. 25℃时,
资料ⅱ.生成氢氧化物沉淀的如下表(金属离子的起始浓度为)
开始沉淀时 1.5
完全沉淀时 2.8
①甲同学认为:由于反应恰好完全进行,因此试管中不存在;乙同学则推测该溶液中仍存在,他推测的依据是 。
②丙同学在试管中加入的盐酸,预期发生反应的离子方程式是 ;丙同学并未观察到沉淀明显溶解。丙同学依据资料信息,猜想盐酸不能使溶解可能的原因是 。
③欲使沉淀溶解,可采取的措施是 。
参考答案:
1.D
2.A
3.B
4.B
5.D
6.A
7.C
8.D
9.C
10.C
11.正确 12.正确 13.错误 14.错误 15.正确 16.错误 17.错误 18.错误 19.错误 20.错误 21.错误 22.正确 23.错误 24.正确 25.正确 26.正确 27.正确 28.错误 29.错误 30.错误 31.错误 32.错误 33.错误 34.错误 35.错误
36.97.8%
37. H2N2O2HN2O2-+H+ c(Na+>c(N2O22-)>c(OH-)>c(HN2O2-)>c(H+) > > 3×10-4 C
38. [3.2,8.3)
39.(1)发酵生成的有机酸能中和OH-,使平衡向右移动,加速牙齿腐蚀
(2)Ca5(PO4)3OH(s)+F-(aq)Ca5(PO4)3F(s)+OH-(aq)
40.0.2 mol·L-1
41.(1) Mg3(PO4)2 c=10-4mol/L
(2) 可以增大反应物的接触面积,增大反应速率; Fe3+; Mg(OH)2,Ca(OH)2; 会导致生成BaC2O4沉淀,产品产量会减少;
(3)D
42. Zn2++4OH-==ZnO22-+2H2O 10-17 8.0~12.0
43. A、C A、D I 0.1mol·L-1醋酸溶液 < c(CH3COO-)> c (Na+)> c (H+)> c (OH-)
或[CH3COO-]> [Na+]>[ H+]> [OH-] 1.0×10﹣8 (NH4)2Fe(SO4)2 Fe2+水解显酸性,对NH的水解有抑制作用 ②①③
44.(1)
(2)
(3)
(4)
(5)
45.(1) 23.70mL 0.1000mol/L
(2) 酸 在滴定终点时,当滴入最后一滴碘溶液时,溶液由无色变为蓝色,且保持30s不变 0.16 CD
(3)D
46.(1)
(2)随着氯化钠浓度的增大,有利于PbS的浸出,消耗了大量的,减少了的氧化
(3)
(4)碳酸钠水解呈碱性,所以碳酸铅中混有碱式碳酸盐
(5)
(6)7.12%
47. 增大反应物的浓度使平衡正向移动 溶液颜色变浅。 溶液酸性太弱 增强溶液的酸性至<1.5。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
3.3沉淀溶解平衡同步练习-鲁科版高中化学选择性必修1
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.侯德榜先生为我国的制碱工业做出了突出贡献,其制碱原理为NH3+NaCl+CO2+H2O=NaHCO3↓+NH4Cl。实验室模拟原理流程如下:
下列说法错误的是
A.先通入NH3的目的是造成碱性环境利于CO2的吸收
B.操作①为过滤、操作②为灼烧
C.该模拟流程应用了溶解性和热稳定性:Na2CO3>NaHCO3
D.蒸发母液可得到纯净的NH4Cl
2.已知:BaMoO4、BaSO4均难溶于水,lg2≈0.3,离子浓度≤10-5mol/L时认为其沉淀完全。T℃时,BaMoO4、BaSO4的沉淀溶解平衡曲线如图所示,其中p(Ba)=-lgc(Ba2+),p(X)=-lgc(MoO)或-lgc(SO)。下列叙述正确的是
A.T℃时,Z点对应为BaMoO4的不饱和溶液
B.T℃时,向等浓度的Na2SO4和Na2MoO4的混合溶液中加入BaCl2溶液,先析出BaMoO4沉淀
C.T℃时,Ksp(BaMoO4)的数量级为10-7
D.T℃时,BaMoO4(s)+SOBaSO4(s)+MoO的平衡常数K=200
3.下列实验操作中,其现象、解释及结论均正确的是
序号 实验操作 实验现象 解释或结论
A 取少量Fe与水蒸气高温反应的固体产物于试管中,加足量的稀硫酸溶解,再滴入硫氰化钾溶液 溶液未出现血红色 反应后的固体产物没有+3的铁
B 向含有ZnS的悬浊液中滴入少量的CuSO4溶液 出现黑色沉淀 Ksp(CuS)<Ksp(ZnS)
C 加热乙醇与浓H2SO4的混合溶液,将产生的气体直接通入酸性高锰酸钾溶液中 溶液紫色褪去 产生的气体一定是乙烯
D 向BaCl2溶液中通入SO2和X气体 产生白色沉淀 气体X一定具有强氧化性
A.A B.B C.C D.D
4.下列说法正确的是
A.含有AgCl和AgI固体的悬浊液中c(Ag+)>c(Cl-)=c(I-)
B.25 ℃时Cu(OH)2在水中的溶解度大于在Cu(NO3)2溶液中的溶解度
C.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
D.25 ℃,AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
5.某温度下,FeS的水溶液中存在平衡FeS(s)Fe2+(aq)+S2-(aq),其沉淀溶解平衡曲线如图所示。下列说法正确的是
A.可以通过升温实现由c点变到a点 B.d点可能有沉淀生成
C.a点对应的Ksp大于b点对应的Ksp D.该温度下,Ksp(FeS)=2.0×10-18
6.NA为阿伏加德罗常数的值,下列叙述正确的是
A.1L1mol·L-1溴化铵水溶液中NH与H+离子数之和大于NA
B.标准状况下,1.12LHF中含有氢原子数为0.05NA
C.常温下,Ksp(AgCl)=1.8×10-10,则AgCl饱和溶液中Ag+数目为×10-5NA
D.电解饱和食盐水时(惰性电极),阴阳两极产生气体总质量为73g时转移电子数为NA
7.根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 结论
A 常温下,测得溶液和溶液的分别为1.3和1.0 氮元素的非金属性强于碳元素
B 向较浓的溶液中滴入少量酸性溶液,观察溶液紫色是否褪去 证明有还原性
C 用计测定相同浓度的溶液和溶液的,前者的小于后者的 的酸性弱于
D 向2mL溶液中加1mL溶液,产生白色沉淀;再加入1mL溶液,产生红褐色沉淀。 沉淀转化为沉淀
A.A B.B C.C D.D
8.室温下,向10mL浓度均为0.1mol/L的CuCl2、FeC12和ZnCl2溶液中分别滴加等浓度的Na2S溶液,滴加过程中pc[pc=-1gc(M2+),M2+为Cu2+或Fe2+或Zn2+]与Na2S溶液体积的关系如图所示。已知:Ksp(CuS)
B.a点的CuCl2溶液中:c(H+)=c(OH-)+2c[Cu(OH)2]
C.a→d→g的过程中,水的电离程度经历由大到小后又增大的过程
D.将足量ZnCl2晶体加入0.1mol/L的Na2S溶液中,c(Zn2+)最大可达到10-24.4mol·L-1
9.化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+FeS(s)CuS(s)+Fe2+(aq)下列有关叙述中正确的是
①FeS的Ksp大于CuS的Ksp
②该反应平衡常数K=
③溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Fe2+)保持不变
④达到平衡时c(Fe2+)=c(Cu2+)
A.②③ B.①③④ C.①② D.②③④
10.室温下,通过下列实验探究NaHCO3溶液的性质
实验 实验操作和现象
1 用pH试纸测得0.1mol·L-1NaHCO3溶液的pH约为8
2 向0.1mol·L-1NaHCO3溶液中加入过量0.1mol·L-1Ba(OH)2溶液,产生白色沉淀
3 向0.1mol·L-1NaHCO3溶液中加入等体积0.1mol·L-1NaOH溶液
4 向浓NaHCO3溶液中加入浓Al2(SO4)3溶液,有气体和沉淀生成
下列说法不正确的是
A.实验1的溶液中存在c(Na+)>c(H2CO3)>c()
B.实验2所得上层清液中存在c(Ba2+)·c()=Ksp(BaCO3)
C.实验3反应后的溶液中存在c(Na+)
二、填空题
判断正误
11.pH<7的溶液,可能呈酸性。
12.当溶液中的c(H+)或c(OH-)较小时,用pH表示其酸碱性更为方便。
13.把pH试纸直接插入待测溶液中,测其pH。
14.等浓度的醋酸和盐酸与Zn反应时生成H2的速率:醋酸>盐酸。
15.中和等体积、等pH的盐酸和醋酸所用NaOH的物质的量:醋酸>盐酸。
16.中和等浓度等体积的盐酸和醋酸所用NaOH的物质的量:盐酸>醋酸。
17.加水稀释两种相同pH的酸,pH变化大的一定是强酸。
18.含有CH3COOH与CH3COONa的混合液一定呈酸性。
19.在相同温度下,pH相等的氨水和NaOH溶液,n(OH-)相等。
20.体积相等、pH值相等的CH3COOH和盐酸与Zn反应,开始时盐酸放出H2快。
21.pH=12的氨水和pH=2的盐酸等体积混合,混合液的pH<7。
22.pH=2的盐酸、pH=2的醋酸中由水电离出的c(H+)均为10-12mol·L-1。
23.向10mLpH=11的氨水中,加入10mLpH=3的H2SO4溶液,混合液pH=7。
24.1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11。
25.测得0.1mol·L-1的一元酸HA溶液pH=3.0,则HA一定为弱电解质。
26.25℃时,将0.1mol·L-1的NaOH溶液加水稀释100倍,所得溶液的pH=11.0。
27.25℃时,将0.1mol·L-1的HA溶液加水稀释至pH=4.0,所得溶液c(OH-)=1×10-10mol·L-1。
28.0.1mol·L-1的HA溶液与0.1mol·L-1的NaOH溶液等体积混合,所得溶液pH一定等于7.0。
29.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的pH<7。
30.向10mL0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,将减小。
31.将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>b>c。
32.pH=11和pH=13的NaOH溶液等体积混合后,溶液中的c(H+)=mol·L-1。
33.pH=12的NaOH溶液中,c(H+)=10-12mol·L-1,将溶液稀释为原体积的10倍后c(H+)=mol·L-1=10-13mol·L-1。
34.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,因生成的CH3COONa水解,所以由水电离出的c(H+)>10-7mol·L-1。
35.已知某分散系中存在:M(OH)2(s) M2+(aq)+2OH-(aq),K=a,c(M2+)=bmol·L-1时,溶液的pH等于14+lg()。
36.二硫化钼(MoS2,其中Mo的化合价为+4)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如下:
钼酸钠晶体(Na2MoO4 2H2O)是一种无公害型冷却水系统金属缓蚀剂,可以由MoS2制备。在制备过程中需加入Ba(OH)2固体除去,若溶液中c(MoO)=0.4mol/L,c(SO)=0.05mol/L,常温下,当BaMoO4即将开始沉淀时,的去除率为 [忽略溶液体积变化。已知:259℃,Ksp(BaMoO4)=4.0×10 8,Ksp(BaSO4)=1.1×10 10]
37.连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
①写出H2N2O2在水溶液中的电离方程式: 。
②c点时溶液中各离子浓度由大到小的顺序为 。
③b点时溶液中c(H2N2O2) c(N2O22-)。(填“>”“<”或“=”,下同)
④a点时溶液中c(Na+) c(HN2O)+c(N2O22-)。
(2)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中= 。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
(3)有时我们将NaHCO3溶液中的平衡表示为:2HCO3-H2CO3+CO32-;为了证明该平衡存在,你认为应向NaHCO3溶液中加入下列哪种试剂合理 (填序号)
A.适当浓度的盐酸
B.适当浓度Ba(OH)2溶液
C.适当浓度BaCl2溶液
38.工业上以菱锰矿(主要成分是MnCO3,还含有Fe2+、Ni2+等)为原料制备电解锰的工艺流程如图所示。
溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子 Ni2+ Mn2+ Fe3+ Fe2+
开始沉淀时(c=0.01mol L-1)的pH 7.2 8.3 2.2 7.5
沉淀完全时(c=1.0×10-5mol L-1)的pH 8.7 9.8 3.2 9.0
加入氨水的目的是为除去杂质,根据流程图及表中数据,pH应调控在 范围内。常温下,Ksp[Fe(OH)3]=4.0×10-38,当pH=4时,溶液中c(Fe3+)= 。
39.牙齿表面由一层硬的组成为Ca5(PO4)3OH的难溶物质保护着,它在唾液中存在下列平衡:Ca5(PO4)3OH(s)5Ca2+(aq)+3PO(aq)+OH-(aq)。
(1)进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。
(2)已知Ca5(PO4)3F的溶解度比Ca5(PO4)3OH更小,请用离子方程式表示使用含氟牙膏防止龋齿的原因: 。
40.锂离子电池的广泛应用同样也要求处理电池废料以节约资源、保护环境。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(由Al箔、LiFePO4活性材料、少量不溶于酸碱的导电剂组成)中的资源,部分流程如图:
若滤液②中c(Li+)=4mol·L-1加入等体积的Na2CO3后,沉淀中的Li元素占原Li元素总量的95.5%,计算滤液③中c()= 。[Ksp(Li2CO3)=1.62×10-3]。
41.完成下列问题
(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol/L的MgCl2和CaCl2混合溶液中逐滴加入Na3P04,先生成 沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c= mol/L。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
①毒重石用盐酸浸取前需充分研磨,目的是 。
②加入NH3·H2O调节PH=8可除去 (填离子符号),滤渣II中含 (填化学式)。加入H2C2O4时应避免过量,原因是 。
Ca2+ Mg2+ Fe3+
开始沉淀时的pH 11.9 9.1 1.9
完全沉淀时的pH 13.9 11.1 3.7
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL0.01mol/LNa2SO4溶液,下列叙述正确的是
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀.溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
42.如图所示,横轴为溶液的pH,纵轴为Zn2+或ZnO22-物质的量浓度的对数。回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为 。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp= 。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液pH的范围是 。
43.酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1)氨水是中学常见的碱溶液
① 下列事实可证明NH3·H2O是弱碱的是 (填字母序号)。
A.常温下,0. 1 mol·L-1氨水pH为11
B.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
C.常温下,0. 1mol·L-1氯化铵溶液的pH为5
D.铵盐受热易分解
② 下列方法中,可以使氨水电离程度增大的是 (填字母序号)。
A.加入少量氯化铁固体 B.通入氨气
C.加入少量氯化铵固体 D.加水稀释
(2)盐酸和醋酸是中学常见酸
用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
① 滴定醋酸的曲线是 (填“Ⅰ”或“Ⅱ”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③ V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)常温下将0.2mol/L HCl溶液与0.2mol/L氨水溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,求混合溶液中下列算式的精确计算结果(填具体数字):c(H+)﹣c(NH3﹒H2O)= mol/L.
(4)铵盐和氯化银是中学常见盐
①0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液相比较 (填溶质的化学式)溶液中NH的浓度更大,其原因是
②含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:
AgCl(s)Ag+(aq)+Cl-(aq)
在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:
①100 mL蒸馏水
②100 mL 0.3 mol·L-1AgNO3溶液
③100 mL 0.1 mol·L-1 MgCl2溶液
充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为 (填序号)。
44.用相关化学反应原理解释下列问题。
(1)请用离子方程式表示热纯碱溶液除油污原理 。
(2)请解释不能通过水溶液的离子反应制备,其原因是 。
(3)氯碱工业原理 。
(4)难溶物ZnS作沉淀剂除去废水中,写出该过程的离子方程式 。
(5)将0.3mol的气态高能燃料乙硼烷()在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为 。
三、实验题
45.滴定实验是化学学科中最重要的定量实验之一、常见的滴定实验有酸碱中和滴定、氧化还原应滴定、沉淀滴定等等。
(1)酸碱中和滴定—用0.1000mol·L-1 HCl标准溶液测定某NaOH溶液的物质的量浓度(用酚酞作指示剂),请回答下列问题:
①若某学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为 ;
②该学生做了三组平行实验,数据记录如下:实验序号待测NaOH溶液的体积/mL 0.1000mol·L-1HCl溶液的体积/mL滴定前刻度 滴定后刻度
1 25.00 0.00 25.02
2 25.00 1.56 31.30
3 25.00 0.22 25.20
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (小数点后保留四位);
(2)氧化还原滴定——葡萄酒中抗氧化剂残留量的测定葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
注:实验中加入盐酸的目的:将Na2S2O5全部转化成SO2。
①滴定时,I2溶液应装在 (“酸”或“碱”)式滴定管中,滴定终点时滴定现象是 。
②实验消耗标准I2溶液25.00mL,所测样品中抗氧化剂的残留量(以游离SO2计算)为 g/L。
③上述滴定过程中的原理为 (用离子方程式表示),下列情形会造成测定结果偏高的 。
A. 滴定持续时间稍长,溶液中部分HI被空气氧化
B. 滴定前平视,滴定后俯视
C. 盛装标准I2溶液的滴定管用蒸馏水洗净后,未润洗
D. 滴定前滴定管尖嘴有气泡,滴定后气泡消失
(3)沉淀滴定——滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是___________(填选项字母)。
难溶物 AgCl AgBr AgCN Ag2CrO4 AgSCN
颜色 白 浅黄 白 砖红 白
Ksp 1.77×10-10 5.35×10-13 1.21×10-16 1.12×10-12 1.0×10-12
A.NaCl B.NaBr C.NaCN D.Na2CrO4
46.铅和锰是工业生产中的重要金属,利用软锰矿(主要成分)和方铅矿(主要成分PbS,含少量)协同浸出制取铅、锰氧化物是重要的化工方法。
已知:
(1)在搅拌条件下将方铅矿、软锰矿和盐酸混合溶液进行混合,反应生成和S。写出该过程中主要发生的化学方程式 。
(2)研究表明加入氯化钠对体系中Pb、Mn、Fe元素的浸出率有影响,结果如图所示。随着氯化钠浓度的增大,铁元素的浸出率下降的原因是 。
(3)在浸出结束后加入NaOH溶液调节pH除铁。已知:,。若、起始浓度分别为1mol/L和0.8mol/L,加入等体积NaOH溶液后pH为3.0,则此时 。
(4)氯化铅配合物与硫酸溶液反应生成。利用与溶液进一步反应制取。将所得固体样品进行X—射线衍射分析,结果如图所示。固体样品中出现杂质的原因是 。
(5)利用除去、后的溶液制备。在弱碱性氨水溶液中,采用充氧氧化制备得到,写出该离子反应方程式 。
(6)加热烘干过程中常常混有杂质,现对样品中的含量进行测定。取样品22.19g加入足量浓盐酸并加热,得到标准状况下2.24L氯气。(和在加热时均能和浓盐酸反应生成)计算样品中的质量分数为 。(写出计算过程)
47.室温下,某小组同学对溶液的性质进行如下探究:
实验I
(1)甲同学测定溶液,用化学用语表示原因 。
(2)乙同学观察试管中的现象:对比试管和,发现试管中红色更深,由此该同学得出的结论是 ;试管中的现象是 。
(3)小组同学依据上述实验现象,得出试管a中发生反应的离子方程式为 。
实验Ⅱ
(4)实验Ⅱ开始前小组同学查阅了相关资料,并对实验现象进行了预测
资料i. 25℃时,
资料ⅱ.生成氢氧化物沉淀的如下表(金属离子的起始浓度为)
开始沉淀时 1.5
完全沉淀时 2.8
①甲同学认为:由于反应恰好完全进行,因此试管中不存在;乙同学则推测该溶液中仍存在,他推测的依据是 。
②丙同学在试管中加入的盐酸,预期发生反应的离子方程式是 ;丙同学并未观察到沉淀明显溶解。丙同学依据资料信息,猜想盐酸不能使溶解可能的原因是 。
③欲使沉淀溶解,可采取的措施是 。
参考答案:
1.D
2.A
3.B
4.B
5.D
6.A
7.C
8.D
9.C
10.C
11.正确 12.正确 13.错误 14.错误 15.正确 16.错误 17.错误 18.错误 19.错误 20.错误 21.错误 22.正确 23.错误 24.正确 25.正确 26.正确 27.正确 28.错误 29.错误 30.错误 31.错误 32.错误 33.错误 34.错误 35.错误
36.97.8%
37. H2N2O2HN2O2-+H+ c(Na+>c(N2O22-)>c(OH-)>c(HN2O2-)>c(H+) > > 3×10-4 C
38. [3.2,8.3)
39.(1)发酵生成的有机酸能中和OH-,使平衡向右移动,加速牙齿腐蚀
(2)Ca5(PO4)3OH(s)+F-(aq)Ca5(PO4)3F(s)+OH-(aq)
40.0.2 mol·L-1
41.(1) Mg3(PO4)2 c=10-4mol/L
(2) 可以增大反应物的接触面积,增大反应速率; Fe3+; Mg(OH)2,Ca(OH)2; 会导致生成BaC2O4沉淀,产品产量会减少;
(3)D
42. Zn2++4OH-==ZnO22-+2H2O 10-17 8.0~12.0
43. A、C A、D I 0.1mol·L-1醋酸溶液 < c(CH3COO-)> c (Na+)> c (H+)> c (OH-)
或[CH3COO-]> [Na+]>[ H+]> [OH-] 1.0×10﹣8 (NH4)2Fe(SO4)2 Fe2+水解显酸性,对NH的水解有抑制作用 ②①③
44.(1)
(2)
(3)
(4)
(5)
45.(1) 23.70mL 0.1000mol/L
(2) 酸 在滴定终点时,当滴入最后一滴碘溶液时,溶液由无色变为蓝色,且保持30s不变 0.16 CD
(3)D
46.(1)
(2)随着氯化钠浓度的增大,有利于PbS的浸出,消耗了大量的,减少了的氧化
(3)
(4)碳酸钠水解呈碱性,所以碳酸铅中混有碱式碳酸盐
(5)
(6)7.12%
47. 增大反应物的浓度使平衡正向移动 溶液颜色变浅。 溶液酸性太弱 增强溶液的酸性至<1.5。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
