鲁科版 高中化学 选择性必修2 2.3离子键、配位键与金属键同步练习(含答案)
文档属性
| 名称 | 鲁科版 高中化学 选择性必修2 2.3离子键、配位键与金属键同步练习(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 853.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-08 19:51:25 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2.3离子键、配位键与金属键同步练习-鲁科版高中化学选择性必修2
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列关于离子键的说法正确的是( )
A.离子键就是阴、阳离子间的静电引力
B.所有金属元素与所有非金属元素间都能形成离子键
C.钠离子与氯离子可以形成离子键
D.在离子化合物中,两个氯离子间也存在离子键
2.照相底片定影并回收定影液硫代硫酸钠和银,经历如下过程,下列说法不正确的是:
A.晶体中所含的作用力只有离子键、配位键
B.与是等电子体,结构相似,相当于中O被一个S原子替换
C.该过程中与结合能力:-
D.副产物的键角小于的原因:分子中S的孤电子对对成键电子对的排斥作用使键角变小
3.向盛有硝酸银溶液的试管中加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到无色透明溶液,下列说法中正确的是
A.反应前后Ag+的浓度不变
B.沉淀溶解后,生成的[Ag(NH3)2]OH难电离
C.上述现象说明[Ag(NH3)2]+不如AgOH稳定
D.配合离子[Ag(NH3)2]+中,Ag+提供空轨道,NH3给出孤对电子
4.在碱性镀铜中电镀液的主要成分是,其内界的电离与弱电解质类似,仅部分解离为中心离子和配位体。设NA为阿伏加德罗常数的值,下列说法正确的是
A.1mol/L溶液中数目小于NA
B.22.4LNH3含有的质子数目为10NA
C.1mol的配位键数目为2NA
D.N2和H2合成1molNH3转移电子数目为3NA
5.下列各组离子在给定溶液中一定能大量共存的是
A.与金属铝反应产生的溶液中:
B.含有大量的溶液中:
C.在的氢氧化钡溶液中:
D.能使甲基橙变红的溶液中:
6.多酚氧化酶与植物的抗病性有关。配合物是多酚氧化酶的模型配合物。EDTB的一种合成过程如下:
下列有关说法错误的是
A.乙二醇可与EDTA反应形成环状化合物
B.EDTB中N的杂化轨道类型为、
C.配离子中的配位原子是N
D.EDTA分子中所含元素的第一电离能由小到大的顺序为H7.中配体分子NH3、H2O的空间结构和相应的键角如图所示。下列叙述不正确的是
A.基态Cr原子的核外电子排布式应为[Ar]3d54s1
B.中三价铬离子提供空轨道,N、O、Cl提供孤电子对与三价铬离子形成配位键,中心离子的配位数为6
C.NH3分子中的N原子,H2O分子中的O原子均为sp3杂化
D.H2O的键角(104.5°)小于NH3的键角(107.3°)(如图)是因为氧的电负性大于氮的电负性
8.为阿伏加德罗常数的值。下列说法正确的是
A.石墨中所含六元环数目为
B.乙烯和环丙烷混合气体中的氢原子数为
C.配合物完全电离出的数目为
D.标准状况下,中氯原子的数目为
9.下列物质不是配合物的是
A.NaCl B.[Fe(SCN)2]Cl C.[Cu(NH3)4]Cl2 D.[Ag(NH3)2]OH
10.下列叙述中错误的是( )。
A.带相反电荷离子之间的相互吸引力称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键
D.非金属原子间也可能形成离子键
二、填空题
11.近日,比亚迪宣布推出基于磷酸铁锂技术的“刀片电池”,刀片电池能量密度大,安全性高。电池的正极活性材料是LiFePO4。
(1)铁元素位于周期表 ;基态Fe2+的电子排布式为 。
(2)正极材料LiFePO4的阴离子PO的空间构型为 ,磷原子采取的杂化方式为 。
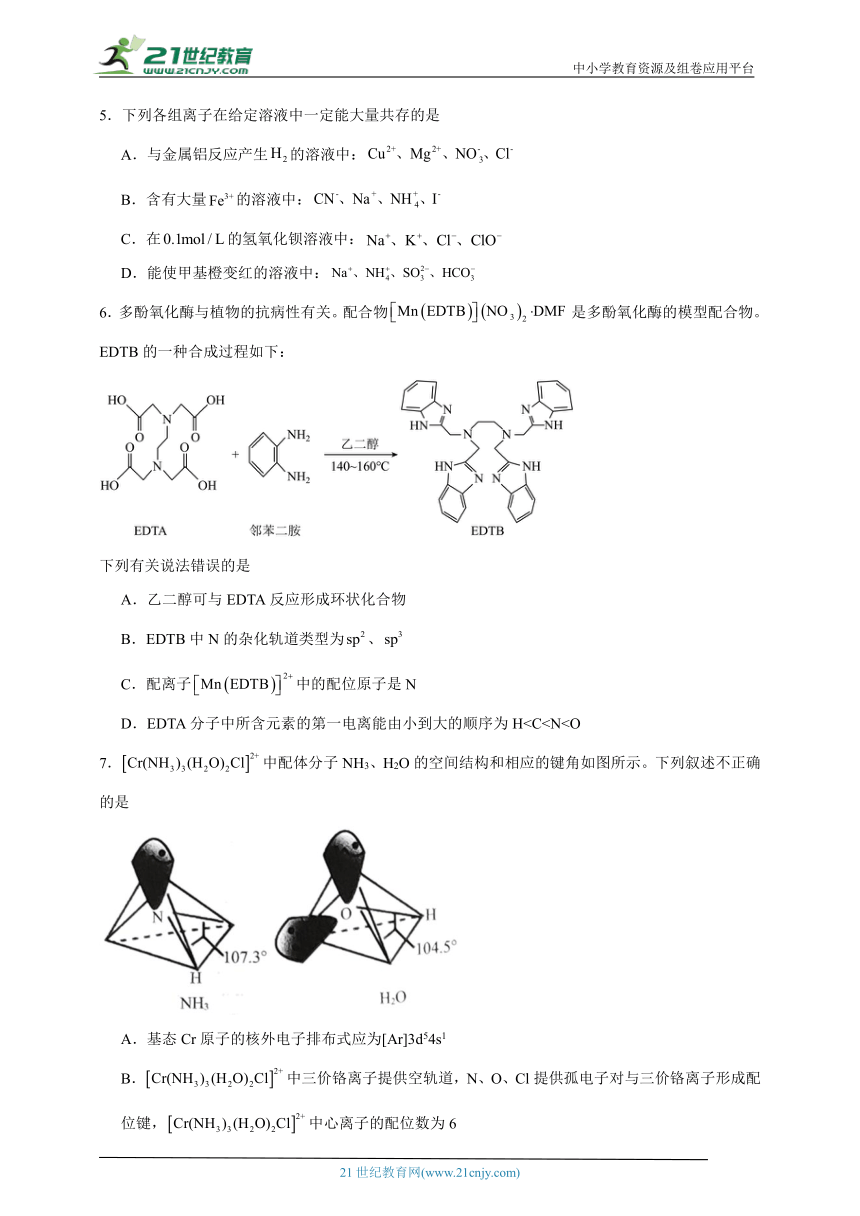
(3)Fe原子或离子外围有较多能量相近的空轨道,能与SCN-、CN-、C2O等形成配合物。[Fe(SCN)6]3-的结构简式如下图所示,其结构中σ键和π键的个数比为 ,[Fe(SCN)6]3-中含有的化学键类型是 。 (填字母)。
a.极性共价键 b.离子键 c.配位键 d.金属键
12.写出下列化合物的电子式
(1)K2O ;
(2)Na2O2 ;
(3)NH4F ;
(4)Ca(OH)2 ;
(5)CH4 ;
(6)H2O2 。
13.
(1)在化工、冶金、电子、电镀等生产部门排放废水中,常常含有一些汞金属元素,汞元素能在生物体内积累,不易排出体外,具有很大的危害。处理含Hg2+废水可加入Na2S或通入H2S,使Hg2+形成HgS沉淀,但如果Na2S过量则达不到去除Hg2+的目的,为什么? ,解决这一问题的方法是再向该废水中加入FeSO4,可有效地使HgS沉降,为什么? 。
(2)铊属于放射性的高危重金属。铊和铊的氧化物都有毒,能使人的中枢神经系统、肠胃系统及肾脏等部位发生病变。人如果饮用了被铊污染的水或吸入了含铊化合物的粉尘,就会引起铊中毒。常用普鲁士蓝作为解毒剂,治疗量为每日250mg/kg,请说明用普鲁士蓝作为解毒剂的化学原理 ,并写出相应的化学方程式 。
(3)在研究酸雨造成的某地土壤的酸化问题时,需pH=10.00的碳酸盐缓冲溶液,在500mL0.20mol/L的NaHCO3溶液中需加入 g的碳酸钠来配制1L的缓冲溶液。(已知H2CO3的pK2=10.25)
14.过渡元素等在生活、科研中有广泛用途和重要研究价值。回答下列问题:
(1)分子作为配体时,碳原子和氧原子均能够提供孤电子对。与钴形成配位化合物时,提供孤电子对的为 (填元素名称)原子。
(2)高氯酸六氨合钴(Ⅱ)的结构为,其外界离子的空间构型为 。
(3)下列对的中心原子采取的杂化类型判断合理的是_______(填标号)。
A. B. C. D.
15.A、B、C、D、代表4种元素,请完成下列问题:
(1)A元素的负一价离子的电子层结构与氩相同,B元素的正一价离子的电子层结构与氙相同,A、B形成的化合物的化学式为 .
(2)C元素的正三价离子的3d轨道为半充满状态,C元素的符号为 .在同期表中位置 ,其基态原子的价电子排布图为 .
(3)D元素基态原子的M层全充满,N层没有成对电子,只有1个未成对电子,其硫酸盐逐滴加入氨水生成难溶物的离子方程式为 ,继续添加氨水,难溶物溶解,得到深蓝色溶液的离子方程为 ,写出阳离子的结构式 .
16.几种物质:
①MgCl2 ②H2O ③Al ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He
(1)只含有离子键的是(选填序号,下同) ;
(2)含有共价键的离子化合物是 ;
(3)共价化合物是 ;
(4)熔融状态时和固态时,都能导电的是 ;
(5)HClO的结构式 ,I2的电子式 。
17.三价铬离子(Cr3+)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。回答下列问题:
(1)Cr的价层电子排布式为 。
(2)O、N、C的第一电离能由大到小的顺序为 。
(3)SO2分子的VSEPR模型名称为 ,其中心原子的杂化方式为 。
(4)化学式为CrCl3 6H2O的化合物有多种结构,其中一种可表示为[CrCl2(H2O)4]Cl 2H2O,该物质的配离子中提供孤电子对的原子为 ,配位数为 。
18.配位键
(1)配位键的形成:成键原子一方提供 ,另一方提供 形成共价键。
(2)配位键的表示:常用“ ”来表示配位键,箭头指向接受孤电子对的原子,如可表示为 ,在中,虽然有一个形成过程与其他3个形成过程不同,但是一旦形成之后,4个共价键就完全 。
19.离子键的形成
形成过程:电负性较大的非金属元素的原子容易 形成阴离子,电负性较小的金属元素的原子容易 形成阳离子。当这两种原子相互接近到一定程度时,容易发生电子得、失而形成阴、阳离子,阴、阳离子通过 可形成稳定的化合物。
实质:离子键的实质是 之间的 作用。包括 和 。
形成条件:成键原子所属元素的 差值越大,原子之间越容易发生 ,形成离子键。
20.已知Co(NH3)5BrSO4可形成两种钴的配合物,若在配合物[Co(NH3)5Br]SO4的溶液中加入BaCl2溶液时,现象是 ;若在配合物[Co(SO4)(NH3)5]Br的溶液中加入BaCl2溶液时,现象是 ,若加入AgNO3溶液时,现象是 。
三、实验题
21.某课外小组研究NH4Cl与CuO反应,进行如下实验(部分装置略):
实验 Ⅰ Ⅱ
装置
现象 向CuO粉末中加入0.1mol·L 1NH4Cl溶液,浸泡一段时间后,固体部分溶解,表面无颜色变化,溶液变为蓝色 加热试管,产生白烟,试管口有白色固体;试管中有水生成,继续加热,黑色固体变蓝,最终部分变为黄色
资料:Cu(NH3) Cu2++4NH3
(1)实验Ⅰ中,固体部分溶解的原因是 (用化学用语解释)。该小组同学预测蓝色溶液中可能存在Cu(NH3)。
①Cu(NH3)中,Cu2+与NH3形成的化学键称为 ,提供孤电子对的成键原子是 。
②设计实验方案验证蓝色溶液中存在Cu(NH3)。
(2)实验Ⅱ中黑色固体变蓝,最终部分固体变为黄色的过程中,发生了如下变化:
对物质X,做出如下假设:
ⅰ.X是NH4Cl,由CuCl2生成CuCl的化学反应方程式是 。
ⅱ.X是 ,理由是 。
(3)实验Ⅰ过程中未观察到氧化还原反应的产物,实验Ⅱ反应过程中有氧化还原反应发生。反应不同可能的原因是 。
22.三氯化六氨合钴(III){[Co(NH3)6]Cl3}是一种重要的原料。实验室以活性炭为催化剂,用H2O2、CoCl2为原料制备[Co(NH3)6]Cl3,反应过程中会放出大量的热。
已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
②[Co(NH3)6]Cl3在水中的溶解度曲线图所示。
③加入少量浓盐酸有利于[Co(NH3)6]Cl3析出。
制备[Co(NH3)6]Cl3实验步骤如下:
I.称取研细的CoCl2 6H2O10.0g和NH4Cl5.0g于烧杯中溶解,将溶液转入三颈烧瓶,加入25mL浓氨水和适量活性炭粉末,控制温度在10℃以下,逐滴加入5mL30%的H2O2溶液。实验装置如图所示。
II.将混合物在水浴1中反应一段时间,再改用水浴2处理,充分结晶后过滤。
III.……
(1)上图中仪器a的名称为 。
(2)步骤I将Co2+转化[Co(NH3)6]3+过程中,先加浓氨水,后加H2O2溶液的目的是 。
(3)步骤II中采用“冰水浴”的是 (填“水浴1”或“水浴2”)。制备[Co(NH3)6]Cl3的总反应化学方程式为 。
(4)[Co(NH3)6]Cl3配合物的内界为 (用化学式表示)。
(5)步骤III是为了获得纯净的[Co(NH3)6]Cl3。设计由步骤II过滤后的滤渣获取[Co(NH3)6]Cl3的实验方案:向滤渣中加入80℃左右的热水,充分搅拌后, ,低温干燥(实验中须使用的试剂:浓盐酸、无水乙醇)。
23.三氯化六氨合钴是一种橙黄色晶体,可溶于水和稀酸溶液、不溶于乙醇,与热的强碱溶液反应产生、.某实验小组利用下列方法制备并测定其组成.
I.制备晶体:
向锥形瓶中加入适量研细的、和蒸馏水.加热溶解后加入活性炭催化剂.冷却,加入浓氨水,继续冷却至10℃以下,缓慢加入双氧水,水浴加热至60℃左右并恒温20min,然后用冰水冷却,生成产品沉淀.抽滤,将沉淀溶解于50mL沸热的稀盐酸中,趁热过滤.在滤液中缓慢加入浓盐酸,立即有大量橙黄色晶体析出,冷却、过滤、洗涤、干燥.
Ⅱ.测定晶体组成:
(ⅰ)氨含量的测定(装置如图所示):
称取样品于锥形瓶中,加水溶解.在另一锥形瓶中加入标准HCl溶液并置于冰水浴中.从漏斗中加入足量20%的NaOH溶液,加热,保持微沸状态并持续1小时左右.然后取出插入标准HCl溶液中的导管,用纯水冲洗导管内外,洗涤液并入装有标准HCl溶液的锥形瓶中.取出锥形瓶,加入指示剂,用NaOH标准溶液滴定剩余的HCl,达到滴定终点时消耗NaOH标准溶液.
(ⅱ)钴含量的测定:
将上述左侧锥形瓶内样品残渣转移到碘量瓶中,冷却后加入足量KI溶液,立即盖上瓶塞并充分振荡后,加入浓盐酸,在暗处放置15min(还原产物为)。然后加入蒸馏水和淀粉溶液,用标准溶液滴定至终点,记录消耗标准溶液的体积(已知:)。
回答下列问题:
(1)制备实验中,生成的化学方程式为 。
(2)“水浴加热至60℃”的原因为 ;“洗涤”时适宜选择的洗涤剂为 。
(3)由氨含量的测定实验,可得样品中氨的质量分数为 (用含、、、、m的代数式表示);若省略“纯水冲洗导管内外”,会使测定结果 (填“偏高”、“偏低”或“无影响”)。
(4)钴含量的测定实验中,含钴粒子发生反应的离子方程式为 ;滴定终点时溶液颜色的变化为 。
(5)小组成员查阅资料得知,若不加活性炭催化剂,制备产物主要是。现有10mL浓度为的或溶液,请设计实验区分: 。
参考答案:
1.C
2.A
3.D
4.D
5.C
6.D
7.D
8.B
9.A
10.A
11.(1) 第四周期Ⅷ族 1s22s22p63s23p63d6
(2) 正四面体形 sp3
(3) 3:2 ac
12.
13.(1) 如果Na2S过量,会生成[HgS2]2-,而使HgS溶解,达不到去除Hg2+的目的 去除过量S2—
(2) 普鲁士蓝作为解毒剂是因为普鲁士蓝具有离子交换剂的作用,铊离子可置换普鲁士蓝中的钾离子随粪便排出 KFeIII[FeII(CN)6](s)+Tl+=TlFe[Fe(CN)6](s)+K+
(3)6.0
14.(1)碳
(2)正四面体形
(3)C
15. CsCl Fe 第四周期,第ⅤⅢ族 3d64s2 Cu2++2NH3 H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3 =[Cu(NH3)4]2++2OH﹣
16.(1)①
(2)⑤⑥
(3)②④⑦
(4)③
(5) H-O-Cl
17.(1)3d54s1
(2)N>O>C
(3) 平面三角形 sp2杂化
(4) O、Cl 6
18.(1) 孤电子对 空轨道
(2) → 相同
19. 得到 失去 静电作用 阴、阳离子 静电 静电引力 静电斥力 电负性 电子得失
20. 产生白色沉淀 无明显现象 产生淡黄色沉淀
21.(1) CuO+2NH4Cl=CuCl2+2NH3+H2O 配位键 N 取两份等体积的实验I中溶液于两试管中,分别加入等量的水和稀硫酸,加入稀硫酸的溶液颜色变得更浅;取少量实验I中溶液少许于一试管中,加热,溶液颜色变浅,即可验证蓝色溶液中存在Cu(NH3)
(2) 2NH4Cl+6CuCl26CuCl+N2+8HCl NH3 NH4Cl受热分解生成NH3,NH3有还原性
(3)由于温度低等原因,NH4Cl溶液与CuO无法发生氧化还原反应;NH4Cl溶液与CuO的氧化还原反应的化学反应速率慢、反应限度小等
22.(1)分液漏斗
(2)将不易被氧化的Co2+转化为具有较强还原性的[Co(NH3)6]2+
(3) 水浴2 H2O2+2CoCl2+2NH4Cl+10NH3 H2O=2Co(NH3)6Cl3+12H2O或H2O2+2CoCl2+2NH4Cl+10NH3=2Co(NH3)6Cl3+2H2O
(4)[Co(NH3)6]3+
(5)趁热过滤,冷却后向滤液中加入少量浓盐酸,边加边搅拌,充分静置后过滤,用无水乙醇洗涤晶体2~3次
23.(1)
(2) 温度过低,反应速率较慢,温度过高,双氧水和浓氨水分解挥发 乙醇
(3) 偏高
(4) 溶液蓝色褪去
(5)取两种溶液各10mL,加入指示剂,用溶液滴定,若消耗20mL,则为;若消耗30mL,则为
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2.3离子键、配位键与金属键同步练习-鲁科版高中化学选择性必修2
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列关于离子键的说法正确的是( )
A.离子键就是阴、阳离子间的静电引力
B.所有金属元素与所有非金属元素间都能形成离子键
C.钠离子与氯离子可以形成离子键
D.在离子化合物中,两个氯离子间也存在离子键
2.照相底片定影并回收定影液硫代硫酸钠和银,经历如下过程,下列说法不正确的是:
A.晶体中所含的作用力只有离子键、配位键
B.与是等电子体,结构相似,相当于中O被一个S原子替换
C.该过程中与结合能力:-
D.副产物的键角小于的原因:分子中S的孤电子对对成键电子对的排斥作用使键角变小
3.向盛有硝酸银溶液的试管中加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到无色透明溶液,下列说法中正确的是
A.反应前后Ag+的浓度不变
B.沉淀溶解后,生成的[Ag(NH3)2]OH难电离
C.上述现象说明[Ag(NH3)2]+不如AgOH稳定
D.配合离子[Ag(NH3)2]+中,Ag+提供空轨道,NH3给出孤对电子
4.在碱性镀铜中电镀液的主要成分是,其内界的电离与弱电解质类似,仅部分解离为中心离子和配位体。设NA为阿伏加德罗常数的值,下列说法正确的是
A.1mol/L溶液中数目小于NA
B.22.4LNH3含有的质子数目为10NA
C.1mol的配位键数目为2NA
D.N2和H2合成1molNH3转移电子数目为3NA
5.下列各组离子在给定溶液中一定能大量共存的是
A.与金属铝反应产生的溶液中:
B.含有大量的溶液中:
C.在的氢氧化钡溶液中:
D.能使甲基橙变红的溶液中:
6.多酚氧化酶与植物的抗病性有关。配合物是多酚氧化酶的模型配合物。EDTB的一种合成过程如下:
下列有关说法错误的是
A.乙二醇可与EDTA反应形成环状化合物
B.EDTB中N的杂化轨道类型为、
C.配离子中的配位原子是N
D.EDTA分子中所含元素的第一电离能由小到大的顺序为H
A.基态Cr原子的核外电子排布式应为[Ar]3d54s1
B.中三价铬离子提供空轨道,N、O、Cl提供孤电子对与三价铬离子形成配位键,中心离子的配位数为6
C.NH3分子中的N原子,H2O分子中的O原子均为sp3杂化
D.H2O的键角(104.5°)小于NH3的键角(107.3°)(如图)是因为氧的电负性大于氮的电负性
8.为阿伏加德罗常数的值。下列说法正确的是
A.石墨中所含六元环数目为
B.乙烯和环丙烷混合气体中的氢原子数为
C.配合物完全电离出的数目为
D.标准状况下,中氯原子的数目为
9.下列物质不是配合物的是
A.NaCl B.[Fe(SCN)2]Cl C.[Cu(NH3)4]Cl2 D.[Ag(NH3)2]OH
10.下列叙述中错误的是( )。
A.带相反电荷离子之间的相互吸引力称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键
D.非金属原子间也可能形成离子键
二、填空题
11.近日,比亚迪宣布推出基于磷酸铁锂技术的“刀片电池”,刀片电池能量密度大,安全性高。电池的正极活性材料是LiFePO4。
(1)铁元素位于周期表 ;基态Fe2+的电子排布式为 。
(2)正极材料LiFePO4的阴离子PO的空间构型为 ,磷原子采取的杂化方式为 。
(3)Fe原子或离子外围有较多能量相近的空轨道,能与SCN-、CN-、C2O等形成配合物。[Fe(SCN)6]3-的结构简式如下图所示,其结构中σ键和π键的个数比为 ,[Fe(SCN)6]3-中含有的化学键类型是 。 (填字母)。
a.极性共价键 b.离子键 c.配位键 d.金属键
12.写出下列化合物的电子式
(1)K2O ;
(2)Na2O2 ;
(3)NH4F ;
(4)Ca(OH)2 ;
(5)CH4 ;
(6)H2O2 。
13.
(1)在化工、冶金、电子、电镀等生产部门排放废水中,常常含有一些汞金属元素,汞元素能在生物体内积累,不易排出体外,具有很大的危害。处理含Hg2+废水可加入Na2S或通入H2S,使Hg2+形成HgS沉淀,但如果Na2S过量则达不到去除Hg2+的目的,为什么? ,解决这一问题的方法是再向该废水中加入FeSO4,可有效地使HgS沉降,为什么? 。
(2)铊属于放射性的高危重金属。铊和铊的氧化物都有毒,能使人的中枢神经系统、肠胃系统及肾脏等部位发生病变。人如果饮用了被铊污染的水或吸入了含铊化合物的粉尘,就会引起铊中毒。常用普鲁士蓝作为解毒剂,治疗量为每日250mg/kg,请说明用普鲁士蓝作为解毒剂的化学原理 ,并写出相应的化学方程式 。
(3)在研究酸雨造成的某地土壤的酸化问题时,需pH=10.00的碳酸盐缓冲溶液,在500mL0.20mol/L的NaHCO3溶液中需加入 g的碳酸钠来配制1L的缓冲溶液。(已知H2CO3的pK2=10.25)
14.过渡元素等在生活、科研中有广泛用途和重要研究价值。回答下列问题:
(1)分子作为配体时,碳原子和氧原子均能够提供孤电子对。与钴形成配位化合物时,提供孤电子对的为 (填元素名称)原子。
(2)高氯酸六氨合钴(Ⅱ)的结构为,其外界离子的空间构型为 。
(3)下列对的中心原子采取的杂化类型判断合理的是_______(填标号)。
A. B. C. D.
15.A、B、C、D、代表4种元素,请完成下列问题:
(1)A元素的负一价离子的电子层结构与氩相同,B元素的正一价离子的电子层结构与氙相同,A、B形成的化合物的化学式为 .
(2)C元素的正三价离子的3d轨道为半充满状态,C元素的符号为 .在同期表中位置 ,其基态原子的价电子排布图为 .
(3)D元素基态原子的M层全充满,N层没有成对电子,只有1个未成对电子,其硫酸盐逐滴加入氨水生成难溶物的离子方程式为 ,继续添加氨水,难溶物溶解,得到深蓝色溶液的离子方程为 ,写出阳离子的结构式 .
16.几种物质:
①MgCl2 ②H2O ③Al ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He
(1)只含有离子键的是(选填序号,下同) ;
(2)含有共价键的离子化合物是 ;
(3)共价化合物是 ;
(4)熔融状态时和固态时,都能导电的是 ;
(5)HClO的结构式 ,I2的电子式 。
17.三价铬离子(Cr3+)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。回答下列问题:
(1)Cr的价层电子排布式为 。
(2)O、N、C的第一电离能由大到小的顺序为 。
(3)SO2分子的VSEPR模型名称为 ,其中心原子的杂化方式为 。
(4)化学式为CrCl3 6H2O的化合物有多种结构,其中一种可表示为[CrCl2(H2O)4]Cl 2H2O,该物质的配离子中提供孤电子对的原子为 ,配位数为 。
18.配位键
(1)配位键的形成:成键原子一方提供 ,另一方提供 形成共价键。
(2)配位键的表示:常用“ ”来表示配位键,箭头指向接受孤电子对的原子,如可表示为 ,在中,虽然有一个形成过程与其他3个形成过程不同,但是一旦形成之后,4个共价键就完全 。
19.离子键的形成
形成过程:电负性较大的非金属元素的原子容易 形成阴离子,电负性较小的金属元素的原子容易 形成阳离子。当这两种原子相互接近到一定程度时,容易发生电子得、失而形成阴、阳离子,阴、阳离子通过 可形成稳定的化合物。
实质:离子键的实质是 之间的 作用。包括 和 。
形成条件:成键原子所属元素的 差值越大,原子之间越容易发生 ,形成离子键。
20.已知Co(NH3)5BrSO4可形成两种钴的配合物,若在配合物[Co(NH3)5Br]SO4的溶液中加入BaCl2溶液时,现象是 ;若在配合物[Co(SO4)(NH3)5]Br的溶液中加入BaCl2溶液时,现象是 ,若加入AgNO3溶液时,现象是 。
三、实验题
21.某课外小组研究NH4Cl与CuO反应,进行如下实验(部分装置略):
实验 Ⅰ Ⅱ
装置
现象 向CuO粉末中加入0.1mol·L 1NH4Cl溶液,浸泡一段时间后,固体部分溶解,表面无颜色变化,溶液变为蓝色 加热试管,产生白烟,试管口有白色固体;试管中有水生成,继续加热,黑色固体变蓝,最终部分变为黄色
资料:Cu(NH3) Cu2++4NH3
(1)实验Ⅰ中,固体部分溶解的原因是 (用化学用语解释)。该小组同学预测蓝色溶液中可能存在Cu(NH3)。
①Cu(NH3)中,Cu2+与NH3形成的化学键称为 ,提供孤电子对的成键原子是 。
②设计实验方案验证蓝色溶液中存在Cu(NH3)。
(2)实验Ⅱ中黑色固体变蓝,最终部分固体变为黄色的过程中,发生了如下变化:
对物质X,做出如下假设:
ⅰ.X是NH4Cl,由CuCl2生成CuCl的化学反应方程式是 。
ⅱ.X是 ,理由是 。
(3)实验Ⅰ过程中未观察到氧化还原反应的产物,实验Ⅱ反应过程中有氧化还原反应发生。反应不同可能的原因是 。
22.三氯化六氨合钴(III){[Co(NH3)6]Cl3}是一种重要的原料。实验室以活性炭为催化剂,用H2O2、CoCl2为原料制备[Co(NH3)6]Cl3,反应过程中会放出大量的热。
已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
②[Co(NH3)6]Cl3在水中的溶解度曲线图所示。
③加入少量浓盐酸有利于[Co(NH3)6]Cl3析出。
制备[Co(NH3)6]Cl3实验步骤如下:
I.称取研细的CoCl2 6H2O10.0g和NH4Cl5.0g于烧杯中溶解,将溶液转入三颈烧瓶,加入25mL浓氨水和适量活性炭粉末,控制温度在10℃以下,逐滴加入5mL30%的H2O2溶液。实验装置如图所示。
II.将混合物在水浴1中反应一段时间,再改用水浴2处理,充分结晶后过滤。
III.……
(1)上图中仪器a的名称为 。
(2)步骤I将Co2+转化[Co(NH3)6]3+过程中,先加浓氨水,后加H2O2溶液的目的是 。
(3)步骤II中采用“冰水浴”的是 (填“水浴1”或“水浴2”)。制备[Co(NH3)6]Cl3的总反应化学方程式为 。
(4)[Co(NH3)6]Cl3配合物的内界为 (用化学式表示)。
(5)步骤III是为了获得纯净的[Co(NH3)6]Cl3。设计由步骤II过滤后的滤渣获取[Co(NH3)6]Cl3的实验方案:向滤渣中加入80℃左右的热水,充分搅拌后, ,低温干燥(实验中须使用的试剂:浓盐酸、无水乙醇)。
23.三氯化六氨合钴是一种橙黄色晶体,可溶于水和稀酸溶液、不溶于乙醇,与热的强碱溶液反应产生、.某实验小组利用下列方法制备并测定其组成.
I.制备晶体:
向锥形瓶中加入适量研细的、和蒸馏水.加热溶解后加入活性炭催化剂.冷却,加入浓氨水,继续冷却至10℃以下,缓慢加入双氧水,水浴加热至60℃左右并恒温20min,然后用冰水冷却,生成产品沉淀.抽滤,将沉淀溶解于50mL沸热的稀盐酸中,趁热过滤.在滤液中缓慢加入浓盐酸,立即有大量橙黄色晶体析出,冷却、过滤、洗涤、干燥.
Ⅱ.测定晶体组成:
(ⅰ)氨含量的测定(装置如图所示):
称取样品于锥形瓶中,加水溶解.在另一锥形瓶中加入标准HCl溶液并置于冰水浴中.从漏斗中加入足量20%的NaOH溶液,加热,保持微沸状态并持续1小时左右.然后取出插入标准HCl溶液中的导管,用纯水冲洗导管内外,洗涤液并入装有标准HCl溶液的锥形瓶中.取出锥形瓶,加入指示剂,用NaOH标准溶液滴定剩余的HCl,达到滴定终点时消耗NaOH标准溶液.
(ⅱ)钴含量的测定:
将上述左侧锥形瓶内样品残渣转移到碘量瓶中,冷却后加入足量KI溶液,立即盖上瓶塞并充分振荡后,加入浓盐酸,在暗处放置15min(还原产物为)。然后加入蒸馏水和淀粉溶液,用标准溶液滴定至终点,记录消耗标准溶液的体积(已知:)。
回答下列问题:
(1)制备实验中,生成的化学方程式为 。
(2)“水浴加热至60℃”的原因为 ;“洗涤”时适宜选择的洗涤剂为 。
(3)由氨含量的测定实验,可得样品中氨的质量分数为 (用含、、、、m的代数式表示);若省略“纯水冲洗导管内外”,会使测定结果 (填“偏高”、“偏低”或“无影响”)。
(4)钴含量的测定实验中,含钴粒子发生反应的离子方程式为 ;滴定终点时溶液颜色的变化为 。
(5)小组成员查阅资料得知,若不加活性炭催化剂,制备产物主要是。现有10mL浓度为的或溶液,请设计实验区分: 。
参考答案:
1.C
2.A
3.D
4.D
5.C
6.D
7.D
8.B
9.A
10.A
11.(1) 第四周期Ⅷ族 1s22s22p63s23p63d6
(2) 正四面体形 sp3
(3) 3:2 ac
12.
13.(1) 如果Na2S过量,会生成[HgS2]2-,而使HgS溶解,达不到去除Hg2+的目的 去除过量S2—
(2) 普鲁士蓝作为解毒剂是因为普鲁士蓝具有离子交换剂的作用,铊离子可置换普鲁士蓝中的钾离子随粪便排出 KFeIII[FeII(CN)6](s)+Tl+=TlFe[Fe(CN)6](s)+K+
(3)6.0
14.(1)碳
(2)正四面体形
(3)C
15. CsCl Fe 第四周期,第ⅤⅢ族 3d64s2 Cu2++2NH3 H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3 =[Cu(NH3)4]2++2OH﹣
16.(1)①
(2)⑤⑥
(3)②④⑦
(4)③
(5) H-O-Cl
17.(1)3d54s1
(2)N>O>C
(3) 平面三角形 sp2杂化
(4) O、Cl 6
18.(1) 孤电子对 空轨道
(2) → 相同
19. 得到 失去 静电作用 阴、阳离子 静电 静电引力 静电斥力 电负性 电子得失
20. 产生白色沉淀 无明显现象 产生淡黄色沉淀
21.(1) CuO+2NH4Cl=CuCl2+2NH3+H2O 配位键 N 取两份等体积的实验I中溶液于两试管中,分别加入等量的水和稀硫酸,加入稀硫酸的溶液颜色变得更浅;取少量实验I中溶液少许于一试管中,加热,溶液颜色变浅,即可验证蓝色溶液中存在Cu(NH3)
(2) 2NH4Cl+6CuCl26CuCl+N2+8HCl NH3 NH4Cl受热分解生成NH3,NH3有还原性
(3)由于温度低等原因,NH4Cl溶液与CuO无法发生氧化还原反应;NH4Cl溶液与CuO的氧化还原反应的化学反应速率慢、反应限度小等
22.(1)分液漏斗
(2)将不易被氧化的Co2+转化为具有较强还原性的[Co(NH3)6]2+
(3) 水浴2 H2O2+2CoCl2+2NH4Cl+10NH3 H2O=2Co(NH3)6Cl3+12H2O或H2O2+2CoCl2+2NH4Cl+10NH3=2Co(NH3)6Cl3+2H2O
(4)[Co(NH3)6]3+
(5)趁热过滤,冷却后向滤液中加入少量浓盐酸,边加边搅拌,充分静置后过滤,用无水乙醇洗涤晶体2~3次
23.(1)
(2) 温度过低,反应速率较慢,温度过高,双氧水和浓氨水分解挥发 乙醇
(3) 偏高
(4) 溶液蓝色褪去
(5)取两种溶液各10mL,加入指示剂,用溶液滴定,若消耗20mL,则为;若消耗30mL,则为
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
