2024科粤版九年级化学上学期单元测试卷--第四章生命之源——水测试卷(含解析)
文档属性
| 名称 | 2024科粤版九年级化学上学期单元测试卷--第四章生命之源——水测试卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-08 22:39:50 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2024科粤版九年级化学上学期单元测试卷
第四章 生命之源——水
时间:45分钟 满分:100分
可能用到的相对原子质量:H—1 C—12 O—16 S—32 Ca—40 Cu—64
一、选择题(每小题3分,共36分,每小题只有一个选项符合题意)
1.下列工业、农业和日常生活中的用水方式不宜提倡的是 ( )
A.打扫教室时,先喷洒水后扫地
B.农业上对农作物采用滴灌浇水
C.洗澡擦沐浴露时不关上淋浴喷头
D.工业用水循环使用
2.水可以造福人类,但水被污染后会给人类造成灾难。为了防止水被污染,下面各项可采用的是:①抑制水中所有动植物的生长,②不任意排放工业废水,③禁止使用农药和化肥,④生活污水经过净化处理后再排放。 ( )
A.①② B.②③ C.②④ D.③④
3.在淡水缺乏的海岛上,可利用如图所示简易装置从海水中获取淡水。
下列说法不正确的是 ( )
A.水杯中的水是淡水
B.从海水中获取淡水是物理变化
C.海水通过活性炭吸附也能获取淡水
D.获取淡水的快慢与温度有关
4.水是生命之源,下列有关水的说法正确的是 ( )
A.电解水的实验中,得到的氧气与氢气的体积比为1∶2
B.可用肥皂水区分硬水和软水,硬水属于混合物,软水属于纯净物
C.过滤、吸附、蒸馏、消毒等都是常用的净水方法,发生的变化都是物理变化
D.地球上的水储量是丰富的,所以可以不用节约用水
5.在化学反应前后,一定不变的是 ( )
①原子数目 ②分子数目 ③分子种类 ④物质种类 ⑤元素化合价 ⑥原子质量 ⑦物质的总质量 ⑧元素种类
A.①②⑥⑦ B.①⑥⑦⑧ C.①② D.⑦⑧
6.甲烷燃烧的化学方程式为CH4+2O22H2O+CO2,从中可以获取的信息是 ( )
A.在反应前后,分子、原子的种类、数目都没有变化
B.该反应既属于氧化反应又属于化合反应
C.16 g甲烷完全燃烧可以生成18 g水
D.参加反应的甲烷和氧气的分子个数比为1∶2
7.下列化学方程式书写正确的是 ( )
A.铁丝在氧气中燃烧:4Fe+3O22Fe2O3
B.实验室用氯酸钾制氧气:KClO3KCl+O2↑
C.实验室用过氧化氢制取氧气:2H2O22H2O+O2↑
D.镁带燃烧:Mg+O2MgO2
8.下列关于质量守恒定律的说法正确的是 ( )
A.高锰酸钾分解后固体质量变小,符合质量守恒定律
B.只要有气体参加或生成的反应均不遵守质量守恒定律
C.10 g白糖完全溶于70 g水可得到80 g糖水,遵守质量守恒定律
D.引燃密闭容器中的a g氢气和b g氧气,冷却后得到水的质量一定等于(a+b) g
9.电解水实验中产生气体的体积与反应时间的关系如图所示。下列分析正确的是 ( )
A.与电源负极相连的电极上产生的气体是N
B.检验气体M、N可证明水的组成
C.气体M、N的质量比为1∶2
D.通电后气体产生的速率相同
10.现用C3H4合成C5H8O2,若让反应物中的原子100%转化为C5H8O2,即可实现“零排放”。若该反应中反应物和生成物的化学计量数都为1,则应选择的另外两种反应物为 ( )
A.H2和CO B.CO2和H2O
C.H2和CH3OH D.CO和CH3OH
11.用甲烷和水在一定条件下可以制取水煤气(混合气体),其反应的微观示意图如图所示,下列根据微观示意图得出的结论正确的是 ( )
A.反应前后各元素的化合价均不变
B.水煤气的成分是一氧化碳和氧气
C.该反应中含氢元素的化合物有三种
D.该反应的化学方程式中甲烷和水的化学计量数之比为1∶1
12.已知一定质量的炭粉(其成分认为全部是碳)与铜粉的固体混合物在空气中灼烧,完全反应后剩余固体的质量不变,则原固体混合物中碳的质量分数是 ( )
A.20% B.80% C.12% D.64%
二、填空及简答题(共26分)
13.(4分)结合对质量守恒定律的理解,回答下列问题:
(1)水在催化剂的作用下不可能变成汽油,理由是 ;
(2)由CaCO3CaO+CO2↑可知,若将20 g CaCO3高温分解,当剩余固体质量为15.6 g时,生成CO2的质量为 g。
14.(6分)配平下列化学方程式:
(1) Fe+ Cl2 FeCl3
(2) FeS2+ O2 Fe2O3+ SO2
(3) CuO+ C Cu+ CO2
15.(8分)水是宝贵的自然资源。如图是自来水生产流程的简化图,请根据下列情况回答问题。
(1)流程中起到絮凝作用的试剂A常用 (填物质名称)。
(2)试剂B可以用来除异味,利用了试剂B的 性。
(3)生活中常用的直饮水,生产中采用核心的“活性炭+超滤膜+紫外线”组合工艺,紫外线的作用相当于自来水生产中试剂C的作用,杀菌过程发生的是 (填“物理”或“化学”)变化。
(4)自来水中含有少量碳酸氢钙[化学式为Ca(HCO3)2]等可溶性化合物,烧水时碳酸氢钙发生分解反应,生成难溶性的碳酸钙、水和二氧化碳,这就是水壶中出现水垢的原因之一。请写出碳酸氢钙受热分解的化学方程式 。
16.(8分)在宏观、微观和符号之间建立联系是化学学科的特点。A、B、C、D表示四种物质,其微观示意图见下表:
(1)依据微观示意图判断,D是由 (填“分子”或“原子”)构成的;
(2)A和B在一定条件下反应生成C和D,反应的化学方程式为 ,若16 g B参加反应,则生成的D的质量为 g;
(3)A和B在点燃条件下充分反应,可以生成D和F两种物质。已知F是一种氧化物,其中含氧元素的质量分数为50%,则F的化学式为 。
三、实验与探究题(共28分)
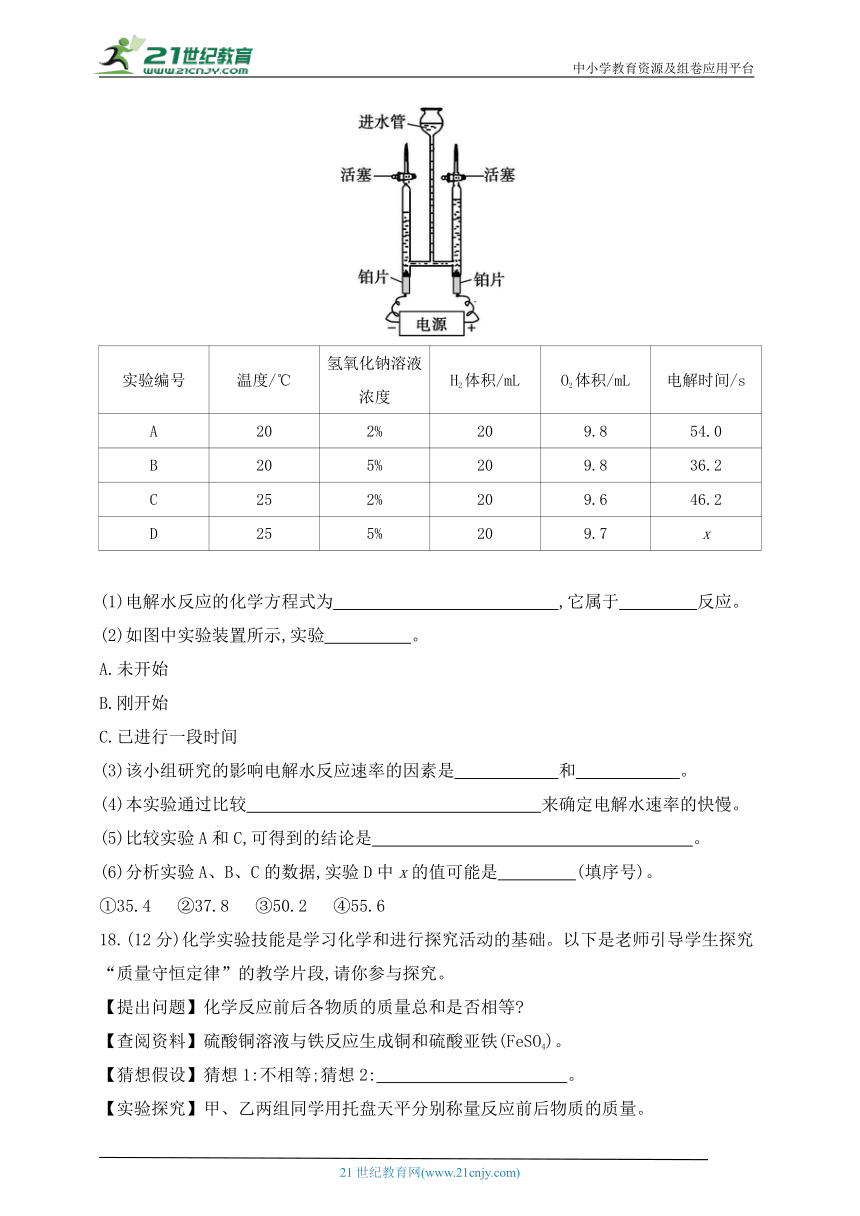
17.(16分)纯水的导电能力很弱,电解水时常在水中加入一些氢氧化钠或硫酸钠,以增强水的导电性。为研究影响电解水反应速率的因素,某课外活动小组进行了实验探究,实验装置如图所示,数据记录如表(直流电,电压:12 V),请回答问题:
实验编号 温度/℃ 氢氧化钠溶液浓度 H2体积/mL O2体积/mL 电解时间/s
A 20 2% 20 9.8 54.0
B 20 5% 20 9.8 36.2
C 25 2% 20 9.6 46.2
D 25 5% 20 9.7 x
(1)电解水反应的化学方程式为 ,它属于 反应。
(2)如图中实验装置所示,实验 。
A.未开始
B.刚开始
C.已进行一段时间
(3)该小组研究的影响电解水反应速率的因素是 和 。
(4)本实验通过比较 来确定电解水速率的快慢。
(5)比较实验A和C,可得到的结论是 。
(6)分析实验A、B、C的数据,实验D中x的值可能是 (填序号)。
①35.4 ②37.8 ③50.2 ④55.6
18.(12分)化学实验技能是学习化学和进行探究活动的基础。以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究。
【提出问题】化学反应前后各物质的质量总和是否相等
【查阅资料】硫酸铜溶液与铁反应生成铜和硫酸亚铁(FeSO4)。
【猜想假设】猜想1:不相等;猜想2: 。
【实验探究】甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲组 乙组
将甲组试管中的溶液倾倒进容器中,乙组铁钉放入CuSO4溶液并盖好塞子
实验现象 有气泡产生,天平指针向右偏转 铁钉表面有红色物质析出,溶液颜色发生改变,天平指针没有偏转
结论 猜想1正确 猜想2正确 反应的化学方程式为
【反思评价】究竟哪种猜想正确 通过讨论,同学们发现甲组同学实验过程中有气体逸出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体参与的反应一定要在 中进行。
【优化装置】甲组同学对反应装置进行如下三种改进,查阅资料后发现最佳装置是B,则猜想B中氢氧化钠具有的化学性质是 。
A B C
【得出结论】甲组同学利用改进后的最佳装置进行再次探究实验,均得出猜想2正确。最终得出结论: 的各物质的质量总和等于反应生成的各物质的质量总和。
【解释与应用】化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
硝酸铵(NH4NO3)固体在不同温度下发生不同的分解反应,则下列各物质不可能是其分解产物的是 (填序号)。
A.NH3 B.H2O C.SO2 D.N2
四、分析与计算题(共10分)
19.(10分)小明喜欢养金鱼,他上网查阅资料得知:鱼缸中每升水的氧气含量低于0.003 g时,鱼就会死亡,过氧化钙(CaO2)是一种化学增氧剂,其反应原理是2CaO2+2H2O2□+O2↑。请回答下列问题:
(1)该反应原理中□中物质的化学式为 。
(2)小明将2.88 g过氧化钙放入盛有200 L水的鱼缸中,请你通过计算分析,当氧气完全释放后,鱼缸中水的溶氧量是否符合最低要求 (假设产生的氧气完全溶于水,其他因素忽略不计)
第四章 生命之源——水
1 2 3 4 5 6 7 8 9 10 11 12
C C C A B D C A B D D A
1.C 打扫教室时,先喷洒水后扫地,可以防止灰尘飘起;农业上对农作物采用滴灌浇水,可以节约用水;洗澡擦沐浴露时不关上淋浴喷头,会浪费水资源;工业用水循环使用可节约用水。故选C。
2.C 水中很多动植物对人类有着重要作用,不能全部抑制其生长;不任意排放工业废水可防止水污染;农药和化肥对提高农作物的产量和质量有着重要作用,不能禁止使用,应合理使用;生活污水净化处理后再排放可防止水污染。
3.C 利用该装置得到淡水的原理是海水中的水变成水蒸气,然后水蒸气在塑料膜上凝结成水,滴落到水杯中,水杯中的水属于淡水,A正确;从海水中获取淡水的过程中没有新物质生成,是物理变化,B正确;活性炭具有吸附性,只能除去水中的色素和异味,不能将海水淡化,C错误;温度越高,海水中的水蒸发得越快,获取淡水越快,所以获取淡水的快慢与温度有关,D正确。
4.A 电解水的实验中,得到的氧气与氢气的体积比为1∶2,故A正确;可用肥皂水区分硬水和软水,硬水、软水都属于混合物,故B错误;过滤、吸附、蒸馏三种净水方法发生的变化都是物理变化,消毒发生的变化是化学变化,故C错误;地球上的水储量是丰富的,但可供利用的淡水资源是有限的,我们需要节约用水,故D错误。
5.B 化学变化的本质是分子分成原子,原子再重新构成新分子或组成新物质的过程,原子的种类、数目、质量均不变,元素的种类不变,分子种类一定会发生改变,分子的数目可能发生改变。元素的化合价可能改变。化学变化有新物质生成,物质种类一定会发生改变。由质量守恒定律,反应前后物质的总质量不变。故①⑥⑦⑧一定不变。
6.D 在反应前后,分子的种类发生了改变,原子的种类、数目都没有变化,A错误。该反应是物质与氧气发生的化学反应,属于氧化反应;该反应的生成物是两种,不符合“多变一”的形式,不符合化合反应的特征,不属于化合反应,B错误。该反应可读作:每16份质量的甲烷和64份质量的氧气在点燃条件下恰好反应生成36份质量的水和44份质量的二氧化碳,则16 g甲烷完全燃烧可以生成36 g水,C错误。从微观上,点燃条件下,1个甲烷分子和2个氧分子反应生成2个水分子和1个二氧化碳分子,参加反应的甲烷和氧气的分子个数比为1∶2,D正确。故选D。
7.C 铁在氧气中燃烧生成四氧化三铁,正确的化学方程式为3Fe+2O2Fe3O4,故A错误。氯酸钾在二氧化锰作催化剂并加热条件下生成氯化钾和氧气,正确的化学方程式为2KClO32KCl+3O2↑,故B错误。镁带燃烧生成氧化镁,氧化镁的化学式为MgO,正确的化学方程式为2Mg+O22MgO,故D错误。
8.A 高锰酸钾分解产生气体,剩余固体的质量变小,符合质量守恒定律,A正确;化学反应都符合质量守恒定律,和反应物、生成物的状态无关,B错误;质量守恒定律只适用于化学变化不适用于物理变化,C错误;若氢气和氧气恰好完全反应,则生成水的质量等于(a+b)g,若氢气或氧气剩余,则生成水的质量小于(a+b)g,D错误。
9.B 与电源负极相连的电极上产生的气体是M(氢气);检验气体M、N(氧气)可证明水的组成,即电解水生成氢气和氧气,说明水由氢元素、氧元素组成;气体M、N的体积比为2∶1,质量比为1∶8;通电后气体产生的速率不同,产生氢气比产生氧气速率快。故选B。
10.D C5H8O2中C、H、O原子个数比为5∶8∶2,C3H4中C、H原子个数比为3∶4。用C3H4合成C5H8O2,若让反应物中的原子100%转化为C5H8O2,且反应物和生成物的化学计量数都为1,因为化学反应前后原子种类和个数不变,所以另外两种反应物中含有C、H、O的原子个数比为2∶4∶2。D符合题意。
11.D 观察题图可知,该反应的化学方程式为CH4+H2O CO+3H2,反应前后碳、氢元素的化合价发生了改变,A不正确;水煤气的成分是一氧化碳和氢气,B不正确;该反应中含氢元素的化合物有CH4和H2O两种,C不正确。
12.A 铜与氧气反应生成氧化铜而使固体质量增大,碳与氧气反应生成二氧化碳气体而使固体质量减少;反应前后固体质量不变,则与铜反应的氧气的质量与混合物中碳的质量相等。设混合物中碳的质量为m,则与铜反应的氧气质量为m,设混合物中铜的质量为x,则有:
2Cu+O22CuO
128 32
x m
=
x=4m
则原固体混合物中碳的质量分数=×100%=20%。
13.(每空2分)(1)根据质量守恒定律,反应前后元素的种类不变
(2)4.4
14.(每小题2分)(1)2 3 2 (2)4 11 2 8
(3)2 1 2 1
【解题思路】(1)利用最小公倍数法进行配平,以氯原子作为配平的起点,氯气、氯化铁前面的化学计量数分别为3、2,最后调整铁前面的化学计量数为2。
(2)本题可利用“定一法”进行配平,把Fe2O3的化学计量数定为1,则FeS2、O2、SO2前面的化学计量数分别为2、、4,同时扩大2倍,则FeS2、O2、Fe2O3、SO2前面的化学计量数分别为4、11、2、8。(3)利用最小公倍数法进行配平,以氧原子作为配平的起点,氧化铜、二氧化碳前面的化学计量数分别为2、1,最后调整碳、铜前面的化学计量数为1、2。
15.(每空2分)(1)明矾 (2)吸附 (3)化学
(4)Ca(HCO3)2CaCO3+H2O+CO2↑
16.(每空2分)(1)分子 (2)2H2S+O22S+2H2O 18 (3)SO2
【解题思路】(1)由表格中的图像,可知D物质是水,由分子构成。(2)A和B在一定条件下反应生成C和D,发生反应的化学方程式为2H2S+O22S+2H2O。根据化学反应中B和D的质量比为32∶36,则16 g B完全反应后生成的D的质量为18 g。(3)A和B分别为H2S和O2,根据化学反应前后元素种类不变,生成物中D为H2O,F是一种氧化物,其中一定含硫元素,且其中含氧元素的质量分数为50%,则F为SO2。
17.(每空2分)(1)2H2O2H2↑+O2↑ 分解 (2)C (3)温度 氢氧化钠溶液浓度 (4)得到相同体积氢气所用的时间 (5)氢氧化钠溶液浓度相同时,温度越高,电解水的速率越快 (6)①
18.(每空2分)【猜想假设】相等 【实验探究】CuSO4+FeFeSO4+Cu 【反思评价】密闭装置 【优化装置】能与二氧化碳气体反应 【得出结论】参加反应 【解释与应用】C
【解题思路】有气体参加或生成的反应用于检验质量守恒定律时,为使所有的反应物和生成物都被称量到,应在密闭装置中进行实验。碳酸钠和稀盐酸反应产生的二氧化碳气体可以和氢氧化钠溶液反应。质量守恒定律的内容是参加反应的各物质的质量总和等于反应生成的各物质的质量总和。化学反应前后元素的种类不变,硝酸铵中不含硫元素,其分解不可能得到二氧化硫。
19.(1)Ca(OH)2 (3分)
(2)设生成的氧气的质量为x。
2CaO2+2H2O2Ca(OH)2 +O2↑
144 32
2.88 g x
= (3分)
x=0.64 g (2分)
则每升水中溶解的氧气的质量为×1 L=0.003 2 g>0.003 g。 (2分)
答:鱼缸中水的溶氧量符合最低要求。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024科粤版九年级化学上学期单元测试卷
第四章 生命之源——水
时间:45分钟 满分:100分
可能用到的相对原子质量:H—1 C—12 O—16 S—32 Ca—40 Cu—64
一、选择题(每小题3分,共36分,每小题只有一个选项符合题意)
1.下列工业、农业和日常生活中的用水方式不宜提倡的是 ( )
A.打扫教室时,先喷洒水后扫地
B.农业上对农作物采用滴灌浇水
C.洗澡擦沐浴露时不关上淋浴喷头
D.工业用水循环使用
2.水可以造福人类,但水被污染后会给人类造成灾难。为了防止水被污染,下面各项可采用的是:①抑制水中所有动植物的生长,②不任意排放工业废水,③禁止使用农药和化肥,④生活污水经过净化处理后再排放。 ( )
A.①② B.②③ C.②④ D.③④
3.在淡水缺乏的海岛上,可利用如图所示简易装置从海水中获取淡水。
下列说法不正确的是 ( )
A.水杯中的水是淡水
B.从海水中获取淡水是物理变化
C.海水通过活性炭吸附也能获取淡水
D.获取淡水的快慢与温度有关
4.水是生命之源,下列有关水的说法正确的是 ( )
A.电解水的实验中,得到的氧气与氢气的体积比为1∶2
B.可用肥皂水区分硬水和软水,硬水属于混合物,软水属于纯净物
C.过滤、吸附、蒸馏、消毒等都是常用的净水方法,发生的变化都是物理变化
D.地球上的水储量是丰富的,所以可以不用节约用水
5.在化学反应前后,一定不变的是 ( )
①原子数目 ②分子数目 ③分子种类 ④物质种类 ⑤元素化合价 ⑥原子质量 ⑦物质的总质量 ⑧元素种类
A.①②⑥⑦ B.①⑥⑦⑧ C.①② D.⑦⑧
6.甲烷燃烧的化学方程式为CH4+2O22H2O+CO2,从中可以获取的信息是 ( )
A.在反应前后,分子、原子的种类、数目都没有变化
B.该反应既属于氧化反应又属于化合反应
C.16 g甲烷完全燃烧可以生成18 g水
D.参加反应的甲烷和氧气的分子个数比为1∶2
7.下列化学方程式书写正确的是 ( )
A.铁丝在氧气中燃烧:4Fe+3O22Fe2O3
B.实验室用氯酸钾制氧气:KClO3KCl+O2↑
C.实验室用过氧化氢制取氧气:2H2O22H2O+O2↑
D.镁带燃烧:Mg+O2MgO2
8.下列关于质量守恒定律的说法正确的是 ( )
A.高锰酸钾分解后固体质量变小,符合质量守恒定律
B.只要有气体参加或生成的反应均不遵守质量守恒定律
C.10 g白糖完全溶于70 g水可得到80 g糖水,遵守质量守恒定律
D.引燃密闭容器中的a g氢气和b g氧气,冷却后得到水的质量一定等于(a+b) g
9.电解水实验中产生气体的体积与反应时间的关系如图所示。下列分析正确的是 ( )
A.与电源负极相连的电极上产生的气体是N
B.检验气体M、N可证明水的组成
C.气体M、N的质量比为1∶2
D.通电后气体产生的速率相同
10.现用C3H4合成C5H8O2,若让反应物中的原子100%转化为C5H8O2,即可实现“零排放”。若该反应中反应物和生成物的化学计量数都为1,则应选择的另外两种反应物为 ( )
A.H2和CO B.CO2和H2O
C.H2和CH3OH D.CO和CH3OH
11.用甲烷和水在一定条件下可以制取水煤气(混合气体),其反应的微观示意图如图所示,下列根据微观示意图得出的结论正确的是 ( )
A.反应前后各元素的化合价均不变
B.水煤气的成分是一氧化碳和氧气
C.该反应中含氢元素的化合物有三种
D.该反应的化学方程式中甲烷和水的化学计量数之比为1∶1
12.已知一定质量的炭粉(其成分认为全部是碳)与铜粉的固体混合物在空气中灼烧,完全反应后剩余固体的质量不变,则原固体混合物中碳的质量分数是 ( )
A.20% B.80% C.12% D.64%
二、填空及简答题(共26分)
13.(4分)结合对质量守恒定律的理解,回答下列问题:
(1)水在催化剂的作用下不可能变成汽油,理由是 ;
(2)由CaCO3CaO+CO2↑可知,若将20 g CaCO3高温分解,当剩余固体质量为15.6 g时,生成CO2的质量为 g。
14.(6分)配平下列化学方程式:
(1) Fe+ Cl2 FeCl3
(2) FeS2+ O2 Fe2O3+ SO2
(3) CuO+ C Cu+ CO2
15.(8分)水是宝贵的自然资源。如图是自来水生产流程的简化图,请根据下列情况回答问题。
(1)流程中起到絮凝作用的试剂A常用 (填物质名称)。
(2)试剂B可以用来除异味,利用了试剂B的 性。
(3)生活中常用的直饮水,生产中采用核心的“活性炭+超滤膜+紫外线”组合工艺,紫外线的作用相当于自来水生产中试剂C的作用,杀菌过程发生的是 (填“物理”或“化学”)变化。
(4)自来水中含有少量碳酸氢钙[化学式为Ca(HCO3)2]等可溶性化合物,烧水时碳酸氢钙发生分解反应,生成难溶性的碳酸钙、水和二氧化碳,这就是水壶中出现水垢的原因之一。请写出碳酸氢钙受热分解的化学方程式 。
16.(8分)在宏观、微观和符号之间建立联系是化学学科的特点。A、B、C、D表示四种物质,其微观示意图见下表:
(1)依据微观示意图判断,D是由 (填“分子”或“原子”)构成的;
(2)A和B在一定条件下反应生成C和D,反应的化学方程式为 ,若16 g B参加反应,则生成的D的质量为 g;
(3)A和B在点燃条件下充分反应,可以生成D和F两种物质。已知F是一种氧化物,其中含氧元素的质量分数为50%,则F的化学式为 。
三、实验与探究题(共28分)
17.(16分)纯水的导电能力很弱,电解水时常在水中加入一些氢氧化钠或硫酸钠,以增强水的导电性。为研究影响电解水反应速率的因素,某课外活动小组进行了实验探究,实验装置如图所示,数据记录如表(直流电,电压:12 V),请回答问题:
实验编号 温度/℃ 氢氧化钠溶液浓度 H2体积/mL O2体积/mL 电解时间/s
A 20 2% 20 9.8 54.0
B 20 5% 20 9.8 36.2
C 25 2% 20 9.6 46.2
D 25 5% 20 9.7 x
(1)电解水反应的化学方程式为 ,它属于 反应。
(2)如图中实验装置所示,实验 。
A.未开始
B.刚开始
C.已进行一段时间
(3)该小组研究的影响电解水反应速率的因素是 和 。
(4)本实验通过比较 来确定电解水速率的快慢。
(5)比较实验A和C,可得到的结论是 。
(6)分析实验A、B、C的数据,实验D中x的值可能是 (填序号)。
①35.4 ②37.8 ③50.2 ④55.6
18.(12分)化学实验技能是学习化学和进行探究活动的基础。以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究。
【提出问题】化学反应前后各物质的质量总和是否相等
【查阅资料】硫酸铜溶液与铁反应生成铜和硫酸亚铁(FeSO4)。
【猜想假设】猜想1:不相等;猜想2: 。
【实验探究】甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲组 乙组
将甲组试管中的溶液倾倒进容器中,乙组铁钉放入CuSO4溶液并盖好塞子
实验现象 有气泡产生,天平指针向右偏转 铁钉表面有红色物质析出,溶液颜色发生改变,天平指针没有偏转
结论 猜想1正确 猜想2正确 反应的化学方程式为
【反思评价】究竟哪种猜想正确 通过讨论,同学们发现甲组同学实验过程中有气体逸出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体参与的反应一定要在 中进行。
【优化装置】甲组同学对反应装置进行如下三种改进,查阅资料后发现最佳装置是B,则猜想B中氢氧化钠具有的化学性质是 。
A B C
【得出结论】甲组同学利用改进后的最佳装置进行再次探究实验,均得出猜想2正确。最终得出结论: 的各物质的质量总和等于反应生成的各物质的质量总和。
【解释与应用】化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
硝酸铵(NH4NO3)固体在不同温度下发生不同的分解反应,则下列各物质不可能是其分解产物的是 (填序号)。
A.NH3 B.H2O C.SO2 D.N2
四、分析与计算题(共10分)
19.(10分)小明喜欢养金鱼,他上网查阅资料得知:鱼缸中每升水的氧气含量低于0.003 g时,鱼就会死亡,过氧化钙(CaO2)是一种化学增氧剂,其反应原理是2CaO2+2H2O2□+O2↑。请回答下列问题:
(1)该反应原理中□中物质的化学式为 。
(2)小明将2.88 g过氧化钙放入盛有200 L水的鱼缸中,请你通过计算分析,当氧气完全释放后,鱼缸中水的溶氧量是否符合最低要求 (假设产生的氧气完全溶于水,其他因素忽略不计)
第四章 生命之源——水
1 2 3 4 5 6 7 8 9 10 11 12
C C C A B D C A B D D A
1.C 打扫教室时,先喷洒水后扫地,可以防止灰尘飘起;农业上对农作物采用滴灌浇水,可以节约用水;洗澡擦沐浴露时不关上淋浴喷头,会浪费水资源;工业用水循环使用可节约用水。故选C。
2.C 水中很多动植物对人类有着重要作用,不能全部抑制其生长;不任意排放工业废水可防止水污染;农药和化肥对提高农作物的产量和质量有着重要作用,不能禁止使用,应合理使用;生活污水净化处理后再排放可防止水污染。
3.C 利用该装置得到淡水的原理是海水中的水变成水蒸气,然后水蒸气在塑料膜上凝结成水,滴落到水杯中,水杯中的水属于淡水,A正确;从海水中获取淡水的过程中没有新物质生成,是物理变化,B正确;活性炭具有吸附性,只能除去水中的色素和异味,不能将海水淡化,C错误;温度越高,海水中的水蒸发得越快,获取淡水越快,所以获取淡水的快慢与温度有关,D正确。
4.A 电解水的实验中,得到的氧气与氢气的体积比为1∶2,故A正确;可用肥皂水区分硬水和软水,硬水、软水都属于混合物,故B错误;过滤、吸附、蒸馏三种净水方法发生的变化都是物理变化,消毒发生的变化是化学变化,故C错误;地球上的水储量是丰富的,但可供利用的淡水资源是有限的,我们需要节约用水,故D错误。
5.B 化学变化的本质是分子分成原子,原子再重新构成新分子或组成新物质的过程,原子的种类、数目、质量均不变,元素的种类不变,分子种类一定会发生改变,分子的数目可能发生改变。元素的化合价可能改变。化学变化有新物质生成,物质种类一定会发生改变。由质量守恒定律,反应前后物质的总质量不变。故①⑥⑦⑧一定不变。
6.D 在反应前后,分子的种类发生了改变,原子的种类、数目都没有变化,A错误。该反应是物质与氧气发生的化学反应,属于氧化反应;该反应的生成物是两种,不符合“多变一”的形式,不符合化合反应的特征,不属于化合反应,B错误。该反应可读作:每16份质量的甲烷和64份质量的氧气在点燃条件下恰好反应生成36份质量的水和44份质量的二氧化碳,则16 g甲烷完全燃烧可以生成36 g水,C错误。从微观上,点燃条件下,1个甲烷分子和2个氧分子反应生成2个水分子和1个二氧化碳分子,参加反应的甲烷和氧气的分子个数比为1∶2,D正确。故选D。
7.C 铁在氧气中燃烧生成四氧化三铁,正确的化学方程式为3Fe+2O2Fe3O4,故A错误。氯酸钾在二氧化锰作催化剂并加热条件下生成氯化钾和氧气,正确的化学方程式为2KClO32KCl+3O2↑,故B错误。镁带燃烧生成氧化镁,氧化镁的化学式为MgO,正确的化学方程式为2Mg+O22MgO,故D错误。
8.A 高锰酸钾分解产生气体,剩余固体的质量变小,符合质量守恒定律,A正确;化学反应都符合质量守恒定律,和反应物、生成物的状态无关,B错误;质量守恒定律只适用于化学变化不适用于物理变化,C错误;若氢气和氧气恰好完全反应,则生成水的质量等于(a+b)g,若氢气或氧气剩余,则生成水的质量小于(a+b)g,D错误。
9.B 与电源负极相连的电极上产生的气体是M(氢气);检验气体M、N(氧气)可证明水的组成,即电解水生成氢气和氧气,说明水由氢元素、氧元素组成;气体M、N的体积比为2∶1,质量比为1∶8;通电后气体产生的速率不同,产生氢气比产生氧气速率快。故选B。
10.D C5H8O2中C、H、O原子个数比为5∶8∶2,C3H4中C、H原子个数比为3∶4。用C3H4合成C5H8O2,若让反应物中的原子100%转化为C5H8O2,且反应物和生成物的化学计量数都为1,因为化学反应前后原子种类和个数不变,所以另外两种反应物中含有C、H、O的原子个数比为2∶4∶2。D符合题意。
11.D 观察题图可知,该反应的化学方程式为CH4+H2O CO+3H2,反应前后碳、氢元素的化合价发生了改变,A不正确;水煤气的成分是一氧化碳和氢气,B不正确;该反应中含氢元素的化合物有CH4和H2O两种,C不正确。
12.A 铜与氧气反应生成氧化铜而使固体质量增大,碳与氧气反应生成二氧化碳气体而使固体质量减少;反应前后固体质量不变,则与铜反应的氧气的质量与混合物中碳的质量相等。设混合物中碳的质量为m,则与铜反应的氧气质量为m,设混合物中铜的质量为x,则有:
2Cu+O22CuO
128 32
x m
=
x=4m
则原固体混合物中碳的质量分数=×100%=20%。
13.(每空2分)(1)根据质量守恒定律,反应前后元素的种类不变
(2)4.4
14.(每小题2分)(1)2 3 2 (2)4 11 2 8
(3)2 1 2 1
【解题思路】(1)利用最小公倍数法进行配平,以氯原子作为配平的起点,氯气、氯化铁前面的化学计量数分别为3、2,最后调整铁前面的化学计量数为2。
(2)本题可利用“定一法”进行配平,把Fe2O3的化学计量数定为1,则FeS2、O2、SO2前面的化学计量数分别为2、、4,同时扩大2倍,则FeS2、O2、Fe2O3、SO2前面的化学计量数分别为4、11、2、8。(3)利用最小公倍数法进行配平,以氧原子作为配平的起点,氧化铜、二氧化碳前面的化学计量数分别为2、1,最后调整碳、铜前面的化学计量数为1、2。
15.(每空2分)(1)明矾 (2)吸附 (3)化学
(4)Ca(HCO3)2CaCO3+H2O+CO2↑
16.(每空2分)(1)分子 (2)2H2S+O22S+2H2O 18 (3)SO2
【解题思路】(1)由表格中的图像,可知D物质是水,由分子构成。(2)A和B在一定条件下反应生成C和D,发生反应的化学方程式为2H2S+O22S+2H2O。根据化学反应中B和D的质量比为32∶36,则16 g B完全反应后生成的D的质量为18 g。(3)A和B分别为H2S和O2,根据化学反应前后元素种类不变,生成物中D为H2O,F是一种氧化物,其中一定含硫元素,且其中含氧元素的质量分数为50%,则F为SO2。
17.(每空2分)(1)2H2O2H2↑+O2↑ 分解 (2)C (3)温度 氢氧化钠溶液浓度 (4)得到相同体积氢气所用的时间 (5)氢氧化钠溶液浓度相同时,温度越高,电解水的速率越快 (6)①
18.(每空2分)【猜想假设】相等 【实验探究】CuSO4+FeFeSO4+Cu 【反思评价】密闭装置 【优化装置】能与二氧化碳气体反应 【得出结论】参加反应 【解释与应用】C
【解题思路】有气体参加或生成的反应用于检验质量守恒定律时,为使所有的反应物和生成物都被称量到,应在密闭装置中进行实验。碳酸钠和稀盐酸反应产生的二氧化碳气体可以和氢氧化钠溶液反应。质量守恒定律的内容是参加反应的各物质的质量总和等于反应生成的各物质的质量总和。化学反应前后元素的种类不变,硝酸铵中不含硫元素,其分解不可能得到二氧化硫。
19.(1)Ca(OH)2 (3分)
(2)设生成的氧气的质量为x。
2CaO2+2H2O2Ca(OH)2 +O2↑
144 32
2.88 g x
= (3分)
x=0.64 g (2分)
则每升水中溶解的氧气的质量为×1 L=0.003 2 g>0.003 g。 (2分)
答:鱼缸中水的溶氧量符合最低要求。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
