2024人教版九年级化学上学期单元测试卷--第五单元化学方程式测试卷(含答案)
文档属性
| 名称 | 2024人教版九年级化学上学期单元测试卷--第五单元化学方程式测试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-08 23:15:33 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024人教版九年级化学上学期单元测试卷
第五单元 化学方程式
时间:45分钟 满分:100分
可能用到的相对原子质量:H—1 C—12 N—14 O—16 P—31 S—32 Cl—35.5 K—39
一、选择题(每小题3分,共36分,每小题只有一个选项符合题意)
1.利用天平进行定量研究,最早提出质量守恒定律的科学家是 ( )
A.拉瓦锡 B.门捷列夫 C.徐寿 D.屠呦呦
2.下列对“质量守恒定律”的理解,正确的是 ( )
A.10 g冰受热融化成10 g水,符合质量守恒定律
B.蜡烛燃烧后质量减轻,不符合质量守恒定律
C.镁条在空气中燃烧后,生成物的质量比原来的镁条大,不符合质量守恒定律
D.任何化学反应中参加反应的各物质的质量总和都等于反应后各生成物的质量总和
3.关于化学方程式4P+5O22P2O5,四位同学表达了下列选项所示的四种说法,其中错误的是 ( )
A B C D
4.下列化学方程式书写正确的是 ( )
A.2HgO2Hg+O2 B.H2+O2H2O
C.C+O2CO2 D.2KClO32KCl+3O2↑
5.从2CO+O22CO2中获取的信息错误的是 ( )
A.Co3O4在该反应中作为催化剂
B.该反应前后,分子数目发生改变
C.2 g一氧化碳与1 g氧气完全反应,可以生成3 g二氧化碳
D.在反应前后,碳原子和氧原子的数目都没有改变
6.在深海潜水器或潜水艇中可用过氧化钠(Na2O2)作呼吸面具中氧气的来源,它与二氧化碳反应后的生成物为 ( )
A.Na2CO3和H2 B.Na2O和O2
C.NaOH和O2 D.Na2CO3和O2
7.在反应A+3B2C+2D中,已知A和B的相对分子质量之比为7∶8,当2.8 g A与一定量B恰好完全反应后,生成3.6 g D,则生成C的质量为 ( )
A.9.6 g B.8.8 g C.6.8 g D.2.4 g
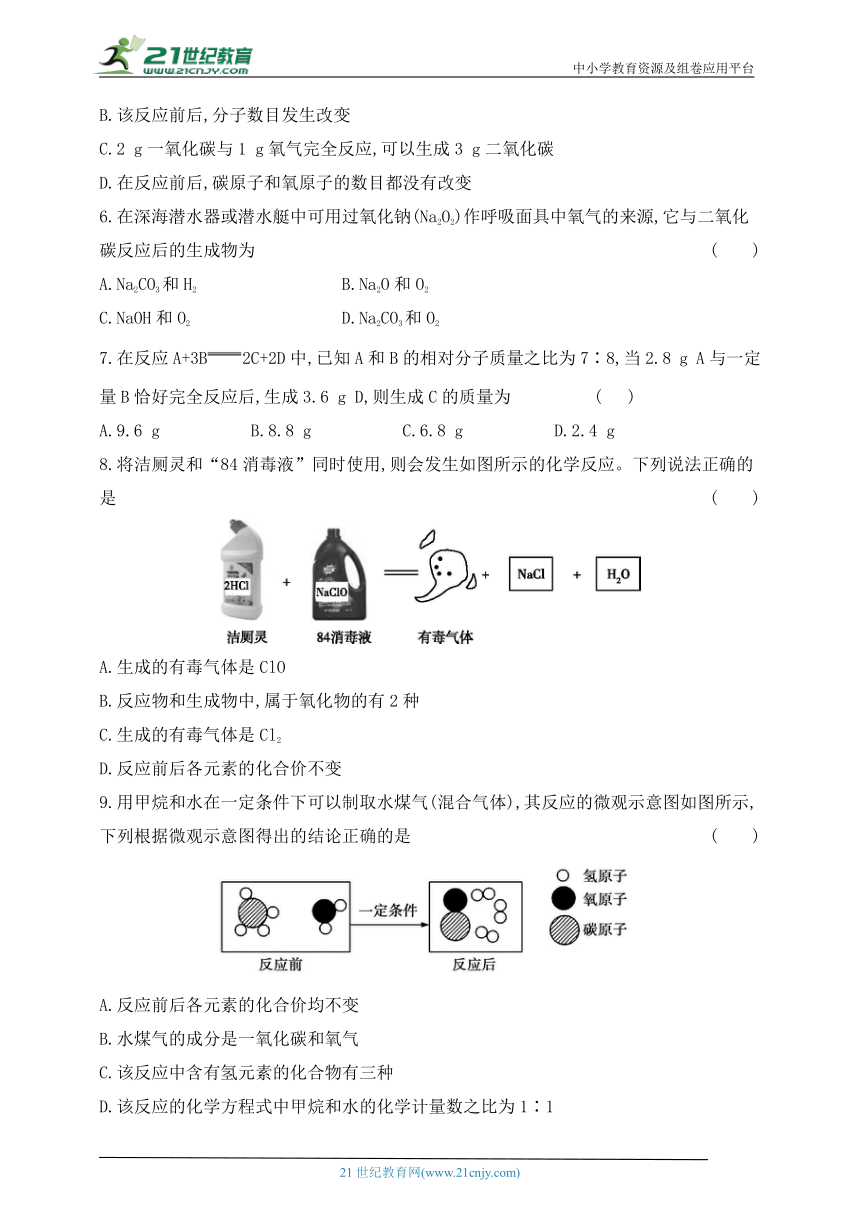
8.将洁厕灵和“84消毒液”同时使用,则会发生如图所示的化学反应。下列说法正确的是 ( )
A.生成的有毒气体是ClO
B.反应物和生成物中,属于氧化物的有2种
C.生成的有毒气体是Cl2
D.反应前后各元素的化合价不变
9.用甲烷和水在一定条件下可以制取水煤气(混合气体),其反应的微观示意图如图所示,下列根据微观示意图得出的结论正确的是 ( )
A.反应前后各元素的化合价均不变
B.水煤气的成分是一氧化碳和氧气
C.该反应中含有氢元素的化合物有三种
D.该反应的化学方程式中甲烷和水的化学计量数之比为1∶1
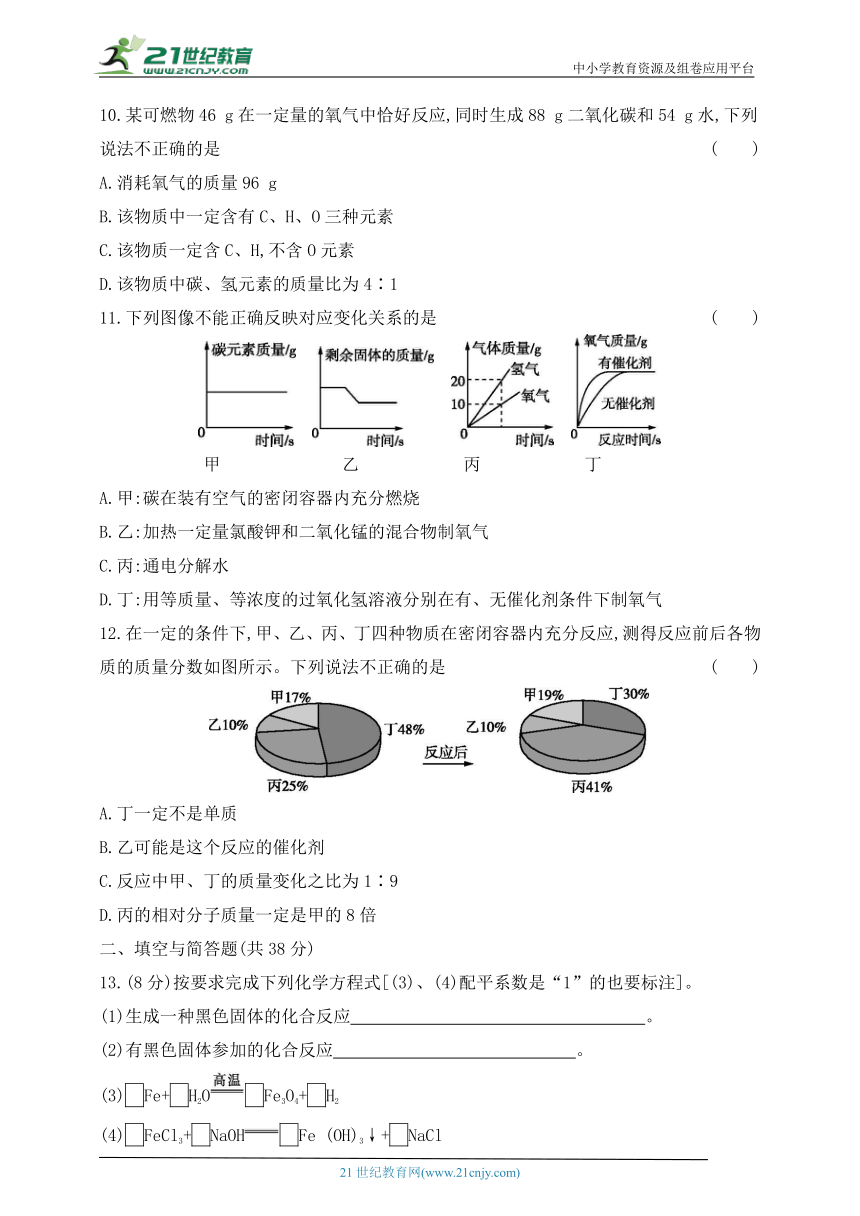
10.某可燃物46 g在一定量的氧气中恰好反应,同时生成88 g二氧化碳和54 g水,下列说法不正确的是 ( )
A.消耗氧气的质量96 g
B.该物质中一定含有C、H、O三种元素
C.该物质一定含C、H,不含O元素
D.该物质中碳、氢元素的质量比为4∶1
11.下列图像不能正确反映对应变化关系的是 ( )
甲 乙 丙 丁
A.甲:碳在装有空气的密闭容器内充分燃烧
B.乙:加热一定量氯酸钾和二氧化锰的混合物制氧气
C.丙:通电分解水
D.丁:用等质量、等浓度的过氧化氢溶液分别在有、无催化剂条件下制氧气
12.在一定的条件下,甲、乙、丙、丁四种物质在密闭容器内充分反应,测得反应前后各物质的质量分数如图所示。下列说法不正确的是 ( )
A.丁一定不是单质
B.乙可能是这个反应的催化剂
C.反应中甲、丁的质量变化之比为1∶9
D.丙的相对分子质量一定是甲的8倍
二、填空与简答题(共38分)
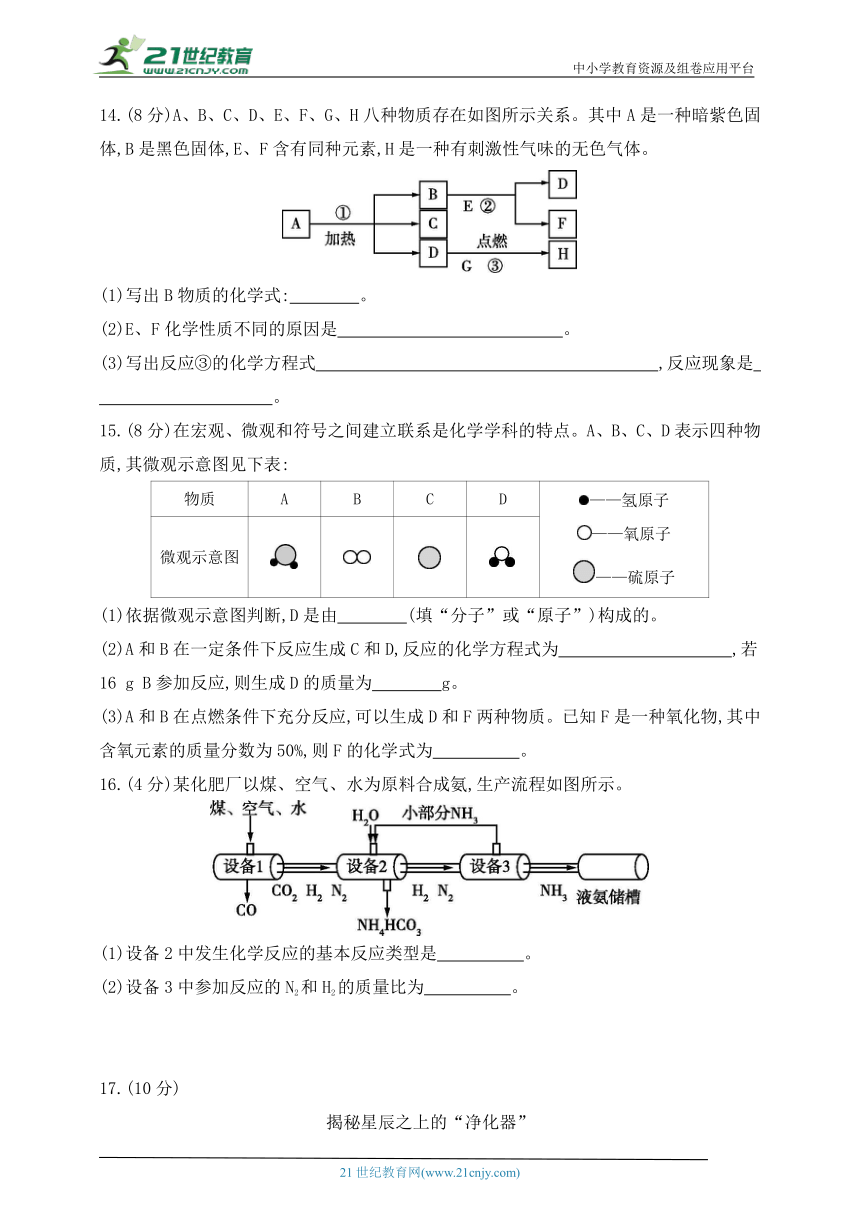
13.(8分)按要求完成下列化学方程式[(3)、(4)配平系数是“1”的也要标注]。
(1)生成一种黑色固体的化合反应 。
(2)有黑色固体参加的化合反应 。
(3) Fe+ H2O Fe3O4+ H2
(4) FeCl3+ NaOH Fe (OH)3↓+ NaCl
14.(8分)A、B、C、D、E、F、G、H八种物质存在如图所示关系。其中A是一种暗紫色固体,B是黑色固体,E、F含有同种元素,H是一种有刺激性气味的无色气体。
(1)写出B物质的化学式: 。
(2)E、F化学性质不同的原因是 。
(3)写出反应③的化学方程式 ,反应现象是 。
15.(8分)在宏观、微观和符号之间建立联系是化学学科的特点。A、B、C、D表示四种物质,其微观示意图见下表:
物质 A B C D ——氢原子 ——氧原子 ——硫原子
微观示意图
(1)依据微观示意图判断,D是由 (填“分子”或“原子”)构成的。
(2)A和B在一定条件下反应生成C和D,反应的化学方程式为 ,若16 g B参加反应,则生成D的质量为 g。
(3)A和B在点燃条件下充分反应,可以生成D和F两种物质。已知F是一种氧化物,其中含氧元素的质量分数为50%,则F的化学式为 。
16.(4分)某化肥厂以煤、空气、水为原料合成氨,生产流程如图所示。
(1)设备2中发生化学反应的基本反应类型是 。
(2)设备3中参加反应的N2和H2的质量比为 。
17.(10分)
揭秘星辰之上的“净化器”
2021年10月,我国3名航天员进驻“天和”核心舱,开启为期6个月的科研工作,为解决航天员在空间站的用水问题,并降低运营成本,“天和”核心舱安装了国际领先的环控生保尿处理子系统和水处理净化器。
尿处理子系统采用蒸汽压缩蒸馏技术将预处理后的尿液进行旋转蒸馏,将收集到的蒸气冷凝后形成冷凝液,然后将冷凝液输出给水处理净化器进行深度净化处理,实现了从“尿”中取“水”。添加了预处理剂的尿液,具有强酸性、强腐蚀性的特点,对于系统的机电运行部件长期正常运行是极大的挑战。研发团队经过对材料、工艺的不断研究,实现了产品的长寿命、高可靠性指标要求。
除此外航天员在轨大量出的汗,也可当作冷凝水收集起来进行处理。
处理所得的再生水可以电解制氧气,排在舱内,减少地面对氧气的补给,生成的氢气还可以与人呼出的二氧化碳在一定条件下进行反应,实现了舱内物质循环利用。
阅读短文,回答下列问题:
(1)对预处理后的尿液进行旋转蒸馏、冷凝的过程属于 (填“物理”或“化学”)变化。
(2)尿处理子系统的机电运行部件的材料,必须具备很强的 性能,才能确保实现产品的长寿命、高可靠性指标要求。
(3)写出空间站用再生水制取氧气的化学方程式 。请你推测在氢气与人呼出的二氧化碳进行反应的过程中,氢气可能会转化为 (写化学式)。
(4)星辰之上的“净化器”具有的优点是 。
三、实验与探究题(共19分)
18.(7分)根据以下实验方案,探究化学反应前后各物质的质量是否相等,请将你的思考及实验结果写在短线处。
【实验探究】同学们用托盘天平分别称量反应前后物质的质量。
实验 方案 方案一 方案二
实验 装置
实验 过程 分别将反应物及反应容器放在托盘天平上,用砝码平衡
取下烧杯,将铁钉浸到硫酸铜溶液中,反应生成硫酸亚铁和铜,观察到的现象是 ,溶液由蓝色逐渐变为浅绿色;再将其放回托盘天平,天平的指针 (填“向左”“向右”或“不”)偏转 取下烧杯并将其倾斜,使小试管中的H2O2溶液进入烧杯中,完全反应后放回托盘天平,天平指针 (填“向左”“向右”或“不”)偏转
【反思评价】上述天平不平衡的方案中,导致天平不平衡的物质是 。
【小结归纳】有气体参加或生成的化学反应,用来验证质量守恒定律时,必须
在 容器中进行。
【解释应用】化学反应中,反应前后 不变,所以纸张燃烧后剩余灰烬的质量变小 (填“遵循”或“不遵循”)质量守恒定律,理由是 。
19.(12分)化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验(如图1),同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
图1 图2
(1)写出镁条燃烧的化学方程式: 。
(2)同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量,有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是 。
(3)小红按图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
【提出问题】黄色固体是什么
【查阅资料】①氧化镁为白色固体;
②镁能与氮气剧烈反应产生黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【作出猜想】黄色固体是Mg3N2。
【实验探究】
实验操作 实验现象 实验结论
取少量黄色固体于试管中,加入适量水,把 放在试管口 黄色固体是Mg3N2
【反思与交流】写出氮气和镁反应的化学方程式 ,实验中气球的作用是 。
四、计算题(共7分)
20.(7分)取15.3 g氯酸钾和4.7 g二氧化锰混合均匀后装入试管,加热一段时间。冷却后称量剩余固体物质的质量为15.2 g。
(1)生成氧气的质量为 。
(2)计算参加反应的氯酸钾占原来氯酸钾的质量分数(计算结果保留到1%)。
第五单元 化学方程式
1 2 3 4 5 6 7 8 9 10 11 12
A D A D C D B C D C C D
1.A 二百多年前,法国化学家拉瓦锡在前人研究的基础上,利用天平进行定量实验研究了空气成分,同时也是最早提出质量守恒定律的科学家,A符合题意。
2.D
3.A 在化学方程式4P+5O22P2O5中,磷、氧气、五氧化二磷的质量比为31∶40∶71,A选项错误。
4.D A中反应物是固体,生成的气体化学式后面应标↑; B中化学方程式没有配平;C中化学方程式缺少反应条件;D中氯酸钾在二氧化锰作催化剂和加热条件下分解生成氯化钾和氧气,书写正确。
5.C Co3O4在该反应中作为催化剂,A正确;该反应前后,分子数目发生改变,由反应前的3个分子变成2个,B正确;CO、O2、CO2之间的质量比为56∶32∶88=7∶4∶11,2 g CO和1 g O2完全反应,CO有剩余,生成的CO2质量小于3 g,C错误;因为在化学反应中,分子可分,原子不可分,所以在反应前后,碳原子和氧原子的数目都没有改变,D正确。
6.D 根据质量守恒定律,化学反应前后元素的种类不变,该反应的反应物为过氧化钠(Na2O2)和二氧化碳,其中含有钠、氧、碳三种元素,生成物中也应该含有这三种元素。分析各选项,A、C中物质含有反应物中没有的氢元素;B中物质只含钠、氧两种元素,缺少碳元素;D中物质含有钠、氧、碳三种元素,符合要求。故选D。
7.B 根据“反应A+3B2C+2D中,已知A和B的相对分子质量之比为7∶8”,则可假设A和B的相对分子质量分别为7a、8a,设与2.8 g A反应的B的质量为x,
=
x=9.6 g
根据质量守恒定律,生成C的质量为2.8 g+9.6 g-3.6 g=8.8 g。
故选B。
8.C HCl和NaClO反应生成氯气、氯化钠和水,有毒的气体是氯气,A错误,C正确;反应物和生成物中,只有水是氧化物,B错误;反应前HCl中氯元素的化合价是-1,NaClO中氯元素的化合价是+1,反应后氯气中氯元素的化合价是0,D错误。故选C。
9.D 观察题图可知,该反应的化学方程式为CH4+H2O CO+3H2,反应前后碳、氢元素的化合价发生了改变,A不正确;水煤气的成分是一氧化碳和氢气,B不正确;该反应中含有氢元素的化合物有CH4和H2O两种,C不正确。
10.C 由质量守恒定律可知,参加反应的反应物的总质量等于生成的生成物的总质量,则消耗氧气的质量为88 g+54 g-46 g=96 g,A正确;由质量守恒定律可知,化学反应前后元素的质量和种类均不变,反应后二氧化碳中含有碳元素,水中含有氢元素,反应前氧气中含有氧元素,则可燃物中一定含有C、H两种元素,二氧化碳中碳元素的质量为88 g×(×100%)=24 g,水中氢元素的质量为54g × (×100%) =6 g,C、H两种元 素的总质量为24 g+6 g=30 g<46 g,则该物质中一定含有C、H、O三种元素,B正确,C不正确;碳元素的质量为24 g,氢元素的质量为6 g,则该物质中碳、氢元素的质量比为24 g∶6 g=4∶1,D正确。故选C。
11.C 碳在装有空气的密闭容器内充分燃烧生成二氧化碳,过程中碳元素质量始终不变,A正确;加热一段时间后,氯酸钾在二氧化锰催化作用下分解生成氯化钾和氧气,随着反应进行,剩余固体质量不断减小,完全反应后剩余固体质量不再变化,B正确;电解水生成氢气和氧气,氢气和氧气质量比是1∶8,C不正确;过氧化氢分解生成水和氧气,用等质量、等浓度的过氧化氢溶液制氧气,有催化剂时反应快一些,需要时间短,但是最终生成氧气质量相等,D正确。
12.D 反应后甲、丙的质量分数增大,都是生成物,丁的质量分数减小,是反应物,即丁分解生成甲、丙,因此丁是化合物,A正确;乙在反应前后质量不变,可能是这个反应的催化剂,B正确;反应中甲、丁的质量变化之比为(19%-17%)∶(48%-30%)=1∶9,C正确;丙的相对分子质量不一定是甲的8倍,因为不知道二者的化学计量数,D错误。
13.(每小题2分)(1)3Fe+2O2Fe3O4 (2)C+O2CO2 (3)3 4 1 4
(4)1 3 1 3
14.(每空2分)(1)MnO2 (2)构成它们的分子不同
(3)S+O2SO2 产生蓝紫色火焰,放出热量,生成有刺激性气味的气体
【解题思路】将题中转化关系解读如下图,进而轻松答题:
15.(每空2分)(1)分子 (2)2H2S+O22S+2H2O 18 (3)SO2
【解题思路】(1)由表格中的图像可知,D物质是水,由分子构成。(2)A和B在一定条件下反应生成C和D,反应的化学方程式为2H2S+O22S+2H2O。根据化学反应中B和D的质量比为32∶36,则16 g B完全反应后生成D的质量为18 g。(3)A和B分别为H2S和O2,根据化学反应前后元素种类不变,生成物中D为H2O,F是一种氧化物,知其一定含硫、氧元素,又其含氧元素的质量分数为50%,则F为SO2。
16.(每空2分)(1)化合反应 (2)14∶3
【解题思路】提炼流程图中物质间的转化信息,设备2和设备3中发生的反应如图所示:
(每空2分)(1)物理 (2)耐强酸,耐强腐蚀 (3)2H2O2H2↑+O2↑ H2O
(4)实现了舱内物质的循环利用
18.(每空1分)铁钉表面有红色物质析出 不 向右 氧气 密闭 原子的种类、数目、质量 遵循 纸张燃烧生成的气体等物质扩散到空气中,使剩余固体质量变小
【解题思路】【实验探究】根据分析,方案一,铁钉与硫酸铜反应生成铜和硫酸亚铁,故观察到的现象是铁钉表面有红色物质析出,溶液由蓝色(硫酸铜溶液)逐渐变为浅绿色(硫酸亚铁溶液);方案二,H2O2在MnO2的催化作用下分解生成氧气和水。【反思评价】方案二天平不平衡的原因是H2O2在MnO2的催化作用下分解放出了氧气,使得天平左边物质质量减小。【小结归纳】根据分析,对于有气体参加的反应,验证质量守恒定律时,一定要在密闭容器中进行。【解释应用】质量守恒定律成立的本质是在反应前后原子的种类、质量、数目均不发生改变。所以根据质量守恒定律,可知纸张燃烧生成的二氧化碳和水,扩散到空气中,使剩余灰烬质量变小。
19.(每空2分)(1)2Mg+O22MgO (2)反应生成的氧化镁有一部分扩散到空气中 (3)湿润的红色石蕊试纸 产生气泡,湿润的红色石蕊试纸变蓝色 3Mg+N2Mg3N2 缓冲气压,密封
20.(1)4.8 g(2分)
(2)设参加反应的KClO3的质量为x。
2KClO32KCl+3O2↑ (2分)
245 96
x 4.8 g
=
x=12.25 g (2分)
参加反应的氯酸钾占原来氯酸钾的质量分数为
×100%≈80% (1分)
答:参加反应的氯酸钾占原来氯酸钾的质量分数为80%。
【解题思路】(1)根据质量守恒定律,反应前后物质的总质量不变,可计算生成氧气的质量为15.3 g+4.7 g-15.2 g=4.8 g。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024人教版九年级化学上学期单元测试卷
第五单元 化学方程式
时间:45分钟 满分:100分
可能用到的相对原子质量:H—1 C—12 N—14 O—16 P—31 S—32 Cl—35.5 K—39
一、选择题(每小题3分,共36分,每小题只有一个选项符合题意)
1.利用天平进行定量研究,最早提出质量守恒定律的科学家是 ( )
A.拉瓦锡 B.门捷列夫 C.徐寿 D.屠呦呦
2.下列对“质量守恒定律”的理解,正确的是 ( )
A.10 g冰受热融化成10 g水,符合质量守恒定律
B.蜡烛燃烧后质量减轻,不符合质量守恒定律
C.镁条在空气中燃烧后,生成物的质量比原来的镁条大,不符合质量守恒定律
D.任何化学反应中参加反应的各物质的质量总和都等于反应后各生成物的质量总和
3.关于化学方程式4P+5O22P2O5,四位同学表达了下列选项所示的四种说法,其中错误的是 ( )
A B C D
4.下列化学方程式书写正确的是 ( )
A.2HgO2Hg+O2 B.H2+O2H2O
C.C+O2CO2 D.2KClO32KCl+3O2↑
5.从2CO+O22CO2中获取的信息错误的是 ( )
A.Co3O4在该反应中作为催化剂
B.该反应前后,分子数目发生改变
C.2 g一氧化碳与1 g氧气完全反应,可以生成3 g二氧化碳
D.在反应前后,碳原子和氧原子的数目都没有改变
6.在深海潜水器或潜水艇中可用过氧化钠(Na2O2)作呼吸面具中氧气的来源,它与二氧化碳反应后的生成物为 ( )
A.Na2CO3和H2 B.Na2O和O2
C.NaOH和O2 D.Na2CO3和O2
7.在反应A+3B2C+2D中,已知A和B的相对分子质量之比为7∶8,当2.8 g A与一定量B恰好完全反应后,生成3.6 g D,则生成C的质量为 ( )
A.9.6 g B.8.8 g C.6.8 g D.2.4 g
8.将洁厕灵和“84消毒液”同时使用,则会发生如图所示的化学反应。下列说法正确的是 ( )
A.生成的有毒气体是ClO
B.反应物和生成物中,属于氧化物的有2种
C.生成的有毒气体是Cl2
D.反应前后各元素的化合价不变
9.用甲烷和水在一定条件下可以制取水煤气(混合气体),其反应的微观示意图如图所示,下列根据微观示意图得出的结论正确的是 ( )
A.反应前后各元素的化合价均不变
B.水煤气的成分是一氧化碳和氧气
C.该反应中含有氢元素的化合物有三种
D.该反应的化学方程式中甲烷和水的化学计量数之比为1∶1
10.某可燃物46 g在一定量的氧气中恰好反应,同时生成88 g二氧化碳和54 g水,下列说法不正确的是 ( )
A.消耗氧气的质量96 g
B.该物质中一定含有C、H、O三种元素
C.该物质一定含C、H,不含O元素
D.该物质中碳、氢元素的质量比为4∶1
11.下列图像不能正确反映对应变化关系的是 ( )
甲 乙 丙 丁
A.甲:碳在装有空气的密闭容器内充分燃烧
B.乙:加热一定量氯酸钾和二氧化锰的混合物制氧气
C.丙:通电分解水
D.丁:用等质量、等浓度的过氧化氢溶液分别在有、无催化剂条件下制氧气
12.在一定的条件下,甲、乙、丙、丁四种物质在密闭容器内充分反应,测得反应前后各物质的质量分数如图所示。下列说法不正确的是 ( )
A.丁一定不是单质
B.乙可能是这个反应的催化剂
C.反应中甲、丁的质量变化之比为1∶9
D.丙的相对分子质量一定是甲的8倍
二、填空与简答题(共38分)
13.(8分)按要求完成下列化学方程式[(3)、(4)配平系数是“1”的也要标注]。
(1)生成一种黑色固体的化合反应 。
(2)有黑色固体参加的化合反应 。
(3) Fe+ H2O Fe3O4+ H2
(4) FeCl3+ NaOH Fe (OH)3↓+ NaCl
14.(8分)A、B、C、D、E、F、G、H八种物质存在如图所示关系。其中A是一种暗紫色固体,B是黑色固体,E、F含有同种元素,H是一种有刺激性气味的无色气体。
(1)写出B物质的化学式: 。
(2)E、F化学性质不同的原因是 。
(3)写出反应③的化学方程式 ,反应现象是 。
15.(8分)在宏观、微观和符号之间建立联系是化学学科的特点。A、B、C、D表示四种物质,其微观示意图见下表:
物质 A B C D ——氢原子 ——氧原子 ——硫原子
微观示意图
(1)依据微观示意图判断,D是由 (填“分子”或“原子”)构成的。
(2)A和B在一定条件下反应生成C和D,反应的化学方程式为 ,若16 g B参加反应,则生成D的质量为 g。
(3)A和B在点燃条件下充分反应,可以生成D和F两种物质。已知F是一种氧化物,其中含氧元素的质量分数为50%,则F的化学式为 。
16.(4分)某化肥厂以煤、空气、水为原料合成氨,生产流程如图所示。
(1)设备2中发生化学反应的基本反应类型是 。
(2)设备3中参加反应的N2和H2的质量比为 。
17.(10分)
揭秘星辰之上的“净化器”
2021年10月,我国3名航天员进驻“天和”核心舱,开启为期6个月的科研工作,为解决航天员在空间站的用水问题,并降低运营成本,“天和”核心舱安装了国际领先的环控生保尿处理子系统和水处理净化器。
尿处理子系统采用蒸汽压缩蒸馏技术将预处理后的尿液进行旋转蒸馏,将收集到的蒸气冷凝后形成冷凝液,然后将冷凝液输出给水处理净化器进行深度净化处理,实现了从“尿”中取“水”。添加了预处理剂的尿液,具有强酸性、强腐蚀性的特点,对于系统的机电运行部件长期正常运行是极大的挑战。研发团队经过对材料、工艺的不断研究,实现了产品的长寿命、高可靠性指标要求。
除此外航天员在轨大量出的汗,也可当作冷凝水收集起来进行处理。
处理所得的再生水可以电解制氧气,排在舱内,减少地面对氧气的补给,生成的氢气还可以与人呼出的二氧化碳在一定条件下进行反应,实现了舱内物质循环利用。
阅读短文,回答下列问题:
(1)对预处理后的尿液进行旋转蒸馏、冷凝的过程属于 (填“物理”或“化学”)变化。
(2)尿处理子系统的机电运行部件的材料,必须具备很强的 性能,才能确保实现产品的长寿命、高可靠性指标要求。
(3)写出空间站用再生水制取氧气的化学方程式 。请你推测在氢气与人呼出的二氧化碳进行反应的过程中,氢气可能会转化为 (写化学式)。
(4)星辰之上的“净化器”具有的优点是 。
三、实验与探究题(共19分)
18.(7分)根据以下实验方案,探究化学反应前后各物质的质量是否相等,请将你的思考及实验结果写在短线处。
【实验探究】同学们用托盘天平分别称量反应前后物质的质量。
实验 方案 方案一 方案二
实验 装置
实验 过程 分别将反应物及反应容器放在托盘天平上,用砝码平衡
取下烧杯,将铁钉浸到硫酸铜溶液中,反应生成硫酸亚铁和铜,观察到的现象是 ,溶液由蓝色逐渐变为浅绿色;再将其放回托盘天平,天平的指针 (填“向左”“向右”或“不”)偏转 取下烧杯并将其倾斜,使小试管中的H2O2溶液进入烧杯中,完全反应后放回托盘天平,天平指针 (填“向左”“向右”或“不”)偏转
【反思评价】上述天平不平衡的方案中,导致天平不平衡的物质是 。
【小结归纳】有气体参加或生成的化学反应,用来验证质量守恒定律时,必须
在 容器中进行。
【解释应用】化学反应中,反应前后 不变,所以纸张燃烧后剩余灰烬的质量变小 (填“遵循”或“不遵循”)质量守恒定律,理由是 。
19.(12分)化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验(如图1),同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
图1 图2
(1)写出镁条燃烧的化学方程式: 。
(2)同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量,有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是 。
(3)小红按图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
【提出问题】黄色固体是什么
【查阅资料】①氧化镁为白色固体;
②镁能与氮气剧烈反应产生黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【作出猜想】黄色固体是Mg3N2。
【实验探究】
实验操作 实验现象 实验结论
取少量黄色固体于试管中,加入适量水,把 放在试管口 黄色固体是Mg3N2
【反思与交流】写出氮气和镁反应的化学方程式 ,实验中气球的作用是 。
四、计算题(共7分)
20.(7分)取15.3 g氯酸钾和4.7 g二氧化锰混合均匀后装入试管,加热一段时间。冷却后称量剩余固体物质的质量为15.2 g。
(1)生成氧气的质量为 。
(2)计算参加反应的氯酸钾占原来氯酸钾的质量分数(计算结果保留到1%)。
第五单元 化学方程式
1 2 3 4 5 6 7 8 9 10 11 12
A D A D C D B C D C C D
1.A 二百多年前,法国化学家拉瓦锡在前人研究的基础上,利用天平进行定量实验研究了空气成分,同时也是最早提出质量守恒定律的科学家,A符合题意。
2.D
3.A 在化学方程式4P+5O22P2O5中,磷、氧气、五氧化二磷的质量比为31∶40∶71,A选项错误。
4.D A中反应物是固体,生成的气体化学式后面应标↑; B中化学方程式没有配平;C中化学方程式缺少反应条件;D中氯酸钾在二氧化锰作催化剂和加热条件下分解生成氯化钾和氧气,书写正确。
5.C Co3O4在该反应中作为催化剂,A正确;该反应前后,分子数目发生改变,由反应前的3个分子变成2个,B正确;CO、O2、CO2之间的质量比为56∶32∶88=7∶4∶11,2 g CO和1 g O2完全反应,CO有剩余,生成的CO2质量小于3 g,C错误;因为在化学反应中,分子可分,原子不可分,所以在反应前后,碳原子和氧原子的数目都没有改变,D正确。
6.D 根据质量守恒定律,化学反应前后元素的种类不变,该反应的反应物为过氧化钠(Na2O2)和二氧化碳,其中含有钠、氧、碳三种元素,生成物中也应该含有这三种元素。分析各选项,A、C中物质含有反应物中没有的氢元素;B中物质只含钠、氧两种元素,缺少碳元素;D中物质含有钠、氧、碳三种元素,符合要求。故选D。
7.B 根据“反应A+3B2C+2D中,已知A和B的相对分子质量之比为7∶8”,则可假设A和B的相对分子质量分别为7a、8a,设与2.8 g A反应的B的质量为x,
=
x=9.6 g
根据质量守恒定律,生成C的质量为2.8 g+9.6 g-3.6 g=8.8 g。
故选B。
8.C HCl和NaClO反应生成氯气、氯化钠和水,有毒的气体是氯气,A错误,C正确;反应物和生成物中,只有水是氧化物,B错误;反应前HCl中氯元素的化合价是-1,NaClO中氯元素的化合价是+1,反应后氯气中氯元素的化合价是0,D错误。故选C。
9.D 观察题图可知,该反应的化学方程式为CH4+H2O CO+3H2,反应前后碳、氢元素的化合价发生了改变,A不正确;水煤气的成分是一氧化碳和氢气,B不正确;该反应中含有氢元素的化合物有CH4和H2O两种,C不正确。
10.C 由质量守恒定律可知,参加反应的反应物的总质量等于生成的生成物的总质量,则消耗氧气的质量为88 g+54 g-46 g=96 g,A正确;由质量守恒定律可知,化学反应前后元素的质量和种类均不变,反应后二氧化碳中含有碳元素,水中含有氢元素,反应前氧气中含有氧元素,则可燃物中一定含有C、H两种元素,二氧化碳中碳元素的质量为88 g×(×100%)=24 g,水中氢元素的质量为54g × (×100%) =6 g,C、H两种元 素的总质量为24 g+6 g=30 g<46 g,则该物质中一定含有C、H、O三种元素,B正确,C不正确;碳元素的质量为24 g,氢元素的质量为6 g,则该物质中碳、氢元素的质量比为24 g∶6 g=4∶1,D正确。故选C。
11.C 碳在装有空气的密闭容器内充分燃烧生成二氧化碳,过程中碳元素质量始终不变,A正确;加热一段时间后,氯酸钾在二氧化锰催化作用下分解生成氯化钾和氧气,随着反应进行,剩余固体质量不断减小,完全反应后剩余固体质量不再变化,B正确;电解水生成氢气和氧气,氢气和氧气质量比是1∶8,C不正确;过氧化氢分解生成水和氧气,用等质量、等浓度的过氧化氢溶液制氧气,有催化剂时反应快一些,需要时间短,但是最终生成氧气质量相等,D正确。
12.D 反应后甲、丙的质量分数增大,都是生成物,丁的质量分数减小,是反应物,即丁分解生成甲、丙,因此丁是化合物,A正确;乙在反应前后质量不变,可能是这个反应的催化剂,B正确;反应中甲、丁的质量变化之比为(19%-17%)∶(48%-30%)=1∶9,C正确;丙的相对分子质量不一定是甲的8倍,因为不知道二者的化学计量数,D错误。
13.(每小题2分)(1)3Fe+2O2Fe3O4 (2)C+O2CO2 (3)3 4 1 4
(4)1 3 1 3
14.(每空2分)(1)MnO2 (2)构成它们的分子不同
(3)S+O2SO2 产生蓝紫色火焰,放出热量,生成有刺激性气味的气体
【解题思路】将题中转化关系解读如下图,进而轻松答题:
15.(每空2分)(1)分子 (2)2H2S+O22S+2H2O 18 (3)SO2
【解题思路】(1)由表格中的图像可知,D物质是水,由分子构成。(2)A和B在一定条件下反应生成C和D,反应的化学方程式为2H2S+O22S+2H2O。根据化学反应中B和D的质量比为32∶36,则16 g B完全反应后生成D的质量为18 g。(3)A和B分别为H2S和O2,根据化学反应前后元素种类不变,生成物中D为H2O,F是一种氧化物,知其一定含硫、氧元素,又其含氧元素的质量分数为50%,则F为SO2。
16.(每空2分)(1)化合反应 (2)14∶3
【解题思路】提炼流程图中物质间的转化信息,设备2和设备3中发生的反应如图所示:
(每空2分)(1)物理 (2)耐强酸,耐强腐蚀 (3)2H2O2H2↑+O2↑ H2O
(4)实现了舱内物质的循环利用
18.(每空1分)铁钉表面有红色物质析出 不 向右 氧气 密闭 原子的种类、数目、质量 遵循 纸张燃烧生成的气体等物质扩散到空气中,使剩余固体质量变小
【解题思路】【实验探究】根据分析,方案一,铁钉与硫酸铜反应生成铜和硫酸亚铁,故观察到的现象是铁钉表面有红色物质析出,溶液由蓝色(硫酸铜溶液)逐渐变为浅绿色(硫酸亚铁溶液);方案二,H2O2在MnO2的催化作用下分解生成氧气和水。【反思评价】方案二天平不平衡的原因是H2O2在MnO2的催化作用下分解放出了氧气,使得天平左边物质质量减小。【小结归纳】根据分析,对于有气体参加的反应,验证质量守恒定律时,一定要在密闭容器中进行。【解释应用】质量守恒定律成立的本质是在反应前后原子的种类、质量、数目均不发生改变。所以根据质量守恒定律,可知纸张燃烧生成的二氧化碳和水,扩散到空气中,使剩余灰烬质量变小。
19.(每空2分)(1)2Mg+O22MgO (2)反应生成的氧化镁有一部分扩散到空气中 (3)湿润的红色石蕊试纸 产生气泡,湿润的红色石蕊试纸变蓝色 3Mg+N2Mg3N2 缓冲气压,密封
20.(1)4.8 g(2分)
(2)设参加反应的KClO3的质量为x。
2KClO32KCl+3O2↑ (2分)
245 96
x 4.8 g
=
x=12.25 g (2分)
参加反应的氯酸钾占原来氯酸钾的质量分数为
×100%≈80% (1分)
答:参加反应的氯酸钾占原来氯酸钾的质量分数为80%。
【解题思路】(1)根据质量守恒定律,反应前后物质的总质量不变,可计算生成氧气的质量为15.3 g+4.7 g-15.2 g=4.8 g。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
