化学人教版(2019)选择性必修2 3.2.1分子晶体(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.2.1分子晶体(共24张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 632.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-08 20:51:33 | ||
图片预览




文档简介
(共24张PPT)
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第1课时 分子晶体
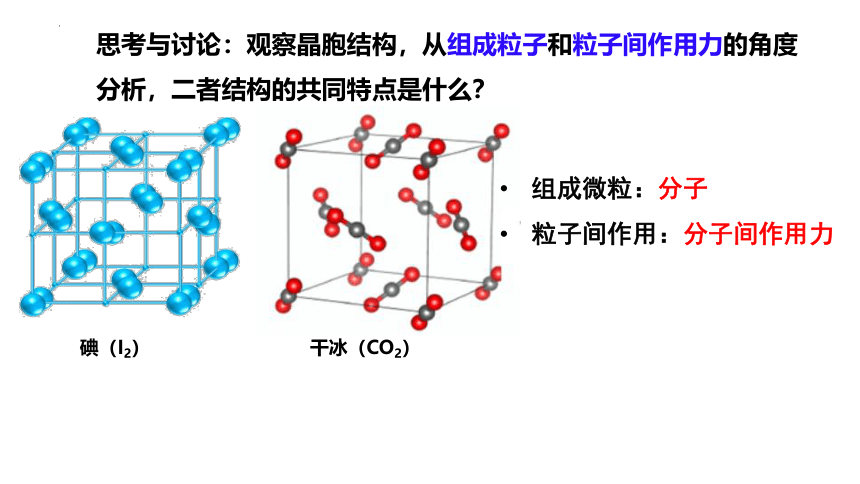
思考与讨论:观察晶胞结构,从组成粒子和粒子间作用力的角度分析,二者结构的共同特点是什么?
碘(I2) 干冰(CO2)
组成微粒:分子
粒子间作用:分子间作用力
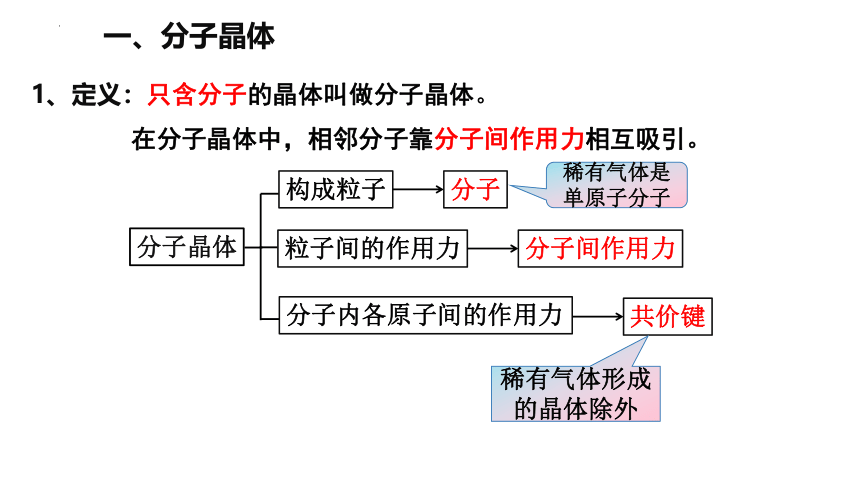
一、分子晶体
1、定义:只含分子的晶体叫做分子晶体。
在分子晶体中,相邻分子靠分子间作用力相互吸引。
构成粒子
分子晶体
分子
粒子间的作用力
分子间作用力
分子内各原子间的作用力
共价键
稀有气体形成的晶体除外
稀有气体是单原子分子
2、典型的分子晶体:
①所有非金属氢化物:H2O,H2S,NH3,CH4,HX
②部分非金属单质:X2,O2,H2, S8,P4, C60,稀有气体
③部分非金属氧化物: CO2, SO2, P4O6, P4O10
④几乎所有的酸:H2SO4,HNO3,H3PO4
⑤绝大多数有机物:乙醇,冰醋酸,蔗糖
一、分子晶体
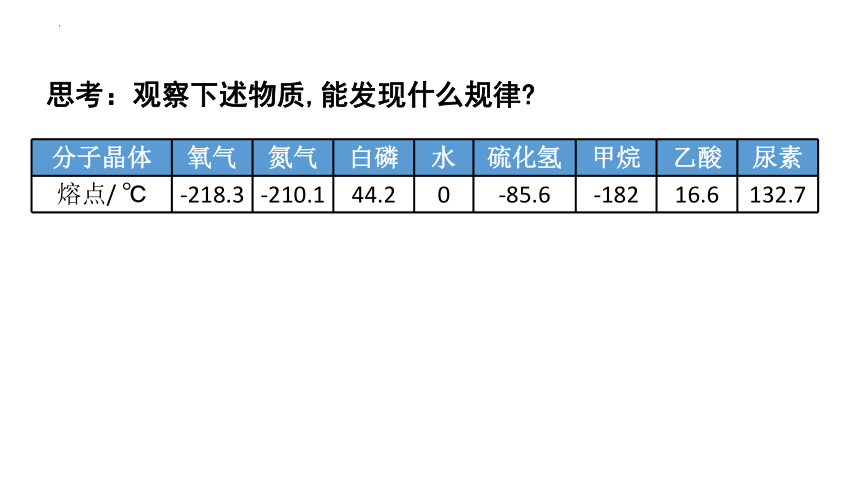
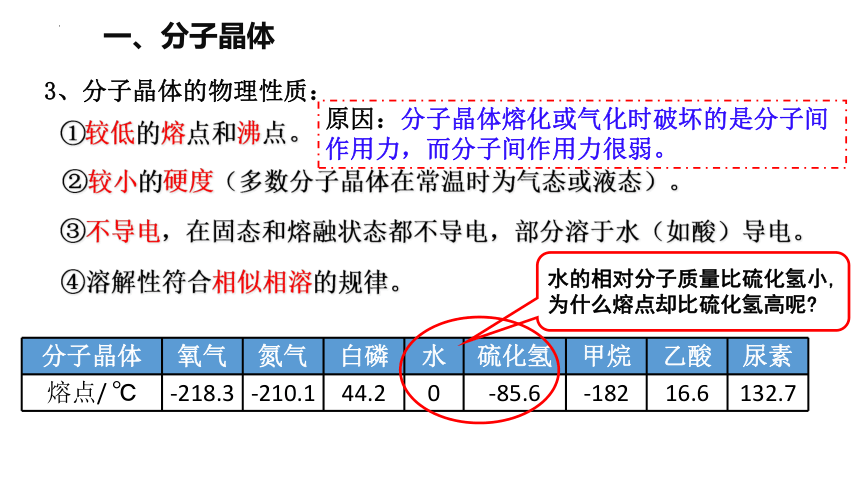
分子晶体 氧气 氮气 白磷 水 硫化氢 甲烷 乙酸 尿素
熔点/ ℃ -218.3 -210.1 44.2 0 -85.6 -182 16.6 132.7
思考:观察下述物质,能发现什么规律
3、分子晶体的物理性质:
①较低的熔点和沸点。
②较小的硬度(多数分子晶体在常温时为气态或液态)。
③不导电,在固态和熔融状态都不导电,部分溶于水(如酸)导电。
④溶解性符合相似相溶的规律。
原因:分子晶体熔化或气化时破坏的是分子间作用力,而分子间作用力很弱。
一、分子晶体
分子晶体 氧气 氮气 白磷 水 硫化氢 甲烷 乙酸 尿素
熔点/ ℃ -218.3 -210.1 44.2 0 -85.6 -182 16.6 132.7
水的相对分子质量比硫化氢小,为什么熔点却比硫化氢高呢
4、分子晶体熔、沸点高低的判断
②组成和结构相似,分子间只有范德华力的分子晶体,相对分子质量越大,范德华力越大,熔、沸点越高。如:CO2是气态,CS2是固态。
③相对分子质量相近,极性分子形成的分子晶体比非极性分子形成的分子晶体的熔、沸点高,如CO>N2
①主要以氢键作用形成的分子晶体,比一般的分子晶体的熔、沸点高。
如H2O>H2S,HF>HCl,NH3>PH3 。
一、分子晶体
④在烷烃的同分异构体中,一般来说,支链数越多,熔、沸点越低。
1、下列分子晶体的溶、沸点高低正确的是( )
A、Cl2>I2
B、CCl4 > SiCl4
C、CH3CH2OH > CH3CH3
D、C(CH3)4 > CH3CH2CH2CH2CH3
C
2、下列晶体由原子构成,且属于分子晶体的是( )
A、固态氢 B、固态氦
C、磷 D、三氧化硫
B
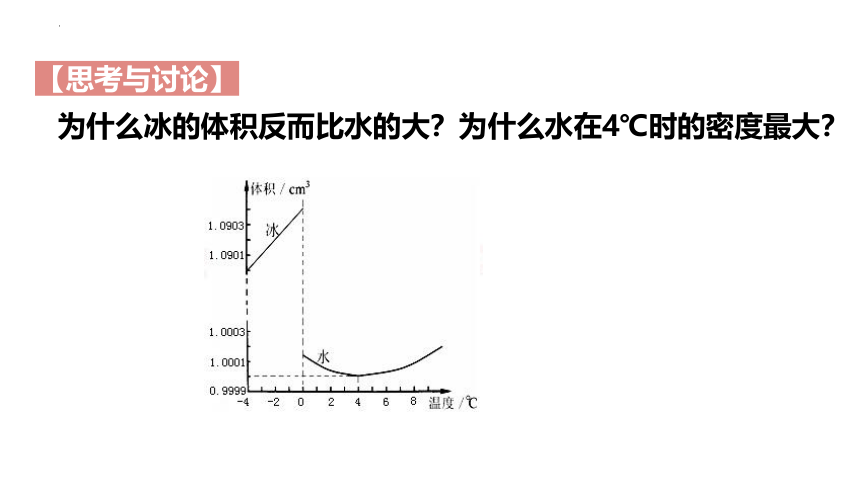
为什么冰的体积反而比水的大?为什么水在4℃时的密度最大?
【思考与讨论】
1、冰的结构
二、两种典型的分子晶体
①水分子间的作用力主要是氢键,也有范德华力。
②由于氢键具有方向性,使四面体中心的水分子与顶点的4个相邻的水分子相互吸引。这一排列使得晶体中分子的空间利用率降低,留有相当大的空隙,因而冰的密度比水的小。
③当冰刚刚融化时,热运动使冰的结构部分解体,水分之间的空隙减小,密度反而增大,超过4℃时,由于热运动加剧,分子间的间距增大,密度渐渐减小。
二、两种典型的分子晶体
2、干冰的结构
干冰中的CO2分子间只存在范德华力,不存在氢键。熔点比冰低得多,常压下极易升华。
干冰晶胞是一种面心立方结构,在立方体的顶角各有一个CO2分子,6个面的中心又各有一个CO2分子。
每个晶胞中有4个CO2分子,12个原子。
思考:每个CO2分子周围等距离且最近的CO2分子有多少个?
(与CO2分子等距离且最近的CO2分子共有12个 )
分子密堆积:如果分子间作用力只是范德华力(无分子间氢键),若以一个分子为中心,其周围最多可以有12个紧邻的分子,分子晶体的这一特征称为分子密堆积。如:C60、干冰 、I2、O2。
碳60的晶胞
碘晶体晶胞
3、分子晶体的结构特征
分子密堆积 分子非密堆积
微粒间作用力
空间 特点
性质特点
通常每个分子周围有12个紧邻的分子
每个分子周围紧邻的分子
数小于12个,空间利用率低
范德华力
范德华力和氢键
熔、沸点低,密度大
熔、沸点高,密度小
二、两种典型的分子晶体
1、下列关于冰和干冰的描述正确的是( )
①熔点:冰<干冰; ②密度:冰<干冰
③晶体中分子间的作用力类型相同;
④晶体的空间利用率:冰<干冰
A、①③
B、②④
C、①④
D、②③
B
4、分子晶体的判断方法
①依据物质的类别判断
组成分子晶体的粒子是分子,粒子间作用是分子间作用力。
分子晶体的硬度小,熔、沸点低,在熔融状态或固体时均不导电,部分溶于水(如酸)导电。
部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、绝大多数有机物的晶体都是分子晶体。
②依据组成晶体的粒子及粒子间作用判断
③依据物质的性质判断
分子晶体的定义
分子晶体
典型的分子晶体
分子晶体的物理性质
分子晶体的结构特征
分子晶体的判断方法
分子晶体熔沸点高低的判断
1.下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、P4、Cu
B.PCl3、CO2、H2SO4
C.SO2、SiO2、P2O5
D.CCl4、H2O、Na2O2
B
【课堂练习】
2.下列有关分子晶体的说法中一定正确的( )
A.分子内均存在共价键
B.分子间一定存在范德华力
C.分子间一定存在氢键
D.其结构一定为分子密堆积
B
3.(1)比较下列化合物熔、沸点的高低(填“>”或“<”)。
①CO2________SO2 ②NH3________PH3 ③O3________O2 ④Ne________Ar
⑤CH3CH2OH________CH3OH ⑥CO________N2
(2)已知AlCl3的熔点为190 ℃(2.02×105 Pa),但它在180 ℃即开始升华。请回答:①AlCl3固体是________晶体。
②设计一个可靠的实验,判断氯化铝是离子化合物还是共价化合物。你设计的实验是_______________________________________。
<
<
>
>
>
>
分子
在熔融状态下,试验其是否导电,若不导电是共价化合物,若导电是离子化合物.
大本练习册P68
易错辨析1
(1)分子晶体中一定含有分子间作用力,不一定含有化学键。( )
(2)分子晶体熔化时,只破坏分子间作用力,不破坏共价键。( )
(3)冰融化和干冰升华破坏的作用力完全相同。( )
提示 干冰升华只破坏范德华力,而冰融化除破坏范德华力外,还破坏氢键。
(4)干冰晶体中只存在范德华力不存在氢键,一个分子周围有12个紧邻分子。
( )
(5)冰晶体中,每个水分子周围只有4个紧邻的分子,1 mol冰中含有1 mol氢键。( )
√
√
×
√
×
大本练习册P70
1.下列有关分子晶体的说法一定正确的是( )
A.分子内均存在共价键 B.分子间一定存在范德华力
C.分子间一定存在氢键 D.分子晶体一定采取分子密堆积方式
B
2.下列物质在室温下均是分子晶体的是( )
A.H2O、CH4、HF B.红磷、硫、碘
C.CO2、SO2、NO2 D.H2SO4、CH3CH2OH、HCHO
B
大本练习册P70
3.下列有关冰和干冰的叙述不正确的是( )
A.干冰和冰都是由分子密堆积形成的晶体
B.冰晶体中,每个水分子周围只有4个紧邻的水分子
C.干冰比冰的熔点低得多,常压下易升华
D.干冰中CO2分子间只存在范德华力,不存在氢键,一个分子周围有12个紧邻的分子
A
大本练习册P71
4.下列物质按熔、沸点由高到低顺序排列,正确的一组是( )
A.HF、HCl、HBr、HI
B.F2、Cl2、Br2、I2
C.H2O、H2S、H2Se、H2Te
D.CI4、CBr4、CCl4、CF4
D
大本练习册P70
5.下列性质符合分子晶体性质的是( )
A.熔点为1 070 ℃,易溶于水,水溶液导电
B.熔点为3 500 ℃,不导电,质硬,难溶于水和有机溶剂
C.能溶于CS2,熔点为113 ℃,沸点为445 ℃
D.熔点为97.81 ℃,质软,导电,密度为0.97 g·cm-3
C
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第1课时 分子晶体
思考与讨论:观察晶胞结构,从组成粒子和粒子间作用力的角度分析,二者结构的共同特点是什么?
碘(I2) 干冰(CO2)
组成微粒:分子
粒子间作用:分子间作用力
一、分子晶体
1、定义:只含分子的晶体叫做分子晶体。
在分子晶体中,相邻分子靠分子间作用力相互吸引。
构成粒子
分子晶体
分子
粒子间的作用力
分子间作用力
分子内各原子间的作用力
共价键
稀有气体形成的晶体除外
稀有气体是单原子分子
2、典型的分子晶体:
①所有非金属氢化物:H2O,H2S,NH3,CH4,HX
②部分非金属单质:X2,O2,H2, S8,P4, C60,稀有气体
③部分非金属氧化物: CO2, SO2, P4O6, P4O10
④几乎所有的酸:H2SO4,HNO3,H3PO4
⑤绝大多数有机物:乙醇,冰醋酸,蔗糖
一、分子晶体
分子晶体 氧气 氮气 白磷 水 硫化氢 甲烷 乙酸 尿素
熔点/ ℃ -218.3 -210.1 44.2 0 -85.6 -182 16.6 132.7
思考:观察下述物质,能发现什么规律
3、分子晶体的物理性质:
①较低的熔点和沸点。
②较小的硬度(多数分子晶体在常温时为气态或液态)。
③不导电,在固态和熔融状态都不导电,部分溶于水(如酸)导电。
④溶解性符合相似相溶的规律。
原因:分子晶体熔化或气化时破坏的是分子间作用力,而分子间作用力很弱。
一、分子晶体
分子晶体 氧气 氮气 白磷 水 硫化氢 甲烷 乙酸 尿素
熔点/ ℃ -218.3 -210.1 44.2 0 -85.6 -182 16.6 132.7
水的相对分子质量比硫化氢小,为什么熔点却比硫化氢高呢
4、分子晶体熔、沸点高低的判断
②组成和结构相似,分子间只有范德华力的分子晶体,相对分子质量越大,范德华力越大,熔、沸点越高。如:CO2是气态,CS2是固态。
③相对分子质量相近,极性分子形成的分子晶体比非极性分子形成的分子晶体的熔、沸点高,如CO>N2
①主要以氢键作用形成的分子晶体,比一般的分子晶体的熔、沸点高。
如H2O>H2S,HF>HCl,NH3>PH3 。
一、分子晶体
④在烷烃的同分异构体中,一般来说,支链数越多,熔、沸点越低。
1、下列分子晶体的溶、沸点高低正确的是( )
A、Cl2>I2
B、CCl4 > SiCl4
C、CH3CH2OH > CH3CH3
D、C(CH3)4 > CH3CH2CH2CH2CH3
C
2、下列晶体由原子构成,且属于分子晶体的是( )
A、固态氢 B、固态氦
C、磷 D、三氧化硫
B
为什么冰的体积反而比水的大?为什么水在4℃时的密度最大?
【思考与讨论】
1、冰的结构
二、两种典型的分子晶体
①水分子间的作用力主要是氢键,也有范德华力。
②由于氢键具有方向性,使四面体中心的水分子与顶点的4个相邻的水分子相互吸引。这一排列使得晶体中分子的空间利用率降低,留有相当大的空隙,因而冰的密度比水的小。
③当冰刚刚融化时,热运动使冰的结构部分解体,水分之间的空隙减小,密度反而增大,超过4℃时,由于热运动加剧,分子间的间距增大,密度渐渐减小。
二、两种典型的分子晶体
2、干冰的结构
干冰中的CO2分子间只存在范德华力,不存在氢键。熔点比冰低得多,常压下极易升华。
干冰晶胞是一种面心立方结构,在立方体的顶角各有一个CO2分子,6个面的中心又各有一个CO2分子。
每个晶胞中有4个CO2分子,12个原子。
思考:每个CO2分子周围等距离且最近的CO2分子有多少个?
(与CO2分子等距离且最近的CO2分子共有12个 )
分子密堆积:如果分子间作用力只是范德华力(无分子间氢键),若以一个分子为中心,其周围最多可以有12个紧邻的分子,分子晶体的这一特征称为分子密堆积。如:C60、干冰 、I2、O2。
碳60的晶胞
碘晶体晶胞
3、分子晶体的结构特征
分子密堆积 分子非密堆积
微粒间作用力
空间 特点
性质特点
通常每个分子周围有12个紧邻的分子
每个分子周围紧邻的分子
数小于12个,空间利用率低
范德华力
范德华力和氢键
熔、沸点低,密度大
熔、沸点高,密度小
二、两种典型的分子晶体
1、下列关于冰和干冰的描述正确的是( )
①熔点:冰<干冰; ②密度:冰<干冰
③晶体中分子间的作用力类型相同;
④晶体的空间利用率:冰<干冰
A、①③
B、②④
C、①④
D、②③
B
4、分子晶体的判断方法
①依据物质的类别判断
组成分子晶体的粒子是分子,粒子间作用是分子间作用力。
分子晶体的硬度小,熔、沸点低,在熔融状态或固体时均不导电,部分溶于水(如酸)导电。
部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、绝大多数有机物的晶体都是分子晶体。
②依据组成晶体的粒子及粒子间作用判断
③依据物质的性质判断
分子晶体的定义
分子晶体
典型的分子晶体
分子晶体的物理性质
分子晶体的结构特征
分子晶体的判断方法
分子晶体熔沸点高低的判断
1.下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、P4、Cu
B.PCl3、CO2、H2SO4
C.SO2、SiO2、P2O5
D.CCl4、H2O、Na2O2
B
【课堂练习】
2.下列有关分子晶体的说法中一定正确的( )
A.分子内均存在共价键
B.分子间一定存在范德华力
C.分子间一定存在氢键
D.其结构一定为分子密堆积
B
3.(1)比较下列化合物熔、沸点的高低(填“>”或“<”)。
①CO2________SO2 ②NH3________PH3 ③O3________O2 ④Ne________Ar
⑤CH3CH2OH________CH3OH ⑥CO________N2
(2)已知AlCl3的熔点为190 ℃(2.02×105 Pa),但它在180 ℃即开始升华。请回答:①AlCl3固体是________晶体。
②设计一个可靠的实验,判断氯化铝是离子化合物还是共价化合物。你设计的实验是_______________________________________。
<
<
>
>
>
>
分子
在熔融状态下,试验其是否导电,若不导电是共价化合物,若导电是离子化合物.
大本练习册P68
易错辨析1
(1)分子晶体中一定含有分子间作用力,不一定含有化学键。( )
(2)分子晶体熔化时,只破坏分子间作用力,不破坏共价键。( )
(3)冰融化和干冰升华破坏的作用力完全相同。( )
提示 干冰升华只破坏范德华力,而冰融化除破坏范德华力外,还破坏氢键。
(4)干冰晶体中只存在范德华力不存在氢键,一个分子周围有12个紧邻分子。
( )
(5)冰晶体中,每个水分子周围只有4个紧邻的分子,1 mol冰中含有1 mol氢键。( )
√
√
×
√
×
大本练习册P70
1.下列有关分子晶体的说法一定正确的是( )
A.分子内均存在共价键 B.分子间一定存在范德华力
C.分子间一定存在氢键 D.分子晶体一定采取分子密堆积方式
B
2.下列物质在室温下均是分子晶体的是( )
A.H2O、CH4、HF B.红磷、硫、碘
C.CO2、SO2、NO2 D.H2SO4、CH3CH2OH、HCHO
B
大本练习册P70
3.下列有关冰和干冰的叙述不正确的是( )
A.干冰和冰都是由分子密堆积形成的晶体
B.冰晶体中,每个水分子周围只有4个紧邻的水分子
C.干冰比冰的熔点低得多,常压下易升华
D.干冰中CO2分子间只存在范德华力,不存在氢键,一个分子周围有12个紧邻的分子
A
大本练习册P71
4.下列物质按熔、沸点由高到低顺序排列,正确的一组是( )
A.HF、HCl、HBr、HI
B.F2、Cl2、Br2、I2
C.H2O、H2S、H2Se、H2Te
D.CI4、CBr4、CCl4、CF4
D
大本练习册P70
5.下列性质符合分子晶体性质的是( )
A.熔点为1 070 ℃,易溶于水,水溶液导电
B.熔点为3 500 ℃,不导电,质硬,难溶于水和有机溶剂
C.能溶于CS2,熔点为113 ℃,沸点为445 ℃
D.熔点为97.81 ℃,质软,导电,密度为0.97 g·cm-3
C
