化学人教版(2019)必修第一册1.3.2氧化剂和还原剂(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.2氧化剂和还原剂(共17张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 593.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-08 21:42:09 | ||
图片预览






文档简介
(共17张PPT)
第一章 物质及其变化
第三节 氧化还原反应
第2课时 氧化剂、还原剂
氧化还原反应
双线桥
氧化还原反应
双线桥
氧化还原反应
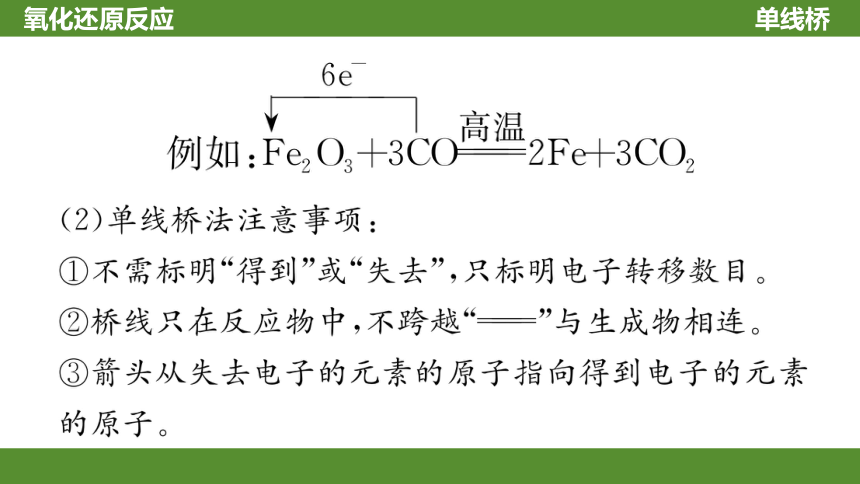
单线桥
氧化还原反应
单线桥
氧化还原反应
氧化还原反应
用双线桥法表示下列方程式电子转移的方向和数目
MnO2+4HCl(浓) = MnCl2+Cl2↑ + 2H2O
△
+4 -1 +2 0
得到2 e-,
化合价降低,被还原
化合价升高,被氧化
失去2 ×e-,
易错警醒:
该反应中,只有一部分氯原子化合价发生变化,还有一部分氯原子价态不变,故失去电子数为2×e-,而不是4 ×e-。
部分氧化还原反应反应
氧化还原反应
甲醛(HCHO)是室内空气污染的主要污染物之一,活性高锰酸钾球是以高锰酸钾为原料,以活性氧化铝为载体,经过二次深加工的一种产品,可用于空气净化除甲醛。其反应原理是:
5HCHO+4KMnO4+6H2SO4===5CO2↑+K2SO4+4MnSO4+11H2O
请分析该反应是否属于氧化还原反应?
0
+4
+7
+2
练习
属于
氧化还原反应
氧化还原反应概念的发展:
电子转移(电子得失或共用电子对偏移)
得氧、失氧
元素化合价升降
元素(宏观视角)
电子(微观视角)
局限性
特征
本质
阅读教材P25科学史话—氧化还原反应概念的发展,人们对氧化还原反应的认识经过了几个发展阶段?
科学史话
氧化还原反应
思考:1.有单质参加或生成的化学反应一定是氧化还原反应吗?
不一定
2.当反应中一种元素被氧化时,一定有另一种元素被还原吗?
不一定
3.某元素从游离态到化合态,该元素一定被氧化吗?
不一定
思考讨论
氧化还原反应
氧化剂
还原反应
还原产物
发生
生成
发生
生成
还原剂
氧化反应
氧化产物
得电子,化合价降低,被还原
失电子,化合价升高,被氧化
e-
同时发生
同时生成
对立统一的思想
电子守恒
得
失
氧化还原反应总结
氧化还原反应
氧化性、还原性
氧化性和还原性:
氧化性:物质得电子性质,氧化剂具有氧化性。
且物质得电子越容易氧化性越强
还原性:物质失电子性质,还原剂具有还原性。
且物质失电子越容易还原性越强
什么剂具有什么性
物质氧化性还原性的强弱和其得失电子的能力有关。与得失电子的数目无关。
氧化还原反应
练习
(1)2H2+O2===2H2O
(2)4P+5O2===2P2O5
(3)Fe+H2SO4===FeSO4+H2↑
(4)2HgO===2Hg+O2↑
点燃
加热
点燃
氧化剂:O2
还原剂:H2
氧化剂:O2
还原剂:P
氧化剂:H2SO4
还原剂:Fe
氧化剂:HgO
还原剂:HgO
1、分析下列氧化还原反应中元素化合价的变化情况,指出氧化剂和还原剂。
氧化还原反应
常见的氧化剂和还原剂
物质种类 常见物质
氧化剂 部分非金属单质 O2、Cl2等
含有高价态元素的化合物 H2SO4(浓)、HNO3、KMnO4、FeCl3等
还原剂 活泼的金属单质 Al、Zn、Fe等
某些非金属单质 C、H2等
某些非金属氧化物 CO、SO2等
含有低价态元素的化合物 Fe2SO4、KI、Na2SO3等
氧化还原反应
氧化性、还原性
易错警示
(1)并非价态越高氧化性越强,在HClO中氯元素化合价为+1价,在HClO4中氯元素的化合价为+7价,但HClO的氧化性比HClO4强。
(2)由于有些氧化还原反应中,氧化剂或还原剂并没有全部发生氧化还原反应,因此在求氧化剂或还原剂的质量或两者的比例时要格外注意。
MnO2+4HCl(浓 ) == MnCl2+2H2O+Cl2↑
氧化剂和还原剂的比例为1:2
其中HCl既体现出还原性也体现出酸性。
△
氧化还原反应
氧化性、还原性
易错警示
(3)元素由化合态变为游离态时,该元素不一定被还原。如:Cu2+→Cu时,铜元素被还原,Cl-→Cl2时,
氯元素被氧化。
(4)同一种氧化剂(或还原剂)所对应的还原产物(或氧化产物)不是一成不变的,取决于还原剂(或氧化剂)的性质、反应条件、反应物的浓度、反应介质的酸碱性等多种因素。如KMnO4在酸性溶液中的还原产物一般是Mn2+;在中性或碱性溶液中还原产物一般是锰的较高价态化合物,如MnO2、K2MnO4等。
氧化还原反应
从化合价角度预测物质的氧化性、还原性
活动1、预测下列物质的性质(氧化性、还原性)
KMnO4
HNO3
O2
H2S
从N的角度:氧化性
从O的角度:还原性
从Mn的角度:氧化性
从O的角度:还原性
可变为-2、-1价,氧化性
从H的角度:氧化性
从S的角度:还原性
Cl2
Fe2+
既有氧化性又有还原性
既有氧化性又有还原性
化合价的角度考虑氧化性、还原性
氧化还原反应
对于同种元素不同价态的原子而言,最高价态只具有氧化性,最低价态只具有还原性,中间价态既有氧化性又有还原性。
最低价:只有还原性
最高价:只有氧化性
最中间价:既有氧化性,又有还原性
价态规律
含有多种价态的物质,其性质和具体发生的反应有关
化合价的角度考虑氧化性、还原性
第一章 物质及其变化
第三节 氧化还原反应
第2课时 氧化剂、还原剂
氧化还原反应
双线桥
氧化还原反应
双线桥
氧化还原反应
单线桥
氧化还原反应
单线桥
氧化还原反应
氧化还原反应
用双线桥法表示下列方程式电子转移的方向和数目
MnO2+4HCl(浓) = MnCl2+Cl2↑ + 2H2O
△
+4 -1 +2 0
得到2 e-,
化合价降低,被还原
化合价升高,被氧化
失去2 ×e-,
易错警醒:
该反应中,只有一部分氯原子化合价发生变化,还有一部分氯原子价态不变,故失去电子数为2×e-,而不是4 ×e-。
部分氧化还原反应反应
氧化还原反应
甲醛(HCHO)是室内空气污染的主要污染物之一,活性高锰酸钾球是以高锰酸钾为原料,以活性氧化铝为载体,经过二次深加工的一种产品,可用于空气净化除甲醛。其反应原理是:
5HCHO+4KMnO4+6H2SO4===5CO2↑+K2SO4+4MnSO4+11H2O
请分析该反应是否属于氧化还原反应?
0
+4
+7
+2
练习
属于
氧化还原反应
氧化还原反应概念的发展:
电子转移(电子得失或共用电子对偏移)
得氧、失氧
元素化合价升降
元素(宏观视角)
电子(微观视角)
局限性
特征
本质
阅读教材P25科学史话—氧化还原反应概念的发展,人们对氧化还原反应的认识经过了几个发展阶段?
科学史话
氧化还原反应
思考:1.有单质参加或生成的化学反应一定是氧化还原反应吗?
不一定
2.当反应中一种元素被氧化时,一定有另一种元素被还原吗?
不一定
3.某元素从游离态到化合态,该元素一定被氧化吗?
不一定
思考讨论
氧化还原反应
氧化剂
还原反应
还原产物
发生
生成
发生
生成
还原剂
氧化反应
氧化产物
得电子,化合价降低,被还原
失电子,化合价升高,被氧化
e-
同时发生
同时生成
对立统一的思想
电子守恒
得
失
氧化还原反应总结
氧化还原反应
氧化性、还原性
氧化性和还原性:
氧化性:物质得电子性质,氧化剂具有氧化性。
且物质得电子越容易氧化性越强
还原性:物质失电子性质,还原剂具有还原性。
且物质失电子越容易还原性越强
什么剂具有什么性
物质氧化性还原性的强弱和其得失电子的能力有关。与得失电子的数目无关。
氧化还原反应
练习
(1)2H2+O2===2H2O
(2)4P+5O2===2P2O5
(3)Fe+H2SO4===FeSO4+H2↑
(4)2HgO===2Hg+O2↑
点燃
加热
点燃
氧化剂:O2
还原剂:H2
氧化剂:O2
还原剂:P
氧化剂:H2SO4
还原剂:Fe
氧化剂:HgO
还原剂:HgO
1、分析下列氧化还原反应中元素化合价的变化情况,指出氧化剂和还原剂。
氧化还原反应
常见的氧化剂和还原剂
物质种类 常见物质
氧化剂 部分非金属单质 O2、Cl2等
含有高价态元素的化合物 H2SO4(浓)、HNO3、KMnO4、FeCl3等
还原剂 活泼的金属单质 Al、Zn、Fe等
某些非金属单质 C、H2等
某些非金属氧化物 CO、SO2等
含有低价态元素的化合物 Fe2SO4、KI、Na2SO3等
氧化还原反应
氧化性、还原性
易错警示
(1)并非价态越高氧化性越强,在HClO中氯元素化合价为+1价,在HClO4中氯元素的化合价为+7价,但HClO的氧化性比HClO4强。
(2)由于有些氧化还原反应中,氧化剂或还原剂并没有全部发生氧化还原反应,因此在求氧化剂或还原剂的质量或两者的比例时要格外注意。
MnO2+4HCl(浓 ) == MnCl2+2H2O+Cl2↑
氧化剂和还原剂的比例为1:2
其中HCl既体现出还原性也体现出酸性。
△
氧化还原反应
氧化性、还原性
易错警示
(3)元素由化合态变为游离态时,该元素不一定被还原。如:Cu2+→Cu时,铜元素被还原,Cl-→Cl2时,
氯元素被氧化。
(4)同一种氧化剂(或还原剂)所对应的还原产物(或氧化产物)不是一成不变的,取决于还原剂(或氧化剂)的性质、反应条件、反应物的浓度、反应介质的酸碱性等多种因素。如KMnO4在酸性溶液中的还原产物一般是Mn2+;在中性或碱性溶液中还原产物一般是锰的较高价态化合物,如MnO2、K2MnO4等。
氧化还原反应
从化合价角度预测物质的氧化性、还原性
活动1、预测下列物质的性质(氧化性、还原性)
KMnO4
HNO3
O2
H2S
从N的角度:氧化性
从O的角度:还原性
从Mn的角度:氧化性
从O的角度:还原性
可变为-2、-1价,氧化性
从H的角度:氧化性
从S的角度:还原性
Cl2
Fe2+
既有氧化性又有还原性
既有氧化性又有还原性
化合价的角度考虑氧化性、还原性
氧化还原反应
对于同种元素不同价态的原子而言,最高价态只具有氧化性,最低价态只具有还原性,中间价态既有氧化性又有还原性。
最低价:只有还原性
最高价:只有氧化性
最中间价:既有氧化性,又有还原性
价态规律
含有多种价态的物质,其性质和具体发生的反应有关
化合价的角度考虑氧化性、还原性
